5.1课题1_质量守恒定律(定稿)
文档属性
| 名称 | 5.1课题1_质量守恒定律(定稿) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-03 00:00:00 | ||
图片预览










文档简介
课件43张PPT。
质量守恒定律
化学反应的本质是生成了新的物质。
可知反应前、后物质的种类发生了变化,
那么,化学反应前、后物质的总质量是否
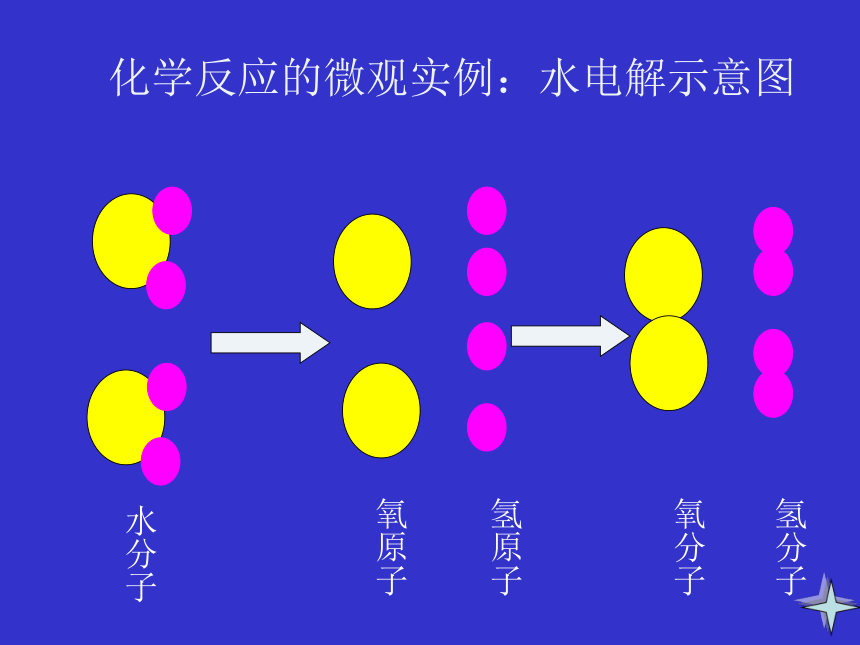
发生了变化。想一想化学反应的微观实例:水电解示意图氢原子氧原子水分子氧分子氢分子从分子和原子观点来看在一切化学反应中,反应前后的原子
种类没有改变,原子的数目没有增减,
原子的质量也没有变化。所以反应前
后各物质的质量总和必然相等。参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律就叫质量守恒定律一、质量守恒定律: 化学反应中反应前各反应物的质量总和与反应
后各生成物的质量总和之间可能有哪几种关系呢?提出问题:作出假设:生成物的质量总和 反应物的质量总和等于大于小于 实验探究一设计实验
方案一:白磷燃烧前后质量的测定方案二:铁与硫酸铜溶液反应前后
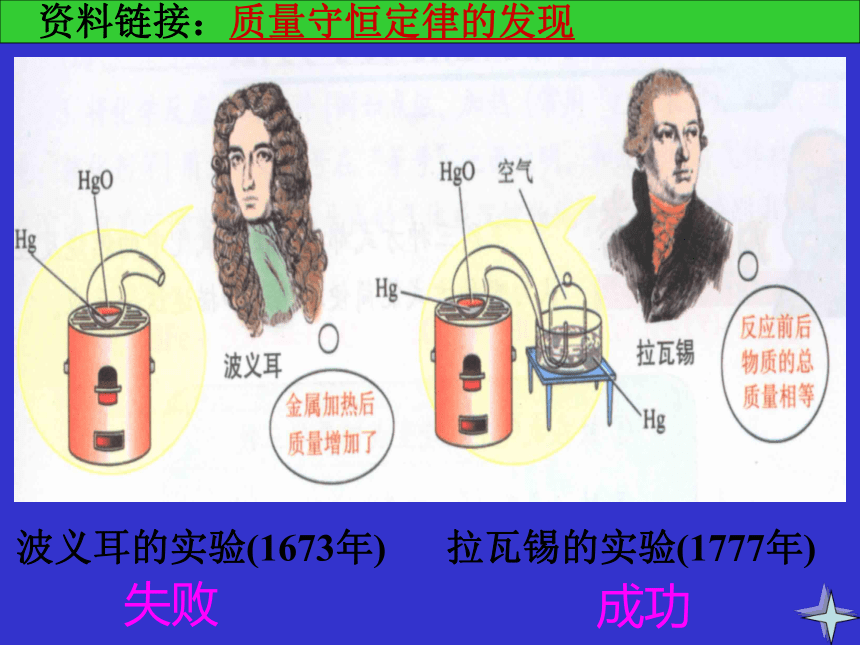
质量的测定相等白磷燃烧,产生大量白烟;气球先膨胀后缩小铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色相等实验过程 资料链接:质量守恒定律的发现波义耳的实验(1673年)拉瓦锡的实验(1777年)失败成功 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。质量守恒定律:参加质量总和质量总和各各实验结果质量守恒定律的实质:(1)质量守恒的原因(五不变):
宏观:元 素的种类不变;
反应物和生成物的总质量不变;
微观:原子的种类不变;
原子的数目不变;
原子的质量不变。 (2)在化学反应中,分子、物质的种类一定变。(两一定变)(3)分子数目不一定变(一不一定变)实验探究二:方案一:碳酸钠和盐酸混合前后质 量的测定方案二:镁带燃烧前后质量的测定实验结果:
1.碳酸钠和盐酸混合后生成物的质量小 于反应物的质量。
所以不遵守质量守恒定律(对吗?)
2.镁带在空气中燃烧后生成物的质量大于反应物的质量。
所以也不遵守质量守恒定律。(对吗?)讨论:
1.为什么会出现生成物的质量大于或小于反应物的质量这些情况?
2.这两个反应到底遵守不遵守质量守恒定律呢?思考:为什么蜡烛燃烧后质量减轻了?
这个反应符合质量守恒定律吗? 遵守质量守恒定律,石蜡燃烧生成的二氧化碳和水跑到空气中去了,所以质量减少,但石蜡和氧气的总质量等于二氧化碳和水的总质量。理解质量守恒定律的定义时要注意: 1.质量守恒定律是关于化学反应的普遍规律,其运用范围是化学变化。一切化学反应都遵循质量守恒定律。2.质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。3.注意定律中的几个关键之处:①“参加反应的各物质”,没有参加反应的物质不包括在内;②“生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。40 (2). 6克碳与一定量的氧气恰好完全反应,生
成二氧化碳22克,有______克氧气参加了反应。16(1).试试看:1、用质量差确定某反应物或生成物的质量(3).在化学反应A+2B = 2C+D中,6gA和 8gB 恰好完全反应,生成9gD。若反应生成15gC,则参加反应的A的质量
为( )
A.18g B.24g
C.12g D.16gA(4) . 24.5克氯酸钾与5克二氧化锰混合共热,待完全反应后,冷却称量剩余固体物质19.9克,则生成氧气_____克。
9.62、推断反应物或生成物的组成元素(1).酒精在氧气中燃烧生成二氧化碳和水,能否根据这一事实,推断出酒精中肯定会有什么元素?可能会有什么元素? 一定有的元素:
可能有的元素:C,HO (2). 生物的呼吸作用表示为:
有机物 + 氧气 → 二氧化碳 + 水
以下关于有机物组成元素推断正确的是( )
A.只含碳元素
B.只含碳元素和氢元素
C.一定含碳、氢和氧元素
D.一定含有碳元素和和氢元素,可能含
有氧元素D3、解释反应前后物质的质量变化(1)、根据质量守恒定律解释细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大。(2)、高锰酸钾受热分解后,剩余固
体的质量比原反应物的质量小,因此这
个反应不遵守质量守恒定律。你认可这
种说法吗?为什么?根据质量守恒定律,在X2+3Y2=2Z中,Z的化学式用X、Y表示应是( )
A、XY2 B、XY3 C、X2Y3 D、X3Y2思考题:二、化学方程式1、定义:用化学式表示化学反应的式子。2、含义表示反应物,生成物以及反应条件。表示反应物、生成物之间的质量关系(质量比)。表示反应物、生成物之间的粒子个数关系。
(粒子个数比)(化学计量数之比)3、读法①碳和氧气在点燃的条件下生成二氧化碳。②1个碳原子和1个氧分子在点燃的条件下反应,生成1个二氧化碳分子。C + O2 = CO2点燃③每12份质量的碳和32份质量的氧气在点燃
的条件下反应生成44份质量的二氧化碳。到30页质量比就是化学方程式中各物质的相对分子质量与化学计量数之积的比。如何正确书写化学方程式课题2知识回顾1、什么叫化学方程式?2、化学方程式能为我们提供那些信息?用化学式来表示化学反应的式子加化学方程式。反应物,生成物;反应条件;
反应物和生成物之间的质量关系;
反应物和生成物的粒子数量关系等。化学方程式书写原则1、以客观事实为基础2、遵循质量守恒定律思考怎样能使化学方程式遵循质量守恒定律?在化学式前添加适当得化学计量数,
使反应式两边各原子的总数都相等——配平例:Fe + O2 —— Fe3O4Fe + O2 —— Fe3O4点燃点燃32配平化学方程式常用的方法——观察法H2 + O2 —— H2O以反应式两边最复杂的化学式为“基准”,其他化学
式向“基准”看齐,在看齐的过程中添加适当的计量数。H2 + 1/2O2 —— H2O2H2 + O2 —— 2H2OKCIO3 —— KCI + 2/3O2KCIO3 —— KCI + O2————3KCIO3 —— 3KCI + 2O24P + 502 2P205
化学方程式的书写步骤之一(1)写出反应物
生成物的化学式点燃P + O2 P2O5
(2)配平4P + 502 2P2O5
(3)标明反应发生条件(4)查:检查化学式是否写错,
化学方程式是否配平,
条件和物质状态标注是否标了
标的是否恰当
化学方程式的书写步骤之二(1) 写出反应物
生成物的化学式△KMnO4 K2MnO4+MnO2+O2(2) 配平2KMnO4 K2MnO4+MnO2+O2
(3)标明反应发生条件(4)标出生成物状态 “↑” “↓”KMnO4 K2MnO4+MnO2+O2KMnO4 K2MnO4+MnO2+O2△↑(5)查:检查化学式是否写错,化学方程式是否配平,
条件和物质状态标注是否标了标的是否恰当注意S + O2 SO2C + O2 CO2点燃点燃↑↑小结:(1)以客观事实为基础,
(2)遵守质量守恒定律3.化学方程式的书写步骤2. 配平化学方程式的方法——观察法四字口诀: 写---平---标---查1. 化学方程式的书写原则试试看,你能配平下列化学方程式吗?24 3 22 22 2练习1:课堂练习练习2、正确书写下列反应的化学方程式5、高锰酸钾加热分解3、水通电分解1、细铁丝燃烧2、铝箔燃烧4、过氧化氢在二氧化锰催化作用下分解练习3、
根据化学方程式 2Mg +O2 == 2MgO
计算此反应中镁、氧气、氧化镁的质量比 。
练习4、在电解水的化学反应中,H2O、H2、O2的质量比为( )
A.9:1:16 B.9:1:8 C.9:2:8 D.10:1:9点燃B3:2:5祝同学们:学习快乐、快乐学习!
化学反应的本质是生成了新的物质。
可知反应前、后物质的种类发生了变化,
那么,化学反应前、后物质的总质量是否
发生了变化。想一想化学反应的微观实例:水电解示意图氢原子氧原子水分子氧分子氢分子从分子和原子观点来看在一切化学反应中,反应前后的原子
种类没有改变,原子的数目没有增减,
原子的质量也没有变化。所以反应前
后各物质的质量总和必然相等。参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律就叫质量守恒定律一、质量守恒定律: 化学反应中反应前各反应物的质量总和与反应
后各生成物的质量总和之间可能有哪几种关系呢?提出问题:作出假设:生成物的质量总和 反应物的质量总和等于大于小于 实验探究一设计实验
方案一:白磷燃烧前后质量的测定方案二:铁与硫酸铜溶液反应前后
质量的测定相等白磷燃烧,产生大量白烟;气球先膨胀后缩小铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色相等实验过程 资料链接:质量守恒定律的发现波义耳的实验(1673年)拉瓦锡的实验(1777年)失败成功 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。质量守恒定律:参加质量总和质量总和各各实验结果质量守恒定律的实质:(1)质量守恒的原因(五不变):
宏观:元 素的种类不变;
反应物和生成物的总质量不变;
微观:原子的种类不变;
原子的数目不变;
原子的质量不变。 (2)在化学反应中,分子、物质的种类一定变。(两一定变)(3)分子数目不一定变(一不一定变)实验探究二:方案一:碳酸钠和盐酸混合前后质 量的测定方案二:镁带燃烧前后质量的测定实验结果:
1.碳酸钠和盐酸混合后生成物的质量小 于反应物的质量。
所以不遵守质量守恒定律(对吗?)
2.镁带在空气中燃烧后生成物的质量大于反应物的质量。
所以也不遵守质量守恒定律。(对吗?)讨论:
1.为什么会出现生成物的质量大于或小于反应物的质量这些情况?
2.这两个反应到底遵守不遵守质量守恒定律呢?思考:为什么蜡烛燃烧后质量减轻了?
这个反应符合质量守恒定律吗? 遵守质量守恒定律,石蜡燃烧生成的二氧化碳和水跑到空气中去了,所以质量减少,但石蜡和氧气的总质量等于二氧化碳和水的总质量。理解质量守恒定律的定义时要注意: 1.质量守恒定律是关于化学反应的普遍规律,其运用范围是化学变化。一切化学反应都遵循质量守恒定律。2.质量守恒定律的“守恒”指的是质量守恒,其它方面如体积等不一定守恒。3.注意定律中的几个关键之处:①“参加反应的各物质”,没有参加反应的物质不包括在内;②“生成的各物质的质量总和”,应当包括生成的各种物质,如沉淀、气体等。40 (2). 6克碳与一定量的氧气恰好完全反应,生
成二氧化碳22克,有______克氧气参加了反应。16(1).试试看:1、用质量差确定某反应物或生成物的质量(3).在化学反应A+2B = 2C+D中,6gA和 8gB 恰好完全反应,生成9gD。若反应生成15gC,则参加反应的A的质量
为( )
A.18g B.24g
C.12g D.16gA(4) . 24.5克氯酸钾与5克二氧化锰混合共热,待完全反应后,冷却称量剩余固体物质19.9克,则生成氧气_____克。
9.62、推断反应物或生成物的组成元素(1).酒精在氧气中燃烧生成二氧化碳和水,能否根据这一事实,推断出酒精中肯定会有什么元素?可能会有什么元素? 一定有的元素:
可能有的元素:C,HO (2). 生物的呼吸作用表示为:
有机物 + 氧气 → 二氧化碳 + 水
以下关于有机物组成元素推断正确的是( )
A.只含碳元素
B.只含碳元素和氢元素
C.一定含碳、氢和氧元素
D.一定含有碳元素和和氢元素,可能含
有氧元素D3、解释反应前后物质的质量变化(1)、根据质量守恒定律解释细铁丝在氧气中燃烧后,生成物的质量比细铁丝的质量大。(2)、高锰酸钾受热分解后,剩余固
体的质量比原反应物的质量小,因此这
个反应不遵守质量守恒定律。你认可这
种说法吗?为什么?根据质量守恒定律,在X2+3Y2=2Z中,Z的化学式用X、Y表示应是( )
A、XY2 B、XY3 C、X2Y3 D、X3Y2思考题:二、化学方程式1、定义:用化学式表示化学反应的式子。2、含义表示反应物,生成物以及反应条件。表示反应物、生成物之间的质量关系(质量比)。表示反应物、生成物之间的粒子个数关系。
(粒子个数比)(化学计量数之比)3、读法①碳和氧气在点燃的条件下生成二氧化碳。②1个碳原子和1个氧分子在点燃的条件下反应,生成1个二氧化碳分子。C + O2 = CO2点燃③每12份质量的碳和32份质量的氧气在点燃
的条件下反应生成44份质量的二氧化碳。到30页质量比就是化学方程式中各物质的相对分子质量与化学计量数之积的比。如何正确书写化学方程式课题2知识回顾1、什么叫化学方程式?2、化学方程式能为我们提供那些信息?用化学式来表示化学反应的式子加化学方程式。反应物,生成物;反应条件;
反应物和生成物之间的质量关系;
反应物和生成物的粒子数量关系等。化学方程式书写原则1、以客观事实为基础2、遵循质量守恒定律思考怎样能使化学方程式遵循质量守恒定律?在化学式前添加适当得化学计量数,
使反应式两边各原子的总数都相等——配平例:Fe + O2 —— Fe3O4Fe + O2 —— Fe3O4点燃点燃32配平化学方程式常用的方法——观察法H2 + O2 —— H2O以反应式两边最复杂的化学式为“基准”,其他化学
式向“基准”看齐,在看齐的过程中添加适当的计量数。H2 + 1/2O2 —— H2O2H2 + O2 —— 2H2OKCIO3 —— KCI + 2/3O2KCIO3 —— KCI + O2————3KCIO3 —— 3KCI + 2O24P + 502 2P205
化学方程式的书写步骤之一(1)写出反应物
生成物的化学式点燃P + O2 P2O5
(2)配平4P + 502 2P2O5
(3)标明反应发生条件(4)查:检查化学式是否写错,
化学方程式是否配平,
条件和物质状态标注是否标了
标的是否恰当
化学方程式的书写步骤之二(1) 写出反应物
生成物的化学式△KMnO4 K2MnO4+MnO2+O2(2) 配平2KMnO4 K2MnO4+MnO2+O2
(3)标明反应发生条件(4)标出生成物状态 “↑” “↓”KMnO4 K2MnO4+MnO2+O2KMnO4 K2MnO4+MnO2+O2△↑(5)查:检查化学式是否写错,化学方程式是否配平,
条件和物质状态标注是否标了标的是否恰当注意S + O2 SO2C + O2 CO2点燃点燃↑↑小结:(1)以客观事实为基础,
(2)遵守质量守恒定律3.化学方程式的书写步骤2. 配平化学方程式的方法——观察法四字口诀: 写---平---标---查1. 化学方程式的书写原则试试看,你能配平下列化学方程式吗?24 3 22 22 2练习1:课堂练习练习2、正确书写下列反应的化学方程式5、高锰酸钾加热分解3、水通电分解1、细铁丝燃烧2、铝箔燃烧4、过氧化氢在二氧化锰催化作用下分解练习3、
根据化学方程式 2Mg +O2 == 2MgO
计算此反应中镁、氧气、氧化镁的质量比 。
练习4、在电解水的化学反应中,H2O、H2、O2的质量比为( )
A.9:1:16 B.9:1:8 C.9:2:8 D.10:1:9点燃B3:2:5祝同学们:学习快乐、快乐学习!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
