主题2 物质结构与性质 第4练 晶体结构与性质AB(含解析)—2024高考化学考前天天练
文档属性
| 名称 | 主题2 物质结构与性质 第4练 晶体结构与性质AB(含解析)—2024高考化学考前天天练 |  | |
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-25 19:52:24 | ||
图片预览




文档简介
第4练 晶体结构与性质AB
真题快递+天天练A组 满分:67分 限时:30分钟
天天练B组 满分:105分 限时:45分钟
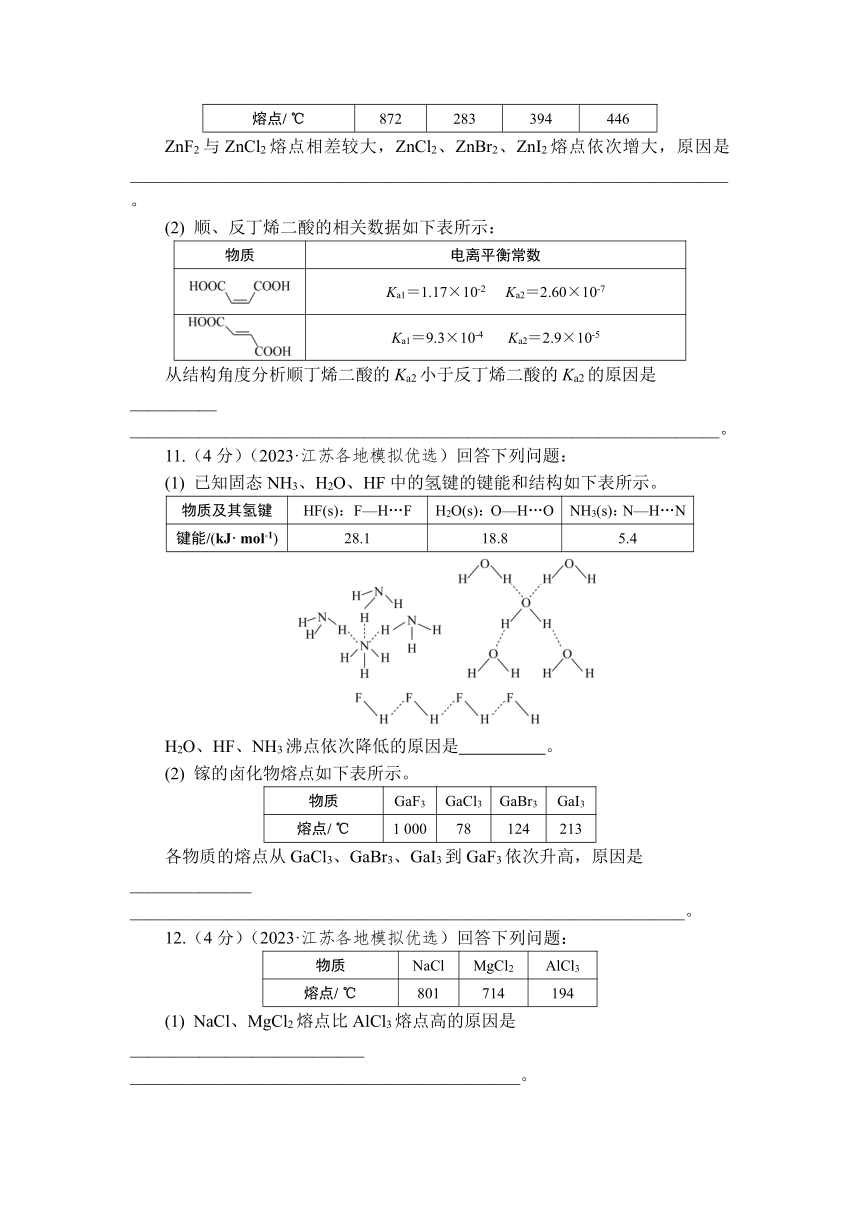
1.(2分)(2022·江苏卷)FeS2具有良好半导体性能。FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S的数目为 ,在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,在给出了FeS2晶胞中的Fe2+和位于晶胞体心的S(S中的S—S键位于晶胞体对角线上,晶胞中的其他S已省略)。如图中用“-”将其中一个S原子与紧邻的Fe2+连接起来。
2.(2分)(2022·全国甲卷)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 。
3.(2分)(2022·广东卷)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图,X的化学式为__________________________________________________________________。
4.(4分)(2022·山东卷)研究笼形包合物结构和性质具有重要意义。化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。
晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为 ;x:y:z= 。
5.(4分)(2022·辽宁卷)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188 g· mol-1,则M元素为 (填元素符号);在该化合物中,M离子的价电子排布式为 。
6.(3分)(2022·山东改编)Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示。晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是( )
A. 每个Cu2-xSe晶胞中Cu2+个数为x
B. 每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为8
C. 每个NaCuSe晶胞中0价Cu原子个数为1-x
D. 当NayCu2-xSe转化为NaCuSe时,每转移2(1-y) mol电子,产生(1-x) mol Cu原子
(3分)(2023·江苏各地优化重组)下列事实与共价键的强弱无关的是( )
A. 金刚石熔点高于晶体硅
B. 碘化氢的沸点高于氯化氢
C. 氮气的化学性质很稳定
D. 乙炔易发生加成反应
2.(3分)(2023·江苏各地模拟优选)能够解释CO2 比 SiO2的熔、沸点低的原因是( )
A. CO2 的相对分子质量比 SiO2 的相对分子质量小
B. C—O键能小于Si—O键能
C. C的原子半径小于Si
D. 破坏CO2晶体只需克服分子间作用力,破坏SiO2晶体要破坏Si—O共价键
3.(3分)(2023·江苏各地模拟优选)下列物质中,常温下以分子晶体形式存在的是( )
A. 氯化铵 B. 单质碘 C. 金刚石 D. 单质硅
4.(3分)(2023·江苏各地模拟优选)某晶体中含有非极性键,下列关于该晶体的说法正确的是( )
A. 可能有很高的熔、沸点 B. 不可能是化合物
C. 只可能是有机物 D. 不可能是离子晶体
5.(3分)(2023·江苏各地模拟优选)根据表中几种物质的熔点数据,判断下列有关说法错误的是 ( )
物质 AlCl3 SiCl4 单质M SiC
熔点/ ℃ 190 -70 2 300 2 830
A. AlCl3为离子晶体 B. 单质M可能是共价晶体
C. SiCl4是分子晶体 D. SiC的熔点比金刚石低
6.(3分)(2023·江苏各地模拟优选)碘和钙形成的某种可溶性二元化合物常用于医药方面,其熔、沸点分别为779 ℃、1 100 ℃,晶胞结构如图所示。下列说法错误的是( )
A. 该物质的化学式是CaI2
B. 该物质在熔融状态和水溶液中均可导电
C. 该化合物熔、沸点高于氟化钙
D. Ca在周期表中所处的s区含有非金属元素
7.(3分)(2023·江苏各地模拟优选)在解释下列物质性质的变化规律与物质结构间的因果关系时,与氢键或化学键的强弱无关的变化规律是( )
A. 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
B. 熔点:金刚石>碳化硅>晶体硅
C. NaF、NaCl、NaBr、NaI的熔点依次降低
D. CF4、CCl4、CBr4、CI4的熔、沸点逐渐升高
8.(3分)(2023·江苏各地模拟优选)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,过程如下图所示。下列叙述正确的是( )
A. NH3与BF3都是由极性键构成的极性分子
B. 六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,1个立方氮化硼晶胞中含有4个氮原子、4个硼原子
C. NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1 mol NH4BF4含有配位键的数目为NA
D. 立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝
9.(6分)(2023·江苏各地模拟优选)回答下列问题:
(1) 氢键存在于分子之问,也可以存在分子内,如邻羟基苯甲醛存在分子内氢键,导致它的沸点比对羟基苯甲醛低,氢键用X—H…Y表示,画出邻羟基苯甲醛的分子内氢键 。
(2) 苯酚常温下在水中溶解度不大,但高于65°时,它能与水任何比例互溶,原因是 。
(3) 三种晶体的熔点数据如下表:
物质 C60 C(金刚石) C(石墨)
熔点 280 ℃ 3 550 ℃ 3 652 ℃
C60和金刚石熔点相差大,石墨的熔点比金刚石高,原因是_________________
______________________________________________________________________。
10.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 锌的四种卤化物晶体的熔点数据如下表所示:
物质 ZnF2 ZnCl2 ZnBr2 ZnI2
熔点/ ℃ 872 283 394 446
ZnF2与ZnCl2熔点相差较大,ZnCl2、ZnBr2、ZnI2熔点依次增大,原因是_____________________________________________________________________。
(2) 顺、反丁烯二酸的相关数据如下表所示:
物质 电离平衡常数
Ka1=1.17×10-2 Ka2=2.60×10-7
Ka1=9.3×10-4 Ka2=2.9×10-5
从结构角度分析顺丁烯二酸的Ka2小于反丁烯二酸的Ka2的原因是__________
____________________________________________________________________。
11.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 已知固态NH3、H2O、HF中的氢键的键能和结构如下表所示。
物质及其氢键 HF(s):F—H…F H2O(s):O—H…O NH3(s):N—H…N
键能/(kJ· mol-1) 28.1 18.8 5.4
H2O、HF、NH3沸点依次降低的原因是 。
(2) 镓的卤化物熔点如下表所示。
物质 GaF3 GaCl3 GaBr3 GaI3
熔点/ ℃ 1 000 78 124 213
各物质的熔点从GaCl3、GaBr3、GaI3到GaF3依次升高,原因是______________
________________________________________________________________。
12.(4分)(2023·江苏各地模拟优选)回答下列问题:
物质 NaCl MgCl2 AlCl3
熔点/ ℃ 801 714 194
NaCl、MgCl2熔点比AlCl3熔点高的原因是___________________________
_____________________________________________。
(2) 苯甲酸的电离平衡常数为Ka=6.4×10-5,为什么邻羟基苯甲酸的电离平衡常数Ka1为苯甲酸的15.9 倍,而间羟基苯甲酸的电离平衡常数为苯甲酸的1.26倍?__________________________________________________________________。
13.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 金刚石和石墨的部分物理性质数据如下表所示:
物质 金刚石 石墨
熔点/ ℃ 3 550 3 652
硬度 10 1.5
石墨的熔点比金刚石高,硬度却比金刚石小得多,原因是__________________
___________________________________________________________________。
互为同分异构体的两种有机物形成氢键如图所示。
沸点:邻羟基苯甲醛 (填“>”“=”或“<”)对羟基苯甲醛,主要原因是 。
14.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 立方氮化硼(BN)是一种超硬材料,硬度仅次于金刚石;砷化镓(GaAs)是一种重要半导体材料,具有空间网状结构,比较立方氮化硼和砷化镓熔点的高低并说明理由:___________________________________________________________。
(2) 四种有机物的沸点数据如下表所示。
物质 CH3OH C2H6 CH3(CH2)9OH CH3(CH2)9CH3
相对分子质量 32 30 158 156
沸点/ ℃ 64.5 -88.6 228 196
CH3OH和C2H6沸点相差较大,CH3(CH2)9OH和CH3(CH2)9CH3沸点相差较小,原因是___________________________________________________________。
1.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 已知C2H6和N2H4均含有18个电子的分子,判断在水中的溶解性大小并说明理由______________________________________________________________。
(2) 四种晶体的熔点数据如下表所示。
物质 ZnF2 ZnCl2 ZnBr2 ZnI2
熔点/ ℃ 872 283 394 446
ZnF2和ZnCl2熔点相差较大,后三者熔点相差较小,原因是________________
______________________________________________________________________。
2.(11分)(2023·江苏各地模拟优选)2019年1月3日,一吨多重的“嫦娥四号”探测器首次实现人类飞行器在月球背面的软着陆,它所搭载的“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量开展工作。下表是As、Ga等元素所在元素周期表中的一部分。回答下列问题:
Al Si P
Ga Ge As
上表中,原子半径最小的是 元素(填元素名称),元素周期表中镓的位置是 。从原子结构角度解释磷与砷的非金属性强弱:___
_____________________________________________________________________。
(2) GaAs可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3。配平反应的化学方程式,并标出电子转移方向和数目:GaAs+HNO3―→Ga(NO3)3+NO2↑+H3AsO4+H2O,_______________________________________________________________。
(3) GaN、GaAs、GaP都是良好的半导体材料,晶体类型与晶体硅相同,它们的熔点如下表所示。
晶体 GaN GaAs GaP
熔点/ ℃ 1 700 1 238 1 480
解释它们熔点变化的原因:___________________________________________。
(4) 亚磷酸(H3PO3)与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐,这两种盐溶液均呈碱性。根据以上信息判断,亚磷酸应属于 酸,Na2HPO3溶液中阴离子浓度由大到小的次序为 。
3.(10分)(2023·江苏各地模拟优选)含硼化合物由于其特殊的结构和性质在生产、生活和科研中应用广泛。回答下列问题:
(1) 基态硼原子的核外电子的空间运动状态有 种;B、N、H的电负性由大到小的顺序为____________________________________________________。
(2) 含硼阴离子[B6O7(OH)6]2-的结构如图所示。其中硼原子的杂化方式为 ,该结构中共有 种不同化学环境的氧原子。
(3) BF3与H2O结合形成固态化合物BF3·OH2…OH2,该物质在6.2 ℃时熔化电离出H3O+和一种含硼阴离子 (填离子符号),该熔化电离过程破坏的作用力为 ,H3O+的空间构型为 。
(4) 金属硼氢化物可用作储氢材料。一种金属硼氢化物氨合物的晶体结构如图所示。图中八面体的中心代表金属M原子,顶点代表氨分子;四面体的中心代表硼原子,顶点代表氢原子。该晶体属立方晶系,晶胞棱边夹角均为90°,棱长为a pm,密度为ρ g·cm-3,阿伏加德罗常数的值为NA。
该晶体的化学式为 。
4.(12分)(2023·江苏各地模拟优选)镓(31Ga)是化学史上第一种先理论预言,后在自然界中被发现并验证的元素。镓的化合物半导体广泛用于电子与微电子工业。
(1) 基态Ga原子中,核外电子占据的最高能层的符号是 。
(2) 门捷列夫预言的“类硼”(即钪,21Sc),“类铝”(即镓,31Ga),“类硅”(即锗,32Ge)三种元素中,未成对电子数最多的是 (填元素符号)。
(3) 氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,与晶体硅属于同一晶体类型。
①Ga、N、As三种元素的电负性由大到小的顺序是 。
②GaN熔点(1 700 ℃)高于GaAs熔点(1 238 ℃)的原因是_________________。
③GaAs可由Ga(CH3)3和AsH3在一定条件下制得,该反应的化学方程式是 ,
Ga(CH3)3分子中Ga原子的杂化方式是 ,AsH3分子的空间构型是 。
(4) 钆镓石榴石是一种激光介质材料,其晶体结构单位如图所示。
钆镓石榴石的化学式是 。
5.(12分)(2023·江苏各地模拟优选)镍钴锰三元材料LiNixCoyMnzO2是一类新型锂离子电池正极材料,具有容量高、循环稳定性好等优点。
(1) 锰元素基态原子的电子排布式为 ,镍、钴、锰三种基态原子中未成对电子数最多的是 。
(2) 镍可以形成多种配合物,如Ni(CO)4、[Ni(NH3)6]SO4等。
①上述两种配合物都存在的化学键的是 (填字母)。
a. 离子键 b. 配位键
c. 极性键 d. 非极性键
②Ni(CO)4常温下难溶于水,易溶于CCl4中,可推知其为__________________
(填“极性分子”或“非极性分子”)。
③[Ni(NH3)6]SO4中阴离子的空间构型为 。
(3) MnO和CoO具有相同的晶体构型,其熔点大小顺序为_________________。
(4) 锂离子电池目前广泛采用溶有LiPF6的碳酸酯作为电解液。
①LiPF6中各元素的第一电离能从大到小的顺序为_______________________。
②常见溶剂碳酸乙烯酯()中碳原子的杂化方式是 。
(5) LiCoO2的晶胞是六棱柱,其结构如图所示,镍钴锰三元材料中Ni和Mn取代了部分Co的位置:
晶胞中含Li原子数为 。
6.(14分)(2023·江苏各地模拟优选)磷及其化合物在工业生产中起着重要的作用。
(1) 基态磷原子价电子的轨道表示式是________________________________。
(2) 磷元素有白磷、黑磷等常见的单质。
①白磷(P4)是分子晶体,易溶于CS2,难溶于水,可能原因是______________
_____________________________________________。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是 (填字母)。
a. 层与层之间的作用力是共价键
b. 分子中磷原子杂化方式为sp2杂化
c. 是混合型晶体
(3) Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是 ,其空间构型是 。
(4) ⅢA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟的熔点分别为2 000、1 070 ℃,从结构角度说明其熔点差异的原因______________________________________________________。
②磷化硼是一种半导体材料,晶胞结构如下图所示。磷化硼的化学式是 。
7.(14分)(2023·江苏各地模拟优选)方钴矿化合物是典型的热电材料,在环境污染和能源危机日益严重的今天,进行新型热电材料的研究具有很强的现实意义。
(1) 基态Co的价电子排布式为 ,Co和Fe的逐级电离能数据如表,Fe的I4大于Co的原因是_________________________________________________。
元素 I1 I2 I3 I4 I5 ……
Fe 462.5 1 561.9 2 957 5 290 7 240
Co 760.4 1 648 3 232 4 950 7 670
(2) Sb是第五周期ⅤA族元素,其同族元素可用于研制农药,例如3,5-二氯苯胺是农用杀菌剂的关键中间体。可由以下方法合成:
①化合物乙中C原子杂化轨道类型为 。
②化合物甲中的σ键和π键个数之比为 (苯环中6个C原子共同形成了一个6原子6电子的大π键π)。
(3) 已知SbCl3的熔点为73 ℃,沸点为223.5 ℃,CoCl2的熔点为735 ℃,沸点为1 049 ℃。两者的熔、沸点差异较大的原因是____________________________。
预测SbCl3的空间构型为________________________________________。
(4) 科学家等研究了一类新型热电材料,叫作填隙方钴矿锑化物,在钴和锑形成的晶体空隙中填充入稀土原子La(如图所示),该化合物的化学式为______
______________________。
8.(14分)(2023·江苏各地模拟优选)Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞如图所示。
M
(1) Zn2+的价层电子排布式是 。
(2) C、O、N的电负性从大到小的顺序是 。
(3) 三乙撑二胺()与Zn2+能形成配位键的原因是_____________________
___________________________________________________________。
(4) 在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1,晶胞如图所示。一定条件下,随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2,被称为“会呼吸”的晶体。
M1
晶体 装载分子 晶胞中Zn2+个数 晶胞体积/cm3
M1 顺式偶氮苯 x 1.30×10-24
M2 反式偶氮苯 4 2.46×10-24
资料:
ⅰ. 反式偶氮苯顺式偶氮苯
ⅱ. M1和M2相互转化时,Zn2+的配体和配体数均不变
①N2的电子式是 。
②偶氮苯()中N的杂化轨道类型是 。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在 (填“σ键”或“π键”)。
③x= 。
④晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是 光照射。
9.(14分)(2023·江苏各地模拟优选)铜及其化合物在生产和生活中有着广泛的应用。请回答下列问题:
(1) 基态铜原子有 种运动状态不相同的电子,其价层电子排布式为
。
(2) 已知铜与氯形成化合物的立方晶胞如下图所示。
①该晶体的化学式为 。
②该晶体中,每个氯原子周围与它最近且等距离的氯原子有 个。
(3) Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如下实验。
序号 实验步骤 实验现象或结论
ⅰ 向CuSO4溶液中逐滴加入氨水至过量 产生蓝色沉淀,随后溶解并得到深蓝色的溶液
ⅱ 再加入无水乙醇 得到深蓝色晶体
ⅲ 测定深蓝色晶体的结构 晶体的化学式为[Cu(NH3)4]SO4·H2O
ⅳ 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 无蓝色沉淀生成
①深蓝色的配离子[Cu(NH3)4]2+的结构简式: 。
②[Cu(NH3)4]SO4·H2O晶体中H2O的中心原子杂化轨道类型为 。
③加入乙醇有晶体析出的原因是 。
④该实验条件下,Cu2+与NH3的结合能力 (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
⑤NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
。
第4练 晶体结构与性质AB
1. 4
2. Ca2+
3. K2SeBr6
4. 2∶3 2∶1∶1
5. Fe 3d6
6. B 解析:由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,位于体内的铜离子和亚铜离子的个数之和为8,设晶胞中的铜离子和亚铜离子的个数分别为a和b,则a+b=8-4x,由化合价代数和为0可得2a+b=4×2,解得a=4x,A错误;由题意可知,Na2Se转化为Cu2-xSe的电极反应式为Na2Se-2e-+(2-x)Cu===Cu2-xSe+2Na+,由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,则每个晶胞中含有4个Na2Se,转移电子数为8,B正确;由题意可知,Cu2-xSe转化为NaCuSe的电极反应式为Cu2-xSe+e-+Na+===NaCuSe+(1-x)Cu,由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,则每个晶胞中含有4个NaCuSe,晶胞中0价铜的个数为(4-4x),C错误;由题意可知,NayCu2-xSe转化为NaCuSe的电极反应式为NayCu2-xSe+(1-y) e-+(1-y) Na+===NaCuSe+(1-x)Cu,所以每转移(1-y)mol电子,产生(1-x) mol铜,D错误。
1. B 解析:金刚石、晶体硅都为共价晶体,熔点高低由共价键键能大小决定,A不符合题意;HI、HCl对应的晶体为分子晶体,影响沸点高低的因素为分子间作用力,与共价键强弱无关,B符合题意;氮气分子中共价键键能较大,化学键较稳定,所以化学性质很稳定,C不符合题意;乙炔分子中含有π键,π键键能较弱、较活泼,易发生加成反应,D不符合题意。
2. D 解析:CO2是分子晶体,CO2的熔化与C===O键能没有关系,其熔化只需要克服范德华力(分子间作用力),SiO2是共价晶体,其熔化要破坏Si—O共价键,共价键的强度远远大于范德华力,A、B、C错误,D正确。
3. B 解析:氯化铵属于离子化合物,以离子晶体形式存在,A错误;单质碘属于分子晶体,以分子晶体形式存在,B正确;金刚石属于共价晶体,以共价晶体形式存在,C错误;单质硅属于共价晶体,以共价晶体形式存在,D错误。
4. A 解析:金刚石为共价晶体,晶体中含有非极性共价键C—C键,原子之间通过共价键结合,断裂需要吸收很高的能量,因此该物质的熔、沸点很高,所以可能有很高的熔、沸点,A正确;同种元素的原子形成的共价键是非极性共价键,不同种元素的原子形成的共价键是极性共价键, H2O2等含有非极性键,属于化合物,B错误;H2、O2等单质中含有非极性键,不属于有机物,因此不一定是有机物,C错误;离子化合物中一定含有离子键,也可能含有非极性共价键,如Na2O2,因此含有非极性键的化合物可能是离子晶体,D错误。
5. A 解析:AlCl3的熔点为190 ℃,熔点较低,因此为分子晶体,A错误;单质M的熔点为2 300 ℃,熔点高,可能是共价晶体,B正确;SiCl4的熔点为-70 ℃,熔点低,因此为分子晶体,C正确;SiC中C—Si键比金刚石中C—C键键长长,键能小,因此SiC的熔点比金刚石低,D正确。
6. C 解析:由图可知,每个晶胞中含有2个I原子,Ca原子的数目为×4+×4=1,因此该物质的化学式是CaI2,A正确;碘化钙是离子晶体,熔融状态和水溶液中均可导电,B正确;氟化钙和碘化钙均为离子化合物,阳离子相同,氟离子半径比碘离子半径小,因此氟化钙中阴、阳离子间作用力较强,熔、沸点较高,C错误;s区中的H是非金属元素,D正确。
7. D 解析:对羟基苯甲酸易形成分子间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,A不符合题意;金刚石、碳化硅、晶体硅都为共价晶体,C原子半径小于Si原子半径,则键长:C—C<C—Si<Si—Si,共价键越短,键能越大,熔、沸点越高,所以熔点:金刚石>碳化硅>晶体硅,B不符合题意;NaF、NaCl、NaBr、NaI均为离子晶体,阳离子均为Na+,离子半径:F-NaCl>NaBr>NaI,则NaF、NaCl、NaBr、NaI的熔点依次降低,C不符合题意;分子晶体的熔、沸点与分子间作用力有关,CF4、CCl4、CBr4、CI4的熔、沸点逐渐升高,是因为分子间作用力逐渐增大,与氢键或化学键的强弱无关,D符合题意。
8. B 解析:NH3是由极性键构成的极性分子,BF3是平面三角形,是由极性键构成的非极性分子,A错误;金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,金刚石的一个晶胞中含有的碳原子数为8,则1个立方氮化硼晶胞中应该含有4个N和4个B原子,B正确;NH4BF4中,NH中含有氮氢配位键,BF中含有硼氟配位键,则1 mol NH4BF4含有配位键的数目为2NA,C错误;立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,均是共价晶体,硼原子半径小于铝原子半径,所以立方氮化硼的熔点大于氮化铝,D错误。
9. (1) (2) 由于苯酚分子间存在较强的氢键,所以常温下溶解度不大,温度升高到65 ℃时,破坏了苯酚分子间氢键,并增加了苯酚的电离度,导致与水任意比互溶 (3) C60是分子晶体,金刚石是共价晶体,分子间作用力弱于共价键,所以C60和与金刚石相差较大,而石墨属于过渡型晶体,熔化时同样要破坏共价键,且石墨中的C—C键键长比金刚石短,共价键强,所以石墨的熔点比金刚石高
10. (1) ZnF2是离子晶体,ZnCl2是分子晶体,熔化时分别破坏离子键和分子间作用力,离子键强于分子间作用力;ZnCl2、ZnBr2、ZnI2是分子晶体,相对分子量越大,分子间作用力越强,熔点越高
(2) 顺丁烯二酸发生一级电离后,更易形成稳定的分子内氢键,使二级电离更困难
11. (1) 虽然单个氢键的键能大小顺序是HF>H2O>NH3,但从各固态物质中的氢键结构可以推知,液态H2O、HF、NH3中氢键数量各不相同,状态变化时要克服的氢键的总键能大小顺序是H2O>HF>NH3,所以H2O、HF、NH3沸点依次降低
(2) 四种物质组成相似,GaF3为离子晶体,熔点最高,其他三种均为分子晶体,分子间作用力随相对分子质量的增大而增大,熔点逐渐升高
12. (1) NaCl、MgCl2 是离子晶体,AlCl3为分子晶体,离子键的强度大于范德华力(分子间作用力) (2) +H+,中存在分子内氢键,更稳定,电离平衡常数更大
13. (1) 石墨晶体中C—C键的键能大于金刚石晶体中的C—C键的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多 (2) < 邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键
14. (1) 立方氮化硼熔点高。两种晶体均为共价晶体,N和B原子半径更小(或键长更短),键能更大,熔点更高 (2) 甲醇分子间可形成氢键,比乙烷分子间作用力强得多,所以沸点相差较大;CH3(CH2)9OH由于烃基较大,氢键作用被削弱,分子间以分子间作用力为主,所以与分子量接近的CH3(CH2)9CH3沸点相差较小
1. (1) 溶解性:N2H4大于C2H6,理由是N2H4与H2O分子之间能形成氢键,从而增大溶解;而乙烷不能与H2O分子之间能形成氢键,溶解性较小 (2) ZnF2是离子晶体,ZnCl2、ZnBr2、ZnI2是分子晶体,离子键的作用大于分子间作用力,故ZnF2的熔点较大,而后三者熔点较低且相差较小
2. (1) 磷 第四周期ⅢA族 磷原子和砷原子的最外层电子数相同,但磷原子比砷原子少一层电子,原子半径小,得电子能力强,所以磷的非金属性强于砷 (2) ===Ga(NO3)3+8NO2↑+H3AsO4+4H2O
(3) GaN、GaP、GaAs都是共价晶体,原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故GaN、GaP、GaAs的熔点依次降低 (4) 二元弱 HPO>OH->H2PO
3. (1) 3 N>H>B (2) sp2、sp3 4 (3) [BF3OH]- 共价键和氢键 三角锥形 (4) M(NH3)6(BH4)2
4. (1) N (2) Ge (3) ①N>As>Ga ②二者都属于共价晶体,由于原子半径:As>N,共价键的键长:Ga—As>Ga—N,则键能:Ga—As<Ga—N,断裂共价键消耗的能量:Ga—As<Ga—N,故物质的熔点:GaN>GaAs ③Ga(CH3)3+AsH3GaAs+3CH4 sp2杂化 三角锥形 (4) Gd3Ga5O12
5. (1) 1s22s22p63s23p63d54s2或[Ar]3d54s2 Mn (2) ①bc ②非极性分子 ③正四面体 (3) CoO>MnO (4) ①F>P>Li ②sp2、sp3 (5) 9
6. (1) (2) ①CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4是非极性分子,易溶于CS2,难溶于水 ②c
(3) PO 正四面体 (4) ①磷化铝和磷化铟属于共价晶体,由于Al、In为同主族元素,随着原子序数的递增,核外电子层数逐渐增加,原子半径:Al7. (1) ①3d74s2 ②Co的第四电离能失去的是3d6的电子,Fe失去的是3d5的电子,比较稳定
(2) ①sp2 ②8∶1 (3) SbCl3是分子晶体,CoCl2是离子晶体 三角锥形 (4) LaCo4Sb12
8. (1) 3d10 (2) O>N>C (3) 三乙撑二胺中的N给出孤电子对,Zn2+有空轨道能接受孤电子对 (4) ①N N ②sp2 π键 ③2 ④紫外
9. (1) 29 3d104s1 (2) CuCl 12 (3) ① ②sp3 ③离子晶体在极性较弱的乙醇中溶解度小 ④大于 ⑤N、F、H三种元素的电负性大小为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键
真题快递+天天练A组 满分:67分 限时:30分钟
天天练B组 满分:105分 限时:45分钟
1.(2分)(2022·江苏卷)FeS2具有良好半导体性能。FeS2的一种晶体与NaCl晶体的结构相似,该FeS2晶体的一个晶胞中S的数目为 ,在FeS2晶体中,每个S原子与三个Fe2+紧邻,且Fe—S间距相等,在给出了FeS2晶胞中的Fe2+和位于晶胞体心的S(S中的S—S键位于晶胞体对角线上,晶胞中的其他S已省略)。如图中用“-”将其中一个S原子与紧邻的Fe2+连接起来。
2.(2分)(2022·全国甲卷)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 。
3.(2分)(2022·广东卷)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图,X的化学式为__________________________________________________________________。
4.(4分)(2022·山东卷)研究笼形包合物结构和性质具有重要意义。化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。
晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为 ;x:y:z= 。
5.(4分)(2022·辽宁卷)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188 g· mol-1,则M元素为 (填元素符号);在该化合物中,M离子的价电子排布式为 。
6.(3分)(2022·山东改编)Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示。晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是( )
A. 每个Cu2-xSe晶胞中Cu2+个数为x
B. 每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为8
C. 每个NaCuSe晶胞中0价Cu原子个数为1-x
D. 当NayCu2-xSe转化为NaCuSe时,每转移2(1-y) mol电子,产生(1-x) mol Cu原子
(3分)(2023·江苏各地优化重组)下列事实与共价键的强弱无关的是( )
A. 金刚石熔点高于晶体硅
B. 碘化氢的沸点高于氯化氢
C. 氮气的化学性质很稳定
D. 乙炔易发生加成反应
2.(3分)(2023·江苏各地模拟优选)能够解释CO2 比 SiO2的熔、沸点低的原因是( )
A. CO2 的相对分子质量比 SiO2 的相对分子质量小
B. C—O键能小于Si—O键能
C. C的原子半径小于Si
D. 破坏CO2晶体只需克服分子间作用力,破坏SiO2晶体要破坏Si—O共价键
3.(3分)(2023·江苏各地模拟优选)下列物质中,常温下以分子晶体形式存在的是( )
A. 氯化铵 B. 单质碘 C. 金刚石 D. 单质硅
4.(3分)(2023·江苏各地模拟优选)某晶体中含有非极性键,下列关于该晶体的说法正确的是( )
A. 可能有很高的熔、沸点 B. 不可能是化合物
C. 只可能是有机物 D. 不可能是离子晶体
5.(3分)(2023·江苏各地模拟优选)根据表中几种物质的熔点数据,判断下列有关说法错误的是 ( )
物质 AlCl3 SiCl4 单质M SiC
熔点/ ℃ 190 -70 2 300 2 830
A. AlCl3为离子晶体 B. 单质M可能是共价晶体
C. SiCl4是分子晶体 D. SiC的熔点比金刚石低
6.(3分)(2023·江苏各地模拟优选)碘和钙形成的某种可溶性二元化合物常用于医药方面,其熔、沸点分别为779 ℃、1 100 ℃,晶胞结构如图所示。下列说法错误的是( )
A. 该物质的化学式是CaI2
B. 该物质在熔融状态和水溶液中均可导电
C. 该化合物熔、沸点高于氟化钙
D. Ca在周期表中所处的s区含有非金属元素
7.(3分)(2023·江苏各地模拟优选)在解释下列物质性质的变化规律与物质结构间的因果关系时,与氢键或化学键的强弱无关的变化规律是( )
A. 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
B. 熔点:金刚石>碳化硅>晶体硅
C. NaF、NaCl、NaBr、NaI的熔点依次降低
D. CF4、CCl4、CBr4、CI4的熔、沸点逐渐升高
8.(3分)(2023·江苏各地模拟优选)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,过程如下图所示。下列叙述正确的是( )
A. NH3与BF3都是由极性键构成的极性分子
B. 六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,1个立方氮化硼晶胞中含有4个氮原子、4个硼原子
C. NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1 mol NH4BF4含有配位键的数目为NA
D. 立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝
9.(6分)(2023·江苏各地模拟优选)回答下列问题:
(1) 氢键存在于分子之问,也可以存在分子内,如邻羟基苯甲醛存在分子内氢键,导致它的沸点比对羟基苯甲醛低,氢键用X—H…Y表示,画出邻羟基苯甲醛的分子内氢键 。
(2) 苯酚常温下在水中溶解度不大,但高于65°时,它能与水任何比例互溶,原因是 。
(3) 三种晶体的熔点数据如下表:
物质 C60 C(金刚石) C(石墨)
熔点 280 ℃ 3 550 ℃ 3 652 ℃
C60和金刚石熔点相差大,石墨的熔点比金刚石高,原因是_________________
______________________________________________________________________。
10.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 锌的四种卤化物晶体的熔点数据如下表所示:
物质 ZnF2 ZnCl2 ZnBr2 ZnI2
熔点/ ℃ 872 283 394 446
ZnF2与ZnCl2熔点相差较大,ZnCl2、ZnBr2、ZnI2熔点依次增大,原因是_____________________________________________________________________。
(2) 顺、反丁烯二酸的相关数据如下表所示:
物质 电离平衡常数
Ka1=1.17×10-2 Ka2=2.60×10-7
Ka1=9.3×10-4 Ka2=2.9×10-5
从结构角度分析顺丁烯二酸的Ka2小于反丁烯二酸的Ka2的原因是__________
____________________________________________________________________。
11.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 已知固态NH3、H2O、HF中的氢键的键能和结构如下表所示。
物质及其氢键 HF(s):F—H…F H2O(s):O—H…O NH3(s):N—H…N
键能/(kJ· mol-1) 28.1 18.8 5.4
H2O、HF、NH3沸点依次降低的原因是 。
(2) 镓的卤化物熔点如下表所示。
物质 GaF3 GaCl3 GaBr3 GaI3
熔点/ ℃ 1 000 78 124 213
各物质的熔点从GaCl3、GaBr3、GaI3到GaF3依次升高,原因是______________
________________________________________________________________。
12.(4分)(2023·江苏各地模拟优选)回答下列问题:
物质 NaCl MgCl2 AlCl3
熔点/ ℃ 801 714 194
NaCl、MgCl2熔点比AlCl3熔点高的原因是___________________________
_____________________________________________。
(2) 苯甲酸的电离平衡常数为Ka=6.4×10-5,为什么邻羟基苯甲酸的电离平衡常数Ka1为苯甲酸的15.9 倍,而间羟基苯甲酸的电离平衡常数为苯甲酸的1.26倍?__________________________________________________________________。
13.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 金刚石和石墨的部分物理性质数据如下表所示:
物质 金刚石 石墨
熔点/ ℃ 3 550 3 652
硬度 10 1.5
石墨的熔点比金刚石高,硬度却比金刚石小得多,原因是__________________
___________________________________________________________________。
互为同分异构体的两种有机物形成氢键如图所示。
沸点:邻羟基苯甲醛 (填“>”“=”或“<”)对羟基苯甲醛,主要原因是 。
14.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 立方氮化硼(BN)是一种超硬材料,硬度仅次于金刚石;砷化镓(GaAs)是一种重要半导体材料,具有空间网状结构,比较立方氮化硼和砷化镓熔点的高低并说明理由:___________________________________________________________。
(2) 四种有机物的沸点数据如下表所示。
物质 CH3OH C2H6 CH3(CH2)9OH CH3(CH2)9CH3
相对分子质量 32 30 158 156
沸点/ ℃ 64.5 -88.6 228 196
CH3OH和C2H6沸点相差较大,CH3(CH2)9OH和CH3(CH2)9CH3沸点相差较小,原因是___________________________________________________________。
1.(4分)(2023·江苏各地模拟优选)回答下列问题:
(1) 已知C2H6和N2H4均含有18个电子的分子,判断在水中的溶解性大小并说明理由______________________________________________________________。
(2) 四种晶体的熔点数据如下表所示。
物质 ZnF2 ZnCl2 ZnBr2 ZnI2
熔点/ ℃ 872 283 394 446
ZnF2和ZnCl2熔点相差较大,后三者熔点相差较小,原因是________________
______________________________________________________________________。
2.(11分)(2023·江苏各地模拟优选)2019年1月3日,一吨多重的“嫦娥四号”探测器首次实现人类飞行器在月球背面的软着陆,它所搭载的“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量开展工作。下表是As、Ga等元素所在元素周期表中的一部分。回答下列问题:
Al Si P
Ga Ge As
上表中,原子半径最小的是 元素(填元素名称),元素周期表中镓的位置是 。从原子结构角度解释磷与砷的非金属性强弱:___
_____________________________________________________________________。
(2) GaAs可以用浓硝酸溶解,生成H3AsO4和Ga(NO3)3。配平反应的化学方程式,并标出电子转移方向和数目:GaAs+HNO3―→Ga(NO3)3+NO2↑+H3AsO4+H2O,_______________________________________________________________。
(3) GaN、GaAs、GaP都是良好的半导体材料,晶体类型与晶体硅相同,它们的熔点如下表所示。
晶体 GaN GaAs GaP
熔点/ ℃ 1 700 1 238 1 480
解释它们熔点变化的原因:___________________________________________。
(4) 亚磷酸(H3PO3)与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐,这两种盐溶液均呈碱性。根据以上信息判断,亚磷酸应属于 酸,Na2HPO3溶液中阴离子浓度由大到小的次序为 。
3.(10分)(2023·江苏各地模拟优选)含硼化合物由于其特殊的结构和性质在生产、生活和科研中应用广泛。回答下列问题:
(1) 基态硼原子的核外电子的空间运动状态有 种;B、N、H的电负性由大到小的顺序为____________________________________________________。
(2) 含硼阴离子[B6O7(OH)6]2-的结构如图所示。其中硼原子的杂化方式为 ,该结构中共有 种不同化学环境的氧原子。
(3) BF3与H2O结合形成固态化合物BF3·OH2…OH2,该物质在6.2 ℃时熔化电离出H3O+和一种含硼阴离子 (填离子符号),该熔化电离过程破坏的作用力为 ,H3O+的空间构型为 。
(4) 金属硼氢化物可用作储氢材料。一种金属硼氢化物氨合物的晶体结构如图所示。图中八面体的中心代表金属M原子,顶点代表氨分子;四面体的中心代表硼原子,顶点代表氢原子。该晶体属立方晶系,晶胞棱边夹角均为90°,棱长为a pm,密度为ρ g·cm-3,阿伏加德罗常数的值为NA。
该晶体的化学式为 。
4.(12分)(2023·江苏各地模拟优选)镓(31Ga)是化学史上第一种先理论预言,后在自然界中被发现并验证的元素。镓的化合物半导体广泛用于电子与微电子工业。
(1) 基态Ga原子中,核外电子占据的最高能层的符号是 。
(2) 门捷列夫预言的“类硼”(即钪,21Sc),“类铝”(即镓,31Ga),“类硅”(即锗,32Ge)三种元素中,未成对电子数最多的是 (填元素符号)。
(3) 氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,与晶体硅属于同一晶体类型。
①Ga、N、As三种元素的电负性由大到小的顺序是 。
②GaN熔点(1 700 ℃)高于GaAs熔点(1 238 ℃)的原因是_________________。
③GaAs可由Ga(CH3)3和AsH3在一定条件下制得,该反应的化学方程式是 ,
Ga(CH3)3分子中Ga原子的杂化方式是 ,AsH3分子的空间构型是 。
(4) 钆镓石榴石是一种激光介质材料,其晶体结构单位如图所示。
钆镓石榴石的化学式是 。
5.(12分)(2023·江苏各地模拟优选)镍钴锰三元材料LiNixCoyMnzO2是一类新型锂离子电池正极材料,具有容量高、循环稳定性好等优点。
(1) 锰元素基态原子的电子排布式为 ,镍、钴、锰三种基态原子中未成对电子数最多的是 。
(2) 镍可以形成多种配合物,如Ni(CO)4、[Ni(NH3)6]SO4等。
①上述两种配合物都存在的化学键的是 (填字母)。
a. 离子键 b. 配位键
c. 极性键 d. 非极性键
②Ni(CO)4常温下难溶于水,易溶于CCl4中,可推知其为__________________
(填“极性分子”或“非极性分子”)。
③[Ni(NH3)6]SO4中阴离子的空间构型为 。
(3) MnO和CoO具有相同的晶体构型,其熔点大小顺序为_________________。
(4) 锂离子电池目前广泛采用溶有LiPF6的碳酸酯作为电解液。
①LiPF6中各元素的第一电离能从大到小的顺序为_______________________。
②常见溶剂碳酸乙烯酯()中碳原子的杂化方式是 。
(5) LiCoO2的晶胞是六棱柱,其结构如图所示,镍钴锰三元材料中Ni和Mn取代了部分Co的位置:
晶胞中含Li原子数为 。
6.(14分)(2023·江苏各地模拟优选)磷及其化合物在工业生产中起着重要的作用。
(1) 基态磷原子价电子的轨道表示式是________________________________。
(2) 磷元素有白磷、黑磷等常见的单质。
①白磷(P4)是分子晶体,易溶于CS2,难溶于水,可能原因是______________
_____________________________________________。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是 (填字母)。
a. 层与层之间的作用力是共价键
b. 分子中磷原子杂化方式为sp2杂化
c. 是混合型晶体
(3) Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是 ,其空间构型是 。
(4) ⅢA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟的熔点分别为2 000、1 070 ℃,从结构角度说明其熔点差异的原因______________________________________________________。
②磷化硼是一种半导体材料,晶胞结构如下图所示。磷化硼的化学式是 。
7.(14分)(2023·江苏各地模拟优选)方钴矿化合物是典型的热电材料,在环境污染和能源危机日益严重的今天,进行新型热电材料的研究具有很强的现实意义。
(1) 基态Co的价电子排布式为 ,Co和Fe的逐级电离能数据如表,Fe的I4大于Co的原因是_________________________________________________。
元素 I1 I2 I3 I4 I5 ……
Fe 462.5 1 561.9 2 957 5 290 7 240
Co 760.4 1 648 3 232 4 950 7 670
(2) Sb是第五周期ⅤA族元素,其同族元素可用于研制农药,例如3,5-二氯苯胺是农用杀菌剂的关键中间体。可由以下方法合成:
①化合物乙中C原子杂化轨道类型为 。
②化合物甲中的σ键和π键个数之比为 (苯环中6个C原子共同形成了一个6原子6电子的大π键π)。
(3) 已知SbCl3的熔点为73 ℃,沸点为223.5 ℃,CoCl2的熔点为735 ℃,沸点为1 049 ℃。两者的熔、沸点差异较大的原因是____________________________。
预测SbCl3的空间构型为________________________________________。
(4) 科学家等研究了一类新型热电材料,叫作填隙方钴矿锑化物,在钴和锑形成的晶体空隙中填充入稀土原子La(如图所示),该化合物的化学式为______
______________________。
8.(14分)(2023·江苏各地模拟优选)Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞如图所示。
M
(1) Zn2+的价层电子排布式是 。
(2) C、O、N的电负性从大到小的顺序是 。
(3) 三乙撑二胺()与Zn2+能形成配位键的原因是_____________________
___________________________________________________________。
(4) 在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1,晶胞如图所示。一定条件下,随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2,被称为“会呼吸”的晶体。
M1
晶体 装载分子 晶胞中Zn2+个数 晶胞体积/cm3
M1 顺式偶氮苯 x 1.30×10-24
M2 反式偶氮苯 4 2.46×10-24
资料:
ⅰ. 反式偶氮苯顺式偶氮苯
ⅱ. M1和M2相互转化时,Zn2+的配体和配体数均不变
①N2的电子式是 。
②偶氮苯()中N的杂化轨道类型是 。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在 (填“σ键”或“π键”)。
③x= 。
④晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是 光照射。
9.(14分)(2023·江苏各地模拟优选)铜及其化合物在生产和生活中有着广泛的应用。请回答下列问题:
(1) 基态铜原子有 种运动状态不相同的电子,其价层电子排布式为
。
(2) 已知铜与氯形成化合物的立方晶胞如下图所示。
①该晶体的化学式为 。
②该晶体中,每个氯原子周围与它最近且等距离的氯原子有 个。
(3) Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如下实验。
序号 实验步骤 实验现象或结论
ⅰ 向CuSO4溶液中逐滴加入氨水至过量 产生蓝色沉淀,随后溶解并得到深蓝色的溶液
ⅱ 再加入无水乙醇 得到深蓝色晶体
ⅲ 测定深蓝色晶体的结构 晶体的化学式为[Cu(NH3)4]SO4·H2O
ⅳ 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 无蓝色沉淀生成
①深蓝色的配离子[Cu(NH3)4]2+的结构简式: 。
②[Cu(NH3)4]SO4·H2O晶体中H2O的中心原子杂化轨道类型为 。
③加入乙醇有晶体析出的原因是 。
④该实验条件下,Cu2+与NH3的结合能力 (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
⑤NH3能与Cu2+形成[Cu(NH3)4]2+,而NF3不能,其原因是
。
第4练 晶体结构与性质AB
1. 4
2. Ca2+
3. K2SeBr6
4. 2∶3 2∶1∶1
5. Fe 3d6
6. B 解析:由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,位于体内的铜离子和亚铜离子的个数之和为8,设晶胞中的铜离子和亚铜离子的个数分别为a和b,则a+b=8-4x,由化合价代数和为0可得2a+b=4×2,解得a=4x,A错误;由题意可知,Na2Se转化为Cu2-xSe的电极反应式为Na2Se-2e-+(2-x)Cu===Cu2-xSe+2Na+,由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,则每个晶胞中含有4个Na2Se,转移电子数为8,B正确;由题意可知,Cu2-xSe转化为NaCuSe的电极反应式为Cu2-xSe+e-+Na+===NaCuSe+(1-x)Cu,由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,则每个晶胞中含有4个NaCuSe,晶胞中0价铜的个数为(4-4x),C错误;由题意可知,NayCu2-xSe转化为NaCuSe的电极反应式为NayCu2-xSe+(1-y) e-+(1-y) Na+===NaCuSe+(1-x)Cu,所以每转移(1-y)mol电子,产生(1-x) mol铜,D错误。
1. B 解析:金刚石、晶体硅都为共价晶体,熔点高低由共价键键能大小决定,A不符合题意;HI、HCl对应的晶体为分子晶体,影响沸点高低的因素为分子间作用力,与共价键强弱无关,B符合题意;氮气分子中共价键键能较大,化学键较稳定,所以化学性质很稳定,C不符合题意;乙炔分子中含有π键,π键键能较弱、较活泼,易发生加成反应,D不符合题意。
2. D 解析:CO2是分子晶体,CO2的熔化与C===O键能没有关系,其熔化只需要克服范德华力(分子间作用力),SiO2是共价晶体,其熔化要破坏Si—O共价键,共价键的强度远远大于范德华力,A、B、C错误,D正确。
3. B 解析:氯化铵属于离子化合物,以离子晶体形式存在,A错误;单质碘属于分子晶体,以分子晶体形式存在,B正确;金刚石属于共价晶体,以共价晶体形式存在,C错误;单质硅属于共价晶体,以共价晶体形式存在,D错误。
4. A 解析:金刚石为共价晶体,晶体中含有非极性共价键C—C键,原子之间通过共价键结合,断裂需要吸收很高的能量,因此该物质的熔、沸点很高,所以可能有很高的熔、沸点,A正确;同种元素的原子形成的共价键是非极性共价键,不同种元素的原子形成的共价键是极性共价键, H2O2等含有非极性键,属于化合物,B错误;H2、O2等单质中含有非极性键,不属于有机物,因此不一定是有机物,C错误;离子化合物中一定含有离子键,也可能含有非极性共价键,如Na2O2,因此含有非极性键的化合物可能是离子晶体,D错误。
5. A 解析:AlCl3的熔点为190 ℃,熔点较低,因此为分子晶体,A错误;单质M的熔点为2 300 ℃,熔点高,可能是共价晶体,B正确;SiCl4的熔点为-70 ℃,熔点低,因此为分子晶体,C正确;SiC中C—Si键比金刚石中C—C键键长长,键能小,因此SiC的熔点比金刚石低,D正确。
6. C 解析:由图可知,每个晶胞中含有2个I原子,Ca原子的数目为×4+×4=1,因此该物质的化学式是CaI2,A正确;碘化钙是离子晶体,熔融状态和水溶液中均可导电,B正确;氟化钙和碘化钙均为离子化合物,阳离子相同,氟离子半径比碘离子半径小,因此氟化钙中阴、阳离子间作用力较强,熔、沸点较高,C错误;s区中的H是非金属元素,D正确。
7. D 解析:对羟基苯甲酸易形成分子间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,A不符合题意;金刚石、碳化硅、晶体硅都为共价晶体,C原子半径小于Si原子半径,则键长:C—C<C—Si<Si—Si,共价键越短,键能越大,熔、沸点越高,所以熔点:金刚石>碳化硅>晶体硅,B不符合题意;NaF、NaCl、NaBr、NaI均为离子晶体,阳离子均为Na+,离子半径:F-
8. B 解析:NH3是由极性键构成的极性分子,BF3是平面三角形,是由极性键构成的非极性分子,A错误;金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,金刚石的一个晶胞中含有的碳原子数为8,则1个立方氮化硼晶胞中应该含有4个N和4个B原子,B正确;NH4BF4中,NH中含有氮氢配位键,BF中含有硼氟配位键,则1 mol NH4BF4含有配位键的数目为2NA,C错误;立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,均是共价晶体,硼原子半径小于铝原子半径,所以立方氮化硼的熔点大于氮化铝,D错误。
9. (1) (2) 由于苯酚分子间存在较强的氢键,所以常温下溶解度不大,温度升高到65 ℃时,破坏了苯酚分子间氢键,并增加了苯酚的电离度,导致与水任意比互溶 (3) C60是分子晶体,金刚石是共价晶体,分子间作用力弱于共价键,所以C60和与金刚石相差较大,而石墨属于过渡型晶体,熔化时同样要破坏共价键,且石墨中的C—C键键长比金刚石短,共价键强,所以石墨的熔点比金刚石高
10. (1) ZnF2是离子晶体,ZnCl2是分子晶体,熔化时分别破坏离子键和分子间作用力,离子键强于分子间作用力;ZnCl2、ZnBr2、ZnI2是分子晶体,相对分子量越大,分子间作用力越强,熔点越高
(2) 顺丁烯二酸发生一级电离后,更易形成稳定的分子内氢键,使二级电离更困难
11. (1) 虽然单个氢键的键能大小顺序是HF>H2O>NH3,但从各固态物质中的氢键结构可以推知,液态H2O、HF、NH3中氢键数量各不相同,状态变化时要克服的氢键的总键能大小顺序是H2O>HF>NH3,所以H2O、HF、NH3沸点依次降低
(2) 四种物质组成相似,GaF3为离子晶体,熔点最高,其他三种均为分子晶体,分子间作用力随相对分子质量的增大而增大,熔点逐渐升高
12. (1) NaCl、MgCl2 是离子晶体,AlCl3为分子晶体,离子键的强度大于范德华力(分子间作用力) (2) +H+,中存在分子内氢键,更稳定,电离平衡常数更大
13. (1) 石墨晶体中C—C键的键能大于金刚石晶体中的C—C键的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多 (2) < 邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键
14. (1) 立方氮化硼熔点高。两种晶体均为共价晶体,N和B原子半径更小(或键长更短),键能更大,熔点更高 (2) 甲醇分子间可形成氢键,比乙烷分子间作用力强得多,所以沸点相差较大;CH3(CH2)9OH由于烃基较大,氢键作用被削弱,分子间以分子间作用力为主,所以与分子量接近的CH3(CH2)9CH3沸点相差较小
1. (1) 溶解性:N2H4大于C2H6,理由是N2H4与H2O分子之间能形成氢键,从而增大溶解;而乙烷不能与H2O分子之间能形成氢键,溶解性较小 (2) ZnF2是离子晶体,ZnCl2、ZnBr2、ZnI2是分子晶体,离子键的作用大于分子间作用力,故ZnF2的熔点较大,而后三者熔点较低且相差较小
2. (1) 磷 第四周期ⅢA族 磷原子和砷原子的最外层电子数相同,但磷原子比砷原子少一层电子,原子半径小,得电子能力强,所以磷的非金属性强于砷 (2) ===Ga(NO3)3+8NO2↑+H3AsO4+4H2O
(3) GaN、GaP、GaAs都是共价晶体,原子半径N<P<As,键长Ga—N<Ga—P<Ga—As,键能Ga—N>Ga—P>Ga—As,故GaN、GaP、GaAs的熔点依次降低 (4) 二元弱 HPO>OH->H2PO
3. (1) 3 N>H>B (2) sp2、sp3 4 (3) [BF3OH]- 共价键和氢键 三角锥形 (4) M(NH3)6(BH4)2
4. (1) N (2) Ge (3) ①N>As>Ga ②二者都属于共价晶体,由于原子半径:As>N,共价键的键长:Ga—As>Ga—N,则键能:Ga—As<Ga—N,断裂共价键消耗的能量:Ga—As<Ga—N,故物质的熔点:GaN>GaAs ③Ga(CH3)3+AsH3GaAs+3CH4 sp2杂化 三角锥形 (4) Gd3Ga5O12
5. (1) 1s22s22p63s23p63d54s2或[Ar]3d54s2 Mn (2) ①bc ②非极性分子 ③正四面体 (3) CoO>MnO (4) ①F>P>Li ②sp2、sp3 (5) 9
6. (1) (2) ①CS2是非极性分子,H2O是极性分子,根据相似相溶原理,P4是非极性分子,易溶于CS2,难溶于水 ②c
(3) PO 正四面体 (4) ①磷化铝和磷化铟属于共价晶体,由于Al、In为同主族元素,随着原子序数的递增,核外电子层数逐渐增加,原子半径:Al
(2) ①sp2 ②8∶1 (3) SbCl3是分子晶体,CoCl2是离子晶体 三角锥形 (4) LaCo4Sb12
8. (1) 3d10 (2) O>N>C (3) 三乙撑二胺中的N给出孤电子对,Zn2+有空轨道能接受孤电子对 (4) ①N N ②sp2 π键 ③2 ④紫外
9. (1) 29 3d104s1 (2) CuCl 12 (3) ① ②sp3 ③离子晶体在极性较弱的乙醇中溶解度小 ④大于 ⑤N、F、H三种元素的电负性大小为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键
同课章节目录
