主题2 物质结构与性质 第5练 物质结构与性质综合练习(含答案)—2024高考化学考前天天练
文档属性
| 名称 | 主题2 物质结构与性质 第5练 物质结构与性质综合练习(含答案)—2024高考化学考前天天练 |  | |
| 格式 | doc | ||
| 文件大小 | 278.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-25 20:00:02 | ||
图片预览


文档简介
第5练 物质结构与性质综合练习
满分:43分 限时:30分钟
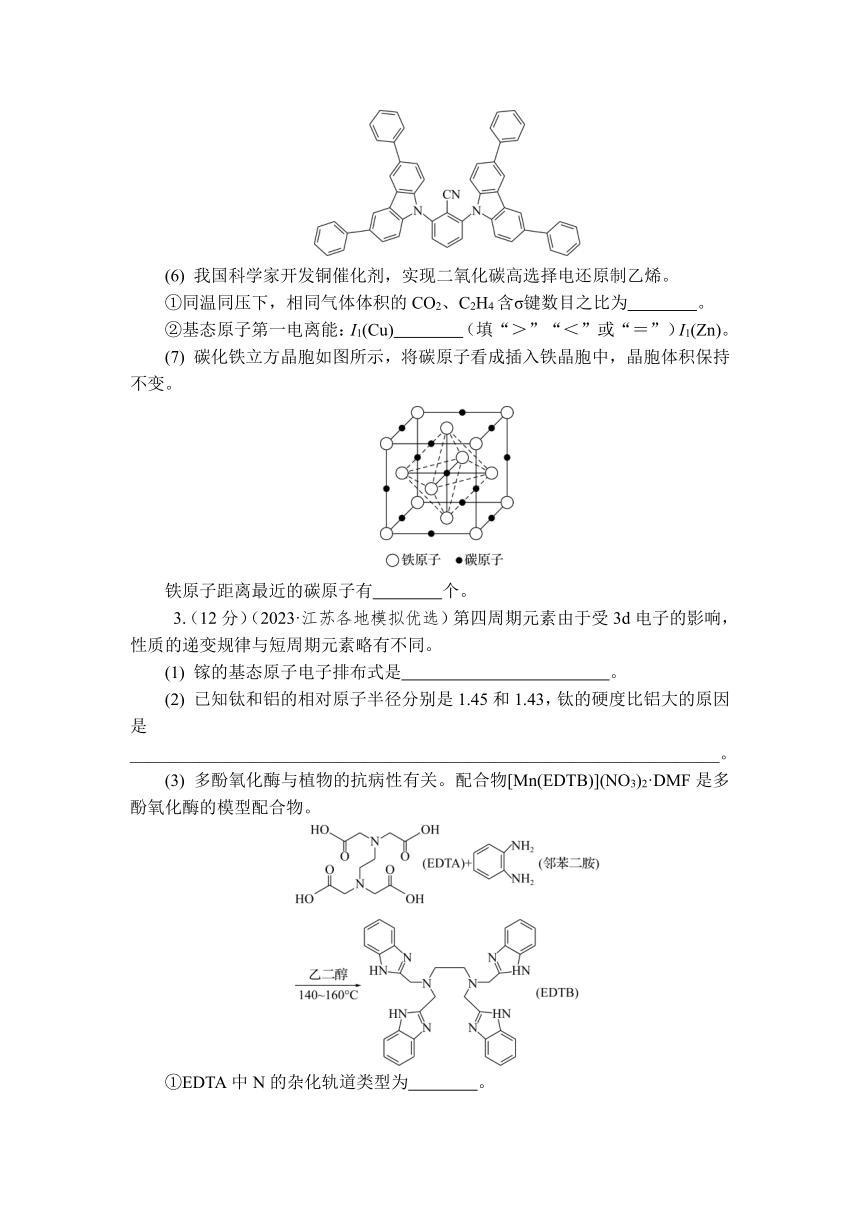
1.(9分)(2023·江苏各地模拟优选)研究者制备了一种含[Fe—O—O—Fe(—OH)2]铁双核结构的催化剂,实现了常温下CH4高效转化为CH3COOH。回答下列问题:
(1) 基态Fe3+的价电子排布式为_______________________________________。
(2) [Fe—O—O—Fe(—OH)2]中O原子的杂化形式为 ,草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷,其中NH的空间构型为 。
(3) 在无水状态下,FeCl2与NH3形成[Fe(NH3)6]Cl2,1 mol [Fe(NH3)6]Cl2含配位键的物质的量为 mol,NH3形成配合物后H—N—H键角会 (填“变大”“变小”或“不变”),原因是____________________________________________________________________________________________________。
(4) 黄铜矿是最重要的铜矿。黄铜矿的长方体晶胞结构及晶胞参数见下图。由图可知,黄铜矿的化学式为 。
2.(10分)(2023·江苏各地模拟优选)我国科学家合成介孔Fe—N—C催化剂大幅度提高了锌空气(O2)燃料电池的寿命和性能。请回答下列问题:
(1) 锌元素位于周期表的 区。
(2) N、C、O、Zn的电负性由大到小排序为 (填元素符号)
(3) 在N、C、O的简单氢化物中,沸点最高的是 (填化学式,下同),属于非极性分子的是 。
(4) [Zn(NH3)2(H2O)2]2+只有一种结构,则[Zn(NH3)4]2+的空间构型为 (填“正方形”或“正四面体形”)
(5) 我国科学家开发高效稳定荧光OLED器件,其材料的结构如图所示,碳原子杂化类型有 。
(6) 我国科学家开发铜催化剂,实现二氧化碳高选择电还原制乙烯。
①同温同压下,相同气体体积的CO2、C2H4含σ键数目之比为 。
②基态原子第一电离能:I1(Cu) (填“>”“<”或“=”)I1(Zn)。
(7) 碳化铁立方晶胞如图所示,将碳原子看成插入铁晶胞中,晶胞体积保持不变。
铁原子距离最近的碳原子有 个。
3.(12分)(2023·江苏各地模拟优选)第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1) 镓的基态原子电子排布式是 。
(2) 已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是____________________________________________________________________。
(3) 多酚氧化酶与植物的抗病性有关。配合物[Mn(EDTB)](NO3)2·DMF是多酚氧化酶的模型配合物。
①EDTA中N的杂化轨道类型为 。
②1个邻苯二胺分子中σ键的数目为 。
③EDTB分子中所含元素的电负性由小到大的顺序为____________________。
④与NO互为等电子体的一种阴离子为 。
⑤配离子[Mn(EDTB)]2+中的配位原子是 。
(4) 向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色透明溶液,向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解、后析出的原因是(用离子方程式和简单的文字说明加以解释):
______________________________________________________________________。
(5) 氮化铝在电子工业上有广泛应用,其晶胞如图1所示。N原子所在空隙的类型是 (填“正四面体”“正八面体”或“立方体”)空隙。
eq \o(\s\up7(),\s\do5(图1)) eq \o(\s\up7(),\s\do5(图2))
(6) 铁和氮组成一种过渡金属氮化物,其结构如图2所示。该化合物的化学式为 。
4.(4分)(2023·江苏各地模拟优选)碳和硅均为元素周期表中ⅣA族的元素,其单质和化合物有着重要应用。
(1) 石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式 。石墨烯中C的杂化类型为 。
②下图为单层石墨烯的结构示意图。12 g 的石墨烯中由C原子连接成的六元环的物质的量约为 mol。
③石墨烯加氢制得的石墨烷,可用(CH)n表示。下列有关叙述正确的是 (填字母,下同)。
a. 石墨烷属于烷烃
b. 石墨烷难溶于水
c. 石墨烷中所有碳原子共平面
d. 石墨烷可以发生加成反应
④石墨烯可由加热SiC晶体脱除Si的方法制得。该过程属于 。
a. 物理变化
b. 分解反应
c. 氧化还原反应
(2) SiC的晶体结构与晶体硅类似。SiC的晶体类型为 ,晶体中Si原子与Si-C键的数目之比为 。
(3) CHCl3与SiHCl3空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:_____________
_______________________________________________________________。
5.(8分)(2023·江苏各地模拟优选)离子液体是指在室温附近呈液态的全部由离子构成的物质,也称室温熔融盐。离子液体有许多传统溶剂无法比拟的独特性能,广泛应用于化学研究的各个领域。1-丁基-3-甲基咪唑六氟磷酸盐(简称BMIM,结构如图)是一种常见的离子液体,熔点为6.5 ℃,可代替有机溶剂用于酶促酯合成以及其他环境友好的反应。请回答下列问题:
(1) 基态磷原子价电子排布图为______________________________________。
(2) N、F、P三种元素第一电离能由大到小顺序为 。
(3) 已知分子中的大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则BMIM中的大π键可表示为 。
(4) 离子晶体的熔点一般较高,如氯化钠的熔点为801℃,而离子液体的熔点一般低于150 ℃。结合BMIM的结构分析离子液体的熔点一般较低的原因:____________________________________________________________________。
(5) 下列有关离子液体的叙述正确的是 (填字母)。
a. 离子液体具有良好的导电性,可以作为电池的电解质
b. 离子液体中含有离子键、共价键、配位键和氢键等化学键
c. 离子液体与传统溶剂相比具有难挥发的优点,是一种“绿色”溶剂
d. 通过改变阳离子、阴离子的不同组合,可以设计合成出不同的离子液体
e. 离子液体对有机物有良好的溶解性能,而对无机物的溶解性能较差
(6) 化学家发现一种组成为N4H的阳离子,其结构中N原子均为sp3杂化,请推测N4H的结构式: 。
(7) 某种离子液体低温下的晶胞结构如图所示。该离子液体化学式为 。
第5练 物质结构与性质综合练习
1. (1) 3d5 (2) sp3 正四面体 (3) 6 变大 NH3形成配合物后,N周围的孤电子对变为成键电子对,且孤电子对对成键电子对的排斥作用大于成键电子对对成键电子对的排斥作用 (4) CuFeS2
2. (1) ds (2) O>N>C>Zn (3) H2O CH4 (4) 正四面体形 (5) sp、sp2
(6) ①2∶5 ②< (7) 6
3. (1) 1s22s22p63s23p63d104s24p1 (2) Ti原子的价电子数比Al多,金属键更强 (3) ①sp3 ②16 ③H(6) Fe3N
4. (1) ①1s22s22p2 sp2杂化 ②0.5 ③ b ④bc (2) 共价晶体 1∶4 (3) SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑
5. (1) (2) F>N>P (3) π (4) 离子液体阴阳离子体积很大,结构松散,导致阴阳离子之间的作用力较小,熔点较低
(5) acd (6) (7) XY
满分:43分 限时:30分钟
1.(9分)(2023·江苏各地模拟优选)研究者制备了一种含[Fe—O—O—Fe(—OH)2]铁双核结构的催化剂,实现了常温下CH4高效转化为CH3COOH。回答下列问题:
(1) 基态Fe3+的价电子排布式为_______________________________________。
(2) [Fe—O—O—Fe(—OH)2]中O原子的杂化形式为 ,草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷,其中NH的空间构型为 。
(3) 在无水状态下,FeCl2与NH3形成[Fe(NH3)6]Cl2,1 mol [Fe(NH3)6]Cl2含配位键的物质的量为 mol,NH3形成配合物后H—N—H键角会 (填“变大”“变小”或“不变”),原因是____________________________________________________________________________________________________。
(4) 黄铜矿是最重要的铜矿。黄铜矿的长方体晶胞结构及晶胞参数见下图。由图可知,黄铜矿的化学式为 。
2.(10分)(2023·江苏各地模拟优选)我国科学家合成介孔Fe—N—C催化剂大幅度提高了锌空气(O2)燃料电池的寿命和性能。请回答下列问题:
(1) 锌元素位于周期表的 区。
(2) N、C、O、Zn的电负性由大到小排序为 (填元素符号)
(3) 在N、C、O的简单氢化物中,沸点最高的是 (填化学式,下同),属于非极性分子的是 。
(4) [Zn(NH3)2(H2O)2]2+只有一种结构,则[Zn(NH3)4]2+的空间构型为 (填“正方形”或“正四面体形”)
(5) 我国科学家开发高效稳定荧光OLED器件,其材料的结构如图所示,碳原子杂化类型有 。
(6) 我国科学家开发铜催化剂,实现二氧化碳高选择电还原制乙烯。
①同温同压下,相同气体体积的CO2、C2H4含σ键数目之比为 。
②基态原子第一电离能:I1(Cu) (填“>”“<”或“=”)I1(Zn)。
(7) 碳化铁立方晶胞如图所示,将碳原子看成插入铁晶胞中,晶胞体积保持不变。
铁原子距离最近的碳原子有 个。
3.(12分)(2023·江苏各地模拟优选)第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1) 镓的基态原子电子排布式是 。
(2) 已知钛和铝的相对原子半径分别是1.45和1.43,钛的硬度比铝大的原因是____________________________________________________________________。
(3) 多酚氧化酶与植物的抗病性有关。配合物[Mn(EDTB)](NO3)2·DMF是多酚氧化酶的模型配合物。
①EDTA中N的杂化轨道类型为 。
②1个邻苯二胺分子中σ键的数目为 。
③EDTB分子中所含元素的电负性由小到大的顺序为____________________。
④与NO互为等电子体的一种阴离子为 。
⑤配离子[Mn(EDTB)]2+中的配位原子是 。
(4) 向盛有硫酸铜水溶液的试管中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色透明溶液,向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解、后析出的原因是(用离子方程式和简单的文字说明加以解释):
______________________________________________________________________。
(5) 氮化铝在电子工业上有广泛应用,其晶胞如图1所示。N原子所在空隙的类型是 (填“正四面体”“正八面体”或“立方体”)空隙。
eq \o(\s\up7(),\s\do5(图1)) eq \o(\s\up7(),\s\do5(图2))
(6) 铁和氮组成一种过渡金属氮化物,其结构如图2所示。该化合物的化学式为 。
4.(4分)(2023·江苏各地模拟优选)碳和硅均为元素周期表中ⅣA族的元素,其单质和化合物有着重要应用。
(1) 石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式 。石墨烯中C的杂化类型为 。
②下图为单层石墨烯的结构示意图。12 g 的石墨烯中由C原子连接成的六元环的物质的量约为 mol。
③石墨烯加氢制得的石墨烷,可用(CH)n表示。下列有关叙述正确的是 (填字母,下同)。
a. 石墨烷属于烷烃
b. 石墨烷难溶于水
c. 石墨烷中所有碳原子共平面
d. 石墨烷可以发生加成反应
④石墨烯可由加热SiC晶体脱除Si的方法制得。该过程属于 。
a. 物理变化
b. 分解反应
c. 氧化还原反应
(2) SiC的晶体结构与晶体硅类似。SiC的晶体类型为 ,晶体中Si原子与Si-C键的数目之比为 。
(3) CHCl3与SiHCl3空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:_____________
_______________________________________________________________。
5.(8分)(2023·江苏各地模拟优选)离子液体是指在室温附近呈液态的全部由离子构成的物质,也称室温熔融盐。离子液体有许多传统溶剂无法比拟的独特性能,广泛应用于化学研究的各个领域。1-丁基-3-甲基咪唑六氟磷酸盐(简称BMIM,结构如图)是一种常见的离子液体,熔点为6.5 ℃,可代替有机溶剂用于酶促酯合成以及其他环境友好的反应。请回答下列问题:
(1) 基态磷原子价电子排布图为______________________________________。
(2) N、F、P三种元素第一电离能由大到小顺序为 。
(3) 已知分子中的大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则BMIM中的大π键可表示为 。
(4) 离子晶体的熔点一般较高,如氯化钠的熔点为801℃,而离子液体的熔点一般低于150 ℃。结合BMIM的结构分析离子液体的熔点一般较低的原因:____________________________________________________________________。
(5) 下列有关离子液体的叙述正确的是 (填字母)。
a. 离子液体具有良好的导电性,可以作为电池的电解质
b. 离子液体中含有离子键、共价键、配位键和氢键等化学键
c. 离子液体与传统溶剂相比具有难挥发的优点,是一种“绿色”溶剂
d. 通过改变阳离子、阴离子的不同组合,可以设计合成出不同的离子液体
e. 离子液体对有机物有良好的溶解性能,而对无机物的溶解性能较差
(6) 化学家发现一种组成为N4H的阳离子,其结构中N原子均为sp3杂化,请推测N4H的结构式: 。
(7) 某种离子液体低温下的晶胞结构如图所示。该离子液体化学式为 。
第5练 物质结构与性质综合练习
1. (1) 3d5 (2) sp3 正四面体 (3) 6 变大 NH3形成配合物后,N周围的孤电子对变为成键电子对,且孤电子对对成键电子对的排斥作用大于成键电子对对成键电子对的排斥作用 (4) CuFeS2
2. (1) ds (2) O>N>C>Zn (3) H2O CH4 (4) 正四面体形 (5) sp、sp2
(6) ①2∶5 ②< (7) 6
3. (1) 1s22s22p63s23p63d104s24p1 (2) Ti原子的价电子数比Al多,金属键更强 (3) ①sp3 ②16 ③H
4. (1) ①1s22s22p2 sp2杂化 ②0.5 ③ b ④bc (2) 共价晶体 1∶4 (3) SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑
5. (1) (2) F>N>P (3) π (4) 离子液体阴阳离子体积很大,结构松散,导致阴阳离子之间的作用力较小,熔点较低
(5) acd (6) (7) XY
同课章节目录
