主题4 化学变化与规律 第1练 物质转化历程AB(含解析)—2024高考化学考前天天练
文档属性
| 名称 | 主题4 化学变化与规律 第1练 物质转化历程AB(含解析)—2024高考化学考前天天练 |  | |
| 格式 | doc | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-25 20:22:14 | ||
图片预览


文档简介
主题4 化学变化与规律
第1练 物质转化历程AB
真题快递+天天练A组 满分:42分 限时:30分钟
天天练B组 满分:30分 限时:20分钟
1.(3分)(2022·山东)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
A. 含N分子参与的反应一定有电子转移
B. 由NO生成HONO的反应历程有2种
C. 增大NO的量,C3H8的平衡转化率不变
D. 当主要发生包含②的历程时,最终生成的水减少
2.(3分)(2022·广东)科学家进行了如图所示的碳循环研究。下列说法正确的是( )
A. 淀粉是多糖,在一定条件下能水解成葡萄糖
B. 葡萄糖与果糖互为同分异构体,都属于烃类
C. 1 mol CO中含有6.02×1024个电子
D. 22.4 L CO2被还原生成1 mol CO
3.(3分)(2022·湖南)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO转化为N2进入大气层,反应过程如图所示。
下列说法正确的是( )
A. 过程Ⅰ中NO发生氧化反应
B. a和b中转移的e-数目相等
C. 过程Ⅱ中参与反应的n(NO)∶n(NH)=1∶4
D. 过程Ⅰ→Ⅲ的总反应为NO+NH===N2↑+2H2O
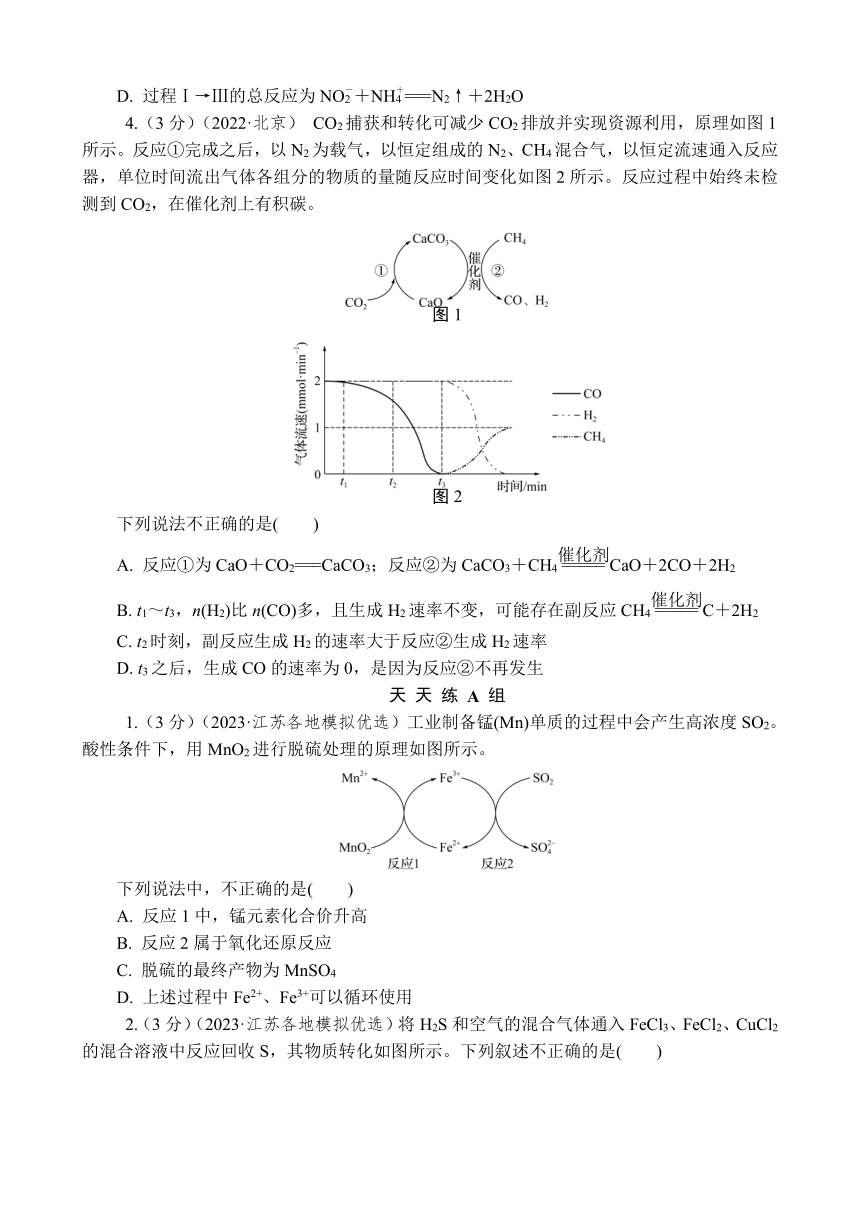
4.(3分)(2022·北京) CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
eq \o(\s\up7(),\s\do5(图1))
eq \o(\s\up7(),\s\do5(图2))
下列说法不正确的是( )
A. 反应①为CaO+CO2===CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B. t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能存在副反应CH4C+2H2
C. t2时刻,副反应生成H2的速率大于反应②生成H2速率
D. t3之后,生成CO的速率为0,是因为反应②不再发生
1.(3分)(2023·江苏各地模拟优选)工业制备锰(Mn)单质的过程中会产生高浓度SO2。酸性条件下,用MnO2进行脱硫处理的原理如图所示。
下列说法中,不正确的是( )
A. 反应1中,锰元素化合价升高
B. 反应2属于氧化还原反应
C. 脱硫的最终产物为MnSO4
D. 上述过程中Fe2+、Fe3+可以循环使用
2.(3分)(2023·江苏各地模拟优选)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述不正确的是( )
A. H2S和空气通过上述循环的目的是降低活化能,提高总反应速率
B. 在转化过程中能循环利用的物质是FeCl3和CuCl2
C. 该过程的总反应式为2H2S+O22H2O+2S↓
D. 若有1 mol H2S发生图示转化的同时消耗O2为0.4 mol,则混合液中Fe3+浓度增大
3.(3分)(2023·江苏各地模拟优选)联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是( )
A. ①转化中N2H4是还原剂
B. ③中发生反应后溶液的pH减小
C. 1 mol N2H4可处理水中1 mol O2
D. 工业上也可使用Na2SO3处理锅炉水中的溶解氧
4.(3分)(2023·江苏各地模拟优选)《环境科学》刊发了我国科研部门采用零价铁(ZVI)活化过二硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)]的研究成果,其反应机制模型如图所示。下列叙述不正确的是( )
A. 56 g Fe参加反应,消耗的S2O大于1 mol
B. 过二硫酸钠(Na2S2O8)中S的化合价为+6价
C. pH越大,越有利于去除废水中的正五价砷
D. 碱性条件下,硫酸根自由基发生反应的方程式为SO·+H2O===SO+·OH+H+
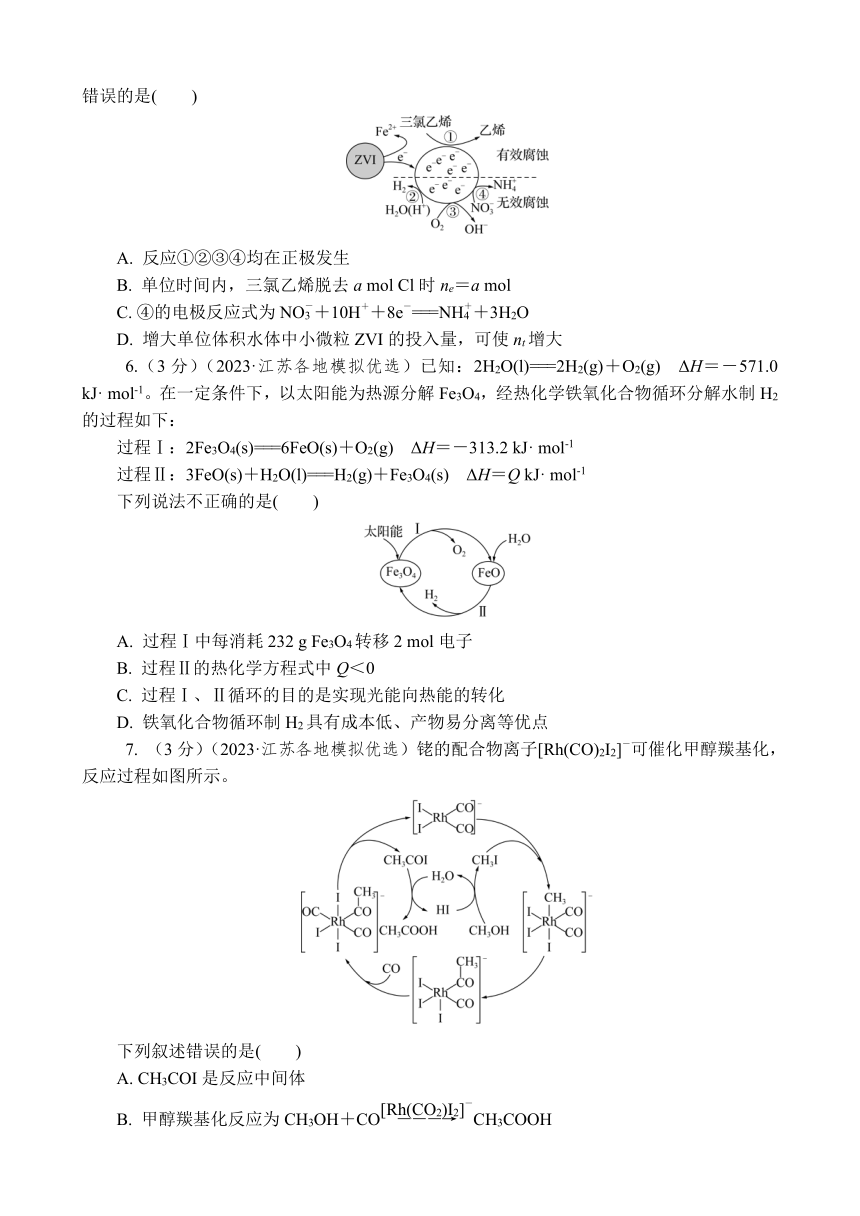
5.(3分)(2023·江苏各地模拟优选)利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图。H+、O2、NO等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是( )
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去a mol Cl时ne=a mol
C. ④的电极反应式为NO+10H++8e-===NH+3H2O
D. 增大单位体积水体中小微粒ZVI的投入量,可使nt增大
6.(3分)(2023·江苏各地模拟优选)已知:2H2O(l)===2H2(g)+O2(g) ΔH=-571.0 kJ· mol-1。在一定条件下,以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g) ΔH=-313.2 kJ· mol-1
过程Ⅱ:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=Q kJ· mol-1
下列说法不正确的是( )
A. 过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子
B. 过程Ⅱ的热化学方程式中Q<0
C. 过程Ⅰ、Ⅱ循环的目的是实现光能向热能的转化
D. 铁氧化合物循环制H2具有成本低、产物易分离等优点
7. (3分)(2023·江苏各地模拟优选)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( )
A. CH3COI是反应中间体
B. 甲醇羰基化反应为CH3OH+COCH3COOH
C. 反应过程中Rh的成键数目保持不变
D. 存在反应CH3OH+HI―→CH3I+H2O
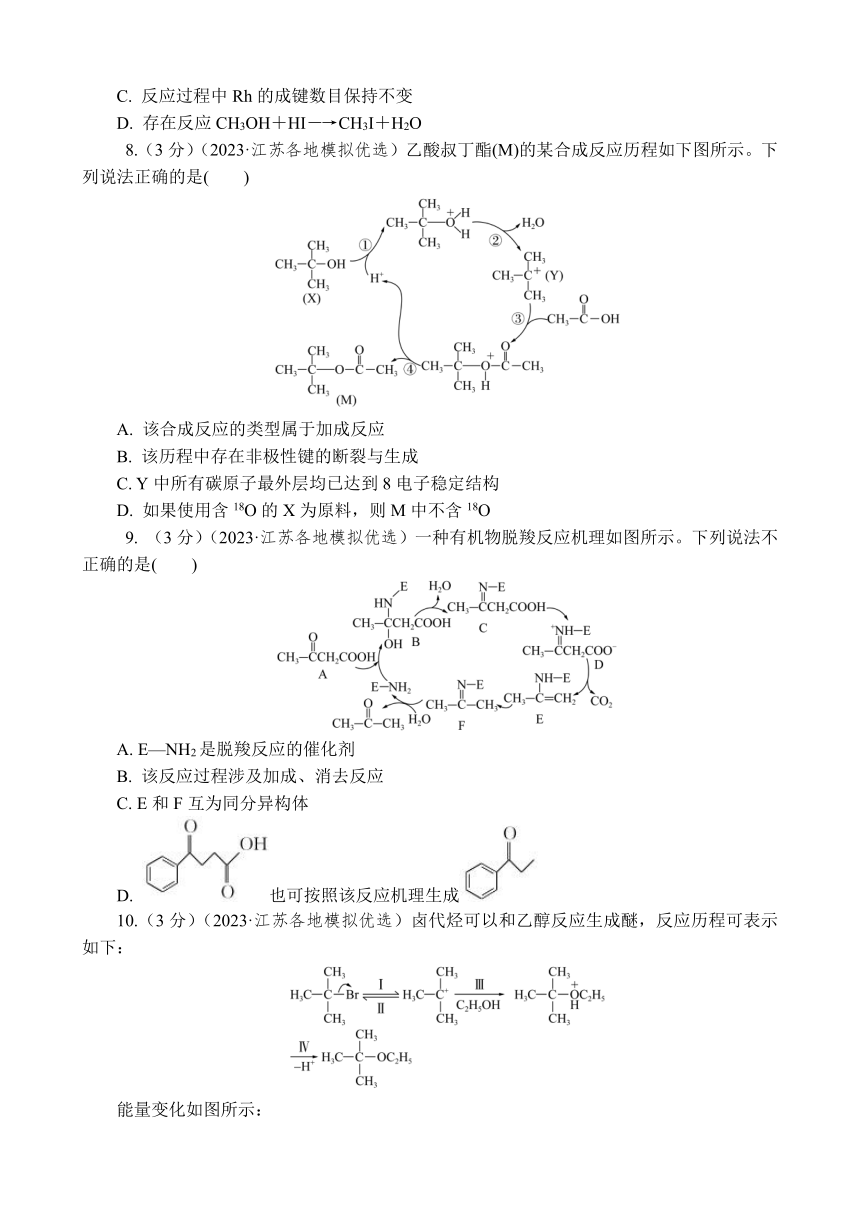
8.(3分)(2023·江苏各地模拟优选)乙酸叔丁酯(M)的某合成反应历程如下图所示。下列说法正确的是( )
A. 该合成反应的类型属于加成反应
B. 该历程中存在非极性键的断裂与生成
C. Y中所有碳原子最外层均已达到8电子稳定结构
D. 如果使用含18O的X为原料,则M中不含18O
9. (3分)(2023·江苏各地模拟优选)一种有机物脱羧反应机理如图所示。下列说法不正确的是( )
A. E—NH2是脱羧反应的催化剂
B. 该反应过程涉及加成、消去反应
C. E和F互为同分异构体
D. 也可按照该反应机理生成
10.(3分)(2023·江苏各地模拟优选)卤代烃可以和乙醇反应生成醚,反应历程可表示如下:
能量变化如图所示:
下列说法正确的是( )
A. 高温条件下有利于反应Ⅰ的进行
B. 反应Ⅱ是决速步骤
C. 反应Ⅲ的中间体比反应Ⅳ的中间体稳定
D. 各步反应都有共价键的断裂和生成
1.(3分)(2023·江苏各地模拟优选)Buchwald Hartwig偶联反应(布赫瓦尔德-哈特维希反应)是合成芳胺的重要方法,反应机理如图(图中Ar表示芳香烃基,表示为副反应)。下列有关说法不正确的是 ( )
A. 3、5和8都是反应的中间体
B. 该过程仅涉及加成反应
C. 理论上1 mol最多能消耗2 mol
D. 若原料用和,则可能得到的产物为、和
2.(3分)(2023·江苏各地模拟优选)TRAP是一种温和的氧化剂,TRAP试剂中的RuO不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。TRAP氧化醇的反应机理如下图,下列说法正确的是( )
A. 铑(Ru)在TRAP机理图中共呈现了4种价态
B. 步骤④中NMO作还原剂,作用是使TRAP试剂再生
C. 反应⑥的离子方程式为2RuO===RuO2+RuO,是TRAP试剂再生的另一途径
D. 若R1为CH2===CH—,R2为H—,则TRAP氧化该醇的主产物为丙醛
3.(3分)(2023·江苏各地模拟优选)脯氨酸是构成蛋白质的氨基酸之一,是其中唯一的亚氨基酸。Benjamin List发现脯氨酸可以催化不对称有机反应,因此获得了2021年的诺贝尔化学奖。脯氨酸催化的羟醛缩合反应机理如图所示。下列有关说法不正确的是( )
A. 反应原料中的原子100%转化为产物
B. 由图中可知脯氨酸的结构为
C. 该过程涉及了加成反应和消去反应
D. 若原料用2 丁酮和苯甲醛,则产物可能为
4.(3分)(2023·江苏各地模拟优选)Negishi偶联反应是构筑碳碳键的重要方法之一,反应过程如图所示(R、R′表示烃基)。下列说法正确的是( )
A. RZnCl是该反应的催化剂
B. 反应过程中只生成一种偶联有机产物
C. 反应过程中涉及极性键的断裂和非极性键的形成
D. 存在反应方程式:
5.(3分)(2023·江苏各地模拟优选)下列说法不正确的是( )
A. 总反应可表示为H2+O2===H2O2
B. 该过程中Pd的化合价有0价和+2价两种状态
C. ①②均为氧化还原反应
D. HCl和Cl-可循环利用
6.(3分)(2023·江苏各地模拟优选)Pd/C催化某清洁反应是获得甲苯的常用途径,反应机理如图所示。下列说法错误的是( )
A. 若—R为—C2H5,则X为乙醇
B. 反应过程存在极性键及非极性键的断裂和形成
C. 该途径生产甲苯符合原子利用率100%
D. 活性炭可以负载高分散的Pd,提高催化剂活性
7.(3分)(2023·江苏各地模拟优选)近年,在钯(Pd)催化下进行的偶联反应成为研究热点,其中一种反应机理如图所示,下列有关说法错误的是( )
已知:R1、R2表示烃基,X表示卤原子,Y表示羟基。
A. 转化过程中涉及氧化还原反应
B. 转化过程中未发生非极性键的断裂和形成
C. R2—Pd(Ⅱ)—OC(CH3)3是中间体
D. 转化过程中存在如下反应:R2—Pd(Ⅱ)—X+NaOC(CH3)3―→NaX+R2
—Pd(Ⅱ)—OC(CH3)3
8.(3分)(2023·江苏各地模拟优选)以SiO2表面隔离的Cr3+催化丙烷无氧脱氢的机理如图,随着反应的进行,副反应产生的积炭会导致催化剂失活。下列说法正确的是( )
A. 基态铬原子核外有6种能量不同的电子
B. 总反应方程式为C3H8C3H4 +2H2
C. Cr3+改变反应活化能的同时改变了反应的热效应
D. 在该体系中加入CO2有利于丙烷脱氢
9.(3分)(2023·江苏各地模拟优选)据文献报道,氨催化还原法可用来消除某些污染气体,其反应历程如图所示。
下列说法错误的是( )
A. V的价电子排布式为3d34s2
B. V5+—OH在该反应过程中作催化剂
C. 总反应化学方程式为4NH3+3O22N2+6H2O
D. 当消耗标准状况下11.2 L O2时,整个过程转移6 mol e-
10.(3分)(2023·江苏各地模拟优选)我国科学家开发出新型铁纳米催化剂,实现了芳环和杂芳环的氢氘交换反应。该纳米催化方法具有很高的普适性,可对芳胺、酚、含氮杂环等近90个化合物进行选择性氘代,实现了超过30个氘代药物分子和天然产物的制备。其反应历程如图所示。
提示:—X表示—NH2、—OH等官能团。下列说法错误的是( )
A. 该新型纳米铁催化剂不能增大平衡常数
B. 上述循环中断裂了极性键和形成了非极性键
C. 上述总反应属于取代反应
D. 总反应方程式为+DOH
主题4 化学变化与规律 第1练 物质转化历程AB
1. D 解析:根据反应机理的图示知,含N分子发生的反应有NO+·OOH===NO2+·OH、NO+NO2+H2O===2HONO、NO2+·C3H7===C3H6+HONO、HONO===NO+·OH,含N分子NO、NO2、HONO中N元素的化合价依次为+2价、+4价、+3价,上述反应中均有元素化合价的升降,都为氧化还原反应,一定有电子转移,A正确;根据图示,由NO生成HONO的反应历程有2种,B正确;NO是催化剂,增大NO的量,C3H8的平衡转化率不变,C正确;无论反应历程如何,在NO催化下,丙烷与O2反应制备丙烯的总反应都为2C3H8+O22C3H6+2H2O,当主要发生包含②的历程时,最终生成的水不变,D错误。
2. A 解析:淀粉是由葡萄糖分子聚合而成的多糖,在一定条件下水解可得到葡萄糖,A正确;葡萄糖与果糖的分子式均为C6H12O6,结构不同,二者互为同分异构体,但含有O元素,不是烃类,属于烃的衍生物,B错误;一个CO分子含有14个电子,则1 mol CO中含有14×6.02×1023=8.428×1024个电子,C错误;未指明气体处于标况下,不能用标况下的气体摩尔体积计算其物质的量,D错误。
3. D 解析:由图示可知,过程Ⅰ中NO转化为NO,氮元素化合价由+3价降低到+2价,NO作氧化剂,被还原,发生还原反应,A错误;由图示可知,过程Ⅰ为NO在酶1的作用下转化为NO和H2O,依据得失电子守恒、电荷守恒和原子守恒可知,生成1 mol NO,a过程转移1 mol e-,过程Ⅱ为NO和NH在酶2的作用下发生氧化还原反应生成H2O和N2H4,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为NO+NH+3e-+2H+H2O+N2H4,消耗1 mol NO,b过程转移4 mol e-,转移电子数目不相等,B错误;由图示可知,过程Ⅱ发生反应的参与反应的离子方程式为NO+NH+3e-+2H+H2O+N2H4,n(NO)∶n(NH)=1∶1,C错误;由图示可知,过程Ⅰ的离子方程式为NO+2H++e-NO+H2O,过程Ⅱ的离子方程式为NO+NH+3e-+2H+H2O+N2H4,过程Ⅲ的离子方程式为N2H4N2↑+4H++4e-,则过程Ⅰ→Ⅲ的总反应为NO+NH=== N2↑+2H2O,D正确。
4. C 解析:由题干图1所示信息可知,反应①为CaO+CO2===CaCO3,结合氧化还原反应配平可得反应②为CaCO3+CH4CaO+2CO+2H2,A正确;由题干图2信息可知,t1~t3,n(H2)比n(CO)多,且生成H2速率不变,且反应过程中始终未检测到CO2,在催化剂上有积碳,故可能存在副反应CH4C+2H2,反应②和副反应中CH4和H2的系数比均为1∶2,B正确;由题干反应②方程式可知,H2和CO的反应速率相等,而t2时刻信息可知,H2的反应速率未变,仍然为2 mmol·min-1,而CO变为1~2 mmol·min-1之间,故能够说明副反应生成H2的速率小于反应②生成H2速率,C错误;由题干图2信息可知,t3之后,CO的速率为0,CH4的速率逐渐增大,最终恢复到1,说明生成CO的速率为0,是因为反应②不再发生,D正确。
1. A 解析:反应1中,锰元素化合价由+4价降低为+2价,A错误;反应2中Fe、S元素化合价有变化,属于氧化还原反应,B正确;根据图示,总反应为MnO2+SO2=== MnSO4,脱硫的最终产物为MnSO4,C正确;根据流程图,可知Fe2+、Fe3+可以循环使用,D正确。
2. D 解析:总反应为硫化氢和氧气反应生成硫和水,H2S和空气通过上述循环相当于铁离子和铜离子作催化剂,催化剂能降低活化能,提高总反应速率,A正确;在转化过程中能循环利用的离子是铁离子和铜离子,则对应的物质是FeCl3和CuCl2,B正确;由图可知,反应物为H2S、O2,生成物为H2O、S,该过程的总反应式为2H2S+O22H2O+2S↓,C正确;总反应为硫化氢和氧气反应生成硫和水,若有1 mol H2S发生图示转化,则失去电子为2 mol,若同时消耗O2为0.4 mol,则得到电子为1.6 mol,则混合液中Fe3+浓度因消耗而减小,D错误。
3. B 解析:①转化中N2H4变成N2,氮元素的化合价升高,所以N2H4是还原剂,A正确;③中发生反应的离子方程式为4Cu(NH3)+O2+2H2O+8NH3===4Cu(NH3)+4OH-,所以溶液的pH增大,B错误;根据反应的机理可知,本质上可看成氧气氧化N2H4,根据电子守恒:O2~4OH-~4e-,N2H4~N2~4e-,所以消耗的n(O2)=n(N2H4),C正确;Na2SO3具有强还原性,能够被锅炉水中的溶解氧氧化:2Na2SO3+O2===2Na2SO4,而且使用常见的Na2SO3成本低,所以工业上也可使用Na2SO3处理锅炉水中的溶解氧,D正确。
4. D 解析:56 g Fe参加反应,根据图示,可得出转化过程中Fe先被S2O氧化为Fe2+,反应为Fe+S2O===Fe2++2SO,然后Fe2+进一步被S2O氧化为Fe3+,最后沉淀中有Fe(OH)2和Fe(OH)3,所以56 g Fe参加反应时,消耗的S2O大于1 mol,A正确;S的化合价为+6价,因为有两个氧是-1价,六个氧是-2价,B正确;碱性条件有利于形成Fe(OH)2和Fe(OH)3沉淀,与正五价砷发生共沉淀,C正确;结合图示可知,碱性条件下,SO·发生反应的方程式为SO·+OH-===SO+·OH,D错误。
5. B 解析:由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,A正确;三氯乙烯C2HCl3中C原子化合价为+1价,乙烯中C原子化合价为-2价,1 mol C2HCl3转化为1 mol C2H4时,得到6 mol电子,脱去3 mol氯原子,所以脱去a mol Cl时ne=2a mol,B错误;由示意图及N元素的化合价变化可写出如下转化NO+8e-―→NH,由于生成物中有NH,所以只能用H+和H2O来配平该反应,而不能用H2O和OH-来配平,所以④的电极反应式为NO+10H++8e-===NH+3H2O,C正确;增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,增大ZVI释放电子的速率,可使nt增大,D正确。
6. C 解析: 由过程Ⅰ可知,2 mol Fe3O4发生反应,会生成1 mol氧气,转移4 mol电子,那么每消耗232 g即1 mol Fe3O4转移2 mol电子,A正确;利用盖斯定律,由2H2O(l)===2H2(g)+O2(g) ΔH=-571.0 kJ· mol-1和2Fe3O4(s)===6FeO(s)+O2(g) ΔH=-313.2 kJ· mol-1可得Q=(-571.0 kJ· mol-1+313.2 kJ· mol-1)=-128.9 kJ· mol-1,所以过程Ⅱ的热化学方程式中Q<0,B正确;过程Ⅰ是太阳能转化为热能,过程Ⅱ是热能转化为化学能,目的是实现太阳能向化学能的转化,C错误;铁氧化合物循环制H2成本低且产物一个是固体,一个是气体,易分离,D正确。
7. C 解析:CH3COI属于甲醇羰基化反应的反应中间体,A正确;甲醇羰基化反应,反应物为甲醇以及CO,产物为乙酸,方程式可写成:CH3OH+COCH3COOH,B正确;铑配合物在整个反应历程中,成键数目、配体种类等均发生了变化,C错误;反应中间体CH3COI与水作用生成的HI可以使甲醇转化为CH3I,方程式可写成:CH3OH+HI―→CH3I+H2O,D正确。
8. D 解析:该反应属于取代反应,A不符合题意;该反应中只存在C—O键、O—H键等极性键断裂,没有非极性键断裂,B不符合题意;Y中最中间的碳正离子缺电子,最外层电子数未达8电子稳定结构,C不符合题意;根据该反应进程描述,可以看到是叔丁醇上C—O键断裂,最终连接的是乙酸提供的氧原子,故X结构中若带有18O原子,最终不会存在于产物酯的分子中,会在生成的水分子中,D符合题意。
9. D 解析:根据有机物脱羧反应机理图可知,E—NH2先参与反应,后面又生成,没有增加或减少,故应为催化剂,A正确;A→B是加成反应,B→C是消去反应,B正确;E和F的分子式相同,结构不同,属于同分异构体,C正确;从C→E过程可以看到,碳碳双键是在羧基相连的碳原子上形成,连有氮原子的碳原子也形成碳碳双键,然后才能转化成含有碳氮双键的结构,而对于,只能形成,无法继续向下进行,所以不能按照该反应机理进行,D错误。
10. A 解析:反应Ⅰ是吸热反应,高温条件下有利于反应Ⅰ的进行,A正确;反应Ⅰ活化能最大,是决速步骤,B错误;反应Ⅲ的中间体比反应Ⅳ的中间体能量高,不稳定,C错误;反应Ⅰ只有共价键的断裂,D错误。
1. B 解析:根据反应机理图示,9为目标产物、10是副产物,3、5和8都是反应的中间体,A正确;8→10过程中,形成双键为消去反应,B错误;依据反应+2―→+2HBr,理论上1 mol 最多能消耗2 mol ,C正确;若原料用和,反应的主产物是,副产物为和 ,D正确。
2. A 解析:铑(Ru)在TRAP机理图中共呈现了4种价态,分别是+4价、+5价、+6价、+7价,A正确;RuO与NMO反应,经过过程④和⑤得到RuO和NMM,其中Ru元素从+5价升至+7价,则RuO作还原剂,NMO作氧化剂,B错误;RuO自身发生歧化反应⑥,离子方程式为2RuO===RuO2+RuO,产物不是RuO,则不是TRAP试剂再生的另一途径,C错误;TRAP试剂中的RuO不会氧化碳碳双键,可以将醇仅氧化至醛,若R1为CH2===CH—,R2为H—,则RuO经过过程①和②将CH2===CHCH2OH氧化为CH2===CHCHO(丙烯醛),D错误。
3. B 解析:反应原料HCHO和RCHO参与的反应均为加成反应,则原料中的原子100%转化为产物,A正确;由图中可知,催化剂脯氨酸的结构为,B错误;该过程涉及了加成反应和消去反应,C正确;若原料用2 丁酮()和苯甲醛(),则产物可能为,D正确。
4. C 解析:由图中转化关系知,RZnCl是反应物,A错误;反应过程中生成R—R′、R—R两种偶联有机产物,B错误;反应过程中涉及C—Cl极性键的断裂和C—C非极性键的形成,C正确;反应方程式未配平,D错误。
5. A 解析:由反应机理可知,氢气和氧气在[PdCl4]2-的作用下生成过氧化氢,反应的化学方程式为H2+O2H2O2,A错误;Pd元素在[PdCl4]2-、[PdCl2O2]2-中的化合价均为+2价,Pd单质中为0价,B正确;由反应机理可知,①②均为氧化还原反应,C正确;由反应机理可知,HCl和Cl-均可循环利用,D正确。
6. C 解析: 根据“”可以判断X为ROH,若—R为—C2H5,则X为C2H5OH,即乙醇,A正确;反应有H—H键、C—O键等的断裂,有C—C键、C—H键、O—H键等的形成,B正确;有机化学中加成反应和加聚反应的原子利用率为100%,反应产物有甲苯和醇ROH,原子利用率不是100%,C错误;活性炭表面积很大,可以负载高分散的Pd,增大催化剂与反应物的接触面积,提高催化剂活性,D正确。
7. B 解析: 由图可知,转化过程中Pd元素的化合价发生改变,涉及氧化还原反应,A正确;烃基R1与R2的成键过程中形成碳碳非极性键,B错误;由图可知,R2—Pd(Ⅱ)—OC(CH3)3是中间体之一,C正确;转化过程中存在反应:R2—Pd(Ⅱ)—X+NaOC(CH3)3―→NaX+R2—Pd(Ⅱ)—OC(CH3)3,D正确。
8. D 解析:已知Cr是24号元素,其基态原子核外电子排布式为1s22s22p63s23p63d54s1,故基态铬原子核外共7种能量不同的电子,A错误;由题干反应历程图可知,该过程的总反应方程式为C3H8CH3CH===CH2+H2,B错误;由题干信息可知,Cr3+为催化剂,则催化剂Cr3+能改变反应活化能,但不能改变了反应的热效应,C错误;由题干信息可知,随着反应的进行,副反应产生的积炭会导致催化剂失活,而在该体系中加入CO2,由于C+CO22CO能有效消除积碳,防止催化剂失活,有利于丙烷脱氢,D正确。
9. C 解析:V是23号元素,3d轨道能量比4s高(都是空轨道时),故电子优先进入4s轨道,故V的价电子排布式为3d34s2,A正确;由图可知,V5+—OH在该反应过程中边消耗,边生成,质量和性质未发生改变,故作为催化剂,B正确;反应过程中还有NO参加了反应,总方程为4NH3+O2 +4NO4N2+6H2O,C错误;n(氧气)===0.5 mol,有0.5 mol的氧气参加反应,消耗2 mol NH3, H3→2 化合价升高了3价,故转移的电子物质的量为3×2 mol=6 mol,D正确。
10. B 解析:已知催化剂只能影响化学反应速率,不能使化学平衡发生移动,故该新型纳米铁催化剂不能改变平衡常数,A正确;由题干反应历程图可知,上述循环中断裂了D—O、C—H极性键,形成了H—O、C—D极性键,无非极性键的断裂和形成,B错误;由题干反应历程图可知,上述总反应是重水中的D原子取代了苯环中的H原子,故上述总反应属于取代反应,C正确;由题干反应历程图可知,总反应方程式为+D2O+DOH,D正确。
第1练 物质转化历程AB
真题快递+天天练A组 满分:42分 限时:30分钟
天天练B组 满分:30分 限时:20分钟
1.(3分)(2022·山东)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
A. 含N分子参与的反应一定有电子转移
B. 由NO生成HONO的反应历程有2种
C. 增大NO的量,C3H8的平衡转化率不变
D. 当主要发生包含②的历程时,最终生成的水减少
2.(3分)(2022·广东)科学家进行了如图所示的碳循环研究。下列说法正确的是( )
A. 淀粉是多糖,在一定条件下能水解成葡萄糖
B. 葡萄糖与果糖互为同分异构体,都属于烃类
C. 1 mol CO中含有6.02×1024个电子
D. 22.4 L CO2被还原生成1 mol CO
3.(3分)(2022·湖南)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO转化为N2进入大气层,反应过程如图所示。
下列说法正确的是( )
A. 过程Ⅰ中NO发生氧化反应
B. a和b中转移的e-数目相等
C. 过程Ⅱ中参与反应的n(NO)∶n(NH)=1∶4
D. 过程Ⅰ→Ⅲ的总反应为NO+NH===N2↑+2H2O
4.(3分)(2022·北京) CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之后,以N2为载气,以恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到CO2,在催化剂上有积碳。
eq \o(\s\up7(),\s\do5(图1))
eq \o(\s\up7(),\s\do5(图2))
下列说法不正确的是( )
A. 反应①为CaO+CO2===CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2
B. t1~t3,n(H2)比n(CO)多,且生成H2速率不变,可能存在副反应CH4C+2H2
C. t2时刻,副反应生成H2的速率大于反应②生成H2速率
D. t3之后,生成CO的速率为0,是因为反应②不再发生
1.(3分)(2023·江苏各地模拟优选)工业制备锰(Mn)单质的过程中会产生高浓度SO2。酸性条件下,用MnO2进行脱硫处理的原理如图所示。
下列说法中,不正确的是( )
A. 反应1中,锰元素化合价升高
B. 反应2属于氧化还原反应
C. 脱硫的最终产物为MnSO4
D. 上述过程中Fe2+、Fe3+可以循环使用
2.(3分)(2023·江苏各地模拟优选)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述不正确的是( )
A. H2S和空气通过上述循环的目的是降低活化能,提高总反应速率
B. 在转化过程中能循环利用的物质是FeCl3和CuCl2
C. 该过程的总反应式为2H2S+O22H2O+2S↓
D. 若有1 mol H2S发生图示转化的同时消耗O2为0.4 mol,则混合液中Fe3+浓度增大
3.(3分)(2023·江苏各地模拟优选)联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是( )
A. ①转化中N2H4是还原剂
B. ③中发生反应后溶液的pH减小
C. 1 mol N2H4可处理水中1 mol O2
D. 工业上也可使用Na2SO3处理锅炉水中的溶解氧
4.(3分)(2023·江苏各地模拟优选)《环境科学》刊发了我国科研部门采用零价铁(ZVI)活化过二硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)]的研究成果,其反应机制模型如图所示。下列叙述不正确的是( )
A. 56 g Fe参加反应,消耗的S2O大于1 mol
B. 过二硫酸钠(Na2S2O8)中S的化合价为+6价
C. pH越大,越有利于去除废水中的正五价砷
D. 碱性条件下,硫酸根自由基发生反应的方程式为SO·+H2O===SO+·OH+H+
5.(3分)(2023·江苏各地模拟优选)利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图。H+、O2、NO等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是( )
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去a mol Cl时ne=a mol
C. ④的电极反应式为NO+10H++8e-===NH+3H2O
D. 增大单位体积水体中小微粒ZVI的投入量,可使nt增大
6.(3分)(2023·江苏各地模拟优选)已知:2H2O(l)===2H2(g)+O2(g) ΔH=-571.0 kJ· mol-1。在一定条件下,以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)===6FeO(s)+O2(g) ΔH=-313.2 kJ· mol-1
过程Ⅱ:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH=Q kJ· mol-1
下列说法不正确的是( )
A. 过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子
B. 过程Ⅱ的热化学方程式中Q<0
C. 过程Ⅰ、Ⅱ循环的目的是实现光能向热能的转化
D. 铁氧化合物循环制H2具有成本低、产物易分离等优点
7. (3分)(2023·江苏各地模拟优选)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( )
A. CH3COI是反应中间体
B. 甲醇羰基化反应为CH3OH+COCH3COOH
C. 反应过程中Rh的成键数目保持不变
D. 存在反应CH3OH+HI―→CH3I+H2O
8.(3分)(2023·江苏各地模拟优选)乙酸叔丁酯(M)的某合成反应历程如下图所示。下列说法正确的是( )
A. 该合成反应的类型属于加成反应
B. 该历程中存在非极性键的断裂与生成
C. Y中所有碳原子最外层均已达到8电子稳定结构
D. 如果使用含18O的X为原料,则M中不含18O
9. (3分)(2023·江苏各地模拟优选)一种有机物脱羧反应机理如图所示。下列说法不正确的是( )
A. E—NH2是脱羧反应的催化剂
B. 该反应过程涉及加成、消去反应
C. E和F互为同分异构体
D. 也可按照该反应机理生成
10.(3分)(2023·江苏各地模拟优选)卤代烃可以和乙醇反应生成醚,反应历程可表示如下:
能量变化如图所示:
下列说法正确的是( )
A. 高温条件下有利于反应Ⅰ的进行
B. 反应Ⅱ是决速步骤
C. 反应Ⅲ的中间体比反应Ⅳ的中间体稳定
D. 各步反应都有共价键的断裂和生成
1.(3分)(2023·江苏各地模拟优选)Buchwald Hartwig偶联反应(布赫瓦尔德-哈特维希反应)是合成芳胺的重要方法,反应机理如图(图中Ar表示芳香烃基,表示为副反应)。下列有关说法不正确的是 ( )
A. 3、5和8都是反应的中间体
B. 该过程仅涉及加成反应
C. 理论上1 mol最多能消耗2 mol
D. 若原料用和,则可能得到的产物为、和
2.(3分)(2023·江苏各地模拟优选)TRAP是一种温和的氧化剂,TRAP试剂中的RuO不会氧化碳碳双键,可以将醇仅氧化至醛,不会过度氧化为羧酸。TRAP氧化醇的反应机理如下图,下列说法正确的是( )
A. 铑(Ru)在TRAP机理图中共呈现了4种价态
B. 步骤④中NMO作还原剂,作用是使TRAP试剂再生
C. 反应⑥的离子方程式为2RuO===RuO2+RuO,是TRAP试剂再生的另一途径
D. 若R1为CH2===CH—,R2为H—,则TRAP氧化该醇的主产物为丙醛
3.(3分)(2023·江苏各地模拟优选)脯氨酸是构成蛋白质的氨基酸之一,是其中唯一的亚氨基酸。Benjamin List发现脯氨酸可以催化不对称有机反应,因此获得了2021年的诺贝尔化学奖。脯氨酸催化的羟醛缩合反应机理如图所示。下列有关说法不正确的是( )
A. 反应原料中的原子100%转化为产物
B. 由图中可知脯氨酸的结构为
C. 该过程涉及了加成反应和消去反应
D. 若原料用2 丁酮和苯甲醛,则产物可能为
4.(3分)(2023·江苏各地模拟优选)Negishi偶联反应是构筑碳碳键的重要方法之一,反应过程如图所示(R、R′表示烃基)。下列说法正确的是( )
A. RZnCl是该反应的催化剂
B. 反应过程中只生成一种偶联有机产物
C. 反应过程中涉及极性键的断裂和非极性键的形成
D. 存在反应方程式:
5.(3分)(2023·江苏各地模拟优选)下列说法不正确的是( )
A. 总反应可表示为H2+O2===H2O2
B. 该过程中Pd的化合价有0价和+2价两种状态
C. ①②均为氧化还原反应
D. HCl和Cl-可循环利用
6.(3分)(2023·江苏各地模拟优选)Pd/C催化某清洁反应是获得甲苯的常用途径,反应机理如图所示。下列说法错误的是( )
A. 若—R为—C2H5,则X为乙醇
B. 反应过程存在极性键及非极性键的断裂和形成
C. 该途径生产甲苯符合原子利用率100%
D. 活性炭可以负载高分散的Pd,提高催化剂活性
7.(3分)(2023·江苏各地模拟优选)近年,在钯(Pd)催化下进行的偶联反应成为研究热点,其中一种反应机理如图所示,下列有关说法错误的是( )
已知:R1、R2表示烃基,X表示卤原子,Y表示羟基。
A. 转化过程中涉及氧化还原反应
B. 转化过程中未发生非极性键的断裂和形成
C. R2—Pd(Ⅱ)—OC(CH3)3是中间体
D. 转化过程中存在如下反应:R2—Pd(Ⅱ)—X+NaOC(CH3)3―→NaX+R2
—Pd(Ⅱ)—OC(CH3)3
8.(3分)(2023·江苏各地模拟优选)以SiO2表面隔离的Cr3+催化丙烷无氧脱氢的机理如图,随着反应的进行,副反应产生的积炭会导致催化剂失活。下列说法正确的是( )
A. 基态铬原子核外有6种能量不同的电子
B. 总反应方程式为C3H8C3H4 +2H2
C. Cr3+改变反应活化能的同时改变了反应的热效应
D. 在该体系中加入CO2有利于丙烷脱氢
9.(3分)(2023·江苏各地模拟优选)据文献报道,氨催化还原法可用来消除某些污染气体,其反应历程如图所示。
下列说法错误的是( )
A. V的价电子排布式为3d34s2
B. V5+—OH在该反应过程中作催化剂
C. 总反应化学方程式为4NH3+3O22N2+6H2O
D. 当消耗标准状况下11.2 L O2时,整个过程转移6 mol e-
10.(3分)(2023·江苏各地模拟优选)我国科学家开发出新型铁纳米催化剂,实现了芳环和杂芳环的氢氘交换反应。该纳米催化方法具有很高的普适性,可对芳胺、酚、含氮杂环等近90个化合物进行选择性氘代,实现了超过30个氘代药物分子和天然产物的制备。其反应历程如图所示。
提示:—X表示—NH2、—OH等官能团。下列说法错误的是( )
A. 该新型纳米铁催化剂不能增大平衡常数
B. 上述循环中断裂了极性键和形成了非极性键
C. 上述总反应属于取代反应
D. 总反应方程式为+DOH
主题4 化学变化与规律 第1练 物质转化历程AB
1. D 解析:根据反应机理的图示知,含N分子发生的反应有NO+·OOH===NO2+·OH、NO+NO2+H2O===2HONO、NO2+·C3H7===C3H6+HONO、HONO===NO+·OH,含N分子NO、NO2、HONO中N元素的化合价依次为+2价、+4价、+3价,上述反应中均有元素化合价的升降,都为氧化还原反应,一定有电子转移,A正确;根据图示,由NO生成HONO的反应历程有2种,B正确;NO是催化剂,增大NO的量,C3H8的平衡转化率不变,C正确;无论反应历程如何,在NO催化下,丙烷与O2反应制备丙烯的总反应都为2C3H8+O22C3H6+2H2O,当主要发生包含②的历程时,最终生成的水不变,D错误。
2. A 解析:淀粉是由葡萄糖分子聚合而成的多糖,在一定条件下水解可得到葡萄糖,A正确;葡萄糖与果糖的分子式均为C6H12O6,结构不同,二者互为同分异构体,但含有O元素,不是烃类,属于烃的衍生物,B错误;一个CO分子含有14个电子,则1 mol CO中含有14×6.02×1023=8.428×1024个电子,C错误;未指明气体处于标况下,不能用标况下的气体摩尔体积计算其物质的量,D错误。
3. D 解析:由图示可知,过程Ⅰ中NO转化为NO,氮元素化合价由+3价降低到+2价,NO作氧化剂,被还原,发生还原反应,A错误;由图示可知,过程Ⅰ为NO在酶1的作用下转化为NO和H2O,依据得失电子守恒、电荷守恒和原子守恒可知,生成1 mol NO,a过程转移1 mol e-,过程Ⅱ为NO和NH在酶2的作用下发生氧化还原反应生成H2O和N2H4,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为NO+NH+3e-+2H+H2O+N2H4,消耗1 mol NO,b过程转移4 mol e-,转移电子数目不相等,B错误;由图示可知,过程Ⅱ发生反应的参与反应的离子方程式为NO+NH+3e-+2H+H2O+N2H4,n(NO)∶n(NH)=1∶1,C错误;由图示可知,过程Ⅰ的离子方程式为NO+2H++e-NO+H2O,过程Ⅱ的离子方程式为NO+NH+3e-+2H+H2O+N2H4,过程Ⅲ的离子方程式为N2H4N2↑+4H++4e-,则过程Ⅰ→Ⅲ的总反应为NO+NH=== N2↑+2H2O,D正确。
4. C 解析:由题干图1所示信息可知,反应①为CaO+CO2===CaCO3,结合氧化还原反应配平可得反应②为CaCO3+CH4CaO+2CO+2H2,A正确;由题干图2信息可知,t1~t3,n(H2)比n(CO)多,且生成H2速率不变,且反应过程中始终未检测到CO2,在催化剂上有积碳,故可能存在副反应CH4C+2H2,反应②和副反应中CH4和H2的系数比均为1∶2,B正确;由题干反应②方程式可知,H2和CO的反应速率相等,而t2时刻信息可知,H2的反应速率未变,仍然为2 mmol·min-1,而CO变为1~2 mmol·min-1之间,故能够说明副反应生成H2的速率小于反应②生成H2速率,C错误;由题干图2信息可知,t3之后,CO的速率为0,CH4的速率逐渐增大,最终恢复到1,说明生成CO的速率为0,是因为反应②不再发生,D正确。
1. A 解析:反应1中,锰元素化合价由+4价降低为+2价,A错误;反应2中Fe、S元素化合价有变化,属于氧化还原反应,B正确;根据图示,总反应为MnO2+SO2=== MnSO4,脱硫的最终产物为MnSO4,C正确;根据流程图,可知Fe2+、Fe3+可以循环使用,D正确。
2. D 解析:总反应为硫化氢和氧气反应生成硫和水,H2S和空气通过上述循环相当于铁离子和铜离子作催化剂,催化剂能降低活化能,提高总反应速率,A正确;在转化过程中能循环利用的离子是铁离子和铜离子,则对应的物质是FeCl3和CuCl2,B正确;由图可知,反应物为H2S、O2,生成物为H2O、S,该过程的总反应式为2H2S+O22H2O+2S↓,C正确;总反应为硫化氢和氧气反应生成硫和水,若有1 mol H2S发生图示转化,则失去电子为2 mol,若同时消耗O2为0.4 mol,则得到电子为1.6 mol,则混合液中Fe3+浓度因消耗而减小,D错误。
3. B 解析:①转化中N2H4变成N2,氮元素的化合价升高,所以N2H4是还原剂,A正确;③中发生反应的离子方程式为4Cu(NH3)+O2+2H2O+8NH3===4Cu(NH3)+4OH-,所以溶液的pH增大,B错误;根据反应的机理可知,本质上可看成氧气氧化N2H4,根据电子守恒:O2~4OH-~4e-,N2H4~N2~4e-,所以消耗的n(O2)=n(N2H4),C正确;Na2SO3具有强还原性,能够被锅炉水中的溶解氧氧化:2Na2SO3+O2===2Na2SO4,而且使用常见的Na2SO3成本低,所以工业上也可使用Na2SO3处理锅炉水中的溶解氧,D正确。
4. D 解析:56 g Fe参加反应,根据图示,可得出转化过程中Fe先被S2O氧化为Fe2+,反应为Fe+S2O===Fe2++2SO,然后Fe2+进一步被S2O氧化为Fe3+,最后沉淀中有Fe(OH)2和Fe(OH)3,所以56 g Fe参加反应时,消耗的S2O大于1 mol,A正确;S的化合价为+6价,因为有两个氧是-1价,六个氧是-2价,B正确;碱性条件有利于形成Fe(OH)2和Fe(OH)3沉淀,与正五价砷发生共沉淀,C正确;结合图示可知,碱性条件下,SO·发生反应的方程式为SO·+OH-===SO+·OH,D错误。
5. B 解析:由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,A正确;三氯乙烯C2HCl3中C原子化合价为+1价,乙烯中C原子化合价为-2价,1 mol C2HCl3转化为1 mol C2H4时,得到6 mol电子,脱去3 mol氯原子,所以脱去a mol Cl时ne=2a mol,B错误;由示意图及N元素的化合价变化可写出如下转化NO+8e-―→NH,由于生成物中有NH,所以只能用H+和H2O来配平该反应,而不能用H2O和OH-来配平,所以④的电极反应式为NO+10H++8e-===NH+3H2O,C正确;增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,增大ZVI释放电子的速率,可使nt增大,D正确。
6. C 解析: 由过程Ⅰ可知,2 mol Fe3O4发生反应,会生成1 mol氧气,转移4 mol电子,那么每消耗232 g即1 mol Fe3O4转移2 mol电子,A正确;利用盖斯定律,由2H2O(l)===2H2(g)+O2(g) ΔH=-571.0 kJ· mol-1和2Fe3O4(s)===6FeO(s)+O2(g) ΔH=-313.2 kJ· mol-1可得Q=(-571.0 kJ· mol-1+313.2 kJ· mol-1)=-128.9 kJ· mol-1,所以过程Ⅱ的热化学方程式中Q<0,B正确;过程Ⅰ是太阳能转化为热能,过程Ⅱ是热能转化为化学能,目的是实现太阳能向化学能的转化,C错误;铁氧化合物循环制H2成本低且产物一个是固体,一个是气体,易分离,D正确。
7. C 解析:CH3COI属于甲醇羰基化反应的反应中间体,A正确;甲醇羰基化反应,反应物为甲醇以及CO,产物为乙酸,方程式可写成:CH3OH+COCH3COOH,B正确;铑配合物在整个反应历程中,成键数目、配体种类等均发生了变化,C错误;反应中间体CH3COI与水作用生成的HI可以使甲醇转化为CH3I,方程式可写成:CH3OH+HI―→CH3I+H2O,D正确。
8. D 解析:该反应属于取代反应,A不符合题意;该反应中只存在C—O键、O—H键等极性键断裂,没有非极性键断裂,B不符合题意;Y中最中间的碳正离子缺电子,最外层电子数未达8电子稳定结构,C不符合题意;根据该反应进程描述,可以看到是叔丁醇上C—O键断裂,最终连接的是乙酸提供的氧原子,故X结构中若带有18O原子,最终不会存在于产物酯的分子中,会在生成的水分子中,D符合题意。
9. D 解析:根据有机物脱羧反应机理图可知,E—NH2先参与反应,后面又生成,没有增加或减少,故应为催化剂,A正确;A→B是加成反应,B→C是消去反应,B正确;E和F的分子式相同,结构不同,属于同分异构体,C正确;从C→E过程可以看到,碳碳双键是在羧基相连的碳原子上形成,连有氮原子的碳原子也形成碳碳双键,然后才能转化成含有碳氮双键的结构,而对于,只能形成,无法继续向下进行,所以不能按照该反应机理进行,D错误。
10. A 解析:反应Ⅰ是吸热反应,高温条件下有利于反应Ⅰ的进行,A正确;反应Ⅰ活化能最大,是决速步骤,B错误;反应Ⅲ的中间体比反应Ⅳ的中间体能量高,不稳定,C错误;反应Ⅰ只有共价键的断裂,D错误。
1. B 解析:根据反应机理图示,9为目标产物、10是副产物,3、5和8都是反应的中间体,A正确;8→10过程中,形成双键为消去反应,B错误;依据反应+2―→+2HBr,理论上1 mol 最多能消耗2 mol ,C正确;若原料用和,反应的主产物是,副产物为和 ,D正确。
2. A 解析:铑(Ru)在TRAP机理图中共呈现了4种价态,分别是+4价、+5价、+6价、+7价,A正确;RuO与NMO反应,经过过程④和⑤得到RuO和NMM,其中Ru元素从+5价升至+7价,则RuO作还原剂,NMO作氧化剂,B错误;RuO自身发生歧化反应⑥,离子方程式为2RuO===RuO2+RuO,产物不是RuO,则不是TRAP试剂再生的另一途径,C错误;TRAP试剂中的RuO不会氧化碳碳双键,可以将醇仅氧化至醛,若R1为CH2===CH—,R2为H—,则RuO经过过程①和②将CH2===CHCH2OH氧化为CH2===CHCHO(丙烯醛),D错误。
3. B 解析:反应原料HCHO和RCHO参与的反应均为加成反应,则原料中的原子100%转化为产物,A正确;由图中可知,催化剂脯氨酸的结构为,B错误;该过程涉及了加成反应和消去反应,C正确;若原料用2 丁酮()和苯甲醛(),则产物可能为,D正确。
4. C 解析:由图中转化关系知,RZnCl是反应物,A错误;反应过程中生成R—R′、R—R两种偶联有机产物,B错误;反应过程中涉及C—Cl极性键的断裂和C—C非极性键的形成,C正确;反应方程式未配平,D错误。
5. A 解析:由反应机理可知,氢气和氧气在[PdCl4]2-的作用下生成过氧化氢,反应的化学方程式为H2+O2H2O2,A错误;Pd元素在[PdCl4]2-、[PdCl2O2]2-中的化合价均为+2价,Pd单质中为0价,B正确;由反应机理可知,①②均为氧化还原反应,C正确;由反应机理可知,HCl和Cl-均可循环利用,D正确。
6. C 解析: 根据“”可以判断X为ROH,若—R为—C2H5,则X为C2H5OH,即乙醇,A正确;反应有H—H键、C—O键等的断裂,有C—C键、C—H键、O—H键等的形成,B正确;有机化学中加成反应和加聚反应的原子利用率为100%,反应产物有甲苯和醇ROH,原子利用率不是100%,C错误;活性炭表面积很大,可以负载高分散的Pd,增大催化剂与反应物的接触面积,提高催化剂活性,D正确。
7. B 解析: 由图可知,转化过程中Pd元素的化合价发生改变,涉及氧化还原反应,A正确;烃基R1与R2的成键过程中形成碳碳非极性键,B错误;由图可知,R2—Pd(Ⅱ)—OC(CH3)3是中间体之一,C正确;转化过程中存在反应:R2—Pd(Ⅱ)—X+NaOC(CH3)3―→NaX+R2—Pd(Ⅱ)—OC(CH3)3,D正确。
8. D 解析:已知Cr是24号元素,其基态原子核外电子排布式为1s22s22p63s23p63d54s1,故基态铬原子核外共7种能量不同的电子,A错误;由题干反应历程图可知,该过程的总反应方程式为C3H8CH3CH===CH2+H2,B错误;由题干信息可知,Cr3+为催化剂,则催化剂Cr3+能改变反应活化能,但不能改变了反应的热效应,C错误;由题干信息可知,随着反应的进行,副反应产生的积炭会导致催化剂失活,而在该体系中加入CO2,由于C+CO22CO能有效消除积碳,防止催化剂失活,有利于丙烷脱氢,D正确。
9. C 解析:V是23号元素,3d轨道能量比4s高(都是空轨道时),故电子优先进入4s轨道,故V的价电子排布式为3d34s2,A正确;由图可知,V5+—OH在该反应过程中边消耗,边生成,质量和性质未发生改变,故作为催化剂,B正确;反应过程中还有NO参加了反应,总方程为4NH3+O2 +4NO4N2+6H2O,C错误;n(氧气)===0.5 mol,有0.5 mol的氧气参加反应,消耗2 mol NH3, H3→2 化合价升高了3价,故转移的电子物质的量为3×2 mol=6 mol,D正确。
10. B 解析:已知催化剂只能影响化学反应速率,不能使化学平衡发生移动,故该新型纳米铁催化剂不能改变平衡常数,A正确;由题干反应历程图可知,上述循环中断裂了D—O、C—H极性键,形成了H—O、C—D极性键,无非极性键的断裂和形成,B错误;由题干反应历程图可知,上述总反应是重水中的D原子取代了苯环中的H原子,故上述总反应属于取代反应,C正确;由题干反应历程图可知,总反应方程式为+D2O+DOH,D正确。
同课章节目录
