主题4 化学变化与规律 第7练 化学反应速率与化学平衡原理的应用AB(含解析)—2024高考化学考前天天练
文档属性
| 名称 | 主题4 化学变化与规律 第7练 化学反应速率与化学平衡原理的应用AB(含解析)—2024高考化学考前天天练 |  | |
| 格式 | doc | ||
| 文件大小 | 920.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-25 20:49:57 | ||
图片预览



文档简介
第7练 化学反应速率与化学平衡原理的应用AB
真题快递+天天练A组 满分:42分 限时:45分钟
天天练B组 满分:30分 限时:40分钟
1. (3分)(2022·江苏卷)乙醇 水催化重整可获得H2。其主要反应为C2H5OH(g)+3H2O(g)===2CO2(g)+6H2(g) ΔH=173.3 kJ· mol-1,CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=41.2 kJ· mol-1,在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
CO的选择性=×100%,下列说法正确的是( )
A. 图中曲线①表示平衡时H2产率随温度的变化
B. 升高温度,平衡时CO的选择性增大
C. 一定温度下,增大可提高乙醇平衡转化率
D. 一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
2. (3分)(2021·江苏卷)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[×100%]与温度的关系如图所示。
下列说法正确的是( )
A. 其他条件不变,升高温度,NH3的平衡转化率增大
B. 其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大
C. 催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D. 高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
3.(3分)(2020·江苏卷改编)CH4与CO2重整生成H2和CO的过程中主要发生下列反应:
CH4(g)+CO2(g)===2H2(g)+2CO(g) ΔH=247.1 kJ· mol-1
H2(g)+CO2(g)===H2O(g)+CO(g) ΔH=41.2 kJ· mol-1
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线B表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4的平衡转化率达到X点的值,改变除温度外的特定条件继续反应,CH4的平衡转化率不能达到Y点的值
4.(3分)(2019·江苏卷改编)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A. 反应2NO(g)+O2(g)===2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380 ℃时,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2 000
1.(3分)(2023·江苏各地模拟优选)一定温度下,在2个容积均为1 L的恒容密闭容器中,加入一定量的反应物,发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0,相关数据见下表。
容器编号 温度/ ℃ 起始物质的量/ mol 平衡物质的量/ mol
NO(g) CO(g) CO2(g)
Ⅰ T1 0.2 0.2 0.1
Ⅱ T2 0.2 0.2 0.12
下列说法不正确的是( )
A. T1>T2
B. Ⅰ中反应达到平衡时,CO的转化率为50%
C. 达到平衡所需要的时间:Ⅱ>Ⅰ
D. 对于Ⅰ,平衡后向容器中再充入0.2 mol CO和0.2 mol CO2,平衡正向移动
2. (3分)(2023·江苏各地模拟优选)在容积不变的密闭容器中发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,830 ℃时反应的平衡常数是1.0,下列说法正确的是( )
A. 容器内的压强不变时,说明反应达到平衡状态
B. 若平衡时移走CO2,则平衡向正反应方向移动,化学反应速率增大
C. 830 ℃时,充入0.1 mol CO和0.3 mol H2O保持温度不变,CO平衡转化率为75%
D. 1 000 ℃时,某时刻CO2、H2、CO和H2O的浓度均为0.05 mol·L-1,此时平衡正向移动
3.(3分)(2023·江苏各地模拟优选)在一定温度和催化剂的条件下,发生2NH3(g) N2(g)+3H2(g)。将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。下列的说法不正确的是( )
A. 曲线Ⅰ表示NH3的分压随时间的变化
B. 用H2的浓度变化表示0~t1时间内的反应速率v(H2)= mol·L-1·min-1(用含t1的代数式表示)
C. t2时将容器体积迅速缩小至原来的一半并保持不变,N2分压变化趋势的曲线是b
D. 在此温度下该反应的化学平衡常数Kp=4 800(kPa)2
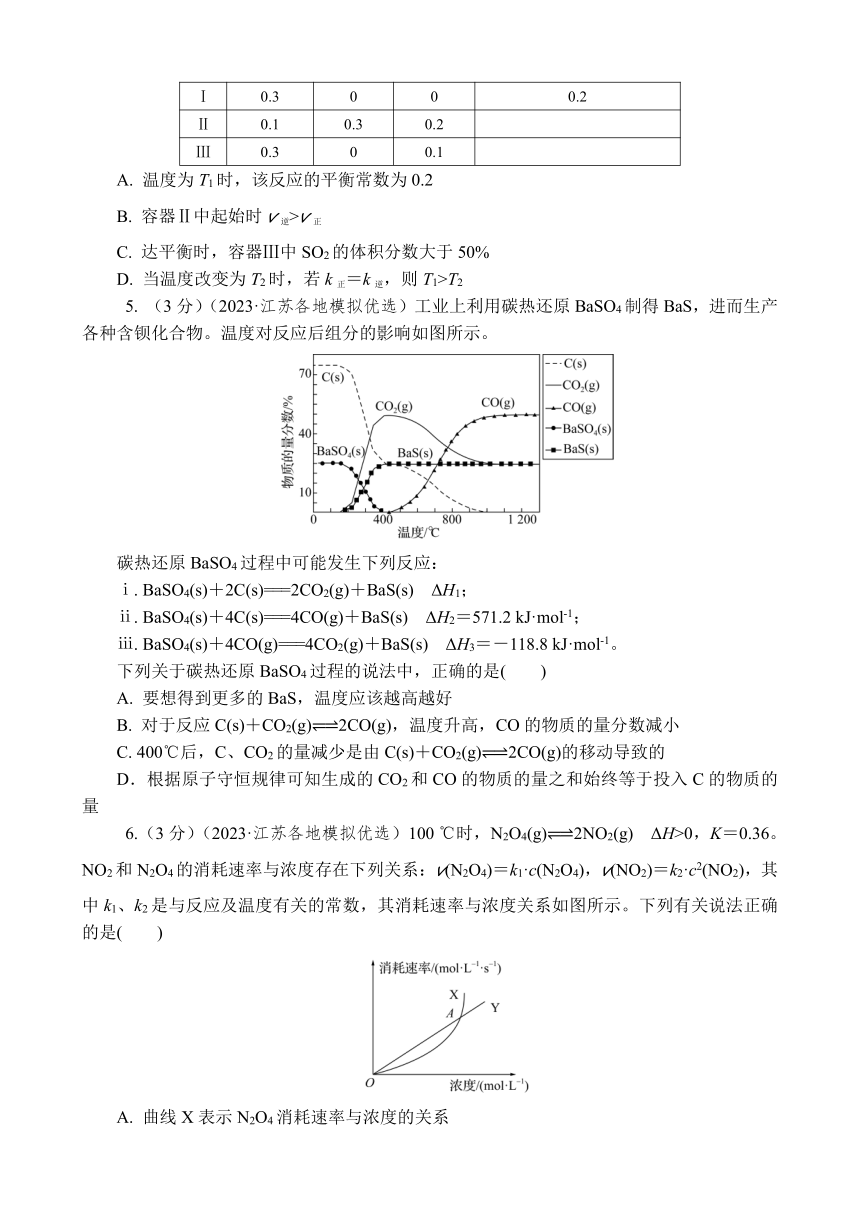
4.(3分)(2023·江苏各地模拟优选)温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2SO3(g) 2SO2(g)+O2(g) ΔH>0。实验测得:v正=k正c2(SO3),v逆=k逆c2(SO2)·c(O2),k正、k逆为速率常数,只与温度有关。下列说法正确的是( )
容器编号 物质的起始浓度/(mol·L-1) 物质的平衡浓度/(mol·L-1)
c(SO3) c(SO2) c(O2) c(SO2)
Ⅰ 0.3 0 0 0.2
Ⅱ 0.1 0.3 0.2
Ⅲ 0.3 0 0.1
A. 温度为T1时,该反应的平衡常数为0.2
B. 容器Ⅱ中起始时v逆>v正
C. 达平衡时,容器Ⅲ中SO2的体积分数大于50%
D. 当温度改变为T2时,若k正=k逆,则T1>T2
5. (3分)(2023·江苏各地模拟优选)工业上利用碳热还原BaSO4制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图所示。
碳热还原BaSO4过程中可能发生下列反应:
ⅰ. BaSO4(s)+2C(s)===2CO2(g)+BaS(s) ΔH1;
ⅱ. BaSO4(s)+4C(s)===4CO(g)+BaS(s) ΔH2=571.2 kJ·mol-1;
ⅲ. BaSO4(s)+4CO(g)===4CO2(g)+BaS(s) ΔH3=-118.8 kJ·mol-1。
下列关于碳热还原BaSO4过程的说法中,正确的是( )
A. 要想得到更多的BaS,温度应该越高越好
B. 对于反应C(s)+CO2(g) 2CO(g),温度升高,CO的物质的量分数减小
C. 400℃后,C、CO2的量减少是由C(s)+CO2(g) 2CO(g)的移动导致的
D.根据原子守恒规律可知生成的CO2和CO的物质的量之和始终等于投入C的物质的量
6.(3分)(2023·江苏各地模拟优选)100 ℃时,N2O4(g) 2NO2(g) ΔH>0,K=0.36。NO2和N2O4的消耗速率与浓度存在下列关系:v(N2O4)=k1·c(N2O4),v(NO2)=k2·c2(NO2),其中k1、k2是与反应及温度有关的常数,其消耗速率与浓度关系如图所示。下列有关说法正确的是( )
A. 曲线X表示N2O4消耗速率与浓度的关系
B. k1与k2都有单位,且单位不同
C. 图中A点处于平衡状态
D. 若在T1温度下,k1=k2,则T1<100 ℃
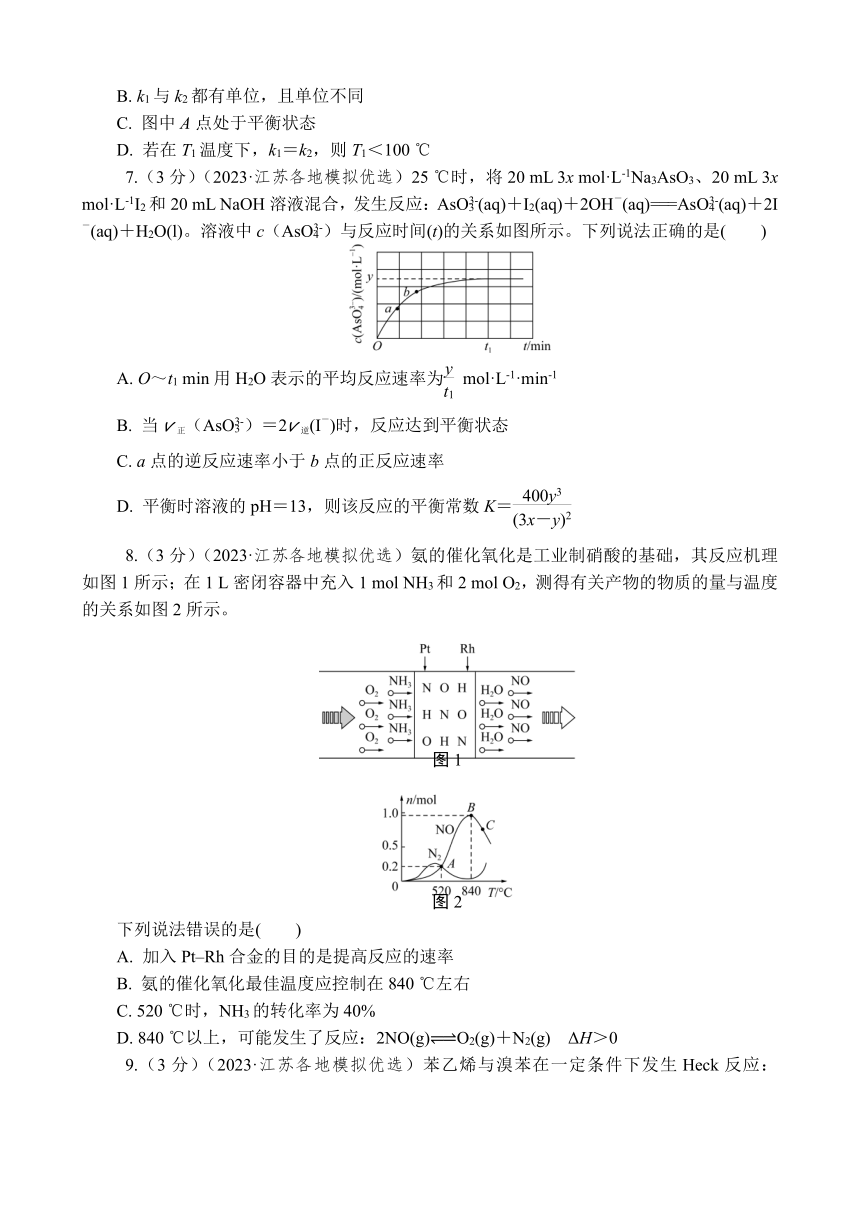
7.(3分)(2023·江苏各地模拟优选)25 ℃时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)===AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。下列说法正确的是( )
A. O~t1 min用H2O表示的平均反应速率为 mol·L-1·min-1
B. 当v正(AsO)=2v逆(I-)时,反应达到平衡状态
C. a点的逆反应速率小于b点的正反应速率
D. 平衡时溶液的pH=13,则该反应的平衡常数K=
8.(3分)(2023·江苏各地模拟优选)氨的催化氧化是工业制硝酸的基础,其反应机理如图1所示;在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关产物的物质的量与温度的关系如图2所示。
eq \o(\s\up7(),\s\do5(图1))
eq \o(\s\up7(),\s\do5(图2))
下列说法错误的是( )
A. 加入Pt Rh合金的目的是提高反应的速率
B. 氨的催化氧化最佳温度应控制在840 ℃左右
C. 520 ℃时,NH3的转化率为40%
D. 840 ℃以上,可能发生了反应:2NO(g) O2(g)+N2(g) ΔH>0
9.(3分)(2023·江苏各地模拟优选)苯乙烯与溴苯在一定条件下发生Heck反应:,某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如下数据:
反应温度/ ℃ 100 100 100 100 120 140 160
反应时间/h 10 12 14 16 14 14 14
产率/% 81.2 84.4 86.6 86.2 93.5 96.6 96.0
下列说法正确的是( )
A. 该反应为吸热反应
B. 由表中数据可知最佳反应条件为120 ℃、14 h
C. 100 ℃时、反应时间10~14 h内,产率增加的原因是反应速率增大
D. 从140 ℃升到160 ℃,反应相同时间,产率下降的原因可能是平衡向逆反应方向移动
10.(3分)(江苏省百校大联考2022届高三模拟)在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。已知:
CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-165 kJ· mol-1
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=41 kJ· mol-1
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
CH4选择性=×100%。下列有关说法正确的是( )
A. 在260~320 ℃间,以NiCeO2为催化剂,升高温度CH4的产率不变
B. 延长W点的反应时间,一定能提高CO2的转化率
C. 选择合适的催化剂,有利于提高CO2的转化率
D. 高于320 ℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动
1. (3分)(2023·江苏各地模拟优选)用活性炭对NO进行吸附可减少环境污染,反应如下:C(s)+2NO(g) N2(g)+CO2(g)+34.0 kJ,T1 ℃时,在密闭容器中测得反应在不同时刻各物质的浓度如下:
浓度物质 0 10 20 30 40 50
NO 1.00 0.58 0.40 0.40 0.48 0.48
N2 0 0.21 0.30 0.30 0.36 0.36
下列说法不正确的是( )
A. 第30 min后,改变的条件可能是适当缩小了容器的体积
B. 其他条件不变,在第50 min后降低温度,可使容器中N2的浓度升高至0.6 mol·L-1
C. 第30 min和第40 min时NO的转化率相同
D. 向容器内通适量氧气可能会使平衡逆向移动
2.(3分)(2023·江苏各地模拟优选)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。现将不同物质的量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,发生反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
实验组 温度/ ℃ 起始量/ mol 平衡量/ mol 达到平衡所需时间/min
H2O CO H2 CO
1 650 2 4 1.6 2.4 5
2 900 1 2 0.4 1.6 3
下列说法错误的是( )
A. 实验1达到化学平衡,以v(H2O)表示的化学反应速率为0.16 mol·L-1·min-1
B. 该反应的正反应活化能小于逆反应活化能
C. 900 ℃时,实验2若CO(g)、H2O(g)的起始加入的物质的量分别为4 mol、2 mol,则达到平衡时H2O的转化率为40%
D. 650 ℃时,实验1若CO(g)、H2O(g),CO2(g)、H2(g)的起始加入的物质的量分别为1.5 mol、2 mol、2.5 mol、3 mol,则此时v(正)3.(3分)(2023·江苏各地模拟优选)某研究小组以Ag ZSM为催化剂,在容积为1 L的容器中,相同时间下测得0.1 mol NO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g) N2(g)+O2(g);有CO时反应为2CO(g)+2NO(g) 2CO2(g)+N2(g)]。下列说法正确的是( )
A. 反应2NO(g) N2(g)+O2(g)的ΔH>0
B. 达平衡后,其他条件不变,使>1,CO转化率上升
C. X点可以通过更换高效催化剂提高NO转化率
D. Y点再通入CO、N2各0.01 mol,此时v正(CO) >v逆(CO)
4.(3分)(2023·江苏各地模拟优选)合成氨原料气中的CO可通过水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g)除去。某合成氨原料气中N2、H2、CO、CO2的体积分数分别为20%、50%、25%、5%。一定温度下按不同投料比[]通入水蒸气,平衡后混合气体中CO的体积分数如下表。
CO的体积分数/%温度/ ℃ =1 =3 =5
200 1.70 0.21 0.02
250 2.73 0.30 0.06
300 6.00 0.84 0.43
350 7.85 1.52 0.80
下列说法不正确的是( )
A. 从表中数据可知,水煤气变换反应的ΔH<0
B. 温度相同时,投料比越大,CO的转化率越高
C. 按=1通入水蒸气后,反应前CO在混合气体中的体积分数为20%
D. 根据=1时数据推算,300 ℃时水煤气变换反应的平衡常数K为46
5.(3分)(2023·江苏各地模拟优选)工业生产硫酸的一步重要反应是2SO2(g)+O2(g)===2SO3(g) ΔH<0,如果该反应在容积不变的密闭容器中进行,下列各图表示当其他条件不变时改变某一条件对上述反应的影响,其中结论正确的是 ( )
eq \o(\s\up7(),\s\do5(Ⅰ)) eq \o(\s\up7(),\s\do5(Ⅱ))
eq \o(\s\up7(),\s\do5(Ⅲ)) eq \o(\s\up7(),\s\do5(Ⅳ))
A. 图Ⅰ表示催化剂对化学平衡的影响,且甲使用了催化剂
B. 图Ⅱ表示SO2平衡转化率与温度及压强的关系,可以判断T1>T2
C. 图Ⅲ表示t0时刻表示升高温度或增大压强对反应速率的影响
D. Ⅳ中A、B、C三点体系对应的温度: T(C)>T(B)>T(A)
6.(3分)(2023·江苏各地模拟优选)利用I2O5可消除CO污染,相关反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. a点所在温度下,0~0.5 min反应速率v(CO)=0.3 mol·L-1·min-1
7.(3分)(2023·江苏各地模拟优选)探究盐酸盐溶液对反应Fe3++SCN- ===[Fe(SCN)]2+ (血红色)的影响。将2 mL 0.01 mol·L-1的FeCl2溶液与2 mL 0.02 mol·L-1的KSCN溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如图所示。
已知:ⅰ. 溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略;
ⅱ. Fe3++4Cl-===[FeCl4]-(黄色)。
下列说法正确的是( )
A. 注入试剂①后,平衡Fe3++SCN- [Fe(SCN)]2+不移动
B. 透光率③比②高, 一定是溶液pH不同导致的
C. 透光率④比③高,可能发生了反应[Fe(SCN)]2++4Cl-===[FeCl4]- +SCN-
D. 若要证明试剂③中Cl-对平衡体系有影响,还应使用0.04 mol·L-1的KNO3溶液进行实验
8.(3分)(2023·江苏各地模拟优选)向一恒温恒容的密闭容器中充入1 mol X2和3 mol Y2发生反应:X2(g)+3Y2(g) 2XY3(g),测得部分物质的物质的量浓度与时间关系如图1所示,在TiO2 Cu催化下反应机理与能量变化如图2所示。
eq \o(\s\up7(),\s\do5(图1))
eq \o(\s\up7(),\s\do5(图2))
下列说法正确的是( )
A. 3c(X2)=c(Y2)时,表明反应达到平衡
B. t2 min时改变某种条件,重新达到平衡后,该反应的化学平衡常数一定减小
C. 投料改为2 mol X2和6 mol Y2,XY3的平衡体积分数增大
D. 寻找合适催化剂降低活化能,能有效提高X2的平衡转化率
9.(3分)(2023·江苏各地模拟优选)在催化剂作用下,向恒容容器中按物质的量比1∶1充入甲醇和异丁烯(用R表示),分别在T1和T2两个温度下反应生成W:CH3OH(g)+R(g) W(g) ΔH。异丁烯的转化率随时间的变化关系如图所示。下列说法不正确的是( )
A. T1>T2,ΔH<0
B. 维持T2不变,再向容器中充入1 mol W,新平衡时W的百分含量增大
C. vM正=vB正>vA逆
D. 240~300 min时间内,T1和T2两个温度下平均反应速率相等
10.(3分)(2023·江苏各地模拟优选)在一定温度下,将1 mol CO2和3 mol H2充入体积为1 L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )
A. 平衡混合气体中C原子的物质的量是1 mol
B. 该反应的反应物的总能量高于生成物的总能量
C. 该反应的化学平衡常数K=
D. 其他条件相同时,若起始充入2 mol CO2和6 mol H2,达到平衡时CH3OH的物质的量分数大于25%
第7练 化学反应速率与化学平衡原理的应用AB
1. B 解析:曲线②代表H2的产率,A错误;升高温度,平衡时CO的选择性增大,B正确;两种物质参加反应,增大一种物质的浓度,会降低该物质的平衡转化率,C错误;选用高效催化剂,不会影响平衡时H2的产率,D错误。
2. D 解析:NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向进行,氨气的平衡转化率降低,A错误;根据图像,在175~300 ℃范围,随温度的升高,N2的选择性降低,即产生氮气的量减少,B错误;根据图像,温度高于250 ℃ ,氮气的选择性降低,且氨气的转化率变化并不大,浪费能源,温度应略小于225 ℃,此时氨气的转化率、氮气的选择性较大,C错误;氮气对环境无污染,氮的氧化物污染环境,因此高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,D正确。
3. B 解析:甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,A错误;根据两个反应得到总反应为CH4(g)+2CO2(g)=== H2(g)+3CO(g) +H2O (g),加入的CH4与CO2物质的量相等,CO2消耗量大于CH4,因此CO2的转化率大于CH4,因此曲线B表示CH4的平衡转化率随温度变化,B正确;使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,C错误;800 K时,甲烷的转化率为X点,可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,D错误。
4. B 解析:随温度升高NO的转化率先升高后降低,说明温度较低时反应较慢,一段时间内并未达到平衡,分析温度较高时,已达到平衡时的NO转化率可知,温度越高NO转化率越低,说明温度升高平衡向逆反应方向移动,根据勒夏特列原理分析该反应为放热反应,ΔH<0,A错误;根据上述分析,X点时,反应还未到达平衡状态,反应正向进行,所以延长反应时间能提高NO的转化率,B正确;Y点,反应已经达到平衡状态,此时增加O2的浓度,使得正反应速率大于逆反应速率,平衡向正反应方向移动,可以提高NO的转化率,C错误;设NO起始浓度为a mol·L-1,NO的转化率为50%,则平衡时NO、O2和NO2的浓度分别为0.5a mol·L-1、(5×10-4-0.25a)mol·L-1、0.5a mol·L-1,平衡常数K==>=2 000,D错误。
1. D 解析:两次实验起始投入量相同,该反应为放热反应,温度T2达到平衡时,二氧化碳的量少,降温平衡正向移动,故T1>T2,A正确;Ⅰ中反应达到平衡时,CO2的物质的量为0.1 mol,则参加反应的CO的物质的量为0.1 mol,起始投入量为0.2 mol,则其转化率为50%,B正确;T1>T2,温度越高,反应速率越大,达到平衡所需要的时间越短,C正确;恒容1 L的容器中,对于反应Ⅰ平衡时NO、CO、N2、CO2的物质的量分别为0.1 mol、0.1 mol、0.05 mol、0.1 mol,平衡常数K==5,平衡后向容器中再充入0.2 mol CO和0.2 mol CO2,此时浓度商Qc==5,K=Qc,平衡不移动,D错误。
2. C 解析:该反应气体分子总数始终不变、故压强也始终不变,则当体系压强不随时间变化时不能说明反应达到平衡状态,A错误;若平衡时移走CO2,则减少了产物浓度,平衡向正反应方向移动,但化学反应速率减小,B错误; 830℃时,充入0.1 mol CO和0.3 mol H2O保持温度不变,
K===1,得x=0.075 mol,则CO平衡转化率为75%,C正确;CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,830 ℃时反应的平衡常数是1.0,1 000 ℃时,平衡左移,则K<1,某时刻CO2、H2、CO和H2O的浓度均为0.05 mol·L-1,Qc==1>K,则此时平衡向逆反应方向移动,D错误。
3. B 解析:根据图示可知,Ⅰ表示物质的分压逐渐减小,Ⅱ、Ⅲ分压逐渐增大,且Ⅱ分压增大的多于Ⅲ,所以故曲线Ⅰ表示NH3的分压随时间的变化,Ⅱ、Ⅲ分别表示H2、N2的分压随时间的变化,A正确;密闭容器中0.1 mol NH3总压为200 kPa,t1时H2的分压为120 kPa,则H2的物质的量为n(H2)=×0.1 mol=0.06 mol,故v(H2)== mol·L-1·min-1,B错误; 容器体积迅速缩小到原来的一半,则氮气的分压迅速增大到原来的2倍,压强增大,平衡向气体总体积减小的方向移动,即平衡逆向移动,N2的分压应比原来2倍小,N2分压变化趋势的曲线是b,C正确;在该温度下,达到平衡时,p(N2)=40 kPa,p(H2)=120 kPa,p(NH3)=120 kPa,则化学平衡常数Kp===4 800(kPa)2,D正确。
4. B 解析:由第一组数据可知,平衡时c(SO2)=0.2 mol·L-1,c(O2)=0.1 mol·L-1,c(SO3)= 0.1 mol·L-1,代入平衡常数表达式可知K=0.4,A错误;Ⅱ中Qc==1.8>0.4,平衡逆向移动,所以v逆>v正,B正确;Ⅲ中相当于在Ⅰ平衡的基础上充入0.1 mol的O2,平衡逆向移动,而Ⅰ中平衡时SO2的体积分数为50%,Ⅲ中达平衡时,SO2的体积分数小于50%,C错误;因为K=,当温度改变为T2时,k正=k逆,即K==1>0.4,则反应2SO3(g) 2SO2(g)+O2(g)的ΔH>0,温度升高,平衡正向移动,平衡常数增大,所以T15. C 解析:由图可知,反应在400℃以后,BaS的含量基本不变,并非温度越高越好,A错误;根据盖斯定律,ΔH=(ΔH2-ΔH3)×=172.5 kJ·mol-1>0,温度升高,平衡正向移动,CO的物质的量分数增大,B错误;400℃后,BaS的物质的量分数变化不大,硫化钡基本反应完全, CO2的量减少,CO的量增加,故反应后组分的变化是由C(s)+CO2(g) 2CO(g)的移动导致的,C正确;为使硫酸钡得到充分还原,需要加入过量的碳,故反应过程中生成的CO2和CO的物质的量之和小于投入C的物质的量,D错误。
6. B 解析:根据图象,曲线X随浓度的变化大于曲线Y随浓度的变化,因为v(N2O4)=k 1·c(N2O4),v(NO2)= k2·c2(NO2),所以曲线X表示NO2消耗速率与浓度的关系,A错误;根据v(N2O4)=k1·c(N2O4),v(NO2)=k2·c2(NO2),浓度的单位为mol·L-1 ,而反应速率的单位为 mol·L-1·s-1,因此k1与k2都有单位,且单位不同,k1的单位是s-1,k2的单位为L·mol-1·s-1,B正确;交点A表示的消耗速率v(N2O4)=v(NO2),而达到平衡时NO2的消耗速率应该是N2O4消耗速率的2倍,v(NO2)=2v(N2O4),C错误;100 ℃时,N2O4(g) 2NO2(g) ΔH>0,K=0.36=,而平衡时,v(NO2)=2v(N2O4),因此v(NO2)= k2·c2(NO2)=2v(N2O4)=2k1·c(N2O4),则==0.36,若在T1温度下,k1=k2,则=2,平衡常数增大,反应需要正向移动,温度需要升高,即T1>100 ℃,D错误。
7. C 解析:一般不用纯固体、纯液体表示反应速率,不能用H2O表示该反应的平均反应速率,A错误;依据反应速率之比等于化学计量数之比,当2v正(AsO)=v逆(I-)时,正、逆反应速率相等,反应达到平衡状态,B错误;由图可知,a到b的过程中,反应一直正向进行,正反应速率一直减小,逆反应速率一直增大,直到增大到与正反应速率相等,反应达到平衡状态,在反应达到平衡前,逆反应速率均小于正反应速率,a点和b点均未达到平衡状态,且a到b反应逐渐趋于平衡,a点的逆反应速率小于b点的正反应速率,C正确;根据题意,溶液混合后起始时,c(AsO)=c(I2)= x mol·L-1,由图可知, 平衡时c(AsO)=y mol·L-1,c(I-)= 2y mol·L-1,c(AsO)=c(I2)=(x-y) mol·L-1,平衡时溶液的pH=13,则c(OH-)=0.1 mol·L-1,反应的平衡常数K= eq \f(c(AsO)·c2(I-),c(AsO)·c(I2)·c2(OH-))=,D错误。
8. C 解析:Pt-Rh合金作催化剂可以降低活化能,提高反应速率,A正确;根据图示可知,840℃氨的催化氧化生成NO最多,B正确;520 ℃时,生成0.2 mol NO和0.2 mol N2,根据氮原子守恒可知,有0.6 mol NH3转化,即转化率为60%,C错误;840 ℃以上,N2的产率上升、NO的产率下降,说明可能发生了反应2NO(g) O2(g)+N2(g),升高温度氮气产率增加,说明该反应的正反应是吸热反应,ΔH>0,D正确。
9. D 解析:由140 ℃升到160 ℃,反应相同时间产率下降的原因可能是平衡向逆反应方向移动,故该反应为放热反应,A错误;由表中数据可知,反应条件为140 ℃、14 h时产率最高,故为最佳反应条件,B错误;温度不变,随着反应的进行反应物浓度减小,反应速率减小,而在100 ℃时、反应时间10~14 h内,产率增加的原因是在该温度下14小时还未达到平衡,反应还在正向进行,生成的产物越来越多,产率增大,C错误;由A项分析可知,从140 ℃升到160 ℃,反应相同时间产率下降的原因可能是平衡向逆反应方向移动,也可能是催化剂高温下失去活性,D正确。
10. C 解析:在260~320 ℃间,升高温度CH4的选择性基本不变,但CO2的转化率在上升,所以CH4的产率上升,A错误;W点可能是平衡点,延长时间不一定能提高CO2的转化率,B错误;由图可知,使用不同的催化剂,CO2的转化率不同,图示对应的时间内以Ni为催化剂,明显低于相同温度下Ni-CeO2为催化剂的转化率,C正确;高于320 ℃后,随温度的升高CO2转化率上升的原因是催化剂活性增大,反应速率增大,D错误。
1. B 解析:根据表格数据可知,第30 min后,NO、N2的浓度同等倍数的增大,说明平衡不发生移动,该反应为前后气体系数之和相等的反应,所以改变的条件可能是适当缩小了容器的体积,A正确;50 min时NO的浓度为0.48 mol·L-1,N2的浓度为0.36 mol·L-1,若不改变容器的体积,结合方程式,当NO全部转化时N2的浓度应为0.6 mol·L-1,但可逆反应不能完全转化,所以降低温度后平衡正向移动,但N2的浓度也不可能达到0.6 mol·L-1,B错误;第30 min后,NO、N2的浓度同等倍数的增大,说明平衡不移动,所以第30 min和第40 min时NO的转化率相同,C正确;氧气会和NO发生反应,使平衡逆向移动,D正确。
2. D 解析:实验1达到化学平衡,v(H2O)=v(CO)==0.16 mol·L-1·min-1,A正确;该反应前后气体分子数不变,恒温恒容,根据等效平衡原理,对比实验1、2可知,升高温度,生成H2的量减少(0.8变成0.4),说明逆反应是吸热反应,正反应放热,则该反应的正反应活化能小于逆反应活化能,B正确;900 ℃时,实验2达到平衡时H2O的转化率为40%,恒温恒容下,CO(g)、H2O(g)的起始加入的物质的量分别为4 mol、2 mol,与实验2等效,所以达到平衡时H2O的转化率还是40%,C正确;650 ℃时,实验1的K(650 ℃)=,若CO(g)、H2O(g)、CO2(g)、H2(g)的起始加入的物质的量分别为1.5 mol、2 mol、2.5 mol、3 mol,此时Qc=2.5<,反应正向进行,v(正)>v(逆),D错误。
3. D 解析:从曲线Ⅰ可知,无CO时,NO转化率达峰值后继续升高温度,NO转化率下降,即反应2NO(g) N2(g)+O2(g)的平衡随温度升高逆向移动,故其ΔH<0,A错误;达平衡后,其他条件不变,使>1,即增加CO投入,则平衡正向移动,但CO转化率下降,B错误;催化剂影响反应速率,改变反应达到平衡的时间,不能改变平衡的移动,故不能通过更换高效催化剂提高NO转化率,C错误;Y点温度下发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g),起始时c(NO)=c(CO)=0.1 mol·L-1,从曲线Ⅱ知,其NO转化率为80%,此时的平衡常数K== =1 600( mol·L-1)-1;再通入CO、N2各0.01 mol,此时体系浓度商Q==≈889(mol·L-1)-1,Qv逆(CO),D正确。
4. D 解析:由表中数据可知,当一定时,升高温度,平衡后混合气体中CO的体积分数增大,说明升高温度平衡逆向移动,则水煤气变换反应的ΔH<0,A正确;由表中数据可知,温度一定时,反应物投料比越大,平衡时CO的体积分数越小,说明CO的转化率高,B正确;原料气中N2、H2、CO、CO2的体积分数分别为20%、50%、25%、5%,设反应前CO的物质的量为1 mol,则N2为0.8 mol,H2为2 mol,CO2为0.2 mol,又因=1,则H2O(g)为1 mol,总物质的量为5 mol,所以CO的体积分数为×100%=20%,C正确;设反应前CO的物质的量为1 mol,则N2为 0.8 mol,H2为2 mol,CO2为0.2 mol,H2O(g)为1 mol,假设反应达到平衡时CO转化了x mol,则有三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始量/mol 1 1 0.2 2
转化量/mol x x x x
平衡量/mol 1-x 1-x 0.2+x 2+x
300 ℃时CO占6%,所以×100%=6.00%,解得x=0.7,因此CO(g)、H2O(g)、CO2 (g)、H2(g)平衡时的物质的量分别为0.3、0.3、0.9、2.7,反应前后气体体积不变,则平衡常数为K====27,D错误。
5. D 解析:由图Ⅰ可知,改变条件使平衡发生了移动,而催化剂不影响化学平衡,A错误。由于该反应为放热反应,在压强一定时,升高温度,平衡向逆反应方向移动,SO2平衡转化率减小,由图Ⅱ可知T2>T1,B错误。由于该反应为放热反应,升高温度平衡逆向移动,逆反应速率大于正反应速率;增大压强,平衡正向移动,正反应速率大于逆反应速率;图Ⅲ不能表示t0时刻升高温度对反应速率的影响,C错误。正反应放热,温度越高正反应平衡常数越小,所以T(B)>T(A), 逆反应吸热,温度越高,逆反应平衡常数越大,所以T(C)>T(B),故A、B、C三点体系对应的温度T(C)>T(B)>T(A), D正确。
6. C 解析:根据题意可列出如下三段式:
5CO(g)+I2O5(s) 5CO2(g)+I2(s)
起始/mol 2 0
变化/mol y y
b点/mol 2-y y
根据b点时CO2的体积分数φ(CO2)=y÷2=0.80,得y=1.6 mol,转化率等于=(变化量÷起始量)×100%=(1.6÷2)×100%=80%,A错误;两边计量数相等,所以压强始终不变,不能作为平衡状态的标志,B错误;b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,C正确;0~0.5 min时,a点时CO2的体积分数φ(CO2)=0.30,起始时加入的CO为2 mol,反应过程中混合气的总物质的量不变,所以a点时n(CO2)=2×0.3 mol=0.6 mol,所以消耗的CO为0.6 mol,则从反应开始至a点时的反应速率为v(CO)=(0.6 mol÷2 L)÷0.5 min=0.6 mol·L-1·min-1,D错误。
7. C 解析:注入试剂①后,溶液的透光率升高,说明溶液的血红色变浅,即[Fe(SCN)]2+浓度减小,由于稀释也会使[Fe(SCN)]2+浓度减小,平衡会移动,A错误;KCl溶液为含有钾离子的中性溶液,NH4Cl溶液为含有铵根离子(水解显酸性)的酸性溶液,透光率③比②高,可能是阳离子种类或溶液pH导致的,B错误;③为0.04 mol·L-1的KCl溶液,④为4 mol·L-1的KCl溶液,④的浓度大于③的浓度,透光率④比③高,说明血红色变浅,可能是发生了反应[Fe(SCN)]2++4Cl- [FeCl4]- +SCN-,C正确;若要证明试剂③为0.04 mol·L-1的KCl溶液中Cl-对平衡体系有影响,需排除钾离子的干扰,作空白对照实验,不能使用0.04 mol·L-1的KNO3溶液进行实验,因为溶液中有硝酸根离子,可能会影响实验结果的验证,D错误。
8. C 解析:X2和Y2的起始量和转化量之比相等均为1∶3,则反应从开始到平衡过程中始终有c(X2)∶c(Y2)=1∶3,即3c(X2)=c(Y2),所以当3c(X2)=c(Y2)时,反应不一定达到平衡,A错误;由图1可知,t2 min时改变某种条件,重新达到平衡后,X2浓度逐渐增大至不再改变,改变的条件可能是减小Y2浓度或增大XY3浓度或升高温度,若是浓度因素的影响,则平衡常数不变,B错误;投料改为2 mol X2和6 mol Y2,为原投料量的2倍,恒温恒容条件下等同于加压,平衡向正反应方向移动,则XY3的平衡体积分数增大,C正确;催化剂能降低反应的活化能,增大反应速率,但不能使平衡发生移动,不能提高X2的平衡转化率,D错误。
9. C 解析:T1先拐,所以T1>T2,由T2到T1,温度升高,异丁烯的转化率降低,即平衡逆向移动,逆向为吸热反应,则ΔH<0,A正确;其他条件不变,再充入1 mol W,等效于充入1 mol CH3OH和1 mol R,平衡正向移动,此时W的百分含量会相应增大,B正确;温度相同时,M点和B点异丁烯的转化率相同,即异丁烯的浓度相同,有vM正=vB正,但是M点对应的温度T1偏高,所以vM正>vB正,C错误;240~300 min时间内,反应均达平衡状态,正、逆反应速率相等,T1和T2两个温度下平均反应速率相等,D正确。
10. C 解析:初始二氧化碳的物质的量为1 mol,依据碳原子守恒,平衡混合气体中C原子的物质的量是1 mol,A正确;该反应焓变小于0,为放热反应,则反应物的总能量高于生成物的总能量,B正确;平衡混合气体中CH3OH的物质的量分数为25%,设平衡时消耗二氧化碳x mol·L-1,则平衡时二氧化碳的物质的量浓度为(1-x) mol·L-1,氢气的物质的量浓度为(3-3x) mol·L-1,CH3OH的物质的量浓度为x mol·L-1,水蒸气的物质的量浓度为x mol·L-1,=25%,解得x=,则平衡时c(CO2)= mol·L-1,c(H2)=1 mol·L-1,c(CH3OH)=c(H2O)= mol·L-1,化学平衡常数K===,C错误;其他条件相同时,若起始充入2 mol CO2和 6 mol H2,与原来相比,开始反应物浓度是原来的2倍,则压强是原来的2倍,增大压强平衡正向移动,导致二氧化碳和氢气的转化率增大,则平衡时CH3OH的物质的量分数大于25%,D正确。
真题快递+天天练A组 满分:42分 限时:45分钟
天天练B组 满分:30分 限时:40分钟
1. (3分)(2022·江苏卷)乙醇 水催化重整可获得H2。其主要反应为C2H5OH(g)+3H2O(g)===2CO2(g)+6H2(g) ΔH=173.3 kJ· mol-1,CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=41.2 kJ· mol-1,在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
CO的选择性=×100%,下列说法正确的是( )
A. 图中曲线①表示平衡时H2产率随温度的变化
B. 升高温度,平衡时CO的选择性增大
C. 一定温度下,增大可提高乙醇平衡转化率
D. 一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
2. (3分)(2021·江苏卷)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速通过装有催化剂的反应管,NH3的转化率、生成N2的选择性[×100%]与温度的关系如图所示。
下列说法正确的是( )
A. 其他条件不变,升高温度,NH3的平衡转化率增大
B. 其他条件不变,在175~300 ℃范围,随温度的升高,出口处N2和氮氧化物的量均不断增大
C. 催化氧化除去尾气中的NH3应选择反应温度高于250 ℃
D. 高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂
3.(3分)(2020·江苏卷改编)CH4与CO2重整生成H2和CO的过程中主要发生下列反应:
CH4(g)+CO2(g)===2H2(g)+2CO(g) ΔH=247.1 kJ· mol-1
H2(g)+CO2(g)===H2O(g)+CO(g) ΔH=41.2 kJ· mol-1
在恒压、反应物起始物质的量比n(CH4)∶n(CO2)=1∶1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
A. 升高温度、增大压强均有利于提高CH4的平衡转化率
B. 曲线B表示CH4的平衡转化率随温度的变化
C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4的平衡转化率达到X点的值,改变除温度外的特定条件继续反应,CH4的平衡转化率不能达到Y点的值
4.(3分)(2019·江苏卷改编)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A. 反应2NO(g)+O2(g)===2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380 ℃时,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2 000
1.(3分)(2023·江苏各地模拟优选)一定温度下,在2个容积均为1 L的恒容密闭容器中,加入一定量的反应物,发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0,相关数据见下表。
容器编号 温度/ ℃ 起始物质的量/ mol 平衡物质的量/ mol
NO(g) CO(g) CO2(g)
Ⅰ T1 0.2 0.2 0.1
Ⅱ T2 0.2 0.2 0.12
下列说法不正确的是( )
A. T1>T2
B. Ⅰ中反应达到平衡时,CO的转化率为50%
C. 达到平衡所需要的时间:Ⅱ>Ⅰ
D. 对于Ⅰ,平衡后向容器中再充入0.2 mol CO和0.2 mol CO2,平衡正向移动
2. (3分)(2023·江苏各地模拟优选)在容积不变的密闭容器中发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,830 ℃时反应的平衡常数是1.0,下列说法正确的是( )
A. 容器内的压强不变时,说明反应达到平衡状态
B. 若平衡时移走CO2,则平衡向正反应方向移动,化学反应速率增大
C. 830 ℃时,充入0.1 mol CO和0.3 mol H2O保持温度不变,CO平衡转化率为75%
D. 1 000 ℃时,某时刻CO2、H2、CO和H2O的浓度均为0.05 mol·L-1,此时平衡正向移动
3.(3分)(2023·江苏各地模拟优选)在一定温度和催化剂的条件下,发生2NH3(g) N2(g)+3H2(g)。将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。下列的说法不正确的是( )
A. 曲线Ⅰ表示NH3的分压随时间的变化
B. 用H2的浓度变化表示0~t1时间内的反应速率v(H2)= mol·L-1·min-1(用含t1的代数式表示)
C. t2时将容器体积迅速缩小至原来的一半并保持不变,N2分压变化趋势的曲线是b
D. 在此温度下该反应的化学平衡常数Kp=4 800(kPa)2
4.(3分)(2023·江苏各地模拟优选)温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2SO3(g) 2SO2(g)+O2(g) ΔH>0。实验测得:v正=k正c2(SO3),v逆=k逆c2(SO2)·c(O2),k正、k逆为速率常数,只与温度有关。下列说法正确的是( )
容器编号 物质的起始浓度/(mol·L-1) 物质的平衡浓度/(mol·L-1)
c(SO3) c(SO2) c(O2) c(SO2)
Ⅰ 0.3 0 0 0.2
Ⅱ 0.1 0.3 0.2
Ⅲ 0.3 0 0.1
A. 温度为T1时,该反应的平衡常数为0.2
B. 容器Ⅱ中起始时v逆>v正
C. 达平衡时,容器Ⅲ中SO2的体积分数大于50%
D. 当温度改变为T2时,若k正=k逆,则T1>T2
5. (3分)(2023·江苏各地模拟优选)工业上利用碳热还原BaSO4制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图所示。
碳热还原BaSO4过程中可能发生下列反应:
ⅰ. BaSO4(s)+2C(s)===2CO2(g)+BaS(s) ΔH1;
ⅱ. BaSO4(s)+4C(s)===4CO(g)+BaS(s) ΔH2=571.2 kJ·mol-1;
ⅲ. BaSO4(s)+4CO(g)===4CO2(g)+BaS(s) ΔH3=-118.8 kJ·mol-1。
下列关于碳热还原BaSO4过程的说法中,正确的是( )
A. 要想得到更多的BaS,温度应该越高越好
B. 对于反应C(s)+CO2(g) 2CO(g),温度升高,CO的物质的量分数减小
C. 400℃后,C、CO2的量减少是由C(s)+CO2(g) 2CO(g)的移动导致的
D.根据原子守恒规律可知生成的CO2和CO的物质的量之和始终等于投入C的物质的量
6.(3分)(2023·江苏各地模拟优选)100 ℃时,N2O4(g) 2NO2(g) ΔH>0,K=0.36。NO2和N2O4的消耗速率与浓度存在下列关系:v(N2O4)=k1·c(N2O4),v(NO2)=k2·c2(NO2),其中k1、k2是与反应及温度有关的常数,其消耗速率与浓度关系如图所示。下列有关说法正确的是( )
A. 曲线X表示N2O4消耗速率与浓度的关系
B. k1与k2都有单位,且单位不同
C. 图中A点处于平衡状态
D. 若在T1温度下,k1=k2,则T1<100 ℃
7.(3分)(2023·江苏各地模拟优选)25 ℃时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)===AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。下列说法正确的是( )
A. O~t1 min用H2O表示的平均反应速率为 mol·L-1·min-1
B. 当v正(AsO)=2v逆(I-)时,反应达到平衡状态
C. a点的逆反应速率小于b点的正反应速率
D. 平衡时溶液的pH=13,则该反应的平衡常数K=
8.(3分)(2023·江苏各地模拟优选)氨的催化氧化是工业制硝酸的基础,其反应机理如图1所示;在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关产物的物质的量与温度的关系如图2所示。
eq \o(\s\up7(),\s\do5(图1))
eq \o(\s\up7(),\s\do5(图2))
下列说法错误的是( )
A. 加入Pt Rh合金的目的是提高反应的速率
B. 氨的催化氧化最佳温度应控制在840 ℃左右
C. 520 ℃时,NH3的转化率为40%
D. 840 ℃以上,可能发生了反应:2NO(g) O2(g)+N2(g) ΔH>0
9.(3分)(2023·江苏各地模拟优选)苯乙烯与溴苯在一定条件下发生Heck反应:,某实验小组在原料及催化剂钯用量等均相同的条件下进行多组实验,测得如下数据:
反应温度/ ℃ 100 100 100 100 120 140 160
反应时间/h 10 12 14 16 14 14 14
产率/% 81.2 84.4 86.6 86.2 93.5 96.6 96.0
下列说法正确的是( )
A. 该反应为吸热反应
B. 由表中数据可知最佳反应条件为120 ℃、14 h
C. 100 ℃时、反应时间10~14 h内,产率增加的原因是反应速率增大
D. 从140 ℃升到160 ℃,反应相同时间,产率下降的原因可能是平衡向逆反应方向移动
10.(3分)(江苏省百校大联考2022届高三模拟)在一定的温度和压强下,将按一定比例混合的CO2和H2通过装有催化剂的反应器可得到甲烷。已知:
CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH=-165 kJ· mol-1
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=41 kJ· mol-1
催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂作用下反应相同时间,测CO2转化率和生成CH4选择性随温度变化的影响如图所示。
CH4选择性=×100%。下列有关说法正确的是( )
A. 在260~320 ℃间,以NiCeO2为催化剂,升高温度CH4的产率不变
B. 延长W点的反应时间,一定能提高CO2的转化率
C. 选择合适的催化剂,有利于提高CO2的转化率
D. 高于320 ℃后,以Ni为催化剂,随温度的升高CO2转化率上升的原因是平衡正向移动
1. (3分)(2023·江苏各地模拟优选)用活性炭对NO进行吸附可减少环境污染,反应如下:C(s)+2NO(g) N2(g)+CO2(g)+34.0 kJ,T1 ℃时,在密闭容器中测得反应在不同时刻各物质的浓度如下:
浓度物质 0 10 20 30 40 50
NO 1.00 0.58 0.40 0.40 0.48 0.48
N2 0 0.21 0.30 0.30 0.36 0.36
下列说法不正确的是( )
A. 第30 min后,改变的条件可能是适当缩小了容器的体积
B. 其他条件不变,在第50 min后降低温度,可使容器中N2的浓度升高至0.6 mol·L-1
C. 第30 min和第40 min时NO的转化率相同
D. 向容器内通适量氧气可能会使平衡逆向移动
2.(3分)(2023·江苏各地模拟优选)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。现将不同物质的量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,发生反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
实验组 温度/ ℃ 起始量/ mol 平衡量/ mol 达到平衡所需时间/min
H2O CO H2 CO
1 650 2 4 1.6 2.4 5
2 900 1 2 0.4 1.6 3
下列说法错误的是( )
A. 实验1达到化学平衡,以v(H2O)表示的化学反应速率为0.16 mol·L-1·min-1
B. 该反应的正反应活化能小于逆反应活化能
C. 900 ℃时,实验2若CO(g)、H2O(g)的起始加入的物质的量分别为4 mol、2 mol,则达到平衡时H2O的转化率为40%
D. 650 ℃时,实验1若CO(g)、H2O(g),CO2(g)、H2(g)的起始加入的物质的量分别为1.5 mol、2 mol、2.5 mol、3 mol,则此时v(正)
A. 反应2NO(g) N2(g)+O2(g)的ΔH>0
B. 达平衡后,其他条件不变,使>1,CO转化率上升
C. X点可以通过更换高效催化剂提高NO转化率
D. Y点再通入CO、N2各0.01 mol,此时v正(CO) >v逆(CO)
4.(3分)(2023·江苏各地模拟优选)合成氨原料气中的CO可通过水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g)除去。某合成氨原料气中N2、H2、CO、CO2的体积分数分别为20%、50%、25%、5%。一定温度下按不同投料比[]通入水蒸气,平衡后混合气体中CO的体积分数如下表。
CO的体积分数/%温度/ ℃ =1 =3 =5
200 1.70 0.21 0.02
250 2.73 0.30 0.06
300 6.00 0.84 0.43
350 7.85 1.52 0.80
下列说法不正确的是( )
A. 从表中数据可知,水煤气变换反应的ΔH<0
B. 温度相同时,投料比越大,CO的转化率越高
C. 按=1通入水蒸气后,反应前CO在混合气体中的体积分数为20%
D. 根据=1时数据推算,300 ℃时水煤气变换反应的平衡常数K为46
5.(3分)(2023·江苏各地模拟优选)工业生产硫酸的一步重要反应是2SO2(g)+O2(g)===2SO3(g) ΔH<0,如果该反应在容积不变的密闭容器中进行,下列各图表示当其他条件不变时改变某一条件对上述反应的影响,其中结论正确的是 ( )
eq \o(\s\up7(),\s\do5(Ⅰ)) eq \o(\s\up7(),\s\do5(Ⅱ))
eq \o(\s\up7(),\s\do5(Ⅲ)) eq \o(\s\up7(),\s\do5(Ⅳ))
A. 图Ⅰ表示催化剂对化学平衡的影响,且甲使用了催化剂
B. 图Ⅱ表示SO2平衡转化率与温度及压强的关系,可以判断T1>T2
C. 图Ⅲ表示t0时刻表示升高温度或增大压强对反应速率的影响
D. Ⅳ中A、B、C三点体系对应的温度: T(C)>T(B)>T(A)
6.(3分)(2023·江苏各地模拟优选)利用I2O5可消除CO污染,相关反应为I2O5(s)+5CO(g) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. a点所在温度下,0~0.5 min反应速率v(CO)=0.3 mol·L-1·min-1
7.(3分)(2023·江苏各地模拟优选)探究盐酸盐溶液对反应Fe3++SCN- ===[Fe(SCN)]2+ (血红色)的影响。将2 mL 0.01 mol·L-1的FeCl2溶液与2 mL 0.02 mol·L-1的KSCN溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如图所示。
已知:ⅰ. 溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略;
ⅱ. Fe3++4Cl-===[FeCl4]-(黄色)。
下列说法正确的是( )
A. 注入试剂①后,平衡Fe3++SCN- [Fe(SCN)]2+不移动
B. 透光率③比②高, 一定是溶液pH不同导致的
C. 透光率④比③高,可能发生了反应[Fe(SCN)]2++4Cl-===[FeCl4]- +SCN-
D. 若要证明试剂③中Cl-对平衡体系有影响,还应使用0.04 mol·L-1的KNO3溶液进行实验
8.(3分)(2023·江苏各地模拟优选)向一恒温恒容的密闭容器中充入1 mol X2和3 mol Y2发生反应:X2(g)+3Y2(g) 2XY3(g),测得部分物质的物质的量浓度与时间关系如图1所示,在TiO2 Cu催化下反应机理与能量变化如图2所示。
eq \o(\s\up7(),\s\do5(图1))
eq \o(\s\up7(),\s\do5(图2))
下列说法正确的是( )
A. 3c(X2)=c(Y2)时,表明反应达到平衡
B. t2 min时改变某种条件,重新达到平衡后,该反应的化学平衡常数一定减小
C. 投料改为2 mol X2和6 mol Y2,XY3的平衡体积分数增大
D. 寻找合适催化剂降低活化能,能有效提高X2的平衡转化率
9.(3分)(2023·江苏各地模拟优选)在催化剂作用下,向恒容容器中按物质的量比1∶1充入甲醇和异丁烯(用R表示),分别在T1和T2两个温度下反应生成W:CH3OH(g)+R(g) W(g) ΔH。异丁烯的转化率随时间的变化关系如图所示。下列说法不正确的是( )
A. T1>T2,ΔH<0
B. 维持T2不变,再向容器中充入1 mol W,新平衡时W的百分含量增大
C. vM正=vB正>vA逆
D. 240~300 min时间内,T1和T2两个温度下平均反应速率相等
10.(3分)(2023·江苏各地模拟优选)在一定温度下,将1 mol CO2和3 mol H2充入体积为1 L的恒容密闭容器中发生反应并达到平衡:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,测得平衡混合气体中CH3OH的物质的量分数为25%。下列说法不正确的是( )
A. 平衡混合气体中C原子的物质的量是1 mol
B. 该反应的反应物的总能量高于生成物的总能量
C. 该反应的化学平衡常数K=
D. 其他条件相同时,若起始充入2 mol CO2和6 mol H2,达到平衡时CH3OH的物质的量分数大于25%
第7练 化学反应速率与化学平衡原理的应用AB
1. B 解析:曲线②代表H2的产率,A错误;升高温度,平衡时CO的选择性增大,B正确;两种物质参加反应,增大一种物质的浓度,会降低该物质的平衡转化率,C错误;选用高效催化剂,不会影响平衡时H2的产率,D错误。
2. D 解析:NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向进行,氨气的平衡转化率降低,A错误;根据图像,在175~300 ℃范围,随温度的升高,N2的选择性降低,即产生氮气的量减少,B错误;根据图像,温度高于250 ℃ ,氮气的选择性降低,且氨气的转化率变化并不大,浪费能源,温度应略小于225 ℃,此时氨气的转化率、氮气的选择性较大,C错误;氮气对环境无污染,氮的氧化物污染环境,因此高效除去尾气中的NH3,需研发低温下NH3转化率高和N2选择性高的催化剂,D正确。
3. B 解析:甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,A错误;根据两个反应得到总反应为CH4(g)+2CO2(g)=== H2(g)+3CO(g) +H2O (g),加入的CH4与CO2物质的量相等,CO2消耗量大于CH4,因此CO2的转化率大于CH4,因此曲线B表示CH4的平衡转化率随温度变化,B正确;使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,C错误;800 K时,甲烷的转化率为X点,可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,D错误。
4. B 解析:随温度升高NO的转化率先升高后降低,说明温度较低时反应较慢,一段时间内并未达到平衡,分析温度较高时,已达到平衡时的NO转化率可知,温度越高NO转化率越低,说明温度升高平衡向逆反应方向移动,根据勒夏特列原理分析该反应为放热反应,ΔH<0,A错误;根据上述分析,X点时,反应还未到达平衡状态,反应正向进行,所以延长反应时间能提高NO的转化率,B正确;Y点,反应已经达到平衡状态,此时增加O2的浓度,使得正反应速率大于逆反应速率,平衡向正反应方向移动,可以提高NO的转化率,C错误;设NO起始浓度为a mol·L-1,NO的转化率为50%,则平衡时NO、O2和NO2的浓度分别为0.5a mol·L-1、(5×10-4-0.25a)mol·L-1、0.5a mol·L-1,平衡常数K==>=2 000,D错误。
1. D 解析:两次实验起始投入量相同,该反应为放热反应,温度T2达到平衡时,二氧化碳的量少,降温平衡正向移动,故T1>T2,A正确;Ⅰ中反应达到平衡时,CO2的物质的量为0.1 mol,则参加反应的CO的物质的量为0.1 mol,起始投入量为0.2 mol,则其转化率为50%,B正确;T1>T2,温度越高,反应速率越大,达到平衡所需要的时间越短,C正确;恒容1 L的容器中,对于反应Ⅰ平衡时NO、CO、N2、CO2的物质的量分别为0.1 mol、0.1 mol、0.05 mol、0.1 mol,平衡常数K==5,平衡后向容器中再充入0.2 mol CO和0.2 mol CO2,此时浓度商Qc==5,K=Qc,平衡不移动,D错误。
2. C 解析:该反应气体分子总数始终不变、故压强也始终不变,则当体系压强不随时间变化时不能说明反应达到平衡状态,A错误;若平衡时移走CO2,则减少了产物浓度,平衡向正反应方向移动,但化学反应速率减小,B错误; 830℃时,充入0.1 mol CO和0.3 mol H2O保持温度不变,
K===1,得x=0.075 mol,则CO平衡转化率为75%,C正确;CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,830 ℃时反应的平衡常数是1.0,1 000 ℃时,平衡左移,则K<1,某时刻CO2、H2、CO和H2O的浓度均为0.05 mol·L-1,Qc==1>K,则此时平衡向逆反应方向移动,D错误。
3. B 解析:根据图示可知,Ⅰ表示物质的分压逐渐减小,Ⅱ、Ⅲ分压逐渐增大,且Ⅱ分压增大的多于Ⅲ,所以故曲线Ⅰ表示NH3的分压随时间的变化,Ⅱ、Ⅲ分别表示H2、N2的分压随时间的变化,A正确;密闭容器中0.1 mol NH3总压为200 kPa,t1时H2的分压为120 kPa,则H2的物质的量为n(H2)=×0.1 mol=0.06 mol,故v(H2)== mol·L-1·min-1,B错误; 容器体积迅速缩小到原来的一半,则氮气的分压迅速增大到原来的2倍,压强增大,平衡向气体总体积减小的方向移动,即平衡逆向移动,N2的分压应比原来2倍小,N2分压变化趋势的曲线是b,C正确;在该温度下,达到平衡时,p(N2)=40 kPa,p(H2)=120 kPa,p(NH3)=120 kPa,则化学平衡常数Kp===4 800(kPa)2,D正确。
4. B 解析:由第一组数据可知,平衡时c(SO2)=0.2 mol·L-1,c(O2)=0.1 mol·L-1,c(SO3)= 0.1 mol·L-1,代入平衡常数表达式可知K=0.4,A错误;Ⅱ中Qc==1.8>0.4,平衡逆向移动,所以v逆>v正,B正确;Ⅲ中相当于在Ⅰ平衡的基础上充入0.1 mol的O2,平衡逆向移动,而Ⅰ中平衡时SO2的体积分数为50%,Ⅲ中达平衡时,SO2的体积分数小于50%,C错误;因为K=,当温度改变为T2时,k正=k逆,即K==1>0.4,则反应2SO3(g) 2SO2(g)+O2(g)的ΔH>0,温度升高,平衡正向移动,平衡常数增大,所以T1
6. B 解析:根据图象,曲线X随浓度的变化大于曲线Y随浓度的变化,因为v(N2O4)=k 1·c(N2O4),v(NO2)= k2·c2(NO2),所以曲线X表示NO2消耗速率与浓度的关系,A错误;根据v(N2O4)=k1·c(N2O4),v(NO2)=k2·c2(NO2),浓度的单位为mol·L-1 ,而反应速率的单位为 mol·L-1·s-1,因此k1与k2都有单位,且单位不同,k1的单位是s-1,k2的单位为L·mol-1·s-1,B正确;交点A表示的消耗速率v(N2O4)=v(NO2),而达到平衡时NO2的消耗速率应该是N2O4消耗速率的2倍,v(NO2)=2v(N2O4),C错误;100 ℃时,N2O4(g) 2NO2(g) ΔH>0,K=0.36=,而平衡时,v(NO2)=2v(N2O4),因此v(NO2)= k2·c2(NO2)=2v(N2O4)=2k1·c(N2O4),则==0.36,若在T1温度下,k1=k2,则=2,平衡常数增大,反应需要正向移动,温度需要升高,即T1>100 ℃,D错误。
7. C 解析:一般不用纯固体、纯液体表示反应速率,不能用H2O表示该反应的平均反应速率,A错误;依据反应速率之比等于化学计量数之比,当2v正(AsO)=v逆(I-)时,正、逆反应速率相等,反应达到平衡状态,B错误;由图可知,a到b的过程中,反应一直正向进行,正反应速率一直减小,逆反应速率一直增大,直到增大到与正反应速率相等,反应达到平衡状态,在反应达到平衡前,逆反应速率均小于正反应速率,a点和b点均未达到平衡状态,且a到b反应逐渐趋于平衡,a点的逆反应速率小于b点的正反应速率,C正确;根据题意,溶液混合后起始时,c(AsO)=c(I2)= x mol·L-1,由图可知, 平衡时c(AsO)=y mol·L-1,c(I-)= 2y mol·L-1,c(AsO)=c(I2)=(x-y) mol·L-1,平衡时溶液的pH=13,则c(OH-)=0.1 mol·L-1,反应的平衡常数K= eq \f(c(AsO)·c2(I-),c(AsO)·c(I2)·c2(OH-))=,D错误。
8. C 解析:Pt-Rh合金作催化剂可以降低活化能,提高反应速率,A正确;根据图示可知,840℃氨的催化氧化生成NO最多,B正确;520 ℃时,生成0.2 mol NO和0.2 mol N2,根据氮原子守恒可知,有0.6 mol NH3转化,即转化率为60%,C错误;840 ℃以上,N2的产率上升、NO的产率下降,说明可能发生了反应2NO(g) O2(g)+N2(g),升高温度氮气产率增加,说明该反应的正反应是吸热反应,ΔH>0,D正确。
9. D 解析:由140 ℃升到160 ℃,反应相同时间产率下降的原因可能是平衡向逆反应方向移动,故该反应为放热反应,A错误;由表中数据可知,反应条件为140 ℃、14 h时产率最高,故为最佳反应条件,B错误;温度不变,随着反应的进行反应物浓度减小,反应速率减小,而在100 ℃时、反应时间10~14 h内,产率增加的原因是在该温度下14小时还未达到平衡,反应还在正向进行,生成的产物越来越多,产率增大,C错误;由A项分析可知,从140 ℃升到160 ℃,反应相同时间产率下降的原因可能是平衡向逆反应方向移动,也可能是催化剂高温下失去活性,D正确。
10. C 解析:在260~320 ℃间,升高温度CH4的选择性基本不变,但CO2的转化率在上升,所以CH4的产率上升,A错误;W点可能是平衡点,延长时间不一定能提高CO2的转化率,B错误;由图可知,使用不同的催化剂,CO2的转化率不同,图示对应的时间内以Ni为催化剂,明显低于相同温度下Ni-CeO2为催化剂的转化率,C正确;高于320 ℃后,随温度的升高CO2转化率上升的原因是催化剂活性增大,反应速率增大,D错误。
1. B 解析:根据表格数据可知,第30 min后,NO、N2的浓度同等倍数的增大,说明平衡不发生移动,该反应为前后气体系数之和相等的反应,所以改变的条件可能是适当缩小了容器的体积,A正确;50 min时NO的浓度为0.48 mol·L-1,N2的浓度为0.36 mol·L-1,若不改变容器的体积,结合方程式,当NO全部转化时N2的浓度应为0.6 mol·L-1,但可逆反应不能完全转化,所以降低温度后平衡正向移动,但N2的浓度也不可能达到0.6 mol·L-1,B错误;第30 min后,NO、N2的浓度同等倍数的增大,说明平衡不移动,所以第30 min和第40 min时NO的转化率相同,C正确;氧气会和NO发生反应,使平衡逆向移动,D正确。
2. D 解析:实验1达到化学平衡,v(H2O)=v(CO)==0.16 mol·L-1·min-1,A正确;该反应前后气体分子数不变,恒温恒容,根据等效平衡原理,对比实验1、2可知,升高温度,生成H2的量减少(0.8变成0.4),说明逆反应是吸热反应,正反应放热,则该反应的正反应活化能小于逆反应活化能,B正确;900 ℃时,实验2达到平衡时H2O的转化率为40%,恒温恒容下,CO(g)、H2O(g)的起始加入的物质的量分别为4 mol、2 mol,与实验2等效,所以达到平衡时H2O的转化率还是40%,C正确;650 ℃时,实验1的K(650 ℃)=,若CO(g)、H2O(g)、CO2(g)、H2(g)的起始加入的物质的量分别为1.5 mol、2 mol、2.5 mol、3 mol,此时Qc=2.5<,反应正向进行,v(正)>v(逆),D错误。
3. D 解析:从曲线Ⅰ可知,无CO时,NO转化率达峰值后继续升高温度,NO转化率下降,即反应2NO(g) N2(g)+O2(g)的平衡随温度升高逆向移动,故其ΔH<0,A错误;达平衡后,其他条件不变,使>1,即增加CO投入,则平衡正向移动,但CO转化率下降,B错误;催化剂影响反应速率,改变反应达到平衡的时间,不能改变平衡的移动,故不能通过更换高效催化剂提高NO转化率,C错误;Y点温度下发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g),起始时c(NO)=c(CO)=0.1 mol·L-1,从曲线Ⅱ知,其NO转化率为80%,此时的平衡常数K== =1 600( mol·L-1)-1;再通入CO、N2各0.01 mol,此时体系浓度商Q==≈889(mol·L-1)-1,Q
4. D 解析:由表中数据可知,当一定时,升高温度,平衡后混合气体中CO的体积分数增大,说明升高温度平衡逆向移动,则水煤气变换反应的ΔH<0,A正确;由表中数据可知,温度一定时,反应物投料比越大,平衡时CO的体积分数越小,说明CO的转化率高,B正确;原料气中N2、H2、CO、CO2的体积分数分别为20%、50%、25%、5%,设反应前CO的物质的量为1 mol,则N2为0.8 mol,H2为2 mol,CO2为0.2 mol,又因=1,则H2O(g)为1 mol,总物质的量为5 mol,所以CO的体积分数为×100%=20%,C正确;设反应前CO的物质的量为1 mol,则N2为 0.8 mol,H2为2 mol,CO2为0.2 mol,H2O(g)为1 mol,假设反应达到平衡时CO转化了x mol,则有三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始量/mol 1 1 0.2 2
转化量/mol x x x x
平衡量/mol 1-x 1-x 0.2+x 2+x
300 ℃时CO占6%,所以×100%=6.00%,解得x=0.7,因此CO(g)、H2O(g)、CO2 (g)、H2(g)平衡时的物质的量分别为0.3、0.3、0.9、2.7,反应前后气体体积不变,则平衡常数为K====27,D错误。
5. D 解析:由图Ⅰ可知,改变条件使平衡发生了移动,而催化剂不影响化学平衡,A错误。由于该反应为放热反应,在压强一定时,升高温度,平衡向逆反应方向移动,SO2平衡转化率减小,由图Ⅱ可知T2>T1,B错误。由于该反应为放热反应,升高温度平衡逆向移动,逆反应速率大于正反应速率;增大压强,平衡正向移动,正反应速率大于逆反应速率;图Ⅲ不能表示t0时刻升高温度对反应速率的影响,C错误。正反应放热,温度越高正反应平衡常数越小,所以T(B)>T(A), 逆反应吸热,温度越高,逆反应平衡常数越大,所以T(C)>T(B),故A、B、C三点体系对应的温度T(C)>T(B)>T(A), D正确。
6. C 解析:根据题意可列出如下三段式:
5CO(g)+I2O5(s) 5CO2(g)+I2(s)
起始/mol 2 0
变化/mol y y
b点/mol 2-y y
根据b点时CO2的体积分数φ(CO2)=y÷2=0.80,得y=1.6 mol,转化率等于=(变化量÷起始量)×100%=(1.6÷2)×100%=80%,A错误;两边计量数相等,所以压强始终不变,不能作为平衡状态的标志,B错误;b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,C正确;0~0.5 min时,a点时CO2的体积分数φ(CO2)=0.30,起始时加入的CO为2 mol,反应过程中混合气的总物质的量不变,所以a点时n(CO2)=2×0.3 mol=0.6 mol,所以消耗的CO为0.6 mol,则从反应开始至a点时的反应速率为v(CO)=(0.6 mol÷2 L)÷0.5 min=0.6 mol·L-1·min-1,D错误。
7. C 解析:注入试剂①后,溶液的透光率升高,说明溶液的血红色变浅,即[Fe(SCN)]2+浓度减小,由于稀释也会使[Fe(SCN)]2+浓度减小,平衡会移动,A错误;KCl溶液为含有钾离子的中性溶液,NH4Cl溶液为含有铵根离子(水解显酸性)的酸性溶液,透光率③比②高,可能是阳离子种类或溶液pH导致的,B错误;③为0.04 mol·L-1的KCl溶液,④为4 mol·L-1的KCl溶液,④的浓度大于③的浓度,透光率④比③高,说明血红色变浅,可能是发生了反应[Fe(SCN)]2++4Cl- [FeCl4]- +SCN-,C正确;若要证明试剂③为0.04 mol·L-1的KCl溶液中Cl-对平衡体系有影响,需排除钾离子的干扰,作空白对照实验,不能使用0.04 mol·L-1的KNO3溶液进行实验,因为溶液中有硝酸根离子,可能会影响实验结果的验证,D错误。
8. C 解析:X2和Y2的起始量和转化量之比相等均为1∶3,则反应从开始到平衡过程中始终有c(X2)∶c(Y2)=1∶3,即3c(X2)=c(Y2),所以当3c(X2)=c(Y2)时,反应不一定达到平衡,A错误;由图1可知,t2 min时改变某种条件,重新达到平衡后,X2浓度逐渐增大至不再改变,改变的条件可能是减小Y2浓度或增大XY3浓度或升高温度,若是浓度因素的影响,则平衡常数不变,B错误;投料改为2 mol X2和6 mol Y2,为原投料量的2倍,恒温恒容条件下等同于加压,平衡向正反应方向移动,则XY3的平衡体积分数增大,C正确;催化剂能降低反应的活化能,增大反应速率,但不能使平衡发生移动,不能提高X2的平衡转化率,D错误。
9. C 解析:T1先拐,所以T1>T2,由T2到T1,温度升高,异丁烯的转化率降低,即平衡逆向移动,逆向为吸热反应,则ΔH<0,A正确;其他条件不变,再充入1 mol W,等效于充入1 mol CH3OH和1 mol R,平衡正向移动,此时W的百分含量会相应增大,B正确;温度相同时,M点和B点异丁烯的转化率相同,即异丁烯的浓度相同,有vM正=vB正,但是M点对应的温度T1偏高,所以vM正>vB正,C错误;240~300 min时间内,反应均达平衡状态,正、逆反应速率相等,T1和T2两个温度下平均反应速率相等,D正确。
10. C 解析:初始二氧化碳的物质的量为1 mol,依据碳原子守恒,平衡混合气体中C原子的物质的量是1 mol,A正确;该反应焓变小于0,为放热反应,则反应物的总能量高于生成物的总能量,B正确;平衡混合气体中CH3OH的物质的量分数为25%,设平衡时消耗二氧化碳x mol·L-1,则平衡时二氧化碳的物质的量浓度为(1-x) mol·L-1,氢气的物质的量浓度为(3-3x) mol·L-1,CH3OH的物质的量浓度为x mol·L-1,水蒸气的物质的量浓度为x mol·L-1,=25%,解得x=,则平衡时c(CO2)= mol·L-1,c(H2)=1 mol·L-1,c(CH3OH)=c(H2O)= mol·L-1,化学平衡常数K===,C错误;其他条件相同时,若起始充入2 mol CO2和 6 mol H2,与原来相比,开始反应物浓度是原来的2倍,则压强是原来的2倍,增大压强平衡正向移动,导致二氧化碳和氢气的转化率增大,则平衡时CH3OH的物质的量分数大于25%,D正确。
同课章节目录
