2024北京中关村中学高一(下)期中化学(PDF版含答案)
文档属性
| 名称 | 2024北京中关村中学高一(下)期中化学(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-27 06:53:08 | ||
图片预览



文档简介
北京市中关村中学 2023—2024 学年度第二学期期中
高一化学 2024.4
本试卷共8页,100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将
答题卡交回。
可能用到的相对原子质量: H 1 N 14 O 16 S 32
第一部分
本部分共24题,每题2分,共48分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列材料的主要成分不.属.于.无机非金属材料的是
A.瓷砖 B.玻璃 C.第三代铝锂合金 D.水泥
2.下列关于元素周期表的说法正确的是
A.第 IA族的所有元素都是碱金属元素
B.同周期主族元素中,第ⅦA族元素原子半径最小
C.原子的最外层电子数为 2的元素,一定是第ⅡA族元素
D.元素周期表共有 7个周期,18个族
3.下列反应属于吸热反应的是
A.钠与水的反应 B.乙醇的燃烧
C.碳酸氢钠与柠檬酸的反应 D.氢氧化钾与硫酸的反应
4.化学科学需要借助化学专用语言描述,下列有关化学用语不正确的是
A.O22-的电子式: B.质量数为 14的碳原子: C
C. 用电子式表示氯化钠的形成过程:
D.Cl-的结构示意图:
5. 下列电子式书写正确的是
A. B. C. D.
6.下列有关物质性质的比较,可以用元素周期律加以解释的是( )
A.酸性:H2SO4>H3PO4 B.溶解度(25℃):BaCl2>BaSO4
C.沸点:H2O>NH3 D.热稳定性:Na2CO3>NaHCO3
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 1页(共 8页)
7.下列反应的离子方程式不.正.确.的是
A.小苏打治疗胃酸过多:HCO3-+H+=H2O+CO2↑
B.向苦卤(含 Br-)中通入氯气:2Br-+Cl2=2Cl-+Br2
C.用氢氧化钠溶液吸收 SO2尾气:SO2+ 2OH- = SO32-+ H2O
D.金属钾与水反应: K+ H2O= K++ OH- + H2↑
8.干冰的成分是CO2,广泛用于舞台、剧场、影视等制作云海效果。下列说法错误的是
A.CO2属于酸性氧化物 B. 一个 CO2分子中含有 22个质子
C.12C和 14C互为同素异形体 D.1mol CO2 含有的原子数约为 3×6.02×1023
9. NA为阿伏加德罗常数的值,下列叙述正确的是
A.18g重水(D2O)中含有的质子数为 10NA
B.1mol乙醇(原子连接方式 )中含有的极性键数为 8NA
C.32g环状 S8 ( )分子中含有的 S-S 键数为 1NA
D.0.1mol·L-1的 FeCl3溶液中 Cl-的数目为 0.3NA
10.镓(31Ga)与 K同周期,下列关于 Ga 的说法不.正.确.的是
A.位于元素周期表第ⅢA族 B.原子半径比 K小
C.单质的还原性比 K弱 D.Ga(OH)3的碱性比 Al(OH)3弱
11. 下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是
A.石墨转变为金刚石是吸热反应 B.等质量的 S(g)完全燃烧放出的热量小于 S(s)
C.白磷比红磷稳定 D.CO(g)+H2O(g)===CO2(g)+H2(g)为吸热反应
12.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
物质 A. CaCl2 B. NH3 C. NH4Cl D. KOH
所含化学键类型 离子键、非极性共价键 极性共价键 极性共价键 离子键、极性共价键
所属化合物类型 离子化合物 共价化合物 共价化合物 共价化合物
A. A B. B C. C D. D
13. 某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是
A.a和 b不连接时,铁片上会有金属铜析出
B.a和 b +用导线连接时,铜片上发生的反应为:Cu2 + 2e-= Cu
C.无论 a和 b是否连接,铁片均会溶解,溶液蓝色逐渐变浅
D.将表面附着铜的铁片放入稀硫酸中,不能构成原电池
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 2页(共 8页)
14. 下列图中的实验方案,能达到实验目的的是
方案
A B C D
证明非金属性: 氧化性:
目的 Cl > C > Si
反应开始后,U型管液面左高右低,
证明化学能转化为电能
Cl2>Br2>I2 证明是吸热反应
15. 根据元素周期律,由下列事实进行归纳推测,推测不.合.理.的是
选项 事实 推测
A Na与水剧烈反应,K与水反应更剧烈 Li与水反应比较缓慢
B CaSO4微溶于水,BaSO4难溶于水 SrSO4难溶于水(Sr与 Ca、Ba同主族)
C HCl在 1500℃时分解,HI在 230℃时分解 HBr的分解温度介于二者之间
D Si是半导体材料,同族的 Ge是半导体材料 ⅣA族的 Sn和 Pb是半导体材料
16. 下图为反应 2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.拆开 2molH2 (g)和 1 molO2(g)中的化学键成为 H、O原子,共放出 1368 kJ能量
B.2H2(g)+O2(g)=2H2O(g) ΔH=-1852 kJ·mol-1
C.2 molH2(g)和 1 molO2 (g)反应生成 2 mol H2O(1),放出能量小于 484 kJ
D.2H2(g)+O2(g)=2H2O(g) ΔH=- 484 kJ·mol-1
17.利用固体表面催化工艺进行 NO分解的过程如下图所示。
下列说法不.正.确.的是
A.NO属于共价化合物
B.过程②吸收能量,过程③放出能量
C.反应过程中有极性键断裂,有非极性键形成
D.标准状况下,NO分解生成 22.4 L N2时转移电子数约为 2×6.02×1023
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 3页(共 8页)
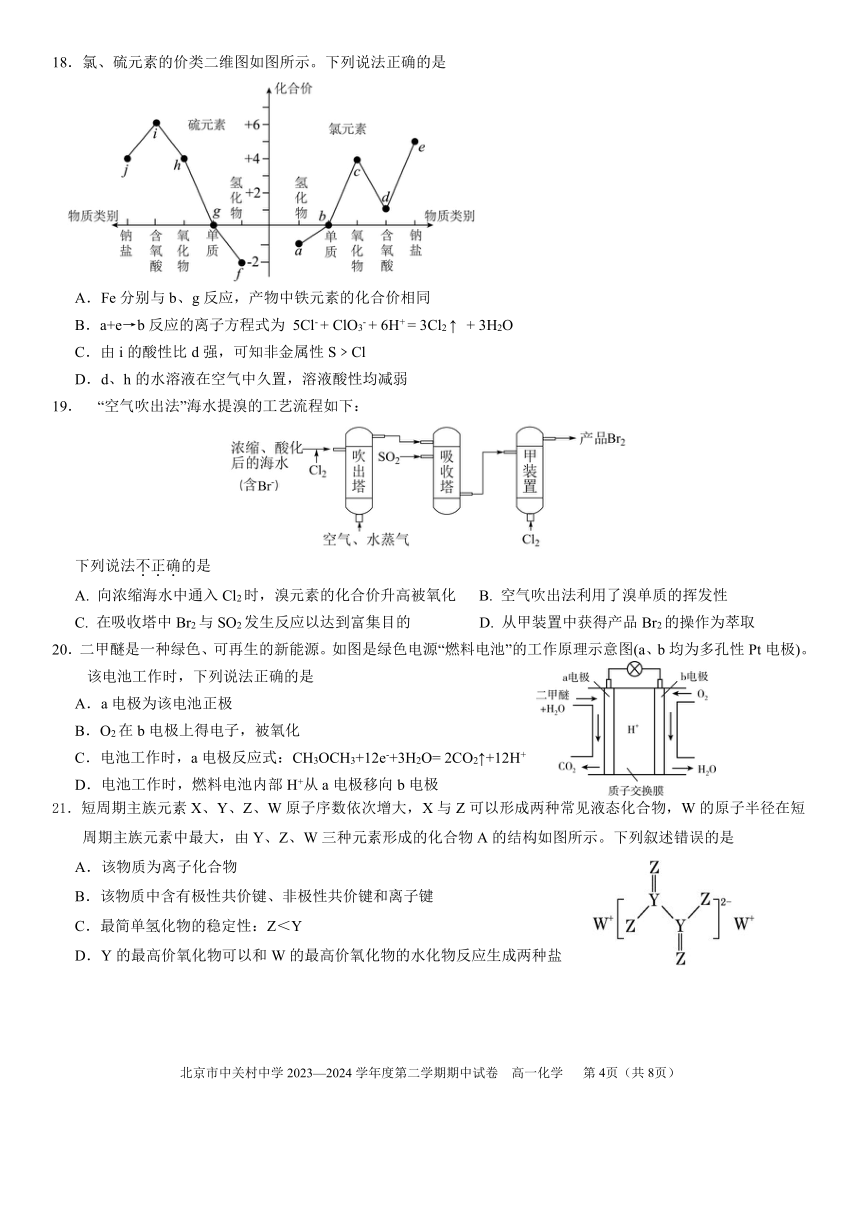
18.氯、硫元素的价类二维图如图所示。下列说法正确的是
A.Fe分别与 b、g反应,产物中铁元素的化合价相同
B.a+e→b反应的离子方程式为 5Cl-+ ClO3-+ 6H+= 3Cl2 ↑ + 3H2O
C.由 i的酸性比 d强,可知非金属性 S﹥Cl
D.d、h的水溶液在空气中久置,溶液酸性均减弱
19. “空气吹出法”海水提溴的工艺流程如下:
下列说法不.正.确.的是
A. 向浓缩海水中通入 Cl2时,溴元素的化合价升高被氧化 B. 空气吹出法利用了溴单质的挥发性
C. 在吸收塔中 Br2与 SO2发生反应以达到富集目的 D. 从甲装置中获得产品 Br2的操作为萃取
20.二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性 Pt电极)。
该电池工作时,下列说法正确的是
A.a电极为该电池正极
B.O2在 b电极上得电子,被氧化
C.电池工作时,a电极反应式:CH3OCH3+12e-+3H2O= 2CO2↑+12H+
D.电池工作时,燃料电池内部 H+从 a电极移向 b电极
21.短周期主族元素 X、Y、Z、W原子序数依次增大,X与 Z可以形成两种常见液态化合物,W的原子半径在短
周期主族元素中最大,由 Y、Z、W三种元素形成的化合物 A的结构如图所示。下列叙述错误的是
A.该物质为离子化合物
B.该物质中含有极性共价键、非极性共价键和离子键
C.最简单氢化物的稳定性:Z<Y
D.Y的最高价氧化物可以和W的最高价氧化物的水化物反应生成两种盐
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 4页(共 8页)
22. 几种短周期元素的原子半径及主要化合价如表:
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、 3 2
下列叙述正确的是( )
A. X、Y分别对应的简单离子半径前者小
B. W的简单氢化物可与其最高价氧化物对应水化物反应生成盐
C.X和 Y对应的最高价氧化物的水化物均能溶于氢氧化钠
D. 一定条件下,W单质可以将 Z单质从其氢化物中置换出来
23. 下列热化学方程式或叙述正确的是
A.1mol液态肼(N2H4 )在足量氧气中完全燃烧生成水蒸气,放出 642kJ热量:
2N2H4(l)+2O2(g)=2N2(g)+4H2O(g) ΔH= -642 kJ·mol-1
B.12g石墨转化为 CO时,放出 110.5kJ热量: 2C(石墨, s) +O2(g)=2CO(g) ΔH= 110.5 kJ·mol-1
C.已知:H2(g)+1/2O2(g)= H2O(l) ΔH= -286 kJ·mol-1 ,则 2H2O(l)=2H2(g)+O2(g) ΔH= +572kJ·mol-1
D. 已知: N2(g) +3H2(g) 2NH3(g) ΔH= -92.4kJ·mol-1,则在一定条件下向密闭容器中充入 0.5mol N2(g)
和 1.5mol H2(g)充分反应放出 46.2kJ的热量
24. 某实验小组探究 KMnO4溶液与 NH3以及铵盐溶液的反应。
已知:MnO4-的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
实验 序号 试剂 a 实验现象
紫色变浅,底部有
Ⅰ 8mol×L-1氨水(pH≈13)
棕黑色沉淀
Ⅱ 0.1mol×L-1 NaOH溶液 (pH =13) 无明显变化
紫色略变浅,底部
Ⅲ 4mol×L-1 (NH4)2SO4溶液(pH≈6)
有少量棕黑色沉淀
4mol×L-1Ⅳ 硫酸酸化的 (NH4)2SO4溶液(pH≈1) 紫色变浅
Ⅴ 硫酸酸化的 4mol×L-1 NH4Cl溶液(pH≈1) 紫色褪去
下列说法不.正.确.的是( )
A.由Ⅱ可知,pH=13时,OH-不能还原MnO4-
B.由Ⅰ、Ⅱ、Ⅲ可知,与 NH4+相比,NH3更易还原MnO4-
C.由Ⅲ、Ⅳ可探究溶液 pH对 NH4+与MnO4-反应的影响
D.由Ⅳ、Ⅴ可知,NH4+浓度降低,其还原性增强
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 5页(共 8页)
第二部分 非选择题(共 52分)
25.(14分)A、B、C、D、E为常见的主族元素,根据下表信息回答问题。
元素 元素性质/原子结构信息
A 短周期元素原子半径最大(稀有气体不参与比较)
B +3价阳离子的核外电子排布与氖原子相同
C 原子核外M电子层与 K电子层的电子数相等
D 与 A同周期,化合价有-1、+7等
E
原子结构示意图:
(1)写出元素 A的原子结构示意图
(2)A、B最高价氧化物对应水化物的碱性强弱: > (填化学式),从原子结构角度解释原因_____。
(3)写出 A、B最高价氧化物对应水化物二者反应的离子方程式
(4)用电子式表示 C和 D形成化合物的过程:
(5)元素 E在周期表中的位置 ,关于元素 E及其化合物的推断中,正确的是 。
a.E与 D的最低负化合价相同 b.E的单质可与 A和 D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和 E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号) ,原因是
(7)元素M与 A同主族,比 A多 2个电子层,M与氧以 2:1比例形成的化合物②的物质类别为 ,任意写
出一个能体现②的类别通性的反应方程式 。
(8)第四周期 VIA族的元素硒(Se)是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序
号) 。
a.硒原子的半径比硫原子的大 b. H2Se 的稳定性比 HCl的强
c. SeO2能与 NaOH溶液反应 d. Na2SeO4可以使酸性高锰酸钾溶液褪色
26.(9分)化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应。
a.镁与盐酸反应 b.氢氧化钠与盐酸反应 c.盐酸与碳酸氢钠反应
d.Ba(OH)2·8H2O晶体与 NH4Cl晶体反应
(1)以上化学反应中能用图 1表示其能量变化的是_____ (填字母),此类反应中有能量变化的原因
是:断开反应物的化学键吸收的总能量_____(填“>”或“<”)形成生成物的化学键释放的总能量。
(2)从以上反应中选择一个反应设计原电池。
①将图 2原电池装置补充完整。
②证实化学能转化为电能的实验现象是__________。
③正极的电极反应式是__________。
④烧杯中溶液的作用是__________。
a.电极材料 b.电极反应物 c.电子导体 d.离子导体
⑤从化学的角度分析,原电池产生电流的原因是__________。
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 6页(共 8页)
27. (10分)高一年级小村同学最近通过学习了解到:“肼”(N2H4)是一种重要的化学物质,可用作喷气式发动
机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1)N2H4属于_____化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_____(填“离子键”
或“极性键”或“非极性键”)
(2)已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态 N2O4作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式____。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式_______,理论上每
消耗 64 g肼可除去标准状况下 O2________L
(4)科学家用肼作为燃料电池的燃料,电池结构如上图所示,写出负极的电极反应式_______。
28.(9分)X、Y、Z、M、Q、R皆为周期表中前 20号元素,其原子半径与主要化合价的关系如图所示。
(1)已知 X位于第一周期,则 X2Y2电子式为 。
(2)比较 Y和 Z的简单氢化物,更稳定的是 (填化学式)。
(3)已知 Q位于第三周期,则 R在元素周期表中的位置是 。
(4)下列推断正确的是 (填“序号”)。
a. 简单离子半径:M > Q+ >R2+
b. 由 X、Y、Z三种元素组成的化合物可能是盐或碱
c. Z与M的最高价氧化物对应水化物均为强酸
(5)M 的单质通入淀粉-KI 溶液,溶液变蓝,写出该反应的离子方程
式 ;比较 I- 和M的阴离子,还原性更强的是 (填离子符号),从原子结构的角度解释原因 。
29. (10分)某小组同学探究 SO2与新制 Cu(OH)2悬浊液的反应。
资料:i.Cu2O为砖红色固体,难溶于水,会在酸性溶液中溶解而转化为 Cu和 Cu2+
ii.CuCl为白色固体,难溶于水,能溶于浓盐酸;能与氨水反应生成[Cu(NH3)2]+,在空气中会立即被氧
化成[Cu(NH3)4]2+,而使溶液显蓝色。
实验装置如图(夹持装置略)
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 7页(共 8页)
序 C 中实验现象
号 物质 a 通入 SO2前 通入 SO2后
I 产生蓝色絮状沉淀 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静
mol L-11 CuSO4溶液
置,试管底部有少量紫红色固体,溶液呈绿色
II 产生蓝色絮状沉淀 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,
1mol L-1 CuCl2溶液
生成大量白色沉淀,溶液呈绿色
(1)B中试剂是 。
(2)通入 SO2前,实验 I、II中产生蓝色絮状沉淀的离子方程式为 。
(3)①实验 I通入 SO2后产生砖红色沉淀,补全该反应的化学方程式。
+ + NaOH==== + Cu2O↓+ H2O
②分析实验 I一段时间后砖红色沉淀消失的可能原因 。
(4)同学们对实验 II中白色沉淀的成分继续探究。
①甲同学取少量白色沉淀,洗净后加入氨水,得到蓝色溶液,此过程中反应的
离子方程式为:CuCl + 2NH3·H2O === [Cu(NH3)2]++Cl- + 2H2O 、 。
②乙同学用另一种方法证明了该白色沉淀为 CuCl,实验方案如下:
填写下表空格:
试剂 1 试剂 2 蒸馏水
现象 1 现象 2
(5)实验 I 和实验 II 中 SO2与新制 Cu(OH)2悬浊液均发生了_________反应(填反应类型),反应现象的不同与
__________________有关。
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 8页(共 8页)
北京市中关村中学高一年级第二学期期中考试
化学试卷参考答案及评分参考 2024.4
第一部分 选择题(48 分)
1 2 3 4 5 6 7 8 9 10 11 12
C B C D B A D C C D A B
13 14 15 16 17 18 19 20 21 22 23 24
D C D D D B D D C D C D
第二部分 非选择题(52分)
若无特别说明,每空 1 分。
25.(14 分)
(1)
(2)NaOH>Al(OH)3 ;
钠和铝电子层数相同,核电荷数 Na<Al,原子半径 Na>Al,金属性 Na>Al (2 分)
(3)OH-+Al(OH)3 =Al(OH) -4
(4) (2 分)
(5) 第四周期第 VIIA 族; ad
(6)Br; 非金属性 Cl>Br,Cl 化合价为-1,Br 化合价为+1,Br 还有 0 价、-1 价,可降价
体现氧化性
(7)碱性氧化物; Rb2O+H2O=2RbOH(合理即可)
(8)ac
26. (9 分)
(1)① cd ② > (2)① ②电流计指针偏转,石墨棒上有气泡冒出 (2 分)
-
③ 2H+ + 2e === H2↑
④ bd
⑤ 原电池将氧化反应和还原反应分别在两个不同的区域进行,并通过能导电的物质形
成闭合回路,产生电流。(2 分)
27.(10 分)
(1) 共价;极性键、非极性键(2 分)
-
(2) 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=(2c-a-2b)kJ·mol 1 (2 分)
-
(3) N H (g)+O (g)=N (g)+2H O(g) ΔH=(c- b)kJ·mol 12 4 2 2 2 (2 分); 44.8L
(4) N2H4-4e
-+4OH- = N2+4H2O(2 分)
28.(9 分)
(1)
(2)H2O
(3)第四周期第 IIA 族
(4)bc
- - -
(5)Cl2 + 2I = 2Cl + I2 (2 分) ; I ; Cl、I 为同主族元素,电子层数 I>Cl,离子
- - - - - -
半径 I >Cl ,失电子能力 I >Cl ,还原性 I >Cl 。(2 分)
29.(10 分)
(1)饱和 NaHSO3 溶液
2+ -(2)Cu + 2OH = Cu(OH)2↓
(3)① (2 分)
②溶液中溶解的 SO2 增多,溶液的酸性增强,使 Cu2O 溶解。
-
(4)① 4[Cu(NH3)2]+ + 8NH3·H2O+ O2 = 4[Cu(NH 2+3)4] + 4OH + 6H2O
②(2 分)
试剂 1 浓盐酸
现象 1 白色沉淀溶解 现象 2 出现白色沉淀
(5)氧化还原 与配制 Cu(OH)2 所用铜盐的阴离子种类
高一化学 2024.4
本试卷共8页,100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将
答题卡交回。
可能用到的相对原子质量: H 1 N 14 O 16 S 32
第一部分
本部分共24题,每题2分,共48分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列材料的主要成分不.属.于.无机非金属材料的是
A.瓷砖 B.玻璃 C.第三代铝锂合金 D.水泥
2.下列关于元素周期表的说法正确的是
A.第 IA族的所有元素都是碱金属元素
B.同周期主族元素中,第ⅦA族元素原子半径最小
C.原子的最外层电子数为 2的元素,一定是第ⅡA族元素
D.元素周期表共有 7个周期,18个族
3.下列反应属于吸热反应的是
A.钠与水的反应 B.乙醇的燃烧
C.碳酸氢钠与柠檬酸的反应 D.氢氧化钾与硫酸的反应
4.化学科学需要借助化学专用语言描述,下列有关化学用语不正确的是
A.O22-的电子式: B.质量数为 14的碳原子: C
C. 用电子式表示氯化钠的形成过程:
D.Cl-的结构示意图:
5. 下列电子式书写正确的是
A. B. C. D.
6.下列有关物质性质的比较,可以用元素周期律加以解释的是( )
A.酸性:H2SO4>H3PO4 B.溶解度(25℃):BaCl2>BaSO4
C.沸点:H2O>NH3 D.热稳定性:Na2CO3>NaHCO3
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 1页(共 8页)
7.下列反应的离子方程式不.正.确.的是
A.小苏打治疗胃酸过多:HCO3-+H+=H2O+CO2↑
B.向苦卤(含 Br-)中通入氯气:2Br-+Cl2=2Cl-+Br2
C.用氢氧化钠溶液吸收 SO2尾气:SO2+ 2OH- = SO32-+ H2O
D.金属钾与水反应: K+ H2O= K++ OH- + H2↑
8.干冰的成分是CO2,广泛用于舞台、剧场、影视等制作云海效果。下列说法错误的是
A.CO2属于酸性氧化物 B. 一个 CO2分子中含有 22个质子
C.12C和 14C互为同素异形体 D.1mol CO2 含有的原子数约为 3×6.02×1023
9. NA为阿伏加德罗常数的值,下列叙述正确的是
A.18g重水(D2O)中含有的质子数为 10NA
B.1mol乙醇(原子连接方式 )中含有的极性键数为 8NA
C.32g环状 S8 ( )分子中含有的 S-S 键数为 1NA
D.0.1mol·L-1的 FeCl3溶液中 Cl-的数目为 0.3NA
10.镓(31Ga)与 K同周期,下列关于 Ga 的说法不.正.确.的是
A.位于元素周期表第ⅢA族 B.原子半径比 K小
C.单质的还原性比 K弱 D.Ga(OH)3的碱性比 Al(OH)3弱
11. 下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是
A.石墨转变为金刚石是吸热反应 B.等质量的 S(g)完全燃烧放出的热量小于 S(s)
C.白磷比红磷稳定 D.CO(g)+H2O(g)===CO2(g)+H2(g)为吸热反应
12.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
物质 A. CaCl2 B. NH3 C. NH4Cl D. KOH
所含化学键类型 离子键、非极性共价键 极性共价键 极性共价键 离子键、极性共价键
所属化合物类型 离子化合物 共价化合物 共价化合物 共价化合物
A. A B. B C. C D. D
13. 某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是
A.a和 b不连接时,铁片上会有金属铜析出
B.a和 b +用导线连接时,铜片上发生的反应为:Cu2 + 2e-= Cu
C.无论 a和 b是否连接,铁片均会溶解,溶液蓝色逐渐变浅
D.将表面附着铜的铁片放入稀硫酸中,不能构成原电池
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 2页(共 8页)
14. 下列图中的实验方案,能达到实验目的的是
方案
A B C D
证明非金属性: 氧化性:
目的 Cl > C > Si
反应开始后,U型管液面左高右低,
证明化学能转化为电能
Cl2>Br2>I2 证明是吸热反应
15. 根据元素周期律,由下列事实进行归纳推测,推测不.合.理.的是
选项 事实 推测
A Na与水剧烈反应,K与水反应更剧烈 Li与水反应比较缓慢
B CaSO4微溶于水,BaSO4难溶于水 SrSO4难溶于水(Sr与 Ca、Ba同主族)
C HCl在 1500℃时分解,HI在 230℃时分解 HBr的分解温度介于二者之间
D Si是半导体材料,同族的 Ge是半导体材料 ⅣA族的 Sn和 Pb是半导体材料
16. 下图为反应 2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.拆开 2molH2 (g)和 1 molO2(g)中的化学键成为 H、O原子,共放出 1368 kJ能量
B.2H2(g)+O2(g)=2H2O(g) ΔH=-1852 kJ·mol-1
C.2 molH2(g)和 1 molO2 (g)反应生成 2 mol H2O(1),放出能量小于 484 kJ
D.2H2(g)+O2(g)=2H2O(g) ΔH=- 484 kJ·mol-1
17.利用固体表面催化工艺进行 NO分解的过程如下图所示。
下列说法不.正.确.的是
A.NO属于共价化合物
B.过程②吸收能量,过程③放出能量
C.反应过程中有极性键断裂,有非极性键形成
D.标准状况下,NO分解生成 22.4 L N2时转移电子数约为 2×6.02×1023
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 3页(共 8页)
18.氯、硫元素的价类二维图如图所示。下列说法正确的是
A.Fe分别与 b、g反应,产物中铁元素的化合价相同
B.a+e→b反应的离子方程式为 5Cl-+ ClO3-+ 6H+= 3Cl2 ↑ + 3H2O
C.由 i的酸性比 d强,可知非金属性 S﹥Cl
D.d、h的水溶液在空气中久置,溶液酸性均减弱
19. “空气吹出法”海水提溴的工艺流程如下:
下列说法不.正.确.的是
A. 向浓缩海水中通入 Cl2时,溴元素的化合价升高被氧化 B. 空气吹出法利用了溴单质的挥发性
C. 在吸收塔中 Br2与 SO2发生反应以达到富集目的 D. 从甲装置中获得产品 Br2的操作为萃取
20.二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性 Pt电极)。
该电池工作时,下列说法正确的是
A.a电极为该电池正极
B.O2在 b电极上得电子,被氧化
C.电池工作时,a电极反应式:CH3OCH3+12e-+3H2O= 2CO2↑+12H+
D.电池工作时,燃料电池内部 H+从 a电极移向 b电极
21.短周期主族元素 X、Y、Z、W原子序数依次增大,X与 Z可以形成两种常见液态化合物,W的原子半径在短
周期主族元素中最大,由 Y、Z、W三种元素形成的化合物 A的结构如图所示。下列叙述错误的是
A.该物质为离子化合物
B.该物质中含有极性共价键、非极性共价键和离子键
C.最简单氢化物的稳定性:Z<Y
D.Y的最高价氧化物可以和W的最高价氧化物的水化物反应生成两种盐
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 4页(共 8页)
22. 几种短周期元素的原子半径及主要化合价如表:
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、 3 2
下列叙述正确的是( )
A. X、Y分别对应的简单离子半径前者小
B. W的简单氢化物可与其最高价氧化物对应水化物反应生成盐
C.X和 Y对应的最高价氧化物的水化物均能溶于氢氧化钠
D. 一定条件下,W单质可以将 Z单质从其氢化物中置换出来
23. 下列热化学方程式或叙述正确的是
A.1mol液态肼(N2H4 )在足量氧气中完全燃烧生成水蒸气,放出 642kJ热量:
2N2H4(l)+2O2(g)=2N2(g)+4H2O(g) ΔH= -642 kJ·mol-1
B.12g石墨转化为 CO时,放出 110.5kJ热量: 2C(石墨, s) +O2(g)=2CO(g) ΔH= 110.5 kJ·mol-1
C.已知:H2(g)+1/2O2(g)= H2O(l) ΔH= -286 kJ·mol-1 ,则 2H2O(l)=2H2(g)+O2(g) ΔH= +572kJ·mol-1
D. 已知: N2(g) +3H2(g) 2NH3(g) ΔH= -92.4kJ·mol-1,则在一定条件下向密闭容器中充入 0.5mol N2(g)
和 1.5mol H2(g)充分反应放出 46.2kJ的热量
24. 某实验小组探究 KMnO4溶液与 NH3以及铵盐溶液的反应。
已知:MnO4-的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
实验 序号 试剂 a 实验现象
紫色变浅,底部有
Ⅰ 8mol×L-1氨水(pH≈13)
棕黑色沉淀
Ⅱ 0.1mol×L-1 NaOH溶液 (pH =13) 无明显变化
紫色略变浅,底部
Ⅲ 4mol×L-1 (NH4)2SO4溶液(pH≈6)
有少量棕黑色沉淀
4mol×L-1Ⅳ 硫酸酸化的 (NH4)2SO4溶液(pH≈1) 紫色变浅
Ⅴ 硫酸酸化的 4mol×L-1 NH4Cl溶液(pH≈1) 紫色褪去
下列说法不.正.确.的是( )
A.由Ⅱ可知,pH=13时,OH-不能还原MnO4-
B.由Ⅰ、Ⅱ、Ⅲ可知,与 NH4+相比,NH3更易还原MnO4-
C.由Ⅲ、Ⅳ可探究溶液 pH对 NH4+与MnO4-反应的影响
D.由Ⅳ、Ⅴ可知,NH4+浓度降低,其还原性增强
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 5页(共 8页)
第二部分 非选择题(共 52分)
25.(14分)A、B、C、D、E为常见的主族元素,根据下表信息回答问题。
元素 元素性质/原子结构信息
A 短周期元素原子半径最大(稀有气体不参与比较)
B +3价阳离子的核外电子排布与氖原子相同
C 原子核外M电子层与 K电子层的电子数相等
D 与 A同周期,化合价有-1、+7等
E
原子结构示意图:
(1)写出元素 A的原子结构示意图
(2)A、B最高价氧化物对应水化物的碱性强弱: > (填化学式),从原子结构角度解释原因_____。
(3)写出 A、B最高价氧化物对应水化物二者反应的离子方程式
(4)用电子式表示 C和 D形成化合物的过程:
(5)元素 E在周期表中的位置 ,关于元素 E及其化合物的推断中,正确的是 。
a.E与 D的最低负化合价相同 b.E的单质可与 A和 D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和 E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号) ,原因是
(7)元素M与 A同主族,比 A多 2个电子层,M与氧以 2:1比例形成的化合物②的物质类别为 ,任意写
出一个能体现②的类别通性的反应方程式 。
(8)第四周期 VIA族的元素硒(Se)是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序
号) 。
a.硒原子的半径比硫原子的大 b. H2Se 的稳定性比 HCl的强
c. SeO2能与 NaOH溶液反应 d. Na2SeO4可以使酸性高锰酸钾溶液褪色
26.(9分)化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应。
a.镁与盐酸反应 b.氢氧化钠与盐酸反应 c.盐酸与碳酸氢钠反应
d.Ba(OH)2·8H2O晶体与 NH4Cl晶体反应
(1)以上化学反应中能用图 1表示其能量变化的是_____ (填字母),此类反应中有能量变化的原因
是:断开反应物的化学键吸收的总能量_____(填“>”或“<”)形成生成物的化学键释放的总能量。
(2)从以上反应中选择一个反应设计原电池。
①将图 2原电池装置补充完整。
②证实化学能转化为电能的实验现象是__________。
③正极的电极反应式是__________。
④烧杯中溶液的作用是__________。
a.电极材料 b.电极反应物 c.电子导体 d.离子导体
⑤从化学的角度分析,原电池产生电流的原因是__________。
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 6页(共 8页)
27. (10分)高一年级小村同学最近通过学习了解到:“肼”(N2H4)是一种重要的化学物质,可用作喷气式发动
机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1)N2H4属于_____化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_____(填“离子键”
或“极性键”或“非极性键”)
(2)已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态 N2O4作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式____。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式_______,理论上每
消耗 64 g肼可除去标准状况下 O2________L
(4)科学家用肼作为燃料电池的燃料,电池结构如上图所示,写出负极的电极反应式_______。
28.(9分)X、Y、Z、M、Q、R皆为周期表中前 20号元素,其原子半径与主要化合价的关系如图所示。
(1)已知 X位于第一周期,则 X2Y2电子式为 。
(2)比较 Y和 Z的简单氢化物,更稳定的是 (填化学式)。
(3)已知 Q位于第三周期,则 R在元素周期表中的位置是 。
(4)下列推断正确的是 (填“序号”)。
a. 简单离子半径:M > Q+ >R2+
b. 由 X、Y、Z三种元素组成的化合物可能是盐或碱
c. Z与M的最高价氧化物对应水化物均为强酸
(5)M 的单质通入淀粉-KI 溶液,溶液变蓝,写出该反应的离子方程
式 ;比较 I- 和M的阴离子,还原性更强的是 (填离子符号),从原子结构的角度解释原因 。
29. (10分)某小组同学探究 SO2与新制 Cu(OH)2悬浊液的反应。
资料:i.Cu2O为砖红色固体,难溶于水,会在酸性溶液中溶解而转化为 Cu和 Cu2+
ii.CuCl为白色固体,难溶于水,能溶于浓盐酸;能与氨水反应生成[Cu(NH3)2]+,在空气中会立即被氧
化成[Cu(NH3)4]2+,而使溶液显蓝色。
实验装置如图(夹持装置略)
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 7页(共 8页)
序 C 中实验现象
号 物质 a 通入 SO2前 通入 SO2后
I 产生蓝色絮状沉淀 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静
mol L-11 CuSO4溶液
置,试管底部有少量紫红色固体,溶液呈绿色
II 产生蓝色絮状沉淀 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,
1mol L-1 CuCl2溶液
生成大量白色沉淀,溶液呈绿色
(1)B中试剂是 。
(2)通入 SO2前,实验 I、II中产生蓝色絮状沉淀的离子方程式为 。
(3)①实验 I通入 SO2后产生砖红色沉淀,补全该反应的化学方程式。
+ + NaOH==== + Cu2O↓+ H2O
②分析实验 I一段时间后砖红色沉淀消失的可能原因 。
(4)同学们对实验 II中白色沉淀的成分继续探究。
①甲同学取少量白色沉淀,洗净后加入氨水,得到蓝色溶液,此过程中反应的
离子方程式为:CuCl + 2NH3·H2O === [Cu(NH3)2]++Cl- + 2H2O 、 。
②乙同学用另一种方法证明了该白色沉淀为 CuCl,实验方案如下:
填写下表空格:
试剂 1 试剂 2 蒸馏水
现象 1 现象 2
(5)实验 I 和实验 II 中 SO2与新制 Cu(OH)2悬浊液均发生了_________反应(填反应类型),反应现象的不同与
__________________有关。
北京市中关村中学 2023—2024学年度第二学期期中试卷 高一化学 第 8页(共 8页)
北京市中关村中学高一年级第二学期期中考试
化学试卷参考答案及评分参考 2024.4
第一部分 选择题(48 分)
1 2 3 4 5 6 7 8 9 10 11 12
C B C D B A D C C D A B
13 14 15 16 17 18 19 20 21 22 23 24
D C D D D B D D C D C D
第二部分 非选择题(52分)
若无特别说明,每空 1 分。
25.(14 分)
(1)
(2)NaOH>Al(OH)3 ;
钠和铝电子层数相同,核电荷数 Na<Al,原子半径 Na>Al,金属性 Na>Al (2 分)
(3)OH-+Al(OH)3 =Al(OH) -4
(4) (2 分)
(5) 第四周期第 VIIA 族; ad
(6)Br; 非金属性 Cl>Br,Cl 化合价为-1,Br 化合价为+1,Br 还有 0 价、-1 价,可降价
体现氧化性
(7)碱性氧化物; Rb2O+H2O=2RbOH(合理即可)
(8)ac
26. (9 分)
(1)① cd ② > (2)① ②电流计指针偏转,石墨棒上有气泡冒出 (2 分)
-
③ 2H+ + 2e === H2↑
④ bd
⑤ 原电池将氧化反应和还原反应分别在两个不同的区域进行,并通过能导电的物质形
成闭合回路,产生电流。(2 分)
27.(10 分)
(1) 共价;极性键、非极性键(2 分)
-
(2) 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=(2c-a-2b)kJ·mol 1 (2 分)
-
(3) N H (g)+O (g)=N (g)+2H O(g) ΔH=(c- b)kJ·mol 12 4 2 2 2 (2 分); 44.8L
(4) N2H4-4e
-+4OH- = N2+4H2O(2 分)
28.(9 分)
(1)
(2)H2O
(3)第四周期第 IIA 族
(4)bc
- - -
(5)Cl2 + 2I = 2Cl + I2 (2 分) ; I ; Cl、I 为同主族元素,电子层数 I>Cl,离子
- - - - - -
半径 I >Cl ,失电子能力 I >Cl ,还原性 I >Cl 。(2 分)
29.(10 分)
(1)饱和 NaHSO3 溶液
2+ -(2)Cu + 2OH = Cu(OH)2↓
(3)① (2 分)
②溶液中溶解的 SO2 增多,溶液的酸性增强,使 Cu2O 溶解。
-
(4)① 4[Cu(NH3)2]+ + 8NH3·H2O+ O2 = 4[Cu(NH 2+3)4] + 4OH + 6H2O
②(2 分)
试剂 1 浓盐酸
现象 1 白色沉淀溶解 现象 2 出现白色沉淀
(5)氧化还原 与配制 Cu(OH)2 所用铜盐的阴离子种类
同课章节目录
