2.1.1 第一节 烷烃 第1课时 (共24张PPT)人教版(2019)选择性必修3
文档属性
| 名称 | 2.1.1 第一节 烷烃 第1课时 (共24张PPT)人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 28.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-27 00:00:00 | ||
图片预览





文档简介
(共24张PPT)
第二章
第一节 烷烃
0
回顾旧知:
烃
仅含碳和氢两种元素的有机化合物称为碳氢化合物,又称烃
碳
氢
烃
烃,读音ting,碳的声母和氢的韵母的组合。
回顾旧知:
烃
根据结构的不同
烷烃
烯烃
炔烃
芳香烃
......
脂肪烃
脂肪
提取
新课导入:
烷烃是一种饱和链烃,属于脂肪烃,烷烃广泛存在于自然界中。
苹果表面的蜡状物质中有二十七烷(C27H56)
圆白菜叶子表层中有二十九烷(C29H60)
蚂蚁分泌的信息素中有十一烷(C11H24)和十三烷(C13H28)
新课导入:
烷烃是一种饱和链烃,属于脂肪烃,生活中常见的烷烃
天然气
液化石油气
汽油、柴油
凡士林
石蜡
思考:烷烃的结构和性质?
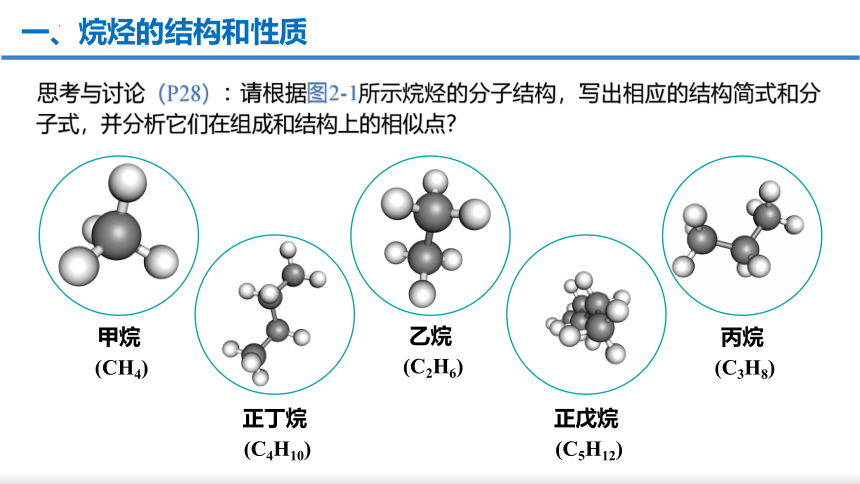
甲烷
(CH4)
乙烷
(C2H6)
丙烷
(C3H8)
正丁烷
(C4H10)
正戊烷
(C5H12)
一、烷烃的结构和性质
请根据图2-1所示烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点?
思考与讨论(P28):
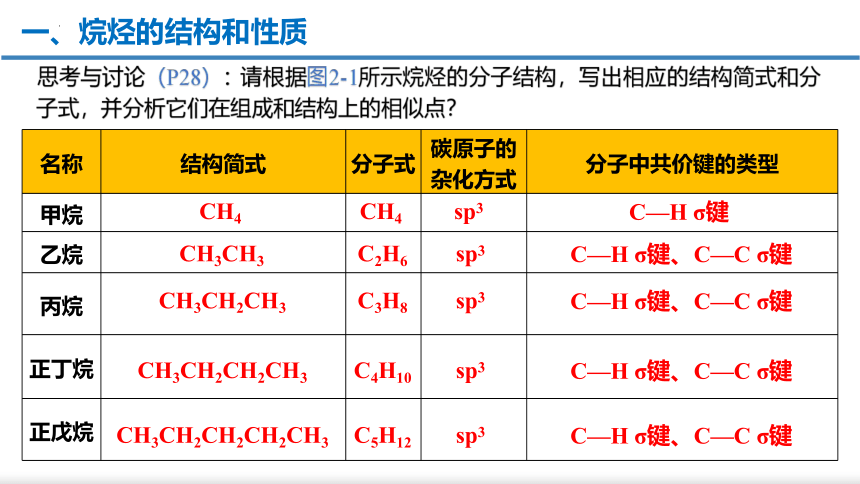
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH4
sp3
C—H σ键
CH3CH3
C2H6
sp3
C—H σ键、C—C σ键
CH3CH2CH3
C3H8
sp3
C—H σ键、C—C σ键
CH3CH2CH2CH3
C4H10
sp3
C—H σ键、C—C σ键
CH3CH2CH2CH2CH3
C5H12
sp3
C—H σ键、C—C σ键
一、烷烃的结构和性质
请根据图2-1所示烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点?
思考与讨论(P28):
1.烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键
3.烷烃分子中的共价键全部是单键,既有极性键(C-H),又有非极性键(C一C,甲烷除外)
2.烷烃的所有原子不可能共平面,分子中的碳原子并非直线状排列,而是锯齿状
4.它们在分子组成上的主要差别是相差一个或若干个CH2原子团。像这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物称为同系物。同系物可用通式表示。
5.链状烷烃的通式:______________
CnH2n+2(n≥1)
一、烷烃的结构和性质
烷烃组成和结构小结:
其共价键的数目为:______________
3n+1(n≥1)
同系物判断的三个关键点
同
两种物质属于同一类物质,官能团的种类和数目一样。
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
似
感受﹒ 理解
差
物理性质 变化规律
状态 烷烃常温下存在的状态由气态逐渐过渡到液态、固态。当碳原子数小于或等于4时,烷烃在常温下呈气态
溶解性 都难溶于极性溶剂如水,易溶于非极性溶剂如有机溶剂
熔、沸点 随碳原子数的增加,分子间作用力增大,熔、沸点逐渐升高,同种烷烃的不同异构体中,支链越多,熔、沸点越低
密度 随碳原子数的增加,密度逐渐增大,但均比水的小
阅读教材P30表2-1并结合你已学知识内容,归纳总结烷烃的物理性质
一、烷烃的结构和性质
甲烷的化学性质
01
02
03
难氧化
能燃烧、不能被酸性高锰酸钾溶液氧化
易取代
在光照条件下与氯气发生取代反应
难分解
高温条件下能分解生成炭黑和氢气
知识回顾
(1) 根据甲烷的性质推测烷烃可能具有的性质,填写下表
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶
不反应
易燃
不反应
不反应
取代反应
思考与讨论P29
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型
预测
感受﹒ 理解
C—C C—H
键能/(kJ·mol-1) 347.7 413.4
H C F
电负性 2.1 2.5 4.0
电负性相差越小,形成的共价键的极性越小,化学反应中越难断裂。
常温下,烷烃的化学性质较稳定
键能越大,化学键越牢固,化学反应中越难断裂。
感受﹒ 理解
结论:
用作溶剂、润滑油
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)完全燃烧的化学方程式。
2C8H18+25O2 16CO2+18H2O
点燃
思考与讨论P29
打火机使用的气体主要是可燃性气体
今多用丁烷、丙烷类和液化石油气
气体经加压后充入贮气箱,一旦释放到空气中便吸热气化而迅速膨胀,极易点燃
早期多用汽油
生活中的化学
(3)根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
烷烃
卤代烃
+
+
C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键
思考与讨论P29
取代反应:
替代法
一取代
二取代
三取代
四取代
五取代
六取代
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
思考与讨论P29
一氯乙烷的制备探究
方法一更好:原子利用率高,产物纯净。
方法一:CH2=CH2+HCl → CH3CH2Cl
方法二:CH3CH3+Cl2 → CH3CH2Cl+HCl
思考与讨论
烷烃与卤素的取代反应是连续反应,产物较为复杂,不适合制备物质
注意:
孙先辉
带温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
1.稳定性
2.氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
3.取代反应——特征反应
特点:纯的卤素单质 光照 连续反应
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
4.分解反应
裂化反应
得到液态烃
裂解反应
裂化汽油
裂解气
C20H42 C10H22+C10H20
C16H34 C8H16+C8H18
一、烷烃的结构和性质
烷烃的化学性质:
还可能生成碳单质和氢气
CnH2n+2 +X2
CnH2n+1X+HX
光照
点燃
01难氧化
具有可燃性
02易取代
光照下与卤素单质发生取代反应
03难分解
一定条件下发生裂化和裂解
化学性质
归纳整理
一、烷烃的结构和性质
1.进行一氯取代反应后,能生成三种沸点不同的产物的烷烃是
A.CH3CH2CH3
B.(CH3)2CHCH3
C.(CH3)3CCH2CH3
D.(CH3)4C
课堂小结
C
2.某烃X是CH4的同系物,分子中碳与氢的质量比为36:7,化学性质与甲烷相似。现取两支试管,分别加入适量溴水,实验操作及现象如下:
有关X的说法正确的是
A.相同条件下,X的密度比水大
B.X分子中的共价键类型仅有极性键
C.X能与Br2发生加成反应使溴水褪色
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
D
课堂小结
3.甲烷是最简单的烷烃,关于甲烷的结构与性质描述不正确的是
A.通常情况下,甲烷跟强酸、强碱不反应
B.甲烷可以使酸性高酸钾溶液褪色
C.甲烷分子空间构型为正四面体的证据是二氯甲烷只有一种
D.甲烷与Cl2反应的四种有机取代产物都难溶于水
课堂小结
B
第二章
第一节 烷烃
0
回顾旧知:
烃
仅含碳和氢两种元素的有机化合物称为碳氢化合物,又称烃
碳
氢
烃
烃,读音ting,碳的声母和氢的韵母的组合。
回顾旧知:
烃
根据结构的不同
烷烃
烯烃
炔烃
芳香烃
......
脂肪烃
脂肪
提取
新课导入:
烷烃是一种饱和链烃,属于脂肪烃,烷烃广泛存在于自然界中。
苹果表面的蜡状物质中有二十七烷(C27H56)
圆白菜叶子表层中有二十九烷(C29H60)
蚂蚁分泌的信息素中有十一烷(C11H24)和十三烷(C13H28)
新课导入:
烷烃是一种饱和链烃,属于脂肪烃,生活中常见的烷烃
天然气
液化石油气
汽油、柴油
凡士林
石蜡
思考:烷烃的结构和性质?
甲烷
(CH4)
乙烷
(C2H6)
丙烷
(C3H8)
正丁烷
(C4H10)
正戊烷
(C5H12)
一、烷烃的结构和性质
请根据图2-1所示烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点?
思考与讨论(P28):
名称 结构简式 分子式 碳原子的杂化方式 分子中共价键的类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH4
sp3
C—H σ键
CH3CH3
C2H6
sp3
C—H σ键、C—C σ键
CH3CH2CH3
C3H8
sp3
C—H σ键、C—C σ键
CH3CH2CH2CH3
C4H10
sp3
C—H σ键、C—C σ键
CH3CH2CH2CH2CH3
C5H12
sp3
C—H σ键、C—C σ键
一、烷烃的结构和性质
请根据图2-1所示烷烃的分子结构,写出相应的结构简式和分子式,并分析它们在组成和结构上的相似点?
思考与讨论(P28):
1.烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键
3.烷烃分子中的共价键全部是单键,既有极性键(C-H),又有非极性键(C一C,甲烷除外)
2.烷烃的所有原子不可能共平面,分子中的碳原子并非直线状排列,而是锯齿状
4.它们在分子组成上的主要差别是相差一个或若干个CH2原子团。像这些结构相似、分子组成上相差一个或若干个CH2原子团的化合物称为同系物。同系物可用通式表示。
5.链状烷烃的通式:______________
CnH2n+2(n≥1)
一、烷烃的结构和性质
烷烃组成和结构小结:
其共价键的数目为:______________
3n+1(n≥1)
同系物判断的三个关键点
同
两种物质属于同一类物质,官能团的种类和数目一样。
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
似
感受﹒ 理解
差
物理性质 变化规律
状态 烷烃常温下存在的状态由气态逐渐过渡到液态、固态。当碳原子数小于或等于4时,烷烃在常温下呈气态
溶解性 都难溶于极性溶剂如水,易溶于非极性溶剂如有机溶剂
熔、沸点 随碳原子数的增加,分子间作用力增大,熔、沸点逐渐升高,同种烷烃的不同异构体中,支链越多,熔、沸点越低
密度 随碳原子数的增加,密度逐渐增大,但均比水的小
阅读教材P30表2-1并结合你已学知识内容,归纳总结烷烃的物理性质
一、烷烃的结构和性质
甲烷的化学性质
01
02
03
难氧化
能燃烧、不能被酸性高锰酸钾溶液氧化
易取代
在光照条件下与氯气发生取代反应
难分解
高温条件下能分解生成炭黑和氢气
知识回顾
(1) 根据甲烷的性质推测烷烃可能具有的性质,填写下表
颜色 溶解性 可燃性 与酸性高锰酸钾溶液 与溴的四氯化碳溶液 与强酸、强碱溶液 与氯气(在光照下)
无色
难溶
不反应
易燃
不反应
不反应
取代反应
思考与讨论P29
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型
预测
感受﹒ 理解
C—C C—H
键能/(kJ·mol-1) 347.7 413.4
H C F
电负性 2.1 2.5 4.0
电负性相差越小,形成的共价键的极性越小,化学反应中越难断裂。
常温下,烷烃的化学性质较稳定
键能越大,化学键越牢固,化学反应中越难断裂。
感受﹒ 理解
结论:
用作溶剂、润滑油
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)完全燃烧的化学方程式。
2C8H18+25O2 16CO2+18H2O
点燃
思考与讨论P29
打火机使用的气体主要是可燃性气体
今多用丁烷、丙烷类和液化石油气
气体经加压后充入贮气箱,一旦释放到空气中便吸热气化而迅速膨胀,极易点燃
早期多用汽油
生活中的化学
(3)根据甲烷与氯气的反应,写出乙烷与氯气反应生成一氯乙烷的化学方程式。指出该反应的反应类型,并从化学键和官能团的角度分析反应中有机化合物的变化。
烷烃
卤代烃
+
+
C—H键断裂,其中的氢原子被氯原子代替,生成C—Cl键
思考与讨论P29
取代反应:
替代法
一取代
二取代
三取代
四取代
五取代
六取代
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
思考与讨论P29
一氯乙烷的制备探究
方法一更好:原子利用率高,产物纯净。
方法一:CH2=CH2+HCl → CH3CH2Cl
方法二:CH3CH3+Cl2 → CH3CH2Cl+HCl
思考与讨论
烷烃与卤素的取代反应是连续反应,产物较为复杂,不适合制备物质
注意:
孙先辉
带温下很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件(如光照或高温)下才能发生某些反应。
1.稳定性
2.氧化反应——可燃性
不能使酸性酸性高锰酸钾溶液褪色
用作溶剂、润滑油
3.取代反应——特征反应
特点:纯的卤素单质 光照 连续反应
CnH2n+2+(3n+1)/2O2 nCO2+(n+1)H2O
用作燃料
4.分解反应
裂化反应
得到液态烃
裂解反应
裂化汽油
裂解气
C20H42 C10H22+C10H20
C16H34 C8H16+C8H18
一、烷烃的结构和性质
烷烃的化学性质:
还可能生成碳单质和氢气
CnH2n+2 +X2
CnH2n+1X+HX
光照
点燃
01难氧化
具有可燃性
02易取代
光照下与卤素单质发生取代反应
03难分解
一定条件下发生裂化和裂解
化学性质
归纳整理
一、烷烃的结构和性质
1.进行一氯取代反应后,能生成三种沸点不同的产物的烷烃是
A.CH3CH2CH3
B.(CH3)2CHCH3
C.(CH3)3CCH2CH3
D.(CH3)4C
课堂小结
C
2.某烃X是CH4的同系物,分子中碳与氢的质量比为36:7,化学性质与甲烷相似。现取两支试管,分别加入适量溴水,实验操作及现象如下:
有关X的说法正确的是
A.相同条件下,X的密度比水大
B.X分子中的共价键类型仅有极性键
C.X能与Br2发生加成反应使溴水褪色
D.试验后试管2中的有机层是上层还是下层,可通过加水确定
D
课堂小结
3.甲烷是最简单的烷烃,关于甲烷的结构与性质描述不正确的是
A.通常情况下,甲烷跟强酸、强碱不反应
B.甲烷可以使酸性高酸钾溶液褪色
C.甲烷分子空间构型为正四面体的证据是二氯甲烷只有一种
D.甲烷与Cl2反应的四种有机取代产物都难溶于水
课堂小结
B
