化学人教版(2019)选择性必修3 2.2.2炔烃(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.2炔烃(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 137.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-28 15:10:48 | ||
图片预览





文档简介
(共21张PPT)
第二节 烯烃 炔烃
第2课时 炔烃
情境引入:乙炔的应用
图1.氧炔焰切割金属
图3.腈纶线
图4.氯丁橡胶、氯丁橡胶手套
图2.聚氯乙烯产品—PVC管、薄膜
1.从化学键的不饱和性等微观角度理解炔烃的结构特点,能辨析物质类别与反应类型之间的关系。
2.能根据已知气体制备原理学习乙炔的实验室制法,并能通过实验探究掌握乙炔的主要化学性质。
学 习 目 标
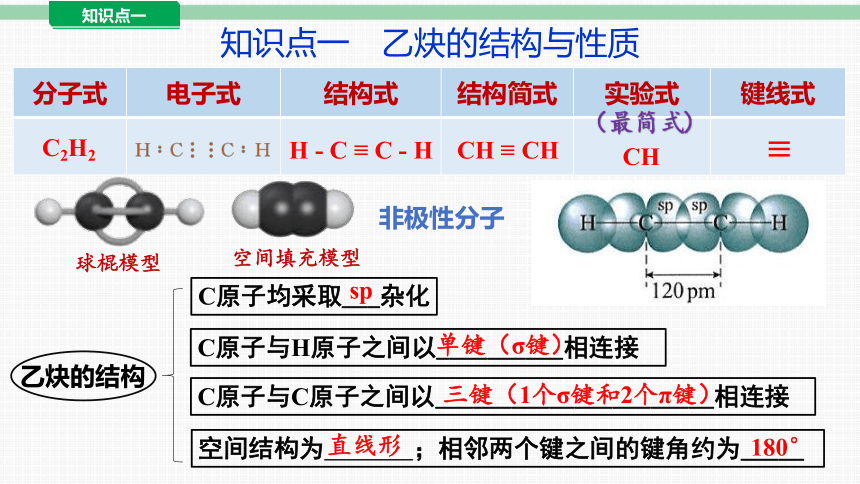
分子式 电子式 结构式 结构简式
乙炔的结构
C原子均采取___杂化
sp
C原子与H原子之间以__________相连接
单键(σ键)
C原子与C原子之间以______________________相连接
三键(1个σ键和2个π键)
空间结构为 ;相邻两个键之间的键角约为_____
180°
球棍模型
空间填充模型
直线形
C2H2
H - C ≡ C - H
CH ≡ CH
实验式 键线式
CH
≡
(最简式)
知识点一 乙炔的结构与性质
非极性分子
知识点一 乙炔的结构与性质
1.物理性质
乙炔(俗称________)是最简单的炔烃。乙炔是无色、无臭的气体,密度比空气____,____溶于水,____溶于有机溶剂。
电石气
小
微
易
C2H2 排空气法?
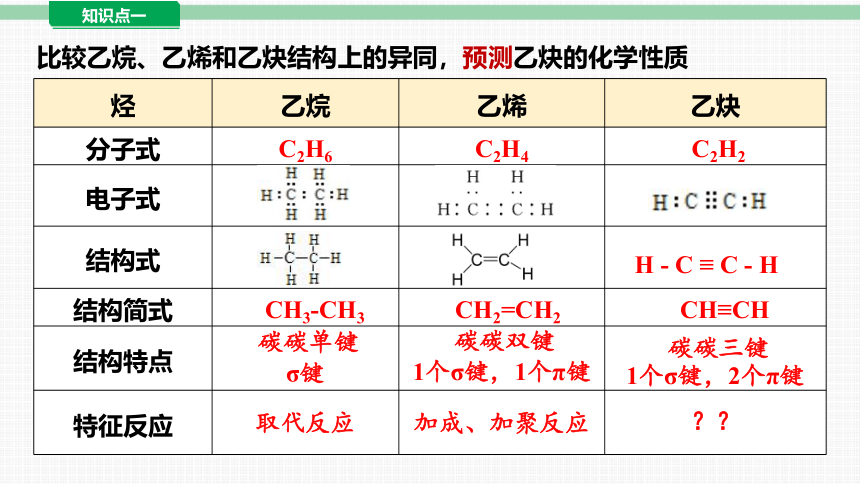
比较乙烷、乙烯和乙炔结构上的异同,预测乙炔的化学性质
烃 乙烷 乙烯 乙炔
分子式 C2H6 C2H4 C2H2
电子式
结构式
结构简式 CH3-CH3 CH2=CH2 CH≡CH
结构特点 碳碳单键 σ键 碳碳双键 1个σ键,1个π键 碳碳三键
1个σ键,2个π键
特征反应 取代反应 加成、加聚反应 ??
H - C ≡ C - H
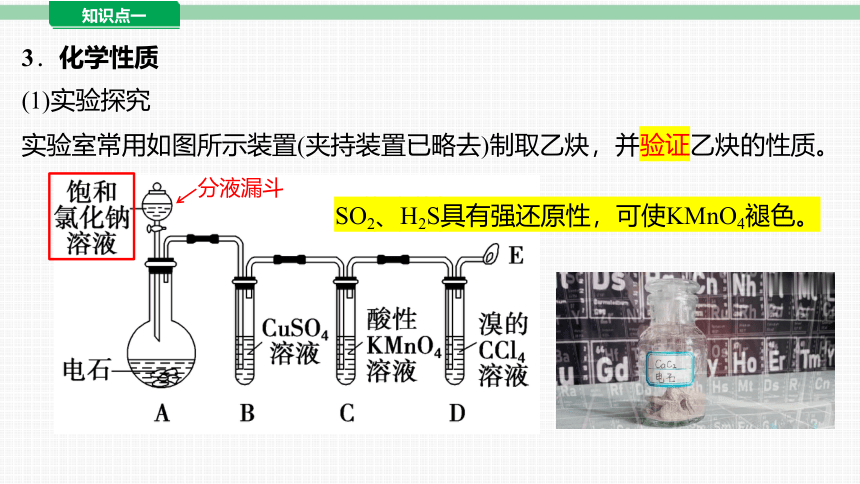
3.化学性质
(1)实验探究
实验室常用如图所示装置(夹持装置已略去)制取乙炔,并验证乙炔的性质。
分液漏斗
SO2、H2S具有强还原性,可使KMnO4褪色。
乙炔的实验室制法
【实验原理】
【实验试剂】
CaC2+2H2O Ca(OH)2+C2H2↑
电石(CaC2)、饱和食盐水、硫酸铜溶液
发生装置:固体 +液体 气体
【实验装置】
Ca(OH)2 +
H OH
H OH
[ ]2-
Ca2+
+
H C C H↑
①为避免反应速率过快,常用饱和食盐水代替水。
②硫酸铜溶液可除去乙炔中混有的H2S等杂质气体。
收集装置:排水集气法。
分液漏斗
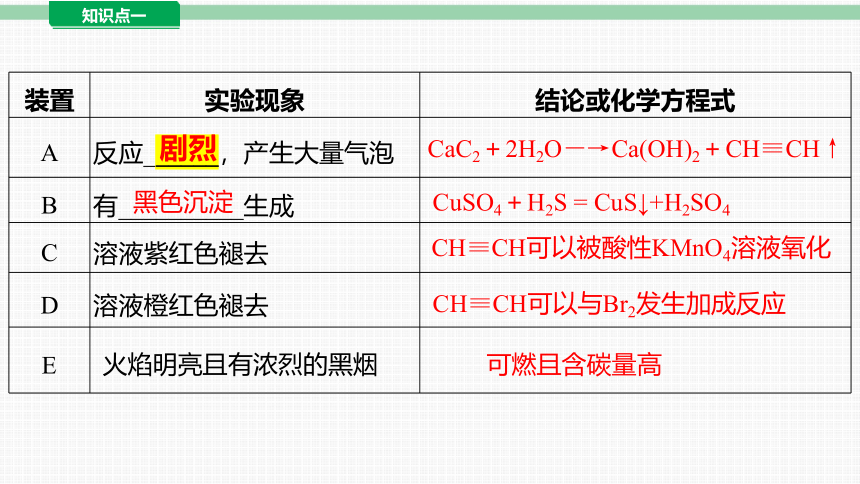
装置 实验现象 结论或化学方程式
A 反应______,产生大量气泡
B 有__________生成
C 溶液紫红色褪去
D 溶液橙红色褪去
E
剧烈
CaC2+2H2O―→Ca(OH)2+CH≡CH↑
黑色沉淀
CuSO4+H2S = CuS↓+H2SO4
CH≡CH可以被酸性KMnO4溶液氧化
CH≡CH可以与Br2发生加成反应
火焰明亮且有浓烈的黑烟
可燃且含碳量高
实验室制取乙炔的注意事项
(1)盛电石的试剂瓶要及时密封并放于干燥处,防止电石吸水而失效。
(2)电石与水反应非常剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,使饱和氯化钠溶液慢慢地滴入。
(3)因反应剧烈且产生气泡,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花。
(4)制取乙炔不能用启普发生器,原因:
①碳化钙遇水反应剧烈;
②反应过程中放出大量的热;
③生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
(5)由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
H2、CO2等 ‖ 块状固体
(2)化学性质
①氧化反应
a.乙炔的燃烧:______________________________。反应放出大量的热,氧炔焰的温度超过3 000 ℃,常用于焊接或切割金属。
b.可使酸性KMnO4溶液______。
褪色
火焰明亮且有浓烟
可以分步表示
与HCl加成 生成氯乙烯
与H2O加成 生成乙醛
[特别提醒]
制聚氯乙烯
③加聚反应
乙炔合成聚乙炔的化学方程式为________________________________,聚乙炔可用于制备导电高分子材料。
聚乙炔具有单双键交替的共轭结构,这种结构使
得电子能够在碳原子之间自由移动。掺杂溴或碘
等物质,其电导率可以显著提高,甚至接近金属
的水平。
20世纪40年代美国杜邦公司研制了一种合成纤维——
聚丙烯腈(腈纶,又称人造毛)
氧化反应
加成反应
加聚反应
①可燃性
②被强氧化剂氧化:使酸性KMnO4溶液紫红色褪去
①与卤素单质或其溶液(足量)→卤代烃:
②与HX→卤代烃:
③与H2→烷烃:
④与H2O→醛:
OH
H
CH=CH
烯醇式
CH3CHO
不稳定
分子重组
聚乙炔
→制备导电高分子材料
乙炔的化学性质
知识点二 炔烃的结构与性质
1.结构特点
炔烃的官能团是__________(—C≡C—)。炔烃分子中只含有一个碳碳三键时,其通式一般表示为___________。
2.物理性质
炔烃物理性质的递变与烷烃和烯烃的相似,沸点也随分子中碳原子数的递增而逐渐升高。
碳碳三键
CnH2n-2
C2H2 含碳量最高!
3.化学性质
炔烃的化学性质与乙炔的相似,能发生加成反应、加聚反应和氧化反应。
4.系统命名法
与烯烃的命名方法相同,只是主链名称为“某炔”。如
CH≡C—CH—CH—CH3
3,4-二甲基-1-戊炔
CH3
CH3
CH3
1.(1)请写出戊炔所有属于炔烃的同分异构体的结构简式并用系统命名法命名:__________________________________________________________
_______________________________________________________________。
(2)某单炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该单炔烃可能的
结构简式为______________________________________________。
CH≡C—CH2—CH2—CH3 1-戊炔、CH3C≡CCH2CH3 2-戊炔、
谢谢观看
第二节 烯烃 炔烃
第2课时 炔烃
情境引入:乙炔的应用
图1.氧炔焰切割金属
图3.腈纶线
图4.氯丁橡胶、氯丁橡胶手套
图2.聚氯乙烯产品—PVC管、薄膜
1.从化学键的不饱和性等微观角度理解炔烃的结构特点,能辨析物质类别与反应类型之间的关系。
2.能根据已知气体制备原理学习乙炔的实验室制法,并能通过实验探究掌握乙炔的主要化学性质。
学 习 目 标
分子式 电子式 结构式 结构简式
乙炔的结构
C原子均采取___杂化
sp
C原子与H原子之间以__________相连接
单键(σ键)
C原子与C原子之间以______________________相连接
三键(1个σ键和2个π键)
空间结构为 ;相邻两个键之间的键角约为_____
180°
球棍模型
空间填充模型
直线形
C2H2
H - C ≡ C - H
CH ≡ CH
实验式 键线式
CH
≡
(最简式)
知识点一 乙炔的结构与性质
非极性分子
知识点一 乙炔的结构与性质
1.物理性质
乙炔(俗称________)是最简单的炔烃。乙炔是无色、无臭的气体,密度比空气____,____溶于水,____溶于有机溶剂。
电石气
小
微
易
C2H2 排空气法?
比较乙烷、乙烯和乙炔结构上的异同,预测乙炔的化学性质
烃 乙烷 乙烯 乙炔
分子式 C2H6 C2H4 C2H2
电子式
结构式
结构简式 CH3-CH3 CH2=CH2 CH≡CH
结构特点 碳碳单键 σ键 碳碳双键 1个σ键,1个π键 碳碳三键
1个σ键,2个π键
特征反应 取代反应 加成、加聚反应 ??
H - C ≡ C - H
3.化学性质
(1)实验探究
实验室常用如图所示装置(夹持装置已略去)制取乙炔,并验证乙炔的性质。
分液漏斗
SO2、H2S具有强还原性,可使KMnO4褪色。
乙炔的实验室制法
【实验原理】
【实验试剂】
CaC2+2H2O Ca(OH)2+C2H2↑
电石(CaC2)、饱和食盐水、硫酸铜溶液
发生装置:固体 +液体 气体
【实验装置】
Ca(OH)2 +
H OH
H OH
[ ]2-
Ca2+
+
H C C H↑
①为避免反应速率过快,常用饱和食盐水代替水。
②硫酸铜溶液可除去乙炔中混有的H2S等杂质气体。
收集装置:排水集气法。
分液漏斗
装置 实验现象 结论或化学方程式
A 反应______,产生大量气泡
B 有__________生成
C 溶液紫红色褪去
D 溶液橙红色褪去
E
剧烈
CaC2+2H2O―→Ca(OH)2+CH≡CH↑
黑色沉淀
CuSO4+H2S = CuS↓+H2SO4
CH≡CH可以被酸性KMnO4溶液氧化
CH≡CH可以与Br2发生加成反应
火焰明亮且有浓烈的黑烟
可燃且含碳量高
实验室制取乙炔的注意事项
(1)盛电石的试剂瓶要及时密封并放于干燥处,防止电石吸水而失效。
(2)电石与水反应非常剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,使饱和氯化钠溶液慢慢地滴入。
(3)因反应剧烈且产生气泡,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花。
(4)制取乙炔不能用启普发生器,原因:
①碳化钙遇水反应剧烈;
②反应过程中放出大量的热;
③生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
(5)由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
H2、CO2等 ‖ 块状固体
(2)化学性质
①氧化反应
a.乙炔的燃烧:______________________________。反应放出大量的热,氧炔焰的温度超过3 000 ℃,常用于焊接或切割金属。
b.可使酸性KMnO4溶液______。
褪色
火焰明亮且有浓烟
可以分步表示
与HCl加成 生成氯乙烯
与H2O加成 生成乙醛
[特别提醒]
制聚氯乙烯
③加聚反应
乙炔合成聚乙炔的化学方程式为________________________________,聚乙炔可用于制备导电高分子材料。
聚乙炔具有单双键交替的共轭结构,这种结构使
得电子能够在碳原子之间自由移动。掺杂溴或碘
等物质,其电导率可以显著提高,甚至接近金属
的水平。
20世纪40年代美国杜邦公司研制了一种合成纤维——
聚丙烯腈(腈纶,又称人造毛)
氧化反应
加成反应
加聚反应
①可燃性
②被强氧化剂氧化:使酸性KMnO4溶液紫红色褪去
①与卤素单质或其溶液(足量)→卤代烃:
②与HX→卤代烃:
③与H2→烷烃:
④与H2O→醛:
OH
H
CH=CH
烯醇式
CH3CHO
不稳定
分子重组
聚乙炔
→制备导电高分子材料
乙炔的化学性质
知识点二 炔烃的结构与性质
1.结构特点
炔烃的官能团是__________(—C≡C—)。炔烃分子中只含有一个碳碳三键时,其通式一般表示为___________。
2.物理性质
炔烃物理性质的递变与烷烃和烯烃的相似,沸点也随分子中碳原子数的递增而逐渐升高。
碳碳三键
CnH2n-2
C2H2 含碳量最高!
3.化学性质
炔烃的化学性质与乙炔的相似,能发生加成反应、加聚反应和氧化反应。
4.系统命名法
与烯烃的命名方法相同,只是主链名称为“某炔”。如
CH≡C—CH—CH—CH3
3,4-二甲基-1-戊炔
CH3
CH3
CH3
1.(1)请写出戊炔所有属于炔烃的同分异构体的结构简式并用系统命名法命名:__________________________________________________________
_______________________________________________________________。
(2)某单炔烃通过催化加氢反应得到2-甲基戊烷,由此推断该单炔烃可能的
结构简式为______________________________________________。
CH≡C—CH2—CH2—CH3 1-戊炔、CH3C≡CCH2CH3 2-戊炔、
谢谢观看
