7.3.2乙酸课件(共26张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3.2乙酸课件(共26张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-28 09:47:40 | ||
图片预览







文档简介
(共26张PPT)
第七章 有机化合物
第三节 乙醇 乙酸
第2课时 乙酸
环节一:情境导入,感知醋的酿造
醋文化
环节一:情境导入,感知醋的酿造
醋文化
我国是世界上谷物酿醋最早的国家,早在公元前8世纪就已有了醋的文字记载。春秋战国时期,已有专门酿醋的作坊。到汉代时,醋开始普遍生产。南北朝时,食醋的产量和销量都已很大,其时的名著《齐民要术》曾系统地总结了我国劳动人民从上古到北魏时期的制醋经验和成就,书中共收载了22种制醋方法,这也是我国现存史料中,对粮食酿造醋的最早记载。
环节一:情境导入,感知醋的酿造
醋文化
醋蒸汽熏蒸居室能杀灭细菌和病毒,防止感冒和传染病;
煮排骨或烧鱼时加点醋,不但能使骨头里的钙、磷、铁等溶解到汤里而被人体吸收,而且还能保持食物中的维生素不被破坏;
鱼骨梗喉,吞食几口醋,可使鱼骨酥软顺利咽下;
醋还有降血压、防止动脉硬化和治疗冠心病的效果;
环节二:联系生活,总结乙酸的物理性质
乙酸的物理性质
无色
液体
强烈刺激性气味
117.9℃
16.6℃
易溶于水和乙醇
当温度低于熔点时,乙酸凝结成类似冰一样的晶体,则纯净的乙酸又称为冰醋酸。
颜色:
状态:
气味:
熔点:
沸点:
溶解性:
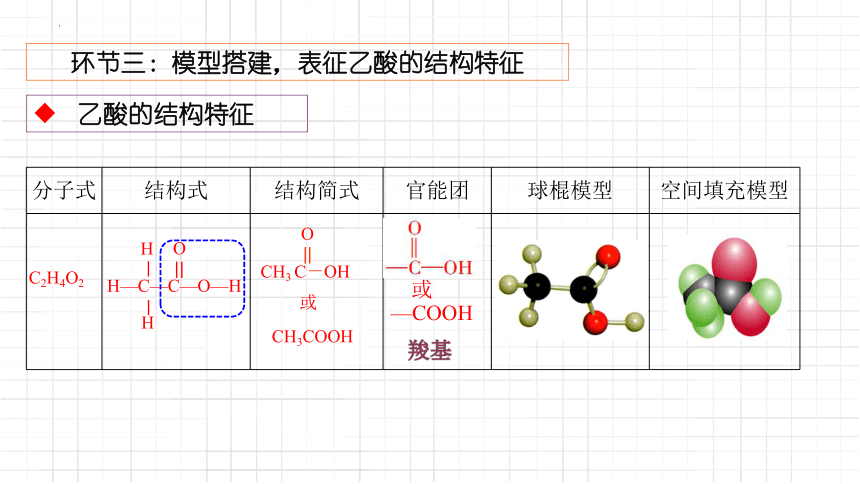
环节三:模型搭建,表征乙酸的结构特征
乙酸的结构特征
分子式 结构式 结构简式 官能团 球棍模型 空间填充模型
C2H4O2
羧基
CH3COOH
O
CH3 C-OH
或
H
O
H
H—C—C—O—H
—COOH
或
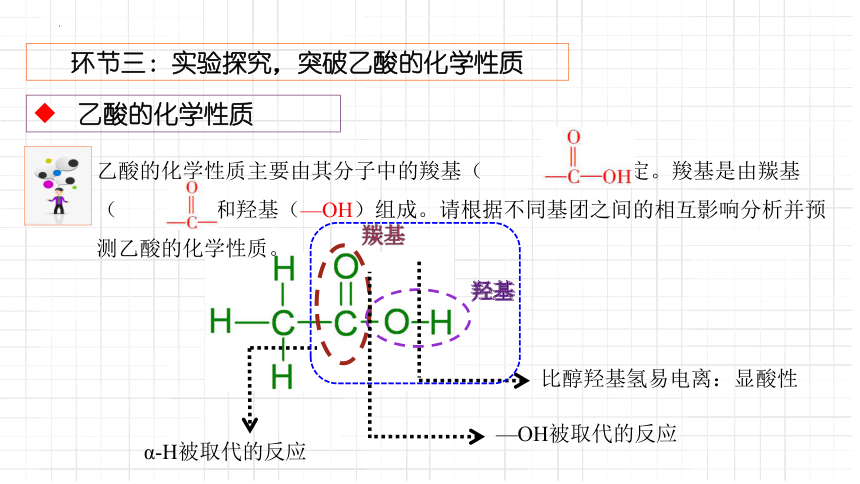
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
乙酸的化学性质主要由其分子中的羧基( )决定。羧基是由羰基( )和羟基(—OH)组成。请根据不同基团之间的相互影响分析并预测乙酸的化学性质。
羰基
羟基
比醇羟基氢易电离:显酸性
—OH被取代的反应
α-H被取代的反应
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酸性
紫色石蕊溶液变 色
2CH3COOH+Zn → (CH3COO)2Zn+H2↑
红
CH3COOH+NaOH → CH3COONa+H2O
2CH3COOH+Na2O → 2CH3COONa+H2O
2CH3COOH+Na2CO3 → 2CH3COONa+CO2↑+H2O
指示剂作用
较活泼金属
碱性氧化物
碱
盐
CH3COOH CH3COO- + H+
环节三:实验探究,突破乙酸的化学性质
1、用食醋浸泡有水垢(主要成分是CaCO3)的暖水瓶或水壶,可以清除其中的水垢。这是利用了醋酸的什么性质?请写出相应的化学方程式?
酸性强弱: CH3COOH>H2CO3
2CH3COOH + CaCO3 = Ca (CH3COO)2+H2O+CO2↑
乙酸的化学性质
环节三:实验探究,突破乙酸的化学性质
2、如何比较乙酸与碳酸、盐酸的酸性强弱?请查阅资料,与同学讨论,根据生活经验设计实验方案。
酸性强弱:HCl > CH3COOH > H2CO3
方案①:分别取浓度均为0.1mol·L-1的盐酸和乙酸溶液,测其pH。
(1)比较盐酸和乙酸溶液的酸性。
方案②:用相同浓度的盐酸和乙酸分别和碳酸钙反应,根据反应速率判断。
(2)比较碳酸和乙酸溶液的酸性。
乙酸的化学性质
环节三:实验探究,突破乙酸的化学性质
乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CH3COOH H—OH C2H5OH
遇石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与NaOH
与Na2CO3 反应 不反应 反应
羟基氢的活泼性强弱 CH3COOH>H2CO3>H2O>C2H5OH 含羟基
酸性
不仅有酸性,且酸性大于碳酸
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
为什么说酒是陈的香?
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
在一支试管中加入3 mL 乙醇,然后边振荡试管边加慢慢加入2 mL浓硫酸,和2 mL 乙酸 ,在加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸汽经导管通入饱和碳酸钠液面之上 ,观察现象 。
现象:饱和碳酸钠液面分层,上层有无色油状液体; 可闻到香味
结论:在浓硫酸存在并加热的条件下,乙酸和乙醇发生了化学反应。
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯化反应
CH3COOH + HOC2H5 H2O + CH3COOC2H5
浓H2SO4
▲
乙酸乙酯(果香味,密度比水小)
酸和醇起反应生成酯和水的反应,叫做酯化反应。
可逆反应
取代反应
酸脱羟基醇脱氢
官能团
断键方式
(低级酯具有一定的挥发性,有芳香气味)
酯:羧酸分子羧基中的羟基被—OR取代后的一类有机物。
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
先加乙醇,再加浓硫酸,最后加乙酸
如何添加药品?
1
催化剂
吸水剂
浓硫酸的作用?
2
CH3COOH + HOC2H5 H2O + CH3COOC2H5
浓H2SO4
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
防止暴沸
加碎瓷片的作用
3
直角长导管作用
4
导气冷凝作用
导管为什么不插入液面以下
5
防止倒吸
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
乙酸乙酯中含有乙酸和乙醇杂质
制得的乙酸乙酯是否纯净?主要杂质有哪些?
6
饱和Na2CO3溶液有什么作用?
7
溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于液体分层
如何分离出乙酸乙酯?
8
分液
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯
乙酸乙酯是酯类物质中的一种
CH3
O
C
O
CH3
CH2
乙酸乙酯
—COOR
O
C
O
官能团
酯基
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯
乙酸异戊酯
戊酸戊酯
很多鲜花和水果的香味都来自酯
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯
酯是有芳香气味的液体,存在于各种水果和花草中。
环节四:归纳整理,巩固提升
归纳整理
O
CH3—C—O—H
一、 乙酸的物理性质
二 、乙酸分子结构
三、 乙酸的化学性质
1. 酸的通性
2. 酯化反应
酸性
酯化反应
CH3COOH CH3COO- +H+
CH3COOH + HOC2H5 H2O + CH3COOC2H5
浓H2SO4
环节二:归纳整理,巩固提升
巩固提升
1.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
C
环节二:归纳整理,巩固提升
巩固提升
A.CH2=CH—CH2—OH
B.
C.CH2=CH—COOH
D.CH3COOH
2.下表为某有机物与各种试剂的反应现象,则这种有机物可能是( )
试剂 钠 溴水 NaHCO3溶液
现象 放出气体 褪色 放出气体
C
环节二:归纳整理,巩固提升
巩固提升
3.除去乙酸乙酯中的乙酸最好的方法是( )
A.用水洗
B.用盐酸洗
C.用氢氧化钠溶液洗
D.用饱和Na2CO3溶液洗
D
环节二:归纳整理,巩固提升
巩固提升
4.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是 ( )
A. 酯化反应的产物只有酯
B. 酯化反应可看成取代反应的一种
C. 酯化反应是有限度的
D. 浓硫酸可作酯化反应的催化剂
A
谢谢观看!
第七章 有机化合物
第三节 乙醇 乙酸
第2课时 乙酸
环节一:情境导入,感知醋的酿造
醋文化
环节一:情境导入,感知醋的酿造
醋文化
我国是世界上谷物酿醋最早的国家,早在公元前8世纪就已有了醋的文字记载。春秋战国时期,已有专门酿醋的作坊。到汉代时,醋开始普遍生产。南北朝时,食醋的产量和销量都已很大,其时的名著《齐民要术》曾系统地总结了我国劳动人民从上古到北魏时期的制醋经验和成就,书中共收载了22种制醋方法,这也是我国现存史料中,对粮食酿造醋的最早记载。
环节一:情境导入,感知醋的酿造
醋文化
醋蒸汽熏蒸居室能杀灭细菌和病毒,防止感冒和传染病;
煮排骨或烧鱼时加点醋,不但能使骨头里的钙、磷、铁等溶解到汤里而被人体吸收,而且还能保持食物中的维生素不被破坏;
鱼骨梗喉,吞食几口醋,可使鱼骨酥软顺利咽下;
醋还有降血压、防止动脉硬化和治疗冠心病的效果;
环节二:联系生活,总结乙酸的物理性质
乙酸的物理性质
无色
液体
强烈刺激性气味
117.9℃
16.6℃
易溶于水和乙醇
当温度低于熔点时,乙酸凝结成类似冰一样的晶体,则纯净的乙酸又称为冰醋酸。
颜色:
状态:
气味:
熔点:
沸点:
溶解性:
环节三:模型搭建,表征乙酸的结构特征
乙酸的结构特征
分子式 结构式 结构简式 官能团 球棍模型 空间填充模型
C2H4O2
羧基
CH3COOH
O
CH3 C-OH
或
H
O
H
H—C—C—O—H
—COOH
或
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
乙酸的化学性质主要由其分子中的羧基( )决定。羧基是由羰基( )和羟基(—OH)组成。请根据不同基团之间的相互影响分析并预测乙酸的化学性质。
羰基
羟基
比醇羟基氢易电离:显酸性
—OH被取代的反应
α-H被取代的反应
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酸性
紫色石蕊溶液变 色
2CH3COOH+Zn → (CH3COO)2Zn+H2↑
红
CH3COOH+NaOH → CH3COONa+H2O
2CH3COOH+Na2O → 2CH3COONa+H2O
2CH3COOH+Na2CO3 → 2CH3COONa+CO2↑+H2O
指示剂作用
较活泼金属
碱性氧化物
碱
盐
CH3COOH CH3COO- + H+
环节三:实验探究,突破乙酸的化学性质
1、用食醋浸泡有水垢(主要成分是CaCO3)的暖水瓶或水壶,可以清除其中的水垢。这是利用了醋酸的什么性质?请写出相应的化学方程式?
酸性强弱: CH3COOH>H2CO3
2CH3COOH + CaCO3 = Ca (CH3COO)2+H2O+CO2↑
乙酸的化学性质
环节三:实验探究,突破乙酸的化学性质
2、如何比较乙酸与碳酸、盐酸的酸性强弱?请查阅资料,与同学讨论,根据生活经验设计实验方案。
酸性强弱:HCl > CH3COOH > H2CO3
方案①:分别取浓度均为0.1mol·L-1的盐酸和乙酸溶液,测其pH。
(1)比较盐酸和乙酸溶液的酸性。
方案②:用相同浓度的盐酸和乙酸分别和碳酸钙反应,根据反应速率判断。
(2)比较碳酸和乙酸溶液的酸性。
乙酸的化学性质
环节三:实验探究,突破乙酸的化学性质
乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CH3COOH H—OH C2H5OH
遇石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与NaOH
与Na2CO3 反应 不反应 反应
羟基氢的活泼性强弱 CH3COOH>H2CO3>H2O>C2H5OH 含羟基
酸性
不仅有酸性,且酸性大于碳酸
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
为什么说酒是陈的香?
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
在一支试管中加入3 mL 乙醇,然后边振荡试管边加慢慢加入2 mL浓硫酸,和2 mL 乙酸 ,在加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸汽经导管通入饱和碳酸钠液面之上 ,观察现象 。
现象:饱和碳酸钠液面分层,上层有无色油状液体; 可闻到香味
结论:在浓硫酸存在并加热的条件下,乙酸和乙醇发生了化学反应。
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯化反应
CH3COOH + HOC2H5 H2O + CH3COOC2H5
浓H2SO4
▲
乙酸乙酯(果香味,密度比水小)
酸和醇起反应生成酯和水的反应,叫做酯化反应。
可逆反应
取代反应
酸脱羟基醇脱氢
官能团
断键方式
(低级酯具有一定的挥发性,有芳香气味)
酯:羧酸分子羧基中的羟基被—OR取代后的一类有机物。
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
先加乙醇,再加浓硫酸,最后加乙酸
如何添加药品?
1
催化剂
吸水剂
浓硫酸的作用?
2
CH3COOH + HOC2H5 H2O + CH3COOC2H5
浓H2SO4
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
防止暴沸
加碎瓷片的作用
3
直角长导管作用
4
导气冷凝作用
导管为什么不插入液面以下
5
防止倒吸
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
实验7-6
乙酸乙酯中含有乙酸和乙醇杂质
制得的乙酸乙酯是否纯净?主要杂质有哪些?
6
饱和Na2CO3溶液有什么作用?
7
溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于液体分层
如何分离出乙酸乙酯?
8
分液
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯
乙酸乙酯是酯类物质中的一种
CH3
O
C
O
CH3
CH2
乙酸乙酯
—COOR
O
C
O
官能团
酯基
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯
乙酸异戊酯
戊酸戊酯
很多鲜花和水果的香味都来自酯
环节三:实验探究,突破乙酸的化学性质
乙酸的化学性质
酯
酯是有芳香气味的液体,存在于各种水果和花草中。
环节四:归纳整理,巩固提升
归纳整理
O
CH3—C—O—H
一、 乙酸的物理性质
二 、乙酸分子结构
三、 乙酸的化学性质
1. 酸的通性
2. 酯化反应
酸性
酯化反应
CH3COOH CH3COO- +H+
CH3COOH + HOC2H5 H2O + CH3COOC2H5
浓H2SO4
环节二:归纳整理,巩固提升
巩固提升
1.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
C
环节二:归纳整理,巩固提升
巩固提升
A.CH2=CH—CH2—OH
B.
C.CH2=CH—COOH
D.CH3COOH
2.下表为某有机物与各种试剂的反应现象,则这种有机物可能是( )
试剂 钠 溴水 NaHCO3溶液
现象 放出气体 褪色 放出气体
C
环节二:归纳整理,巩固提升
巩固提升
3.除去乙酸乙酯中的乙酸最好的方法是( )
A.用水洗
B.用盐酸洗
C.用氢氧化钠溶液洗
D.用饱和Na2CO3溶液洗
D
环节二:归纳整理,巩固提升
巩固提升
4.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是 ( )
A. 酯化反应的产物只有酯
B. 酯化反应可看成取代反应的一种
C. 酯化反应是有限度的
D. 浓硫酸可作酯化反应的催化剂
A
谢谢观看!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
