山东滕州2015 评比优秀教案 鲁科版化学 必修一 第一章 认识化学科学 章节复习
文档属性
| 名称 | 山东滕州2015 评比优秀教案 鲁科版化学 必修一 第一章 认识化学科学 章节复习 |

|
|
| 格式 | zip | ||
| 文件大小 | 122.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-09 00:00:00 | ||
图片预览




文档简介
化学必修1第一章复习总结
适用年级:高一 所需课时:1课时
编写者:王仁会 单位:枣庄一中新校
课型:复习课
教材分析:
本章分三节。第一节认识化学科学,引导学生 ( http: / / www.21cnjy.com )走进化学世界,使他们进一步了解化学学科的任务和特点。认识化学科学的创造性和实用性、化学发展史、化学探索的空间领域。第二节研究物质性质的方法和程序,通过对典型的金属钠和典型的非金属氯气这两种物质性质的探究,介绍研究物质性质的基本方法和一般程序,为学生以后的学习打下基础,使他们认识到高中阶段的探究活动应更有计划性、目的性和针对性。第三节物质的量,帮助学生建立宏观物质的质量、体积与微观粒子数之间的联系,明确高中阶段对于物质和化学反应要从定性的认识进入定量的认识,让学生体会定量研究的方法对学习和研究化学的重要作用。
二. 教学目标
知识与技能:
1、使学生知道化学是在原子、分子层次上认识物质和合成新物质的一门科学;了解20世纪化学发展的历程和21世纪化学发展的趋势。
2、掌握钠和氯气的物理性质和化学性质,了解研究物质性质的基本方法和程序。
3、了解物质的量、摩尔质量、气体摩尔体积和物质的量浓度等有关化学计量的知识。
过程与方法:
引导学生进一步体会观察、实验、分类、比较等科学研究方法在研究物质性质过程中的应用,了解研究物质性质的一般方法和程序。
体会定量研究方法对学习和研究化学的重要作用。
情感态度与价值观:
通过介绍化学科学发展过程中的典型事例,使学生认识化学科学对提高人类生活质量和促进社会发展所起的重要作用,感受化学世界的奇妙与和谐。
通过配置一定体积一定物质的量浓度溶液的实验操作和误差分析,培养学生逻辑思维能力和科学严谨精神。
通过物质的量的相关计算题强调解题规范,单位使用准确,养成良好的学习习惯。
三. 教学重点:
1、钠和氯气的物理性质及化学性质
2、物质的量物质的量、摩尔质量、气体摩尔体积和物质的量浓度的计算
教学难点:
1、实验法探究物质的性质。 2、以物质的量为核心的计算。
教具:复习导学案 、多媒体
教法:复习回顾、练习总结相结合。
四.教学过程
教学环节时间安排 教师活动 学生活动 设计意图
复习回顾第一节知识点 3分钟 通过多媒体展示提出以下问题:化学是一门在 、 水平上研究物质 、 、 、 、 和应用的自然科学。2、化学具有 、 特点。化学不但能 分子还能 分子因此具有创造性。3、化学发展史经历了 、 、 三个阶段,近代化学发展史上的四个里程碑事件是 。 重温教材,总结出答案。原子、分子质组成、结构、性质、变化、制备2创造性、实用性认识分子、制造分 3、古代化学、近代化学、现代化学 提出化学元素学说、燃烧的氧化学说、原子学说、发现元素周期律 引导学生重温教材,复习回顾第一节四个知识点
第一节知识点强化练习2分钟 通过多媒体展示学案中的强化练习习题,提问学生回答答案,做出必要的讲评和纠正。判断下列说法的正误:1、人们可以利用化学变化制造出新的原子和新的分子。( )2、化学家可以制造出自然界中不存在的物质。( ) 3、在近代化学发展史中,英国的科学家道尔顿首先提出化学元素概念,其后英国化学家波义尔提出原子学说。( )4、化学研究及新物质的合成,只会造成严重的环境污染,给人类带来更多的疑难病症。 读题并做出以下判断:错对错错注 ( http: / / www.21cnjy.com )意*:在近代化学发展史上英国科学家波义尔和道尔顿做出了重大贡献,波义尔先提出了化学元素的概念,标志着近代化学的诞生;而后道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。 通过四个判断题强化第一节知识点的复习。通过纠正进一步强调英、法、英、俄等国的科学家在近代化学发展史上的贡献。
复习回顾第二节知识点 一、钠的性质回顾 3分钟二、氯气性回顾3分钟 通过多媒体展示提出以下问题 并展示出正确答案研究物质性质的基本方法有: 、 、 、 。钠的物理性: 色、熔沸点低、硬度 、密度 于煤油 于水。少量钠保存在 中。钠与水现象:钠 在水面上, 化成明亮的小球,四处 动,发出嘶嘶声 ,滴加一滴无色酚酞得 色溶液。,该反应的产物为 和 。钠与氧气反应的产物可能为 和 。研究物质性质的一般程序: 、 、 、 。氯气的物理性质:氯气是一种 色 气味有毒气体。溶于水后与水反应生成 和 称为 ,其颜色为 色。氯水中的三种溶质是: 、 、 ;三种分子是: 、 、 ;四种离子是: 、 、 、 。;铁在氯气中燃烧产生 色浓烟铜在氯气中燃燃产生 色浓烟,产物水溶液呈 色。氢气在氯气中产生 色火焰,集气瓶口有白 。氯气与碱反应产物有: 、 、 次氯酸有 性 性 性。 重温教材,总结回答答案。观察、实验、比较、分类。2、银白、小、大于、小于煤油浮、熔、游、响、红。氢氧化钠、氢气3、氧化钠、过氧化钠观察、预测、实验、结论。黄绿、刺激盐酸、次氯酸 浅黄绿氯气、盐酸、次氯酸Cl2 H2O HClOH+、 OH- 、Cl- 、ClO-棕红棕黄蓝绿苍白白雾盐酸盐、次氯酸盐、水酸性、不稳定性、漂白性 回顾钠的物理性质和化学性质回顾钠的物理性质和化学性质
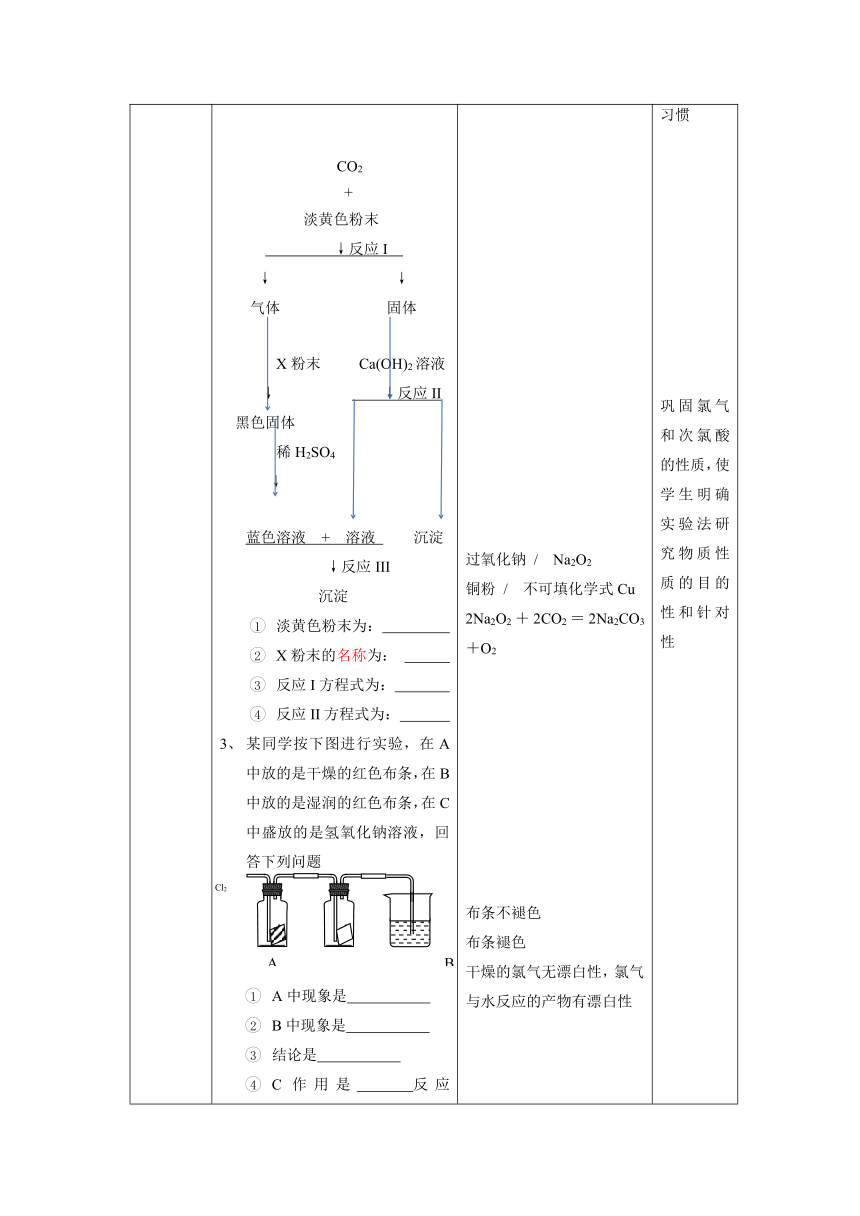
第二节知识点强化练一、钠和氯气性质方程式书写5分钟二、钠和氯气性质实验考察题强化练习9分钟 通过多媒体展示学案中的强化练习习题,提问学生回答答案,做出必要的讲评和纠正。提两名学生上黑板完成钠和氯气化学性质的方程式。其他同学在学案上完成。重点强调过氧化钠与水和二氧化碳的反应。二、引导学生完成学案中以下三道思考题:钠放入三氯化铁溶液中,钠先于水反应,反应方程式为: ,生产的NaOH再与FeCl3,反应方程式为: 总反应方程式为: , 所有的反应现象为: 。某谈黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂,根据下图所示转化关系及现象填空。 CO2 + 淡黄色粉末 ↓反应I ↓ ↓ 气体 固体 X粉末 Ca(OH)2溶液 ↓ ↓反应II黑色固体 稀H2SO4 ↓蓝色溶液 + 溶液 沉淀 ↓反应III 沉淀 淡黄色粉末为: X粉末的名称为: 反应I方程式为: 反应II方程式为: 某同学按下图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题A中现象是 B中现象是 结论是 C作用是 反应是 。 学生在黑板完成学案上方程式书写:第一位学生:Na+H2O—Na+O2 — Na2O Na+O2 —— Na2O2Na2O2+H2O—Na2O2+CO2—第二组学生:1、Cu+Cl2—2、Fe+Cl2—3、H2+Cl2—4、H2O+Cl2—5、NaOH+ Cl2— 在学案上完成三道思考题,回答答案。过氧化钠 / Na2O2铜粉 / 不可填化学式Cu2Na2O2+2CO2=2Na2CO3+O2布条不褪色布条褪色干燥的氯气无漂白性,氯气与水反应的产物有漂白性 巩固钠和氯气的化学性质培养提高强化学生化学方程式的书写能力明确强化钠与盐溶液反应的实质及现象巩固过氧化钠的性质与应用,培养学生图标推理分析能力,强化学生按要求填写答案的习惯巩固氯气和次氯酸的性质,使学生明确实验法研究物质性质的目的性和针对性
复习回顾第三节知识点 5分钟 二、在练习的基础上师生共同推导小结出下列四组公式1、n= N/NA=m/ M=V/Vm=C(B) .V(溶液)2、N= n. = N/ .NA=V/ .NA3、m=n. = N/ .M=V/ .M4、V=n. = N/ .Vm=m/ . Vm 一、在教师引导下完成学案中下列习题已知下列4份CO2气体,分别求出他们的物质的量、粒子数、质量,标况下体积1234物质的量0.5mol粒子数12.06 ×1023质量88g标况体积33.6L 通过公式推导,回顾物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念的定义和应用。
第二节知识点强化练10分钟 通过多媒体展示学案中的强化练习习题,提问学生回答答案,做出必要的讲评和纠正。1、下列物质中所含分子数一定相同的是 。A、1克氢气和8克氧气B、0.1molHCl和22.4LHeC、180℃101KPa时18L水和18LCO2D、22g CO2和3.01×1022个CO2。2、标准状况下,nL HCl 气体溶于m ( http: / / www.21cnjy.com )mLH2O中得密度为p g.cm-3的R L的盐酸,则此盐酸的物质的量浓度为 。A. n/(22.4R) mol·L-1 B. 1000np/(36.5n+22.4m) mol·L-1C. n/22.4 mol·L-1 D. 1000p/(36.5n+22.4m) mol·L-13、在2L含2molH2SO4和2molMgSO4的溶液中,求;C(H2SO4)= C(MgSO4)= C(H+)= C(Mg2+)= C(SO42-)= 在含H2SO4和MgSO4的混合溶液中已知C(H+)=2mol/LC(SO42-)=2mol/L求:C(Mg2+)= 在学案上完成4道题,回答答案。C180℃101KPa时18L水为气体,三同定一同22.4Lhe的物质的量不是0.1mol,注意气体的四个参量中三量定一量2、答案:A B3、1mol/L 1mol/L2mol/L 1mol/L2mol/L1mol/L 强化学生审题和分析问题能力培养学生计算推理能力强化混合液中溶质物质的量浓度计算和离子浓度的计算
板书设计 学生板书(主板): 点燃4Na+O2=2Na2O Na+O2 = Na2O2 2Na+2H2O=2NaOH+H2↑ 浮、游、熔、响、红2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2点燃 点燃 点燃2Fe+3Cl2 =====2FeCl3 Cu+ Cl2 ======== Cu Cl2 H2+Cl2======= 2HCl 棕红 棕黄 苍白 白雾Cl2+H2O=HCl+HClO2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O教师板书(主板):1、n= N/NA=m/ M=V/Vm=C(B) .V(溶液)2、N= n. NA = N/ M.NA=V/ Vm NA3、m=n. M = N/NA.M=V/ Vm.M4、V=n. Vm = N/ NA .Vm=m/ M . Vm
教后记 通过教学检测发现,实验法研究物质(主要 ( http: / / www.21cnjy.com )是本章的钠和氯气)性质是学生学习掌握的一个薄弱点,表现在学生对研究物质性质的实验考查题不能明确实验设计的目的性和针对性,甚至分析不出实验原理。对于物质的量、摩尔质量、气体摩尔体积和物质的量浓度这四个物理量的计算,学生在学习之处不能熟练灵活进行,要在以后的教学中进一步强化练习。
附 化学必修1第一章复习总结(学案)
第一节走进化学科学
一、阅读回顾教材完成下列填空:
1、 化学是一门在 、 水平上研究物质 、 、
、 、 和应用的自然科学。
2、化学具有 、 特点。化学不但能 分子还能 分子因此具有创造性。
3、化学发展史经历了 、 、 三个阶段,近代化学发展史上的四个里程碑事件是 。
二、判断下列说法的正误:
1、人们可以利用化学变化制造出新的原子和新的分子。( )
2、化学家可以制造出自然界中不存在的物质。( )
3、在近代化学发展史中,英国的科学家道尔顿首先提出化学元素概念,其后英国化学家波义尔提出原子学说。( )
4、化学研究及新物质的合成,只会造成严重的环境污染,给人类带来更多的疑难病症。( )
第二节 节研究物质性质的方法和程序
一、回顾 钠的性质,完成下列填空
1、 研究物质性质的基本方法有: 、 、 、 。
2、 钠的物理性: 色、熔 ( http: / / www.21cnjy.com )沸点低、硬度 、密度 于煤油 于水。少量钠保存在 中。钠与水现象:钠 在水面上, 化成明亮的小球,四处 动,发出嘶嘶声 ,滴加一滴无色酚酞得 色溶液。该反应的产物为 和 。
3、 钠与氧气反应的产物可能为 和 。
二、回顾氯气的性质,完成下列填空
1、 研究物质性质的一般程序: 、 、 、 。
2、 氯气的物理性质:氯气是一种 色 气味有毒气体。溶于水后与水反应生成 和 称之为 ,其颜色为 色。氯水中的三种溶质是: 、 、 ;三种分子是: 、 、 ;
四种离子是: 、 、 、 。;
3、 铁在氯气中燃烧产生 ( http: / / www.21cnjy.com ) 色浓烟;铜在氯气中燃燃产生 色浓烟,产物水溶液呈 色。氢气在氯气中产生 色火焰,集气瓶口有 。
4、 氯气与碱反应产物有: 、 、
5、 次氯酸有 性 性 性。
三、完成下列钠反应方程式书写:
Na+H2O—
Na+O2 — Na2O
3 、Na+O2 —— Na2O2
4、Na2O2+H2O—
5、Na2O2+CO2—
四、完成下列氯气反应方程式书写:
1、Cu+Cl2—
2、Fe+Cl2—
3、H2+Cl2—
4、H2O+Cl2—
5、NaOH+ Cl2—
五、完成下三道思考题:
1、 钠放入三氯化铁溶液中,钠先于水反应,反应方程为 ,
生产的NaOH再与FeCl3,反应方程式为: ;
总反应方程式为: 。
所有的反应现象为 。
2、某谈黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂,根据下图所示转化关系及现象填空。
淡黄色粉末为:
X粉末的名称为:
CO2 + 淡黄色粉末的反应方程式为:
固体与Ca(OH)2溶液反应的方程式为:
3、某同学按下图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题
A中现象是 B中现象是
结论是
C作用是 反应是 。
第三节、物质的量
一、已知下列4份CO2气体,分别求出他们的物质的量、粒子数、质量,标况下体积
1 2 3 4
物质的量 0.5mol
粒子数 12.06 ×1023
质量 88g
标况体积 33.6L
二、完成下列四组公式1、n= N/NA=m/ M=V/Vm=C(B) .V(溶液) 2、N= n. = N/ .NA=V/ .NA
3、m=n. = N/ .M=V/ .M 4、V=n. = N/ .Vm=m/ . Vm
三、完成下列思考题
1、下列物质中所含分子数一定相同的是 。
A、1克氢气和8克氧气 B、0.1molHCl和22.4LHe
C、180℃101KPa时18L水和18LCO2 D、22g CO2和3.01×1022个CO2。
2、标准状况下,nL H ( http: / / www.21cnjy.com )Cl 气体溶于m mLH2O中得密度为p g.cm-3的R L的盐酸,则此盐酸的物质的量浓度为 。
A. n/(22.4R) mol·L-1 B. 1000np/(36.5n+22.4m) mol·L-1
C. n/22.4 mol·L-1 D. 1000p/(36.5n+22.4m) mol·L-1
3、在2L含2molH2SO4和2molMgSO4的溶液中,求;
C(H2SO4)= C(MgSO4)= C(H+)= C(Mg2+)=
C(SO42-)=
4、在含H2SO4和MgSO4的混合溶液中已知C(H+)=2mol/L C(SO42-)=2mol/L
求:C(Mg2+)=
Cl2→
A B C
X粉末 稀H2SO4
→气体 黑色固体 蓝色溶液
CO2 + 淡黄色粉末→ 沉淀
Ca(OH)2溶液 溶液
→固体
沉淀
Cl2→
A B C
适用年级:高一 所需课时:1课时
编写者:王仁会 单位:枣庄一中新校
课型:复习课
教材分析:
本章分三节。第一节认识化学科学,引导学生 ( http: / / www.21cnjy.com )走进化学世界,使他们进一步了解化学学科的任务和特点。认识化学科学的创造性和实用性、化学发展史、化学探索的空间领域。第二节研究物质性质的方法和程序,通过对典型的金属钠和典型的非金属氯气这两种物质性质的探究,介绍研究物质性质的基本方法和一般程序,为学生以后的学习打下基础,使他们认识到高中阶段的探究活动应更有计划性、目的性和针对性。第三节物质的量,帮助学生建立宏观物质的质量、体积与微观粒子数之间的联系,明确高中阶段对于物质和化学反应要从定性的认识进入定量的认识,让学生体会定量研究的方法对学习和研究化学的重要作用。
二. 教学目标
知识与技能:
1、使学生知道化学是在原子、分子层次上认识物质和合成新物质的一门科学;了解20世纪化学发展的历程和21世纪化学发展的趋势。
2、掌握钠和氯气的物理性质和化学性质,了解研究物质性质的基本方法和程序。
3、了解物质的量、摩尔质量、气体摩尔体积和物质的量浓度等有关化学计量的知识。
过程与方法:
引导学生进一步体会观察、实验、分类、比较等科学研究方法在研究物质性质过程中的应用,了解研究物质性质的一般方法和程序。
体会定量研究方法对学习和研究化学的重要作用。
情感态度与价值观:
通过介绍化学科学发展过程中的典型事例,使学生认识化学科学对提高人类生活质量和促进社会发展所起的重要作用,感受化学世界的奇妙与和谐。
通过配置一定体积一定物质的量浓度溶液的实验操作和误差分析,培养学生逻辑思维能力和科学严谨精神。
通过物质的量的相关计算题强调解题规范,单位使用准确,养成良好的学习习惯。
三. 教学重点:
1、钠和氯气的物理性质及化学性质
2、物质的量物质的量、摩尔质量、气体摩尔体积和物质的量浓度的计算
教学难点:
1、实验法探究物质的性质。 2、以物质的量为核心的计算。
教具:复习导学案 、多媒体
教法:复习回顾、练习总结相结合。
四.教学过程
教学环节时间安排 教师活动 学生活动 设计意图
复习回顾第一节知识点 3分钟 通过多媒体展示提出以下问题:化学是一门在 、 水平上研究物质 、 、 、 、 和应用的自然科学。2、化学具有 、 特点。化学不但能 分子还能 分子因此具有创造性。3、化学发展史经历了 、 、 三个阶段,近代化学发展史上的四个里程碑事件是 。 重温教材,总结出答案。原子、分子质组成、结构、性质、变化、制备2创造性、实用性认识分子、制造分 3、古代化学、近代化学、现代化学 提出化学元素学说、燃烧的氧化学说、原子学说、发现元素周期律 引导学生重温教材,复习回顾第一节四个知识点
第一节知识点强化练习2分钟 通过多媒体展示学案中的强化练习习题,提问学生回答答案,做出必要的讲评和纠正。判断下列说法的正误:1、人们可以利用化学变化制造出新的原子和新的分子。( )2、化学家可以制造出自然界中不存在的物质。( ) 3、在近代化学发展史中,英国的科学家道尔顿首先提出化学元素概念,其后英国化学家波义尔提出原子学说。( )4、化学研究及新物质的合成,只会造成严重的环境污染,给人类带来更多的疑难病症。 读题并做出以下判断:错对错错注 ( http: / / www.21cnjy.com )意*:在近代化学发展史上英国科学家波义尔和道尔顿做出了重大贡献,波义尔先提出了化学元素的概念,标志着近代化学的诞生;而后道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。 通过四个判断题强化第一节知识点的复习。通过纠正进一步强调英、法、英、俄等国的科学家在近代化学发展史上的贡献。
复习回顾第二节知识点 一、钠的性质回顾 3分钟二、氯气性回顾3分钟 通过多媒体展示提出以下问题 并展示出正确答案研究物质性质的基本方法有: 、 、 、 。钠的物理性: 色、熔沸点低、硬度 、密度 于煤油 于水。少量钠保存在 中。钠与水现象:钠 在水面上, 化成明亮的小球,四处 动,发出嘶嘶声 ,滴加一滴无色酚酞得 色溶液。,该反应的产物为 和 。钠与氧气反应的产物可能为 和 。研究物质性质的一般程序: 、 、 、 。氯气的物理性质:氯气是一种 色 气味有毒气体。溶于水后与水反应生成 和 称为 ,其颜色为 色。氯水中的三种溶质是: 、 、 ;三种分子是: 、 、 ;四种离子是: 、 、 、 。;铁在氯气中燃烧产生 色浓烟铜在氯气中燃燃产生 色浓烟,产物水溶液呈 色。氢气在氯气中产生 色火焰,集气瓶口有白 。氯气与碱反应产物有: 、 、 次氯酸有 性 性 性。 重温教材,总结回答答案。观察、实验、比较、分类。2、银白、小、大于、小于煤油浮、熔、游、响、红。氢氧化钠、氢气3、氧化钠、过氧化钠观察、预测、实验、结论。黄绿、刺激盐酸、次氯酸 浅黄绿氯气、盐酸、次氯酸Cl2 H2O HClOH+、 OH- 、Cl- 、ClO-棕红棕黄蓝绿苍白白雾盐酸盐、次氯酸盐、水酸性、不稳定性、漂白性 回顾钠的物理性质和化学性质回顾钠的物理性质和化学性质
第二节知识点强化练一、钠和氯气性质方程式书写5分钟二、钠和氯气性质实验考察题强化练习9分钟 通过多媒体展示学案中的强化练习习题,提问学生回答答案,做出必要的讲评和纠正。提两名学生上黑板完成钠和氯气化学性质的方程式。其他同学在学案上完成。重点强调过氧化钠与水和二氧化碳的反应。二、引导学生完成学案中以下三道思考题:钠放入三氯化铁溶液中,钠先于水反应,反应方程式为: ,生产的NaOH再与FeCl3,反应方程式为: 总反应方程式为: , 所有的反应现象为: 。某谈黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂,根据下图所示转化关系及现象填空。 CO2 + 淡黄色粉末 ↓反应I ↓ ↓ 气体 固体 X粉末 Ca(OH)2溶液 ↓ ↓反应II黑色固体 稀H2SO4 ↓蓝色溶液 + 溶液 沉淀 ↓反应III 沉淀 淡黄色粉末为: X粉末的名称为: 反应I方程式为: 反应II方程式为: 某同学按下图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题A中现象是 B中现象是 结论是 C作用是 反应是 。 学生在黑板完成学案上方程式书写:第一位学生:Na+H2O—Na+O2 — Na2O Na+O2 —— Na2O2Na2O2+H2O—Na2O2+CO2—第二组学生:1、Cu+Cl2—2、Fe+Cl2—3、H2+Cl2—4、H2O+Cl2—5、NaOH+ Cl2— 在学案上完成三道思考题,回答答案。过氧化钠 / Na2O2铜粉 / 不可填化学式Cu2Na2O2+2CO2=2Na2CO3+O2布条不褪色布条褪色干燥的氯气无漂白性,氯气与水反应的产物有漂白性 巩固钠和氯气的化学性质培养提高强化学生化学方程式的书写能力明确强化钠与盐溶液反应的实质及现象巩固过氧化钠的性质与应用,培养学生图标推理分析能力,强化学生按要求填写答案的习惯巩固氯气和次氯酸的性质,使学生明确实验法研究物质性质的目的性和针对性
复习回顾第三节知识点 5分钟 二、在练习的基础上师生共同推导小结出下列四组公式1、n= N/NA=m/ M=V/Vm=C(B) .V(溶液)2、N= n. = N/ .NA=V/ .NA3、m=n. = N/ .M=V/ .M4、V=n. = N/ .Vm=m/ . Vm 一、在教师引导下完成学案中下列习题已知下列4份CO2气体,分别求出他们的物质的量、粒子数、质量,标况下体积1234物质的量0.5mol粒子数12.06 ×1023质量88g标况体积33.6L 通过公式推导,回顾物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念的定义和应用。
第二节知识点强化练10分钟 通过多媒体展示学案中的强化练习习题,提问学生回答答案,做出必要的讲评和纠正。1、下列物质中所含分子数一定相同的是 。A、1克氢气和8克氧气B、0.1molHCl和22.4LHeC、180℃101KPa时18L水和18LCO2D、22g CO2和3.01×1022个CO2。2、标准状况下,nL HCl 气体溶于m ( http: / / www.21cnjy.com )mLH2O中得密度为p g.cm-3的R L的盐酸,则此盐酸的物质的量浓度为 。A. n/(22.4R) mol·L-1 B. 1000np/(36.5n+22.4m) mol·L-1C. n/22.4 mol·L-1 D. 1000p/(36.5n+22.4m) mol·L-13、在2L含2molH2SO4和2molMgSO4的溶液中,求;C(H2SO4)= C(MgSO4)= C(H+)= C(Mg2+)= C(SO42-)= 在含H2SO4和MgSO4的混合溶液中已知C(H+)=2mol/LC(SO42-)=2mol/L求:C(Mg2+)= 在学案上完成4道题,回答答案。C180℃101KPa时18L水为气体,三同定一同22.4Lhe的物质的量不是0.1mol,注意气体的四个参量中三量定一量2、答案:A B3、1mol/L 1mol/L2mol/L 1mol/L2mol/L1mol/L 强化学生审题和分析问题能力培养学生计算推理能力强化混合液中溶质物质的量浓度计算和离子浓度的计算
板书设计 学生板书(主板): 点燃4Na+O2=2Na2O Na+O2 = Na2O2 2Na+2H2O=2NaOH+H2↑ 浮、游、熔、响、红2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2点燃 点燃 点燃2Fe+3Cl2 =====2FeCl3 Cu+ Cl2 ======== Cu Cl2 H2+Cl2======= 2HCl 棕红 棕黄 苍白 白雾Cl2+H2O=HCl+HClO2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O教师板书(主板):1、n= N/NA=m/ M=V/Vm=C(B) .V(溶液)2、N= n. NA = N/ M.NA=V/ Vm NA3、m=n. M = N/NA.M=V/ Vm.M4、V=n. Vm = N/ NA .Vm=m/ M . Vm
教后记 通过教学检测发现,实验法研究物质(主要 ( http: / / www.21cnjy.com )是本章的钠和氯气)性质是学生学习掌握的一个薄弱点,表现在学生对研究物质性质的实验考查题不能明确实验设计的目的性和针对性,甚至分析不出实验原理。对于物质的量、摩尔质量、气体摩尔体积和物质的量浓度这四个物理量的计算,学生在学习之处不能熟练灵活进行,要在以后的教学中进一步强化练习。
附 化学必修1第一章复习总结(学案)
第一节走进化学科学
一、阅读回顾教材完成下列填空:
1、 化学是一门在 、 水平上研究物质 、 、
、 、 和应用的自然科学。
2、化学具有 、 特点。化学不但能 分子还能 分子因此具有创造性。
3、化学发展史经历了 、 、 三个阶段,近代化学发展史上的四个里程碑事件是 。
二、判断下列说法的正误:
1、人们可以利用化学变化制造出新的原子和新的分子。( )
2、化学家可以制造出自然界中不存在的物质。( )
3、在近代化学发展史中,英国的科学家道尔顿首先提出化学元素概念,其后英国化学家波义尔提出原子学说。( )
4、化学研究及新物质的合成,只会造成严重的环境污染,给人类带来更多的疑难病症。( )
第二节 节研究物质性质的方法和程序
一、回顾 钠的性质,完成下列填空
1、 研究物质性质的基本方法有: 、 、 、 。
2、 钠的物理性: 色、熔 ( http: / / www.21cnjy.com )沸点低、硬度 、密度 于煤油 于水。少量钠保存在 中。钠与水现象:钠 在水面上, 化成明亮的小球,四处 动,发出嘶嘶声 ,滴加一滴无色酚酞得 色溶液。该反应的产物为 和 。
3、 钠与氧气反应的产物可能为 和 。
二、回顾氯气的性质,完成下列填空
1、 研究物质性质的一般程序: 、 、 、 。
2、 氯气的物理性质:氯气是一种 色 气味有毒气体。溶于水后与水反应生成 和 称之为 ,其颜色为 色。氯水中的三种溶质是: 、 、 ;三种分子是: 、 、 ;
四种离子是: 、 、 、 。;
3、 铁在氯气中燃烧产生 ( http: / / www.21cnjy.com ) 色浓烟;铜在氯气中燃燃产生 色浓烟,产物水溶液呈 色。氢气在氯气中产生 色火焰,集气瓶口有 。
4、 氯气与碱反应产物有: 、 、
5、 次氯酸有 性 性 性。
三、完成下列钠反应方程式书写:
Na+H2O—
Na+O2 — Na2O
3 、Na+O2 —— Na2O2
4、Na2O2+H2O—
5、Na2O2+CO2—
四、完成下列氯气反应方程式书写:
1、Cu+Cl2—
2、Fe+Cl2—
3、H2+Cl2—
4、H2O+Cl2—
5、NaOH+ Cl2—
五、完成下三道思考题:
1、 钠放入三氯化铁溶液中,钠先于水反应,反应方程为 ,
生产的NaOH再与FeCl3,反应方程式为: ;
总反应方程式为: 。
所有的反应现象为 。
2、某谈黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂,根据下图所示转化关系及现象填空。
淡黄色粉末为:
X粉末的名称为:
CO2 + 淡黄色粉末的反应方程式为:
固体与Ca(OH)2溶液反应的方程式为:
3、某同学按下图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题
A中现象是 B中现象是
结论是
C作用是 反应是 。
第三节、物质的量
一、已知下列4份CO2气体,分别求出他们的物质的量、粒子数、质量,标况下体积
1 2 3 4
物质的量 0.5mol
粒子数 12.06 ×1023
质量 88g
标况体积 33.6L
二、完成下列四组公式1、n= N/NA=m/ M=V/Vm=C(B) .V(溶液) 2、N= n. = N/ .NA=V/ .NA
3、m=n. = N/ .M=V/ .M 4、V=n. = N/ .Vm=m/ . Vm
三、完成下列思考题
1、下列物质中所含分子数一定相同的是 。
A、1克氢气和8克氧气 B、0.1molHCl和22.4LHe
C、180℃101KPa时18L水和18LCO2 D、22g CO2和3.01×1022个CO2。
2、标准状况下,nL H ( http: / / www.21cnjy.com )Cl 气体溶于m mLH2O中得密度为p g.cm-3的R L的盐酸,则此盐酸的物质的量浓度为 。
A. n/(22.4R) mol·L-1 B. 1000np/(36.5n+22.4m) mol·L-1
C. n/22.4 mol·L-1 D. 1000p/(36.5n+22.4m) mol·L-1
3、在2L含2molH2SO4和2molMgSO4的溶液中,求;
C(H2SO4)= C(MgSO4)= C(H+)= C(Mg2+)=
C(SO42-)=
4、在含H2SO4和MgSO4的混合溶液中已知C(H+)=2mol/L C(SO42-)=2mol/L
求:C(Mg2+)=
Cl2→
A B C
X粉末 稀H2SO4
→气体 黑色固体 蓝色溶液
CO2 + 淡黄色粉末→ 沉淀
Ca(OH)2溶液 溶液
→固体
沉淀
Cl2→
A B C
