2024年九年级中考化学专题复习:计算题 (含解析)
文档属性
| 名称 | 2024年九年级中考化学专题复习:计算题 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-28 22:26:12 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
2024年九年级中考化学专题复习:计算题
1.中药是中华民族优秀传统文化的重要组成部分,桂皮中富含的肉桂醛(化学式)有健脾暖胃、祛除风寒等功效。计算:
(1)肉桂醛的相对分子质量为 ;
(2)肉桂醛中碳、氢、氧三种元素的质量比为 (填最简比);
(3)肉桂醛中所含氢元素的质量为 g;
(4)杏仁中富含苯甲醛,其氧元素的质量分数比肉桂醛中氧元素的质量分数 (填“高”或“低”)。
2.香烟的烟气中含有许多强致癌物和有害物,其中对人体毒害作用最大的有尼古丁,化学式为,请计算:
(1)尼古丁的相对分子质量是 ;
(2)尼古丁中碳、氢、氮三种元素质量比是 (填最简比);
(3)尼古丁中碳元素的质量分数是 (精确到)。
3.“碳捕捉技术”可利用氢氧化钠溶液来吸收CO2,从而实现CO2减排。若用40kg溶质质量分数为20%的氢氧化钠溶液来吸收CO2并制备碳酸钠。(反应方程式为:)
(1)40kg溶质质量分数为20%的氢氧化钠溶液中溶质的质量为 kg。
(2)理论上可“捕捉”CO2的质量为多少?(写出完整步骤)
4.化肥、农药对提高农作物产量有重要作用。
(1)现有常见的化肥:①、②、③、④,其中属于复合肥的是 (填序号,下同),不能与碱性物质混合使用的是 。
(2)波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。某工厂用以下反应:来生产硫酸铜。
①在制得80kg硫酸铜时,若恰好消耗某稀硫酸的质量是400kg,则该稀硫酸中溶质的质量分数是多少? (写出计算过程)
②若用98%的浓硫酸配制上述生产所用的稀硫酸,稀释时需要水的质量是 kg。
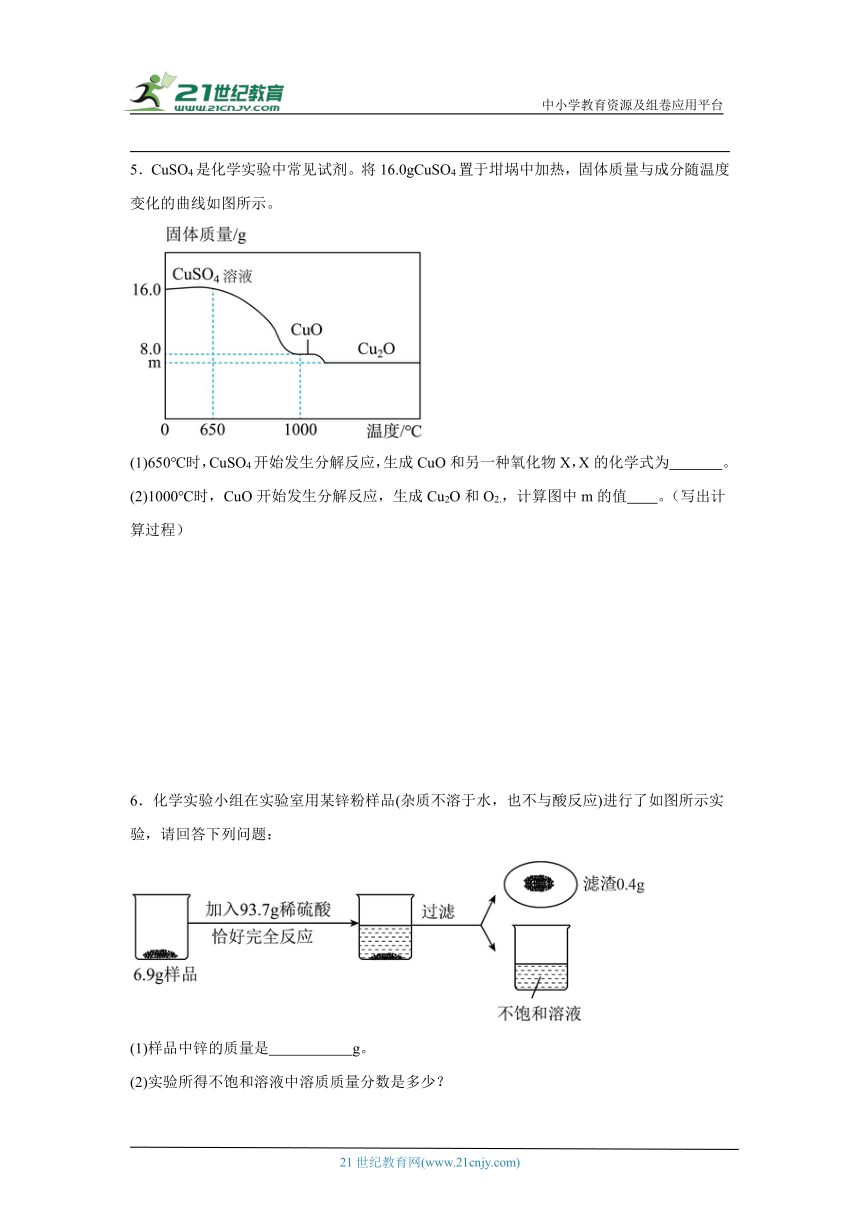
5.CuSO4是化学实验中常见试剂。将16.0gCuSO4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
(1)650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为 。
(2)1000℃时,CuO开始发生分解反应,生成Cu2O和O2.,计算图中m的值 。(写出计算过程)
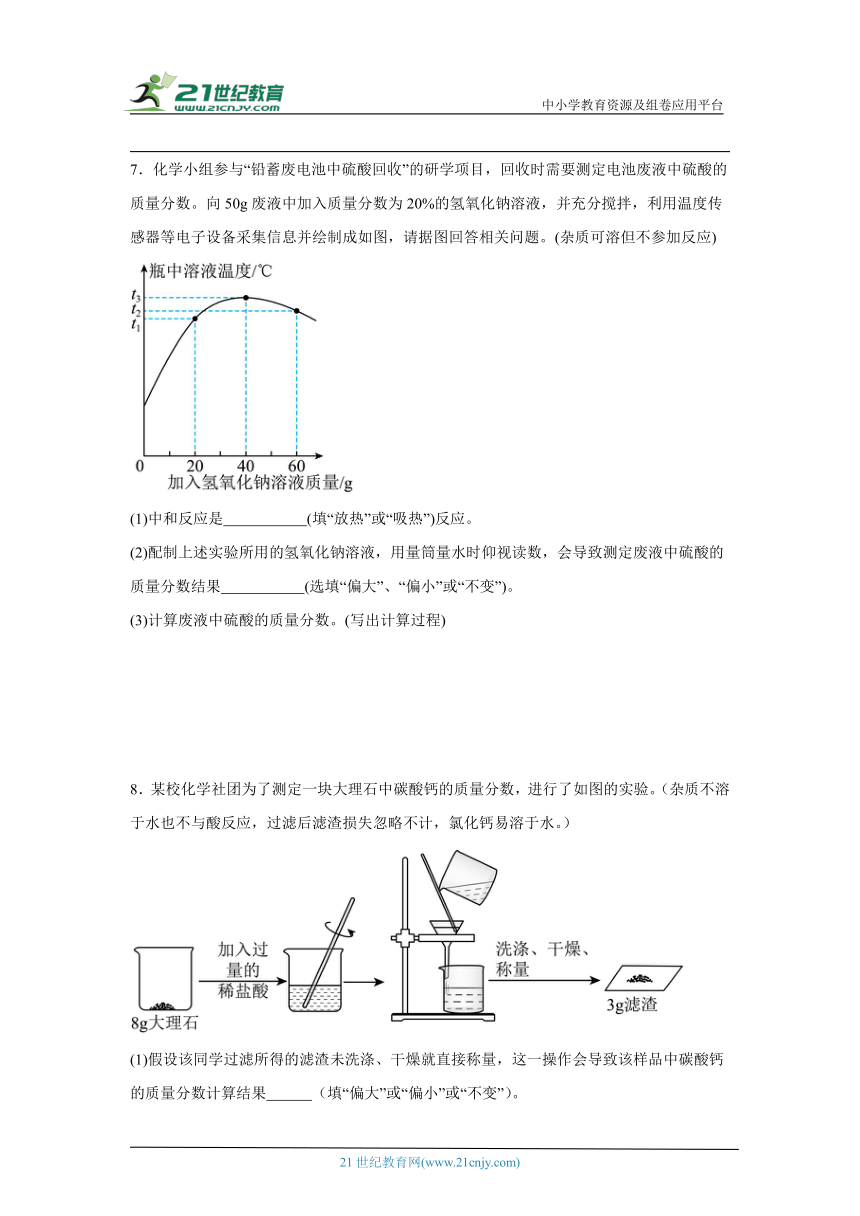
6.化学实验小组在实验室用某锌粉样品(杂质不溶于水,也不与酸反应)进行了如图所示实验,请回答下列问题:
(1)样品中锌的质量是 g。
(2)实验所得不饱和溶液中溶质质量分数是多少?
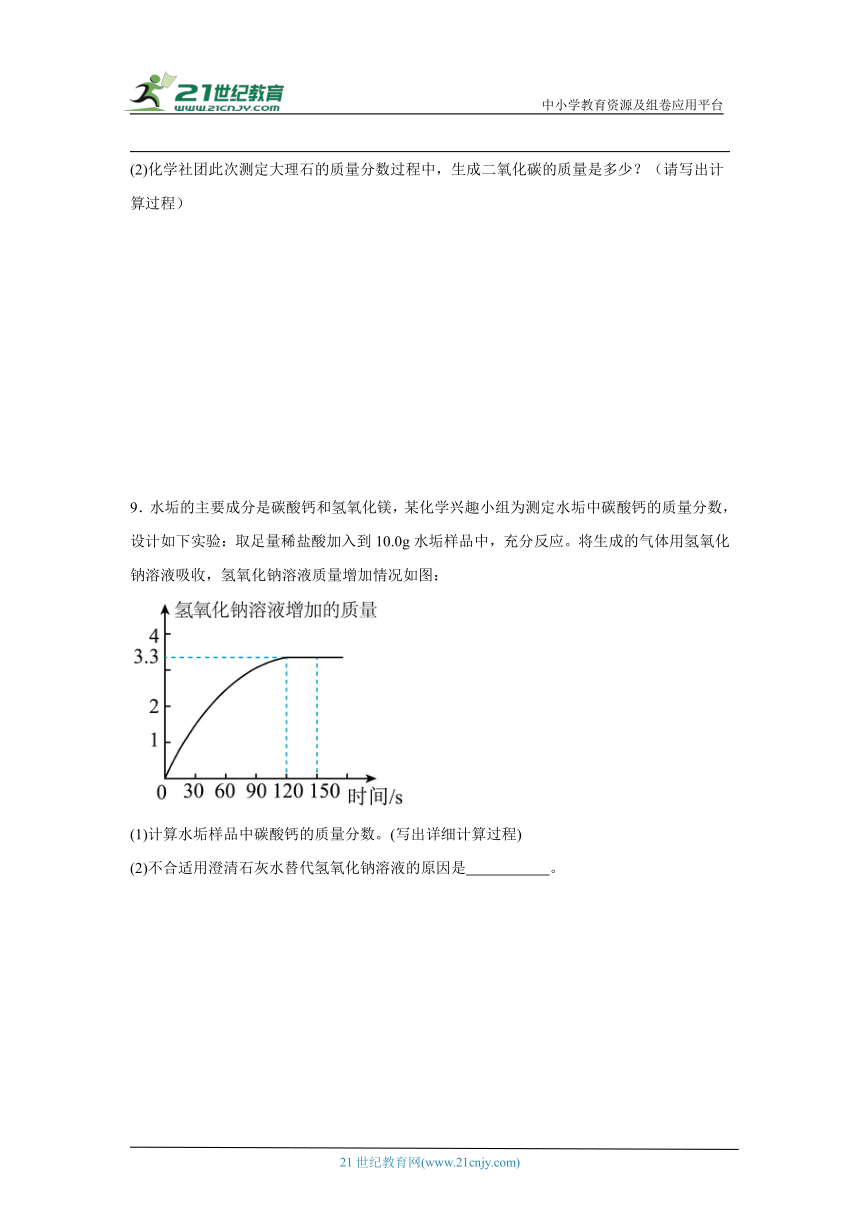
7.化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向50g废液中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)中和反应是 (填“放热”或“吸热”)反应。
(2)配制上述实验所用的氢氧化钠溶液,用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果 (选填“偏大”、“偏小”或“不变”)。
(3)计算废液中硫酸的质量分数。(写出计算过程)
8.某校化学社团为了测定一块大理石中碳酸钙的质量分数,进行了如图的实验。(杂质不溶于水也不与酸反应,过滤后滤渣损失忽略不计,氯化钙易溶于水。)
(1)假设该同学过滤所得的滤渣未洗涤、干燥就直接称量,这一操作会导致该样品中碳酸钙的质量分数计算结果 (填“偏大”或“偏小”或“不变”)。
(2)化学社团此次测定大理石的质量分数过程中,生成二氧化碳的质量是多少?(请写出计算过程)
9.水垢的主要成分是碳酸钙和氢氧化镁,某化学兴趣小组为测定水垢中碳酸钙的质量分数,设计如下实验:取足量稀盐酸加入到10.0g水垢样品中,充分反应。将生成的气体用氢氧化钠溶液吸收,氢氧化钠溶液质量增加情况如图:
(1)计算水垢样品中碳酸钙的质量分数。(写出详细计算过程)
(2)不合适用澄清石灰水替代氢氧化钠溶液的原因是 。
10.“中国天眼”是世界上口径最大的单天线射电望远镜,其“眼镜片”由金刚砂(SiC)制造。生产SiC的化学方程式为SiO2+3CSiC+2CO↑。
(1)SiO2中Si元素的化合价为 。
(2)生产160kg 的SiC,理论上消耗C的质量为多少?
11.材料在人类发展的历史长河中起着非常重要的作用。
(1)金属氧化物加热分解。
加热氧化银(Ag2O)得到银和氧气,写出该反应的化学方程式 。
(2)一定条件下,金属化合物与一些具有还原性的物质发生反应。
木炭还原氧化铜反应的化学方程式是 。
(3)电解法冶炼。
工业上电解熔融氯化钠得到钠和氯气。利用该反应制取46kg金属钠,需要氯化钠的质量至少是 。(根据化学方程式计算,写出计算过程)
12.合金常用来制造机械零件、仪表和日用品。某化学研究小组取10g黄铜(铜、锌合金)进行实验,加入61.7g稀盐酸后恰好完全反应,反应后称得烧杯内剩余物质的总质量为71.5g。请计算:
(1)生成氢气的质量为 g。
(2)反应后所得溶液的溶质质量分数(写出计算过程)。
13.向盛有CuSO4和H2SO4混合溶液的烧杯中,加入过量BaCl2溶液,充分反应再滴加溶质质量分数为10.0%的NaOH溶液,烧杯中沉淀质量与滴加NaOH溶液质量的关系如图所示。请回答下列问题:
(1)m2是指 沉淀的质量。
(2)求完全反应后生成氢氧化铜的质量。(写出计算过程)
14.缺钙会导致儿童发育不良。小兵同学从食物中摄入钙元素的量不足,每天需要服用3片某种钙片。该钙片标签的部分内容如图所示(假设钙片中只有碳酸钙含有钙元素),请计算:
(1)碳酸钙中含有 种元素。
(2)碳酸钙的相对分子质量 。
(3)小兵同学每天从钙片中摄入钙元素的质量 。
(4)如果小兵同学改用喝牛奶(每100mL牛奶中含钙0.10g)来补充钙,每天至少需要喝多少毫升牛奶。
15.为测定某赤铁矿样品中氧化铁的质量分数,取该样品12.0g(杂质不溶于水,且不与酸反应)于烧杯中,慢慢加入100g稀盐酸充分反应。所加稀盐酸的质量与烧杯中剩余固体的质量关系如图所示。
(1)反应过程中除观察到红棕色固体部分溶解外,还可以观察到的现象是 。
(2)计算所用稀盐酸中溶质的质量分数。(请写出计算过程)
16.氯气和氢氧化钠都是非常重要的化工原料,氯碱工业是可以同时获取它们的常用化工方法,其反应原理为:2NaCl+2H2O2NaOH+H2↑+Cl2↑。现有117g质量分数为20%的食盐水,将其中的氯化钠完全电解,试回答下列问题并计算:
(1)氢氧化钠的俗称 ;它具有一定的腐蚀性,若实验时不小心沾在手上了,应该及时用大量水冲洗并涂上 溶液。
(2)Cl2通常可以用来制备盐酸,打开浓盐酸试剂瓶口通常容易出现 (写出现象)。
(3)电解后,溶液中氢氧化钠的质量是多少?(写出计算过程)
17.某化肥厂生产的一种氮肥,其成分是NH4NO3和NH4Cl的混合物。为测定两种成分的含量,同学们做了以下实验:取16g该化肥样品于烧杯中,加入112.7g水完全溶解后,加入100g AgNO3溶液恰好完全反应,过滤,得到白色固体和200g滤液。
(1)NH4NO3中氮元素和氧元素的质量比为 (填最简整数比)。
(2)化肥样品中NH4Cl的质量分数(结果精确到0.1%)。
(3)求实验后得到的200g滤液中溶质的质量分数(结果精确到0.1%)。
18.二氧化锰因应用广泛而备受关注。某研究小组采用如图装置通过焙烧MnCO3制取MnO2,发生反应的化学方程式为:。
(1)固体中 元素的质量减少。
(2)加热至 ℃时,MnO2开始分解。
(3)根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是多少?(请写出计算过程)
(4)A点的固体物质成分是 (填化学式)。
19.铁铜金属粉末常用于生产机械零件。为测定某铁铜金属粉末中铁粉的含量,取20g样品于烧杯中,逐滴加入稀硫酸充分反应后,测得固体质量随加入稀硫酸的质量关系如图所示。计算:
(1)该金属粉末中铁粉的质量分数。
(2)生成氢气的质量。
(3)恰好完全反应时,所得溶液中溶质的质量分数。
20.某学习小组的同学取Na2SO4和MgSO4的固体混合物40g放入烧杯中,加入113.6g水使其完全溶解,再滴加溶质质量分数一定的NaOH溶液,反应过程中滴加NaOH溶液的质量与生成沉淀的质量关系如图所示。请计算:
(1)m的值为 。
(2)当滴加NaOH溶液质量为 g时,恰好完全反应。
(3)恰好完全反应时,所得溶液中溶质的质量分数。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
参考答案:
1.(1)132
(2)
(3)1.6
(4)高
【详解】(1)肉桂醛的相对分子质量为12×9+1×8+16=132;
(2)肉桂醛中碳、氢、氧三种元素的质量比为(12×9):(1×8):16=27:2:4,;
(3)26.4g 肉桂醛中所含氢元素的质量为;
(4)苯甲醛 的化学式为C7H8O,肉桂醛 的化学式为C9H8O ,观察化学式可知,一个分子中所含有的氧原子个数相同,相对分子质量越大,其氧元素的质量分数越小,苯甲醛的相对分子质量比肉桂醛小,故苯甲醛中氧元素的质量分数比肉桂醛中氧元素的质量分数高。
2.(1)162
(2)60:7:14
(3)74.1%
【详解】(1)尼古丁的相对分子质量=,故填:162;
(2)尼古丁中碳、氢、氮三种元素质量比,故填:60:7:14;
(3)尼古丁中碳元素的质量分数为,故填:74.1%。
3.(1)8
(2)解:设理论上可以“捕捉”二氧化碳的质量为x,
答:理论上可“捕捉”CO2的质量为4.4kg。
【详解】(1)40kg溶质质量分数为20%的氢氧化钠溶液中溶质的质量为40kg×20%=8kg,故填:8kg;
(2)见答案。
4.(1) ②④ ①④
(2) 解:设反应消耗的硫酸的质量为x。
解得:x= 49kg
稀硫酸的溶质的质量分数分为×100%=12.25% 350
【详解】(1)复合肥:含有氮、磷、钾元素中的两种及以上的肥料。①(NH4)2SO4含有N,属于氮肥;②KNO3含有K、N,属于复合肥;③CO(NH2)2含有N,属于氮肥;④NH4H2PO4含有P、N属于复合肥;因为铵根离子会与碱性物质反应放出氨气,所以不能混合使用,属于有铵根离子的是①(NH4)2SO4;④NH4H2PO4。故填:②④;①④。
(2)①见答案;
②设所用浓硫酸的质量是y,y×98%=400g×12.25%,解得y=50g,则需要水的质量是400g-50g=350g。
5.(1)SO3
(2)7.2g
解:设生成Cu2O的质量为m
答:图中m的值7.2g。
【详解】(1)650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,根据质量守恒定律,化学反应前后,元素的种类和质量不变,另一氧化物中一定含硫元素,硫元素的质量为16.0g×=3.2g,则另一氧化物中氧元素的质量为16.0g-3.2g-8.0g=4.8g,设该氧化物的化学式为SaOb,则有32a:16b=3.2g:4.8g,得a:b=1:3,故该氧化物的化学式为SO3;
(2)见答案。
6.(1)
(2)解:设反应生成的硫酸锌的质量为,生成氢气的质量为。
则实验所得不饱和溶液中溶质质量分数为
答:实验所得不饱和溶液中溶质质量分数是。
【详解】(1)根据图示可知,锌粉样品质量为,当恰好完全反应后,剩余滤渣的质量为,则参加反应的锌粉的质量为:;故填:;
(2)见答案。
7.(1)放热
(2)偏大
(3)解:该反应放热,温度达到最高点时,说明恰好完全反应,此时溶液的温度为t3℃,消耗氢氧化钠溶液的质量为40g,设废液中硫酸的质量为x,
解得x=9.8g
则废液中硫酸的质量分数为:,
答:废液中硫酸的质量分数为19.6%。
【详解】(1)由图可知,加入氢氧化钠溶液后,氢氧化钠和硫酸反应生成硫酸钠和水,溶液温度升高,则说明中和反应为放热反应;
(2)用量筒量水时仰视读数,读数偏小,则实际量取的水的体积偏多,会导致配制的氢氧化钠溶液质量分数偏小,则通过图示数据计算出的硫酸质量偏大导致质量分数偏大,故填:偏大;
(3)见答案。
8.(1)偏小
(2)解:根据题意,大理石中碳酸钙的质量为8g-3g=5g;
设生成二氧化碳的质量为x
解得x=2.2g
答:生成二氧化碳的质量是2.2g。
【详解】(1)若滤渣未洗涤、干燥就直接称量,则会使滤渣因为含有杂质而使得滤渣质量偏大,会导致该样品中碳酸钙的质量分数计算结果偏小。故填偏小;
(2)见答案;
9.(1)解:设水垢样品中碳酸钙的质量为x。
x=7.5g
水垢样品中碳酸钙的质量分数=
答:水垢样品中碳酸钙的质量分数为75.0%。
(2)石灰水中氢氧化钙浓度低,不利于完全吸收二氧化碳气体
【详解】(1)碳酸钙和盐酸反应生成二氧化碳,根据图示可知,水垢完全反应后生成二氧化碳的质量为3.3g,根据二氧化碳的质量、化学方程式可计算出碳酸钙的质量,从而求出碳酸钙的质量分数,详见答案;
(2)石灰水中氢氧化钙浓度低,不利于完全吸收二氧化碳气体,氢氧化钠的溶解度大,氢氧化钠溶液浓度大,可以用氢氧化钠溶液吸收二氧化碳。
10.(1)+4
(2)设生产160kg 的SiC,理论上消耗C的质量为x,则
x=144kg
答:生产160kg 的SiC,理论上消耗C的质量为144kg。
【详解】(1)SiO2中,氧元素化合价为-2价,设硅元素化合价为x,根据“化合物中各元素化合价代数和为零”,则x+(-2)×2=0,解得x=+4。
(2)见答案。
11.(1)2Ag2O4Ag+O2↑
(2)2CuO+C2Cu+CO2↑
(3)设需要氯化钠的质量至少是x,
x=117kg
答:制取46kg金属钠,至少需要117 kg的氯化钠。
【详解】(1)加热氧化银(Ag2O)得到银和氧气,反应的化学方程式为:2Ag2O4Ag+O2↑;
(2)碳和氧化铜在高温下生成铜和二氧化碳,反应的化学方程式为:2CuO+C2Cu+CO2↑;
(3)见答案。
12.(1)0.2
(2)设参加反应Zn的质量为x,生成ZnCl2的质量为y,则
、
x=6.5g、y=13.6g
反应后溶液的质量为71.5-(10-6.5)=68g,其中溶质质量分数为
答:反应后溶液的溶质质量分数为20%。
【详解】(1)反应前后物质的总质量不变,则生成氢气的质量为10g+61.7g-71.5g=0.2g。
(2)见答案。
13.(1)硫酸钡/BaSO4
(2)解:由题意可知加入80g氢氧化钠溶液质量时,无沉淀产生,是氢氧化钠与硫酸反应;又加入40g氢氧化钠溶液,此时才生成沉淀,是氢氧化钠溶液和硫酸铜反应产生氢氧化铜沉淀。
设生成的氢氧化铜沉淀的质量为x
x=4.9g
答:完全反应后生成氢氧化铜4.9g。
【详解】(1)由题意可知,先向溶液中加入氯化钡溶液,氯化钡中的钡离子和原溶液中的硫酸根离子反应生成硫酸钡沉淀,故m2是硫酸钡的质量;
(2)见答案。
14.(1)3/三
(2)100
(3)0.36g
(4)小兵同学每天从钙片中摄入钙元素的质量为0.36g,每100mL牛奶中含钙0.10g,
则每天至少需要喝牛奶的体积为;
答:每天至少需要喝360毫升牛奶。
【详解】(1)碳酸钙中含有钙、碳、氧三种元素;
(2)碳酸钙的相对分子质量是40+12+16×3+16=100;
(3)根据题意,每天需要服用3片某种钙片,每片含碳酸钙0.3g,则每天从钙片中摄入钙元素的质量为0.3g/片×3片××100%=0.36g;
(4)见答案。
15.(1)无色溶液变为黄色
(2)设75g稀盐酸中溶质质量为x。
解得:x=10.95g
所用稀盐酸中溶质的质量分数为:×100%=14.6%
答:稀盐酸中溶质的质量分数为14.6%。
【详解】(1)氧化铁与盐酸反应生成氯化铁和水,反应过程中除观察到红棕色固体部分溶解外,还可以观察到的现象是:无色溶液变为黄色。故填:无色溶液变为黄色。
(2)见答案。
16.(1) 烧碱/火碱/苛性钠 硼酸/H3BO3
(2)白雾
(3)解:设电解后,溶液中氢氧化钠的质量是x
x=16g
答:电解后,溶液中氢氧化钠的质量是16g
【详解】(1)氢氧化钠俗称烧碱、火碱、苛性钠;
氢氧化钠具有一定的腐蚀性,若实验时不小心沾在手上了,应该及时用大量水冲洗并涂上硼酸溶液,酸碱中和;
(2)浓盐酸具有挥发性,挥发出的氯化氢与空气中的水蒸气结合成盐酸,故打开浓盐酸试剂瓶口通常容易出现白雾;
(3)见答案。
17.(1)7:12
(2)66.9%
解:根据质量守恒定律,溶液减少的质量为生成氯化银沉淀的质量,则氯化银沉淀的质量为16g+112.7g+100g-200g=28.7g;设化肥样品中NH4Cl的质量为x,生成NH4NO3的质量为y,
化肥样品中NH4Cl的质量分数为;
(3)10.7%
实验后得到的200g滤液中溶质的质量分数为≈10.7%;
答:(2)化肥样品中NH4Cl的质量分数为66.9%;
(3)实验后得到的200g滤液中溶质的质量分数10.7%。
【详解】(1)NH4NO3中氮元素和氧元素的质量比为(14×2):(16×3)=7:12,故填:7:12;
(2)见答案;
(3)见答案。
18.(1)氧
(2)300
(3)设最多制得的MnO2的质量是x,
x=34.8g
答:最多制得的MnO2的质量是34.8g
(4)MnO2和Mn2O3
【详解】(1)MnO2中锰元素与氧元素的质量比为55:(16×2)=55:32,MnO中锰元素与氧元素的质量比为55:16=55:16,所以固体中氧元素的质量减少;
(2)由图可知,当温度高于300℃,MnO2会分解;
(3)见答案;
(4)据图可知,A点是MnO2没有完全分解,故是MnO2和Mn2O3的混合物。
19.(1)根据图像可知,最后剩余的6g固体是不与稀硫酸反应的铜,则混合物中铁的质量为20g-6g=14g;
该金属粉末中铁粉的质量分数为;
答:该金属粉末中铁粉的质量分数70%。
(2)解:设生成氢气的质量为x,生成硫酸亚铁的质量为y,
解得x=0.5g;
解得y=38g;
答:生成氢气的质量为0.5g。
(3)恰好完全反应时,所得溶液中溶质的质量分数为,
答:恰好完全反应时,所得溶液中溶质的质量分数为33.5%。
【详解】(1)见答案;
(2)见答案;
(3)见答案。
20.(1)5.8
(2)80
(3)解:设硫酸镁的质量为x,生成硫酸钠的质量为y。
答:恰好完全反应时,所得溶液中溶质的质量分数为20%。
【详解】(1)通过题干和图示得知,因为该体系中仅有一个反应就是硫酸镁和氢氧化钠的反应,且所滴加NaOH溶液的质量是依次以20g进行增加的,故产生沉淀的质量也应该以2.9进行递增,所以m=2.9+2.9=5.8;
(2)观察图示得知,在滴加NaOH溶液的质量为80g时,产生沉淀的质量达到最大值11.6g,之后再滴加NaOH溶液产生沉淀的质量也不增加,所以当滴加NaOH溶液质量为80g,时,恰好完全反应;
(3)见答案。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
中小学教育资源及组卷应用平台
2024年九年级中考化学专题复习:计算题
1.中药是中华民族优秀传统文化的重要组成部分,桂皮中富含的肉桂醛(化学式)有健脾暖胃、祛除风寒等功效。计算:
(1)肉桂醛的相对分子质量为 ;
(2)肉桂醛中碳、氢、氧三种元素的质量比为 (填最简比);
(3)肉桂醛中所含氢元素的质量为 g;
(4)杏仁中富含苯甲醛,其氧元素的质量分数比肉桂醛中氧元素的质量分数 (填“高”或“低”)。
2.香烟的烟气中含有许多强致癌物和有害物,其中对人体毒害作用最大的有尼古丁,化学式为,请计算:
(1)尼古丁的相对分子质量是 ;
(2)尼古丁中碳、氢、氮三种元素质量比是 (填最简比);
(3)尼古丁中碳元素的质量分数是 (精确到)。
3.“碳捕捉技术”可利用氢氧化钠溶液来吸收CO2,从而实现CO2减排。若用40kg溶质质量分数为20%的氢氧化钠溶液来吸收CO2并制备碳酸钠。(反应方程式为:)
(1)40kg溶质质量分数为20%的氢氧化钠溶液中溶质的质量为 kg。
(2)理论上可“捕捉”CO2的质量为多少?(写出完整步骤)
4.化肥、农药对提高农作物产量有重要作用。
(1)现有常见的化肥:①、②、③、④,其中属于复合肥的是 (填序号,下同),不能与碱性物质混合使用的是 。
(2)波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。某工厂用以下反应:来生产硫酸铜。
①在制得80kg硫酸铜时,若恰好消耗某稀硫酸的质量是400kg,则该稀硫酸中溶质的质量分数是多少? (写出计算过程)
②若用98%的浓硫酸配制上述生产所用的稀硫酸,稀释时需要水的质量是 kg。
5.CuSO4是化学实验中常见试剂。将16.0gCuSO4置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
(1)650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,X的化学式为 。
(2)1000℃时,CuO开始发生分解反应,生成Cu2O和O2.,计算图中m的值 。(写出计算过程)
6.化学实验小组在实验室用某锌粉样品(杂质不溶于水,也不与酸反应)进行了如图所示实验,请回答下列问题:
(1)样品中锌的质量是 g。
(2)实验所得不饱和溶液中溶质质量分数是多少?
7.化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向50g废液中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)中和反应是 (填“放热”或“吸热”)反应。
(2)配制上述实验所用的氢氧化钠溶液,用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果 (选填“偏大”、“偏小”或“不变”)。
(3)计算废液中硫酸的质量分数。(写出计算过程)
8.某校化学社团为了测定一块大理石中碳酸钙的质量分数,进行了如图的实验。(杂质不溶于水也不与酸反应,过滤后滤渣损失忽略不计,氯化钙易溶于水。)
(1)假设该同学过滤所得的滤渣未洗涤、干燥就直接称量,这一操作会导致该样品中碳酸钙的质量分数计算结果 (填“偏大”或“偏小”或“不变”)。
(2)化学社团此次测定大理石的质量分数过程中,生成二氧化碳的质量是多少?(请写出计算过程)
9.水垢的主要成分是碳酸钙和氢氧化镁,某化学兴趣小组为测定水垢中碳酸钙的质量分数,设计如下实验:取足量稀盐酸加入到10.0g水垢样品中,充分反应。将生成的气体用氢氧化钠溶液吸收,氢氧化钠溶液质量增加情况如图:
(1)计算水垢样品中碳酸钙的质量分数。(写出详细计算过程)
(2)不合适用澄清石灰水替代氢氧化钠溶液的原因是 。
10.“中国天眼”是世界上口径最大的单天线射电望远镜,其“眼镜片”由金刚砂(SiC)制造。生产SiC的化学方程式为SiO2+3CSiC+2CO↑。
(1)SiO2中Si元素的化合价为 。
(2)生产160kg 的SiC,理论上消耗C的质量为多少?
11.材料在人类发展的历史长河中起着非常重要的作用。
(1)金属氧化物加热分解。
加热氧化银(Ag2O)得到银和氧气,写出该反应的化学方程式 。
(2)一定条件下,金属化合物与一些具有还原性的物质发生反应。
木炭还原氧化铜反应的化学方程式是 。
(3)电解法冶炼。
工业上电解熔融氯化钠得到钠和氯气。利用该反应制取46kg金属钠,需要氯化钠的质量至少是 。(根据化学方程式计算,写出计算过程)
12.合金常用来制造机械零件、仪表和日用品。某化学研究小组取10g黄铜(铜、锌合金)进行实验,加入61.7g稀盐酸后恰好完全反应,反应后称得烧杯内剩余物质的总质量为71.5g。请计算:
(1)生成氢气的质量为 g。
(2)反应后所得溶液的溶质质量分数(写出计算过程)。
13.向盛有CuSO4和H2SO4混合溶液的烧杯中,加入过量BaCl2溶液,充分反应再滴加溶质质量分数为10.0%的NaOH溶液,烧杯中沉淀质量与滴加NaOH溶液质量的关系如图所示。请回答下列问题:
(1)m2是指 沉淀的质量。
(2)求完全反应后生成氢氧化铜的质量。(写出计算过程)
14.缺钙会导致儿童发育不良。小兵同学从食物中摄入钙元素的量不足,每天需要服用3片某种钙片。该钙片标签的部分内容如图所示(假设钙片中只有碳酸钙含有钙元素),请计算:
(1)碳酸钙中含有 种元素。
(2)碳酸钙的相对分子质量 。
(3)小兵同学每天从钙片中摄入钙元素的质量 。
(4)如果小兵同学改用喝牛奶(每100mL牛奶中含钙0.10g)来补充钙,每天至少需要喝多少毫升牛奶。
15.为测定某赤铁矿样品中氧化铁的质量分数,取该样品12.0g(杂质不溶于水,且不与酸反应)于烧杯中,慢慢加入100g稀盐酸充分反应。所加稀盐酸的质量与烧杯中剩余固体的质量关系如图所示。
(1)反应过程中除观察到红棕色固体部分溶解外,还可以观察到的现象是 。
(2)计算所用稀盐酸中溶质的质量分数。(请写出计算过程)
16.氯气和氢氧化钠都是非常重要的化工原料,氯碱工业是可以同时获取它们的常用化工方法,其反应原理为:2NaCl+2H2O2NaOH+H2↑+Cl2↑。现有117g质量分数为20%的食盐水,将其中的氯化钠完全电解,试回答下列问题并计算:
(1)氢氧化钠的俗称 ;它具有一定的腐蚀性,若实验时不小心沾在手上了,应该及时用大量水冲洗并涂上 溶液。
(2)Cl2通常可以用来制备盐酸,打开浓盐酸试剂瓶口通常容易出现 (写出现象)。
(3)电解后,溶液中氢氧化钠的质量是多少?(写出计算过程)
17.某化肥厂生产的一种氮肥,其成分是NH4NO3和NH4Cl的混合物。为测定两种成分的含量,同学们做了以下实验:取16g该化肥样品于烧杯中,加入112.7g水完全溶解后,加入100g AgNO3溶液恰好完全反应,过滤,得到白色固体和200g滤液。
(1)NH4NO3中氮元素和氧元素的质量比为 (填最简整数比)。
(2)化肥样品中NH4Cl的质量分数(结果精确到0.1%)。
(3)求实验后得到的200g滤液中溶质的质量分数(结果精确到0.1%)。
18.二氧化锰因应用广泛而备受关注。某研究小组采用如图装置通过焙烧MnCO3制取MnO2,发生反应的化学方程式为:。
(1)固体中 元素的质量减少。
(2)加热至 ℃时,MnO2开始分解。
(3)根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是多少?(请写出计算过程)
(4)A点的固体物质成分是 (填化学式)。
19.铁铜金属粉末常用于生产机械零件。为测定某铁铜金属粉末中铁粉的含量,取20g样品于烧杯中,逐滴加入稀硫酸充分反应后,测得固体质量随加入稀硫酸的质量关系如图所示。计算:
(1)该金属粉末中铁粉的质量分数。
(2)生成氢气的质量。
(3)恰好完全反应时,所得溶液中溶质的质量分数。
20.某学习小组的同学取Na2SO4和MgSO4的固体混合物40g放入烧杯中,加入113.6g水使其完全溶解,再滴加溶质质量分数一定的NaOH溶液,反应过程中滴加NaOH溶液的质量与生成沉淀的质量关系如图所示。请计算:
(1)m的值为 。
(2)当滴加NaOH溶液质量为 g时,恰好完全反应。
(3)恰好完全反应时,所得溶液中溶质的质量分数。
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
参考答案:
1.(1)132
(2)
(3)1.6
(4)高
【详解】(1)肉桂醛的相对分子质量为12×9+1×8+16=132;
(2)肉桂醛中碳、氢、氧三种元素的质量比为(12×9):(1×8):16=27:2:4,;
(3)26.4g 肉桂醛中所含氢元素的质量为;
(4)苯甲醛 的化学式为C7H8O,肉桂醛 的化学式为C9H8O ,观察化学式可知,一个分子中所含有的氧原子个数相同,相对分子质量越大,其氧元素的质量分数越小,苯甲醛的相对分子质量比肉桂醛小,故苯甲醛中氧元素的质量分数比肉桂醛中氧元素的质量分数高。
2.(1)162
(2)60:7:14
(3)74.1%
【详解】(1)尼古丁的相对分子质量=,故填:162;
(2)尼古丁中碳、氢、氮三种元素质量比,故填:60:7:14;
(3)尼古丁中碳元素的质量分数为,故填:74.1%。
3.(1)8
(2)解:设理论上可以“捕捉”二氧化碳的质量为x,
答:理论上可“捕捉”CO2的质量为4.4kg。
【详解】(1)40kg溶质质量分数为20%的氢氧化钠溶液中溶质的质量为40kg×20%=8kg,故填:8kg;
(2)见答案。
4.(1) ②④ ①④
(2) 解:设反应消耗的硫酸的质量为x。
解得:x= 49kg
稀硫酸的溶质的质量分数分为×100%=12.25% 350
【详解】(1)复合肥:含有氮、磷、钾元素中的两种及以上的肥料。①(NH4)2SO4含有N,属于氮肥;②KNO3含有K、N,属于复合肥;③CO(NH2)2含有N,属于氮肥;④NH4H2PO4含有P、N属于复合肥;因为铵根离子会与碱性物质反应放出氨气,所以不能混合使用,属于有铵根离子的是①(NH4)2SO4;④NH4H2PO4。故填:②④;①④。
(2)①见答案;
②设所用浓硫酸的质量是y,y×98%=400g×12.25%,解得y=50g,则需要水的质量是400g-50g=350g。
5.(1)SO3
(2)7.2g
解:设生成Cu2O的质量为m
答:图中m的值7.2g。
【详解】(1)650℃时,CuSO4开始发生分解反应,生成CuO和另一种氧化物X,根据质量守恒定律,化学反应前后,元素的种类和质量不变,另一氧化物中一定含硫元素,硫元素的质量为16.0g×=3.2g,则另一氧化物中氧元素的质量为16.0g-3.2g-8.0g=4.8g,设该氧化物的化学式为SaOb,则有32a:16b=3.2g:4.8g,得a:b=1:3,故该氧化物的化学式为SO3;
(2)见答案。
6.(1)
(2)解:设反应生成的硫酸锌的质量为,生成氢气的质量为。
则实验所得不饱和溶液中溶质质量分数为
答:实验所得不饱和溶液中溶质质量分数是。
【详解】(1)根据图示可知,锌粉样品质量为,当恰好完全反应后,剩余滤渣的质量为,则参加反应的锌粉的质量为:;故填:;
(2)见答案。
7.(1)放热
(2)偏大
(3)解:该反应放热,温度达到最高点时,说明恰好完全反应,此时溶液的温度为t3℃,消耗氢氧化钠溶液的质量为40g,设废液中硫酸的质量为x,
解得x=9.8g
则废液中硫酸的质量分数为:,
答:废液中硫酸的质量分数为19.6%。
【详解】(1)由图可知,加入氢氧化钠溶液后,氢氧化钠和硫酸反应生成硫酸钠和水,溶液温度升高,则说明中和反应为放热反应;
(2)用量筒量水时仰视读数,读数偏小,则实际量取的水的体积偏多,会导致配制的氢氧化钠溶液质量分数偏小,则通过图示数据计算出的硫酸质量偏大导致质量分数偏大,故填:偏大;
(3)见答案。
8.(1)偏小
(2)解:根据题意,大理石中碳酸钙的质量为8g-3g=5g;
设生成二氧化碳的质量为x
解得x=2.2g
答:生成二氧化碳的质量是2.2g。
【详解】(1)若滤渣未洗涤、干燥就直接称量,则会使滤渣因为含有杂质而使得滤渣质量偏大,会导致该样品中碳酸钙的质量分数计算结果偏小。故填偏小;
(2)见答案;
9.(1)解:设水垢样品中碳酸钙的质量为x。
x=7.5g
水垢样品中碳酸钙的质量分数=
答:水垢样品中碳酸钙的质量分数为75.0%。
(2)石灰水中氢氧化钙浓度低,不利于完全吸收二氧化碳气体
【详解】(1)碳酸钙和盐酸反应生成二氧化碳,根据图示可知,水垢完全反应后生成二氧化碳的质量为3.3g,根据二氧化碳的质量、化学方程式可计算出碳酸钙的质量,从而求出碳酸钙的质量分数,详见答案;
(2)石灰水中氢氧化钙浓度低,不利于完全吸收二氧化碳气体,氢氧化钠的溶解度大,氢氧化钠溶液浓度大,可以用氢氧化钠溶液吸收二氧化碳。
10.(1)+4
(2)设生产160kg 的SiC,理论上消耗C的质量为x,则
x=144kg
答:生产160kg 的SiC,理论上消耗C的质量为144kg。
【详解】(1)SiO2中,氧元素化合价为-2价,设硅元素化合价为x,根据“化合物中各元素化合价代数和为零”,则x+(-2)×2=0,解得x=+4。
(2)见答案。
11.(1)2Ag2O4Ag+O2↑
(2)2CuO+C2Cu+CO2↑
(3)设需要氯化钠的质量至少是x,
x=117kg
答:制取46kg金属钠,至少需要117 kg的氯化钠。
【详解】(1)加热氧化银(Ag2O)得到银和氧气,反应的化学方程式为:2Ag2O4Ag+O2↑;
(2)碳和氧化铜在高温下生成铜和二氧化碳,反应的化学方程式为:2CuO+C2Cu+CO2↑;
(3)见答案。
12.(1)0.2
(2)设参加反应Zn的质量为x,生成ZnCl2的质量为y,则
、
x=6.5g、y=13.6g
反应后溶液的质量为71.5-(10-6.5)=68g,其中溶质质量分数为
答:反应后溶液的溶质质量分数为20%。
【详解】(1)反应前后物质的总质量不变,则生成氢气的质量为10g+61.7g-71.5g=0.2g。
(2)见答案。
13.(1)硫酸钡/BaSO4
(2)解:由题意可知加入80g氢氧化钠溶液质量时,无沉淀产生,是氢氧化钠与硫酸反应;又加入40g氢氧化钠溶液,此时才生成沉淀,是氢氧化钠溶液和硫酸铜反应产生氢氧化铜沉淀。
设生成的氢氧化铜沉淀的质量为x
x=4.9g
答:完全反应后生成氢氧化铜4.9g。
【详解】(1)由题意可知,先向溶液中加入氯化钡溶液,氯化钡中的钡离子和原溶液中的硫酸根离子反应生成硫酸钡沉淀,故m2是硫酸钡的质量;
(2)见答案。
14.(1)3/三
(2)100
(3)0.36g
(4)小兵同学每天从钙片中摄入钙元素的质量为0.36g,每100mL牛奶中含钙0.10g,
则每天至少需要喝牛奶的体积为;
答:每天至少需要喝360毫升牛奶。
【详解】(1)碳酸钙中含有钙、碳、氧三种元素;
(2)碳酸钙的相对分子质量是40+12+16×3+16=100;
(3)根据题意,每天需要服用3片某种钙片,每片含碳酸钙0.3g,则每天从钙片中摄入钙元素的质量为0.3g/片×3片××100%=0.36g;
(4)见答案。
15.(1)无色溶液变为黄色
(2)设75g稀盐酸中溶质质量为x。
解得:x=10.95g
所用稀盐酸中溶质的质量分数为:×100%=14.6%
答:稀盐酸中溶质的质量分数为14.6%。
【详解】(1)氧化铁与盐酸反应生成氯化铁和水,反应过程中除观察到红棕色固体部分溶解外,还可以观察到的现象是:无色溶液变为黄色。故填:无色溶液变为黄色。
(2)见答案。
16.(1) 烧碱/火碱/苛性钠 硼酸/H3BO3
(2)白雾
(3)解:设电解后,溶液中氢氧化钠的质量是x
x=16g
答:电解后,溶液中氢氧化钠的质量是16g
【详解】(1)氢氧化钠俗称烧碱、火碱、苛性钠;
氢氧化钠具有一定的腐蚀性,若实验时不小心沾在手上了,应该及时用大量水冲洗并涂上硼酸溶液,酸碱中和;
(2)浓盐酸具有挥发性,挥发出的氯化氢与空气中的水蒸气结合成盐酸,故打开浓盐酸试剂瓶口通常容易出现白雾;
(3)见答案。
17.(1)7:12
(2)66.9%
解:根据质量守恒定律,溶液减少的质量为生成氯化银沉淀的质量,则氯化银沉淀的质量为16g+112.7g+100g-200g=28.7g;设化肥样品中NH4Cl的质量为x,生成NH4NO3的质量为y,
化肥样品中NH4Cl的质量分数为;
(3)10.7%
实验后得到的200g滤液中溶质的质量分数为≈10.7%;
答:(2)化肥样品中NH4Cl的质量分数为66.9%;
(3)实验后得到的200g滤液中溶质的质量分数10.7%。
【详解】(1)NH4NO3中氮元素和氧元素的质量比为(14×2):(16×3)=7:12,故填:7:12;
(2)见答案;
(3)见答案。
18.(1)氧
(2)300
(3)设最多制得的MnO2的质量是x,
x=34.8g
答:最多制得的MnO2的质量是34.8g
(4)MnO2和Mn2O3
【详解】(1)MnO2中锰元素与氧元素的质量比为55:(16×2)=55:32,MnO中锰元素与氧元素的质量比为55:16=55:16,所以固体中氧元素的质量减少;
(2)由图可知,当温度高于300℃,MnO2会分解;
(3)见答案;
(4)据图可知,A点是MnO2没有完全分解,故是MnO2和Mn2O3的混合物。
19.(1)根据图像可知,最后剩余的6g固体是不与稀硫酸反应的铜,则混合物中铁的质量为20g-6g=14g;
该金属粉末中铁粉的质量分数为;
答:该金属粉末中铁粉的质量分数70%。
(2)解:设生成氢气的质量为x,生成硫酸亚铁的质量为y,
解得x=0.5g;
解得y=38g;
答:生成氢气的质量为0.5g。
(3)恰好完全反应时,所得溶液中溶质的质量分数为,
答:恰好完全反应时,所得溶液中溶质的质量分数为33.5%。
【详解】(1)见答案;
(2)见答案;
(3)见答案。
20.(1)5.8
(2)80
(3)解:设硫酸镁的质量为x,生成硫酸钠的质量为y。
答:恰好完全反应时,所得溶液中溶质的质量分数为20%。
【详解】(1)通过题干和图示得知,因为该体系中仅有一个反应就是硫酸镁和氢氧化钠的反应,且所滴加NaOH溶液的质量是依次以20g进行增加的,故产生沉淀的质量也应该以2.9进行递增,所以m=2.9+2.9=5.8;
(2)观察图示得知,在滴加NaOH溶液的质量为80g时,产生沉淀的质量达到最大值11.6g,之后再滴加NaOH溶液产生沉淀的质量也不增加,所以当滴加NaOH溶液质量为80g,时,恰好完全反应;
(3)见答案。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
同课章节目录
