2024年中考科学重点题型突破练习-推断题(框架类)(含解析)
文档属性
| 名称 | 2024年中考科学重点题型突破练习-推断题(框架类)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 400.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-29 08:05:28 | ||
图片预览

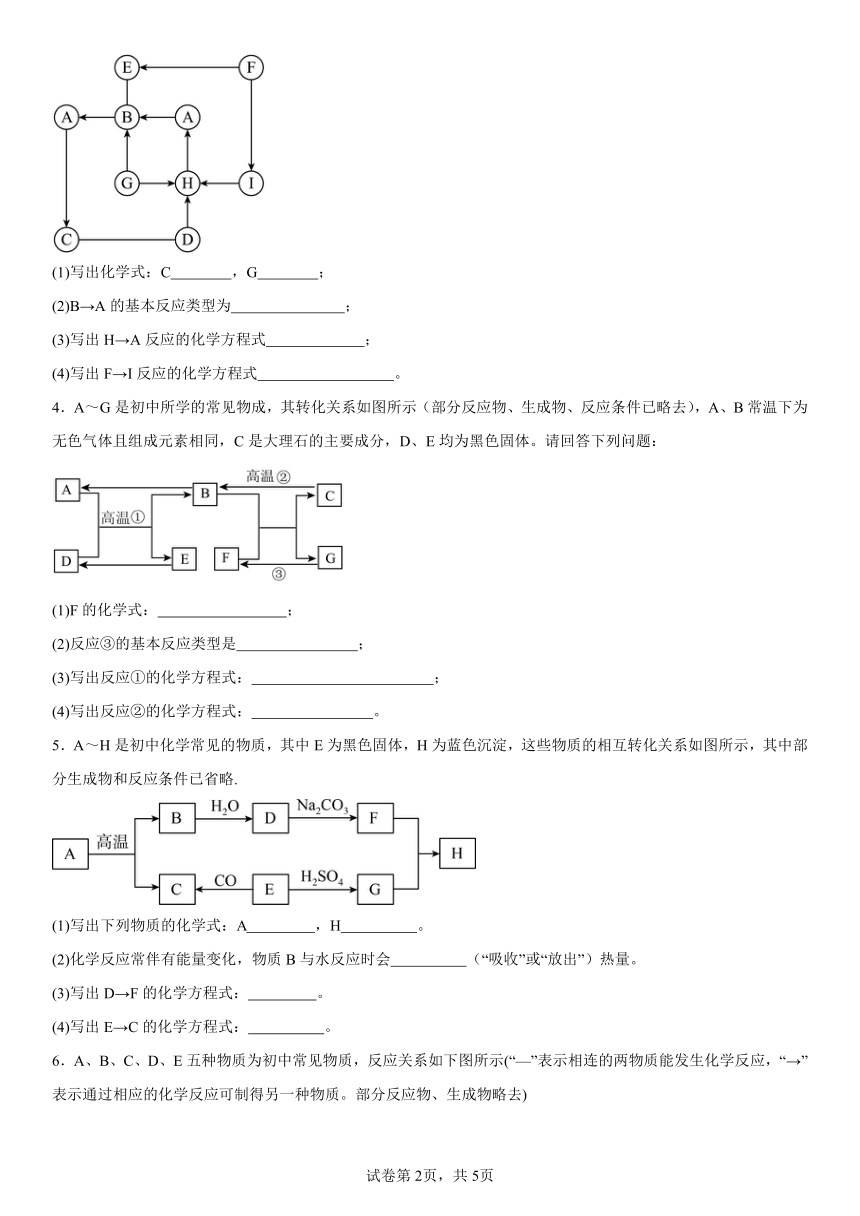

文档简介
2024年中考科学重点题型突破练习-推断题(框架类)
1.如图中A~F分别表示一种常见化合物,A、B都是氧化物,A固体可用作制冷剂,F常用于实验室制取A(部分生成物已略去)。
(1)F的化学式为 。
(2)B→D反应的现象是: 。
(3)写出A→C转化的化学方程式 。
(4)A~F中还能相互反应的两种物质是(用字母表示) 。
2.A、B、C、D、E、F、X、Y都是初中化学只的常见物质,已知X 是一种混合物,A、B、Y是单质;通常情况下,C是一种具有刺激性气味且相对分子质量为17的气体,D、E是含有相同元素的氧化物。它们之间有如下转化关系:
请你回答下列问题:
(1)X的名称 是 。
(2)B与Y反应的条件是 。
(3)E+氧化铁→D的化学方程式是 。
(4)C+D+饱和食盐水→F的化学方程式是 。
3.A~I是初中化学常见的物质,其中A、C、D均为单质; B为胃酸的主要成分;C是紫红色金属;F可用来改良酸性土壤; G是酸雨中的一种酸;F与I是同种类别的物质。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出化学式:C ,G ;
(2)B→A的基本反应类型为 ;
(3)写出H→A反应的化学方程式 ;
(4)写出F→I反应的化学方程式 。
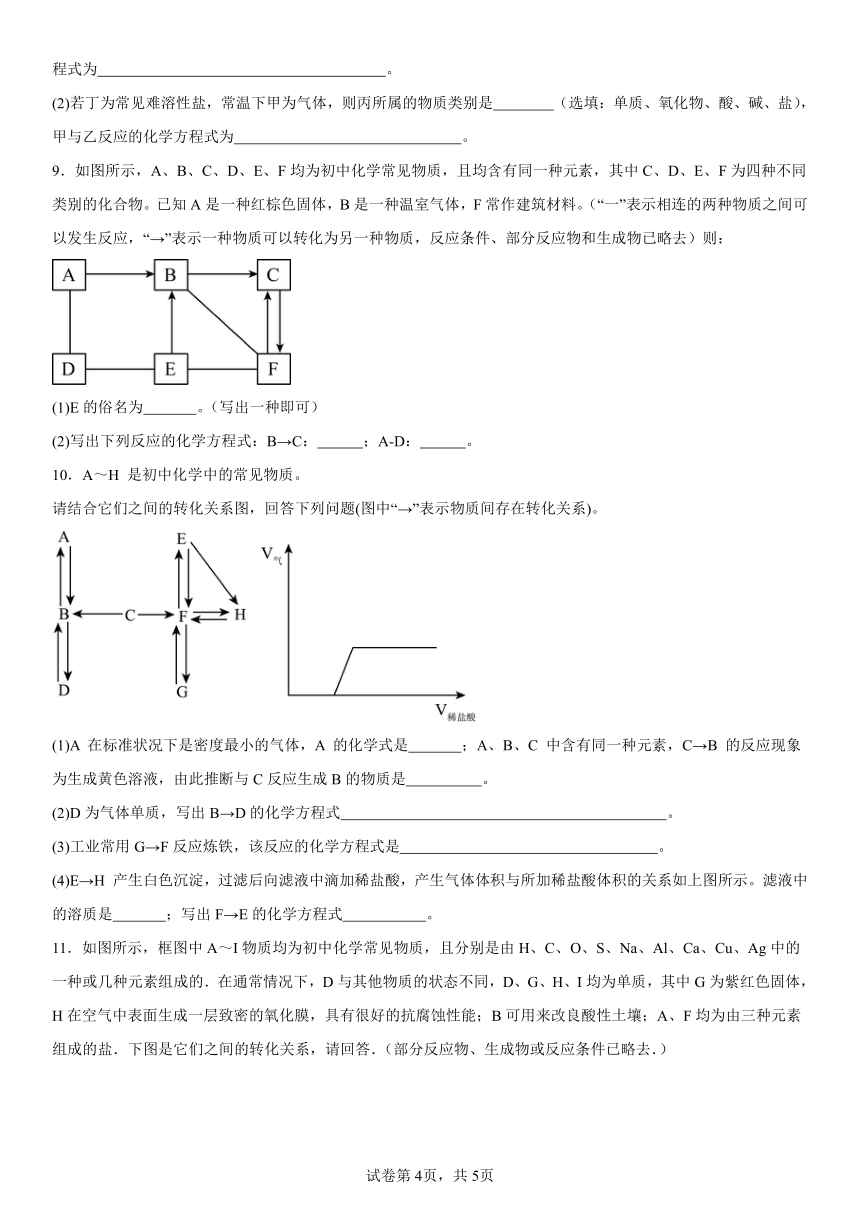
4.A~G是初中所学的常见物成,其转化关系如图所示(部分反应物、生成物、反应条件已略去),A、B常温下为无色气体且组成元素相同,C是大理石的主要成分,D、E均为黑色固体。请回答下列问题:
(1)F的化学式: ;
(2)反应③的基本反应类型是 ;
(3)写出反应①的化学方程式: ;
(4)写出反应②的化学方程式: 。
5.A~H是初中化学常见的物质,其中E为黑色固体,H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.
(1)写出下列物质的化学式:A ,H 。
(2)化学反应常伴有能量变化,物质B与水反应时会 (“吸收”或“放出”)热量。
(3)写出D→F的化学方程式: 。
(4)写出E→C的化学方程式: 。
6.A、B、C、D、E五种物质为初中常见物质,反应关系如下图所示(“—”表示相连的两物质能发生化学反应,“→”表示通过相应的化学反应可制得另一种物质。部分反应物、生成物略去)
(1)若B、C、E为常见气体,且E为最轻的气体,A、D为黑色固体,D—E反应生成红色金属。回答:
①C的化学式 ;
②D的化学式 ;
③AB的化学方程式 。
(2)若A、B、C为不同类别的化合物,A常用来改良酸性土壤,D为蓝色溶液,E为人类从自然界中提取量最大的一种金属。回答:
①C的化学式 ;
②AB的化学方程式 ;
③CD的化学方程式 。
7.A~G均为初中常见的化学物质(“→”表示物质 间的转化关系,“—”表示两端的物质能发生化学反应),其中A、F是初中阶段常见的两种氧化物;B、D是初中阶段常见的两种碱; G是一种常见的建筑材料,E是人体胃液中的一种酸,它们之间有如下图的相互转化关系(图中部分生成物已略去)。请回答下列问题:
(1)B物质的俗称是 ,
(2)C的化学式为 。
(3)写出化学反应①和②的化学方程式:
① ;② 。
8.已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:
(1)常温下,若丁为红色粉末,甲为黑色粉末,则丙的化学式是 ,甲与乙反应的化学方程式为 。
(2)若丁为常见难溶性盐,常温下甲为气体,则丙所属的物质类别是 (选填:单质、氧化物、酸、碱、盐),甲与乙反应的化学方程式为 。
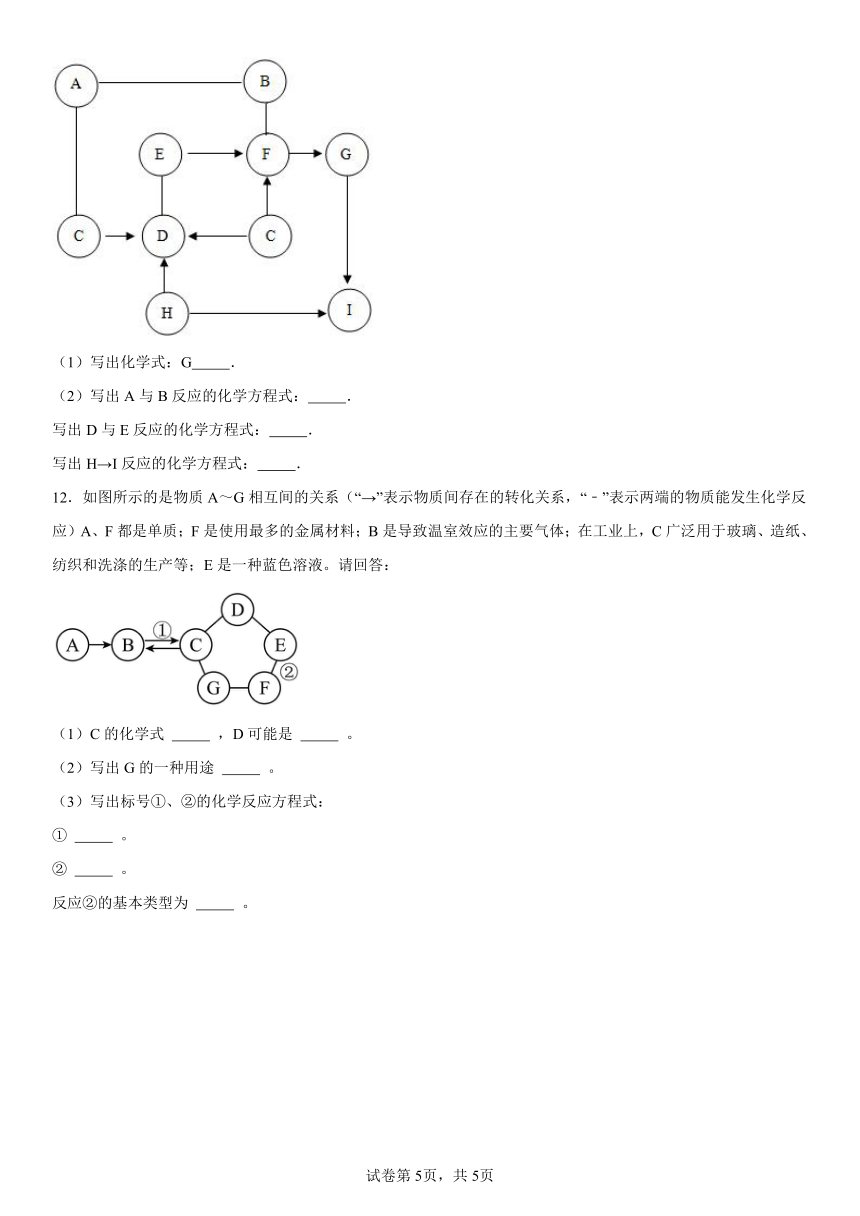
9.如图所示,A、B、C、D、E、F均为初中化学常见物质,且均含有同一种元素,其中C、D、E、F为四种不同类别的化合物。已知A是一种红棕色固体,B是一种温室气体,F常作建筑材料。(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)则:
(1)E的俗名为 。(写出一种即可)
(2)写出下列反应的化学方程式:B→C: ;A-D: 。
10.A~H 是初中化学中的常见物质。
请结合它们之间的转化关系图,回答下列问题(图中“→”表示物质间存在转化关系)。
(1)A 在标准状况下是密度最小的气体,A 的化学式是 ;A、B、C 中含有同一种元素,C→B 的反应现象为生成黄色溶液,由此推断与C反应生成B的物质是 。
(2)D为气体单质,写出B→D的化学方程式 。
(3)工业常用G→F反应炼铁,该反应的化学方程式是 。
(4)E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,产生气体体积与所加稀盐酸体积的关系如上图所示。滤液中的溶质是 ;写出F→E的化学方程式 。
11.如图所示,框图中A~I物质均为初中化学常见物质,且分别是由H、C、O、S、Na、Al、Ca、Cu、Ag中的一种或几种元素组成的.在通常情况下,D与其他物质的状态不同,D、G、H、I均为单质,其中G为紫红色固体,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;B可用来改良酸性土壤;A、F均为由三种元素组成的盐.下图是它们之间的转化关系,请回答.(部分反应物、生成物或反应条件已略去.)
(1)写出化学式:G .
(2)写出A与B反应的化学方程式: .
写出D与E反应的化学方程式: .
写出H→I反应的化学方程式: .
12.如图所示的是物质A~G相互间的关系(“→”表示物质间存在的转化关系,“﹣”表示两端的物质能发生化学反应)A、F都是单质;F是使用最多的金属材料;B是导致温室效应的主要气体;在工业上,C广泛用于玻璃、造纸、纺织和洗涤的生产等;E是一种蓝色溶液。请回答:
(1)C的化学式 ,D可能是 。
(2)写出G的一种用途 。
(3)写出标号①、②的化学反应方程式:
① 。
② 。
反应②的基本类型为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. CaCO3 放出大量的热,块状固体变成粉末 2NaOH+CO2=Na2CO3+H2O A、D
【分析】A、B都是氧化物,A固体可用作制冷剂,则A为二氧化碳;F常用于实验室制取A,则F为碳酸钙;A二氧化碳可以和E生成C,那么E为碱,C为碳酸盐;C可以转化为F碳酸钙和碱E,推测E为氢氧化钠、C为碳酸钠、D为氢氧化钙;A、B都是氧化物,B可以和水转化为氢氧化钙,B为氧化钙;经验证,符合题意。
【详解】根据以上分析可知:
(1)F的化学式为CaCO3;
(2)B→D的反应是氧化钙与水的反应,主要反应现象是:放出大量的热,块状固体变成粉末;
(3)A→C的转化是二氧化碳和氢氧化钠反应,其化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(4)A~F中还能相互反应的两种物质是A二氧化碳和D氢氧化钙,能生成碳酸钙和水。
【点睛】本题是框图式推断题,关键是找准突破口,然后采用顺推或逆推或向中间推的方法,得出正确答案即可。
2. 空气 点燃 3CO+Fe2O3 3CO2+2Fe NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3 ↓
【分析】A、B、C、D、E、F、X、Y都是初中化学只的常见物质,已知X 是一种混合物,分离能得到稀有气体,说明X可能是空气;A、B、Y是单质;氮气和氢气在一定条件下生成氨气,通常情况下,氨气是一种具有刺激性气味且相对分子质量为17的气体,所以C是氨气,D、E是含有相同元素的氧化物,E和氧化铁高温生成D,所以D是二氧化碳,E是一氧化碳,D和Y高温生成一氧化碳,所以Y是碳,D是二氧化碳,B是氧气,A和氢气反应生成氨气,所以A是氮气,经过验证,推导正确。
【详解】根据以上分析可知:
(1)X的名称是空气;
(2)B与Y反应的条件是点燃;
(3)E+氧化铁→D的反应是一氧化碳高温条件下和氧化反应生成铁和二氧化碳,化学方程式是3CO+Fe2O3 3CO2+2Fe;
(4)C+D+饱和食盐水→F的反应是氨气和二氧化碳、和氯化钠、水生成氯化铵和碳酸氢钠化学方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3 ↓。
3.(1) Cu H2SO4
(2)置换反应
(3)
(4)
【分析】A~I是初中化学常见的物质,其中A、C、D均为单质; B为胃酸的主要成分,可推出B为盐酸;C是紫红色金属,可推出C为铜;F可用来改良酸性土壤,可推出F为氢氧化钙; G是酸雨中的一种酸,G能转化为B,可推出G为硫酸;B能转化为A,A能转化为C,可推出A为氢气,C能与D反应,可推出D为氧气,D能转化为H,H能转化为A,可推出H为水,F与I是同种类别的物质,F能转化为I,可推出I为氢氧化钠,F能转化为E,E能与B反应,可推出E为碳酸钙,代入验证,符合题意。
【详解】(1)由分析可知,C为铜,化学式为:Cu;G为硫酸,化学式为:H2SO4;
(2)B→A的反应为活泼金属和盐酸反应生成相应的盐和氢气,该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
(3)H→A的反应为水通电分解生成氢气和氧气,该反应的化学方程式为:;
(4) F→I的反应为氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:。
4.(1)Ca(OH)2
(2)化合反应
(3)
(4)
【分析】A~G是初中所学的常见物成,C是大理石的主要成分,可推出C为碳酸钙,C在高温下反应生成B,B是气体,可推出B为二氧化碳,A、B常温下为无色气体且组成元素相同,可推出A为一氧化碳,D、E均为黑色固体,A能与D在高温下反应生成B和E,E能转化为D,可推出D为四氧化三铁,E为铁,B能与F转化为C和G,G能转化为F,可推出F为氢氧化钙,G为水,代入验证,符合题意。
【详解】(1)由分析可知,F为氢氧化钙,化学式为:Ca(OH)2;
(2)反应③为氧化钙和水反应生成氢氧化钙,该反应符合“多变一”的特点,属于化合反应;
(3)反应①为一氧化碳和四氧化三铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:;
(4)反应②为碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应的化学方程式为:。
5.(1) CaCO3 Cu(OH)2
(2)放出
(3)
(4)
【分析】A高温分解生成B和C,故A为碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,B氧化钙和水化合生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,H是蓝色沉淀,H为氢氧化铜,E为黑色粉末,与硫酸反应生成硫酸铜,与一氧化碳反应生成铜和C二氧化碳,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀。
【详解】(1)由上述分析可知A为碳酸钙,H为氢氧化铜,化学式分别为:A CaCO3,H Cu(OH)2。
(2)物质B氧化钙与水反应生成氢氧化钙时会放出热量。
(3)D为氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故D→F的化学方程式:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(4)E为氧化铜,氧化铜与一氧化碳在加热条件下反应生成铜和二氧化碳,故E→C的化学方程式:。
6.(1) O2 CuO
(2) Fe Ca(OH)2+CO2=CaCO3↓+H2O(合理即可) CuO+H2SO4=CuSO4+H2O
【详解】(1)氢气是最轻的气体,由E为最轻的气体,说明是氢气,D→E反应生成红色金属,说明能生成铜,所以D是含铜的化合物,且是黑色,所以D是氧化铜,A是黑色固体且能制取气体,所以A可以是碳,碳燃烧可以制取一氧化碳或二氧化碳,因为A还能与C反应,所以C是氧气,B也可以与C反应,所以B不能是二氧化碳,只能是一氧化碳;
①由上面的推理可知C是氧气,化学式为O2;
②D是氧化铜,化学式为CuO;
③A→B的反应物是碳和氧气点燃后不充分燃烧生成一氧化碳,反应的化学方程式为;
(2)A常用来改良酸性土壤属于氢氧化钙,D为蓝色溶液属于铜离子溶液,可以是硫酸铜溶液,E为人类从自然界中提取量最大的一种金属,属于铁;金属既可以与盐反应,也可以与酸反应,由于D是硫酸铜属于盐,所以C属于酸,又因为C可以制取硫酸铜,所以C属于硫酸,因为A、B、C属于不同类别的化合物,所以B可以是盐,因为氢氧化钙与二氧化碳反应能生成碳酸钙沉淀和水,所以B可以是碳酸钙。
①由上面的推理可知E是铁,化学式为Fe;
②A→B的反应物是氢氧化钙和二氧化碳,生成物是碳酸钙和水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;
③C→D的反应物可以是氧化铜和硫酸,生成物是硫酸铜和水,反应的化学方程式为CuO+H2SO4=CuSO4+H2O。
7.(1)烧碱或火碱或苛性钠
(2)Na2CO3
(3)
【分析】E是人体胃液中的一种酸,则E是盐酸,G是一种常见的建筑材料,则G可能是碳酸钙,D是碱,能转化生成碳酸钙,则D是氢氧化钙,氢氧化钙能与F相互转化,F为氧化物,则F可能是水,B是碱,则B可能是氢氧化钠,A是氧化物,且能与B反应,则A可能是二氧化碳,C能与氢氧化钠相互转化,且能与氢氧化钙反应,则C可能是碳酸钠,代入框图,推断合理。
【详解】(1)B为氢氧化钠,俗称烧碱、火碱、苛性钠;
(2)C为碳酸钠,化学式为:Na2CO3;
(3)反应①是A和D的反应,A是二氧化碳,D是氢氧化钙,能反应生成碳酸钙沉淀和水,该反应的方程式为:;
反应②是C转化生成B的反应,C是碳酸钠,B是氢氧化钠,可以由氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,该反应方程式为:。
8.(1) CO(合理即可)
(2) 盐
【详解】(1)常温下,若丁为红色粉末,甲为黑色粉末,甲能与乙转化为丁,丙能与乙转化为丁,可推出丁为铜,甲为碳,乙为氧化铜,丙为一氧化碳,代入验证,符合题意。
由分析可知,丙为一氧化碳,化学式为:CO;
甲与乙的反应为碳和氧化铜在高温下反应生成铜和二氧化碳,该反应的化学方程式为:;
(2)若丁为常见难溶性盐,常温下甲为气体,甲能与乙转化为丁,可推出甲为二氧化碳,则乙为氢氧化钙,丁为碳酸钙,乙能与丙转化为丁,丙可能是碳酸钠,碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐;
甲与乙反应为二氧化碳和氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:。
9.(1)纯碱
(2)
【分析】A是一种红棕色固体,则A为氧化铁;B是一种温室气体,能够由A(氧化铁)反应生成,则B为二氧化碳;F常作建筑材料,且能够与B(二氧化碳)反应,则F为氢氧化钙;E能够反应生成B(二氧化碳),还能够与F(氢氧化钙)反应,则E为碳酸钠;D能够与A(氧化铁)反应,还能够与E(碳酸钠)反应,则D为一种酸,可以是稀硫酸;C、D、E、F为四种不同类别的化合物,C能够由B(二氧化碳)反应生成,还能够与F(氢氧化钙)相互转化,则C为水。
【详解】(1)由分析可知,E为碳酸钠,其俗称为纯碱,故填纯碱。
(2)由分析可知,B为二氧化碳,C为水,则反应B→C可以是二氧化碳与氢氧化钠反应生成碳酸钠和水,故反应的化学方程式写为:CO2+2NaOH=Na2CO3+H2O;
由分析可知,A为氧化铁,D为稀硫酸,则反应A D是氧化铁与稀硫酸反应生成硫酸铁和水,故反应的化学方程式写为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
10. H2 Fe2O3 2H2O 通电 2H2↑+ O2↑ Fe2O3 + 3CO 高温 2Fe + 3CO2 NaOH、Na2CO3 2NaOH + CO2 == Na2CO3 + H2O
【详解】根据密度最小的气体,可先推出A是氢气,由溶液呈黄色可推出溶液中含有铁离子,再根据“A、B、C中含有同一种元素”可推出B为水,C中含有氢元素,且能与含铁的化合物反应,所以C为盐酸,D为气体单质,B为水,可推出D为氧气,根据产生气体的图象可以推测,溶液中必定为可溶性碱和碳酸盐的混合物,还得保证该碳酸盐与该碱不反应,所以溶质为氢氧化钠与碳酸钠,进而推出H为碳酸钙,由于工业常用G→F反应炼铁,又因为GF可以相互转化,则F为二氧化碳,G为一氧化碳;所以,(1) A是氢气,化学式是H2;C→B 的反应现象为生成黄色溶液,由此推断与C反应生成B的物质是Fe2O3 ;(2) B→D的化学方程式为:2H2O2H2↑+ O2↑;(3) G→F反应炼铁,该反应的化学方程式是:Fe2O3 + 3CO2Fe + 3CO2;(4) E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,反应开始一段时间后,产生气体,说明氢氧化钠过量,故滤液中含有氢氧化钠和碳酸钠;F→E的化学方程式为:2NaOH + CO2 == Na2CO3 + H2O。
11. Cu Na2CO3+Ca(OH)2=CaCO3↓+2NaOH CuO+H2Cu+H2O Al+3AgNO3═Al(NO3)3+3Ag
【分析】根据框图中A~I物质均为初中化学常见物质,且分别是由H、C、O、S、Na、Al、Ca、Cu、Ag中的一种或几种元素组成的,在通常情况下,D与其他物质的状态不同,D、G、H、I均为单质,G为紫红色固体,所以G是铜,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能,所以H是铝,铝和铜都会转化成I,所以I是银,铝也会转化成单质D,所以D是氢气,B可用来改良酸性土壤,所以B是氢氧化钙,A、F均为由三种元素组成的盐,A、F会与氢氧化钙反应,F会转化成的铜,所以F是硫酸铜,A是碳酸钠,C会与碳酸钠反应,C会转化成的硫酸铜、氢气,所以C是硫酸,E会转化成硫酸铜,所以E是氧化铜,然后将推出的物质进行验证即可。
【详解】(1)由分析可知,G是Cu;
(2)A与B的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
D与E的反应是氧化铜和氢气在加热的条件下生成铜和水,化学方程式为:CuO+H2Cu+H2O;
H→I的反应是铝和硝酸银反应生成硝酸铝和银,化学方程式为:Al+3AgNO3═Al(NO3)3+3Ag。
12. Na2CO3; Ca(OH)2; 除锈 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓; Fe+CuSO4=FeSO4+Cu; 置换反应;
【详解】根据F是使用最多的金属材料; B是导致温室效应的主要气体;在工业上,C广泛用于玻璃、造纸、纺织和洗涤剂的生产等;E是一种蓝色溶液,可得F是铁、B是二氧化碳、C是碳酸钠、E是硫酸铜,由图示可知A可能是碳或氧气,G能够与碳酸钠和铁反应,则G是酸可以是,D既能与碳酸钠反应又能与硫酸铜反应,故D可以是氢氧化钙(只要合理即可);
(1)由分析知C的化学式Na2CO3;G可能是氢氧化钙;
(2)G是盐酸或硫酸,可以用来除掉金属表面的锈;
(3)反应①是碳酸钠与氢氧化钙的反应,方程式为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;反应②是铁与硫酸铜的反应,方程式为Fe+CuSO4=FeSO4+Cu,该反应的特点是单质与化合物硫酸铜生成单质铜和化合物硫酸亚铁的过程,所以是置换反应;
答案第1页,共2页
答案第1页,共2页
1.如图中A~F分别表示一种常见化合物,A、B都是氧化物,A固体可用作制冷剂,F常用于实验室制取A(部分生成物已略去)。
(1)F的化学式为 。
(2)B→D反应的现象是: 。
(3)写出A→C转化的化学方程式 。
(4)A~F中还能相互反应的两种物质是(用字母表示) 。
2.A、B、C、D、E、F、X、Y都是初中化学只的常见物质,已知X 是一种混合物,A、B、Y是单质;通常情况下,C是一种具有刺激性气味且相对分子质量为17的气体,D、E是含有相同元素的氧化物。它们之间有如下转化关系:
请你回答下列问题:
(1)X的名称 是 。
(2)B与Y反应的条件是 。
(3)E+氧化铁→D的化学方程式是 。
(4)C+D+饱和食盐水→F的化学方程式是 。
3.A~I是初中化学常见的物质,其中A、C、D均为单质; B为胃酸的主要成分;C是紫红色金属;F可用来改良酸性土壤; G是酸雨中的一种酸;F与I是同种类别的物质。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出化学式:C ,G ;
(2)B→A的基本反应类型为 ;
(3)写出H→A反应的化学方程式 ;
(4)写出F→I反应的化学方程式 。
4.A~G是初中所学的常见物成,其转化关系如图所示(部分反应物、生成物、反应条件已略去),A、B常温下为无色气体且组成元素相同,C是大理石的主要成分,D、E均为黑色固体。请回答下列问题:
(1)F的化学式: ;
(2)反应③的基本反应类型是 ;
(3)写出反应①的化学方程式: ;
(4)写出反应②的化学方程式: 。
5.A~H是初中化学常见的物质,其中E为黑色固体,H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.
(1)写出下列物质的化学式:A ,H 。
(2)化学反应常伴有能量变化,物质B与水反应时会 (“吸收”或“放出”)热量。
(3)写出D→F的化学方程式: 。
(4)写出E→C的化学方程式: 。
6.A、B、C、D、E五种物质为初中常见物质,反应关系如下图所示(“—”表示相连的两物质能发生化学反应,“→”表示通过相应的化学反应可制得另一种物质。部分反应物、生成物略去)
(1)若B、C、E为常见气体,且E为最轻的气体,A、D为黑色固体,D—E反应生成红色金属。回答:
①C的化学式 ;
②D的化学式 ;
③AB的化学方程式 。
(2)若A、B、C为不同类别的化合物,A常用来改良酸性土壤,D为蓝色溶液,E为人类从自然界中提取量最大的一种金属。回答:
①C的化学式 ;
②AB的化学方程式 ;
③CD的化学方程式 。
7.A~G均为初中常见的化学物质(“→”表示物质 间的转化关系,“—”表示两端的物质能发生化学反应),其中A、F是初中阶段常见的两种氧化物;B、D是初中阶段常见的两种碱; G是一种常见的建筑材料,E是人体胃液中的一种酸,它们之间有如下图的相互转化关系(图中部分生成物已略去)。请回答下列问题:
(1)B物质的俗称是 ,
(2)C的化学式为 。
(3)写出化学反应①和②的化学方程式:
① ;② 。
8.已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:
(1)常温下,若丁为红色粉末,甲为黑色粉末,则丙的化学式是 ,甲与乙反应的化学方程式为 。
(2)若丁为常见难溶性盐,常温下甲为气体,则丙所属的物质类别是 (选填:单质、氧化物、酸、碱、盐),甲与乙反应的化学方程式为 。
9.如图所示,A、B、C、D、E、F均为初中化学常见物质,且均含有同一种元素,其中C、D、E、F为四种不同类别的化合物。已知A是一种红棕色固体,B是一种温室气体,F常作建筑材料。(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)则:
(1)E的俗名为 。(写出一种即可)
(2)写出下列反应的化学方程式:B→C: ;A-D: 。
10.A~H 是初中化学中的常见物质。
请结合它们之间的转化关系图,回答下列问题(图中“→”表示物质间存在转化关系)。
(1)A 在标准状况下是密度最小的气体,A 的化学式是 ;A、B、C 中含有同一种元素,C→B 的反应现象为生成黄色溶液,由此推断与C反应生成B的物质是 。
(2)D为气体单质,写出B→D的化学方程式 。
(3)工业常用G→F反应炼铁,该反应的化学方程式是 。
(4)E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,产生气体体积与所加稀盐酸体积的关系如上图所示。滤液中的溶质是 ;写出F→E的化学方程式 。
11.如图所示,框图中A~I物质均为初中化学常见物质,且分别是由H、C、O、S、Na、Al、Ca、Cu、Ag中的一种或几种元素组成的.在通常情况下,D与其他物质的状态不同,D、G、H、I均为单质,其中G为紫红色固体,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能;B可用来改良酸性土壤;A、F均为由三种元素组成的盐.下图是它们之间的转化关系,请回答.(部分反应物、生成物或反应条件已略去.)
(1)写出化学式:G .
(2)写出A与B反应的化学方程式: .
写出D与E反应的化学方程式: .
写出H→I反应的化学方程式: .
12.如图所示的是物质A~G相互间的关系(“→”表示物质间存在的转化关系,“﹣”表示两端的物质能发生化学反应)A、F都是单质;F是使用最多的金属材料;B是导致温室效应的主要气体;在工业上,C广泛用于玻璃、造纸、纺织和洗涤的生产等;E是一种蓝色溶液。请回答:
(1)C的化学式 ,D可能是 。
(2)写出G的一种用途 。
(3)写出标号①、②的化学反应方程式:
① 。
② 。
反应②的基本类型为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. CaCO3 放出大量的热,块状固体变成粉末 2NaOH+CO2=Na2CO3+H2O A、D
【分析】A、B都是氧化物,A固体可用作制冷剂,则A为二氧化碳;F常用于实验室制取A,则F为碳酸钙;A二氧化碳可以和E生成C,那么E为碱,C为碳酸盐;C可以转化为F碳酸钙和碱E,推测E为氢氧化钠、C为碳酸钠、D为氢氧化钙;A、B都是氧化物,B可以和水转化为氢氧化钙,B为氧化钙;经验证,符合题意。
【详解】根据以上分析可知:
(1)F的化学式为CaCO3;
(2)B→D的反应是氧化钙与水的反应,主要反应现象是:放出大量的热,块状固体变成粉末;
(3)A→C的转化是二氧化碳和氢氧化钠反应,其化学方程式为:2NaOH+CO2=Na2CO3+H2O;
(4)A~F中还能相互反应的两种物质是A二氧化碳和D氢氧化钙,能生成碳酸钙和水。
【点睛】本题是框图式推断题,关键是找准突破口,然后采用顺推或逆推或向中间推的方法,得出正确答案即可。
2. 空气 点燃 3CO+Fe2O3 3CO2+2Fe NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3 ↓
【分析】A、B、C、D、E、F、X、Y都是初中化学只的常见物质,已知X 是一种混合物,分离能得到稀有气体,说明X可能是空气;A、B、Y是单质;氮气和氢气在一定条件下生成氨气,通常情况下,氨气是一种具有刺激性气味且相对分子质量为17的气体,所以C是氨气,D、E是含有相同元素的氧化物,E和氧化铁高温生成D,所以D是二氧化碳,E是一氧化碳,D和Y高温生成一氧化碳,所以Y是碳,D是二氧化碳,B是氧气,A和氢气反应生成氨气,所以A是氮气,经过验证,推导正确。
【详解】根据以上分析可知:
(1)X的名称是空气;
(2)B与Y反应的条件是点燃;
(3)E+氧化铁→D的反应是一氧化碳高温条件下和氧化反应生成铁和二氧化碳,化学方程式是3CO+Fe2O3 3CO2+2Fe;
(4)C+D+饱和食盐水→F的反应是氨气和二氧化碳、和氯化钠、水生成氯化铵和碳酸氢钠化学方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3 ↓。
3.(1) Cu H2SO4
(2)置换反应
(3)
(4)
【分析】A~I是初中化学常见的物质,其中A、C、D均为单质; B为胃酸的主要成分,可推出B为盐酸;C是紫红色金属,可推出C为铜;F可用来改良酸性土壤,可推出F为氢氧化钙; G是酸雨中的一种酸,G能转化为B,可推出G为硫酸;B能转化为A,A能转化为C,可推出A为氢气,C能与D反应,可推出D为氧气,D能转化为H,H能转化为A,可推出H为水,F与I是同种类别的物质,F能转化为I,可推出I为氢氧化钠,F能转化为E,E能与B反应,可推出E为碳酸钙,代入验证,符合题意。
【详解】(1)由分析可知,C为铜,化学式为:Cu;G为硫酸,化学式为:H2SO4;
(2)B→A的反应为活泼金属和盐酸反应生成相应的盐和氢气,该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
(3)H→A的反应为水通电分解生成氢气和氧气,该反应的化学方程式为:;
(4) F→I的反应为氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,该反应的化学方程式为:。
4.(1)Ca(OH)2
(2)化合反应
(3)
(4)
【分析】A~G是初中所学的常见物成,C是大理石的主要成分,可推出C为碳酸钙,C在高温下反应生成B,B是气体,可推出B为二氧化碳,A、B常温下为无色气体且组成元素相同,可推出A为一氧化碳,D、E均为黑色固体,A能与D在高温下反应生成B和E,E能转化为D,可推出D为四氧化三铁,E为铁,B能与F转化为C和G,G能转化为F,可推出F为氢氧化钙,G为水,代入验证,符合题意。
【详解】(1)由分析可知,F为氢氧化钙,化学式为:Ca(OH)2;
(2)反应③为氧化钙和水反应生成氢氧化钙,该反应符合“多变一”的特点,属于化合反应;
(3)反应①为一氧化碳和四氧化三铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:;
(4)反应②为碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应的化学方程式为:。
5.(1) CaCO3 Cu(OH)2
(2)放出
(3)
(4)
【分析】A高温分解生成B和C,故A为碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,B氧化钙和水化合生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,H是蓝色沉淀,H为氢氧化铜,E为黑色粉末,与硫酸反应生成硫酸铜,与一氧化碳反应生成铜和C二氧化碳,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀。
【详解】(1)由上述分析可知A为碳酸钙,H为氢氧化铜,化学式分别为:A CaCO3,H Cu(OH)2。
(2)物质B氧化钙与水反应生成氢氧化钙时会放出热量。
(3)D为氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故D→F的化学方程式:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(4)E为氧化铜,氧化铜与一氧化碳在加热条件下反应生成铜和二氧化碳,故E→C的化学方程式:。
6.(1) O2 CuO
(2) Fe Ca(OH)2+CO2=CaCO3↓+H2O(合理即可) CuO+H2SO4=CuSO4+H2O
【详解】(1)氢气是最轻的气体,由E为最轻的气体,说明是氢气,D→E反应生成红色金属,说明能生成铜,所以D是含铜的化合物,且是黑色,所以D是氧化铜,A是黑色固体且能制取气体,所以A可以是碳,碳燃烧可以制取一氧化碳或二氧化碳,因为A还能与C反应,所以C是氧气,B也可以与C反应,所以B不能是二氧化碳,只能是一氧化碳;
①由上面的推理可知C是氧气,化学式为O2;
②D是氧化铜,化学式为CuO;
③A→B的反应物是碳和氧气点燃后不充分燃烧生成一氧化碳,反应的化学方程式为;
(2)A常用来改良酸性土壤属于氢氧化钙,D为蓝色溶液属于铜离子溶液,可以是硫酸铜溶液,E为人类从自然界中提取量最大的一种金属,属于铁;金属既可以与盐反应,也可以与酸反应,由于D是硫酸铜属于盐,所以C属于酸,又因为C可以制取硫酸铜,所以C属于硫酸,因为A、B、C属于不同类别的化合物,所以B可以是盐,因为氢氧化钙与二氧化碳反应能生成碳酸钙沉淀和水,所以B可以是碳酸钙。
①由上面的推理可知E是铁,化学式为Fe;
②A→B的反应物是氢氧化钙和二氧化碳,生成物是碳酸钙和水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;
③C→D的反应物可以是氧化铜和硫酸,生成物是硫酸铜和水,反应的化学方程式为CuO+H2SO4=CuSO4+H2O。
7.(1)烧碱或火碱或苛性钠
(2)Na2CO3
(3)
【分析】E是人体胃液中的一种酸,则E是盐酸,G是一种常见的建筑材料,则G可能是碳酸钙,D是碱,能转化生成碳酸钙,则D是氢氧化钙,氢氧化钙能与F相互转化,F为氧化物,则F可能是水,B是碱,则B可能是氢氧化钠,A是氧化物,且能与B反应,则A可能是二氧化碳,C能与氢氧化钠相互转化,且能与氢氧化钙反应,则C可能是碳酸钠,代入框图,推断合理。
【详解】(1)B为氢氧化钠,俗称烧碱、火碱、苛性钠;
(2)C为碳酸钠,化学式为:Na2CO3;
(3)反应①是A和D的反应,A是二氧化碳,D是氢氧化钙,能反应生成碳酸钙沉淀和水,该反应的方程式为:;
反应②是C转化生成B的反应,C是碳酸钠,B是氢氧化钠,可以由氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,该反应方程式为:。
8.(1) CO(合理即可)
(2) 盐
【详解】(1)常温下,若丁为红色粉末,甲为黑色粉末,甲能与乙转化为丁,丙能与乙转化为丁,可推出丁为铜,甲为碳,乙为氧化铜,丙为一氧化碳,代入验证,符合题意。
由分析可知,丙为一氧化碳,化学式为:CO;
甲与乙的反应为碳和氧化铜在高温下反应生成铜和二氧化碳,该反应的化学方程式为:;
(2)若丁为常见难溶性盐,常温下甲为气体,甲能与乙转化为丁,可推出甲为二氧化碳,则乙为氢氧化钙,丁为碳酸钙,乙能与丙转化为丁,丙可能是碳酸钠,碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐;
甲与乙反应为二氧化碳和氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:。
9.(1)纯碱
(2)
【分析】A是一种红棕色固体,则A为氧化铁;B是一种温室气体,能够由A(氧化铁)反应生成,则B为二氧化碳;F常作建筑材料,且能够与B(二氧化碳)反应,则F为氢氧化钙;E能够反应生成B(二氧化碳),还能够与F(氢氧化钙)反应,则E为碳酸钠;D能够与A(氧化铁)反应,还能够与E(碳酸钠)反应,则D为一种酸,可以是稀硫酸;C、D、E、F为四种不同类别的化合物,C能够由B(二氧化碳)反应生成,还能够与F(氢氧化钙)相互转化,则C为水。
【详解】(1)由分析可知,E为碳酸钠,其俗称为纯碱,故填纯碱。
(2)由分析可知,B为二氧化碳,C为水,则反应B→C可以是二氧化碳与氢氧化钠反应生成碳酸钠和水,故反应的化学方程式写为:CO2+2NaOH=Na2CO3+H2O;
由分析可知,A为氧化铁,D为稀硫酸,则反应A D是氧化铁与稀硫酸反应生成硫酸铁和水,故反应的化学方程式写为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
10. H2 Fe2O3 2H2O 通电 2H2↑+ O2↑ Fe2O3 + 3CO 高温 2Fe + 3CO2 NaOH、Na2CO3 2NaOH + CO2 == Na2CO3 + H2O
【详解】根据密度最小的气体,可先推出A是氢气,由溶液呈黄色可推出溶液中含有铁离子,再根据“A、B、C中含有同一种元素”可推出B为水,C中含有氢元素,且能与含铁的化合物反应,所以C为盐酸,D为气体单质,B为水,可推出D为氧气,根据产生气体的图象可以推测,溶液中必定为可溶性碱和碳酸盐的混合物,还得保证该碳酸盐与该碱不反应,所以溶质为氢氧化钠与碳酸钠,进而推出H为碳酸钙,由于工业常用G→F反应炼铁,又因为GF可以相互转化,则F为二氧化碳,G为一氧化碳;所以,(1) A是氢气,化学式是H2;C→B 的反应现象为生成黄色溶液,由此推断与C反应生成B的物质是Fe2O3 ;(2) B→D的化学方程式为:2H2O2H2↑+ O2↑;(3) G→F反应炼铁,该反应的化学方程式是:Fe2O3 + 3CO2Fe + 3CO2;(4) E→H 产生白色沉淀,过滤后向滤液中滴加稀盐酸,反应开始一段时间后,产生气体,说明氢氧化钠过量,故滤液中含有氢氧化钠和碳酸钠;F→E的化学方程式为:2NaOH + CO2 == Na2CO3 + H2O。
11. Cu Na2CO3+Ca(OH)2=CaCO3↓+2NaOH CuO+H2Cu+H2O Al+3AgNO3═Al(NO3)3+3Ag
【分析】根据框图中A~I物质均为初中化学常见物质,且分别是由H、C、O、S、Na、Al、Ca、Cu、Ag中的一种或几种元素组成的,在通常情况下,D与其他物质的状态不同,D、G、H、I均为单质,G为紫红色固体,所以G是铜,H在空气中表面生成一层致密的氧化膜,具有很好的抗腐蚀性能,所以H是铝,铝和铜都会转化成I,所以I是银,铝也会转化成单质D,所以D是氢气,B可用来改良酸性土壤,所以B是氢氧化钙,A、F均为由三种元素组成的盐,A、F会与氢氧化钙反应,F会转化成的铜,所以F是硫酸铜,A是碳酸钠,C会与碳酸钠反应,C会转化成的硫酸铜、氢气,所以C是硫酸,E会转化成硫酸铜,所以E是氧化铜,然后将推出的物质进行验证即可。
【详解】(1)由分析可知,G是Cu;
(2)A与B的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
D与E的反应是氧化铜和氢气在加热的条件下生成铜和水,化学方程式为:CuO+H2Cu+H2O;
H→I的反应是铝和硝酸银反应生成硝酸铝和银,化学方程式为:Al+3AgNO3═Al(NO3)3+3Ag。
12. Na2CO3; Ca(OH)2; 除锈 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓; Fe+CuSO4=FeSO4+Cu; 置换反应;
【详解】根据F是使用最多的金属材料; B是导致温室效应的主要气体;在工业上,C广泛用于玻璃、造纸、纺织和洗涤剂的生产等;E是一种蓝色溶液,可得F是铁、B是二氧化碳、C是碳酸钠、E是硫酸铜,由图示可知A可能是碳或氧气,G能够与碳酸钠和铁反应,则G是酸可以是,D既能与碳酸钠反应又能与硫酸铜反应,故D可以是氢氧化钙(只要合理即可);
(1)由分析知C的化学式Na2CO3;G可能是氢氧化钙;
(2)G是盐酸或硫酸,可以用来除掉金属表面的锈;
(3)反应①是碳酸钠与氢氧化钙的反应,方程式为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;反应②是铁与硫酸铜的反应,方程式为Fe+CuSO4=FeSO4+Cu,该反应的特点是单质与化合物硫酸铜生成单质铜和化合物硫酸亚铁的过程,所以是置换反应;
答案第1页,共2页
答案第1页,共2页
