3.1铁及其化合物课件(共51张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1铁及其化合物课件(共51张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 56.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-29 07:32:46 | ||
图片预览








文档简介
(共51张PPT)
补铁剂的选择
铁及其化合物
(1)经常感觉到软弱无力、疲倦困乏
(2)皮肤、粘膜、指甲、口唇等颜色苍白或苍黄
(3)稍微运动就感到心悸、气短
(4)经常有头晕眼花、四肢无力、注意力不集中
(5)头发干枯、脱落
(6)嗜睡,睡眠质量差
(7)食欲减退、食不知味
(8)女生妇女月经量多
缺铁性贫血的常见症状:
初步选铁
你知道哪些铁的单质或化合物,写出它们并进行分类
任务一:哪类物质更适合做补铁剂?
类别 离子方程式
单质
氧化物
碱
盐
优化选铁
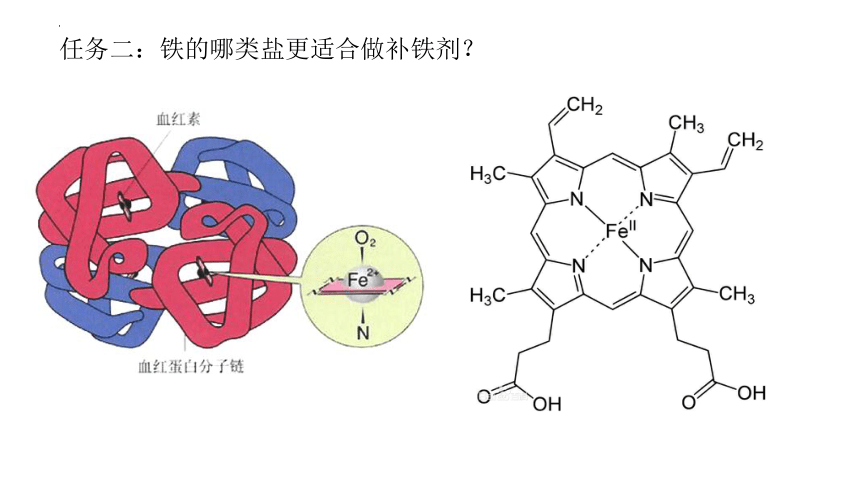
任务二:铁的哪类盐更适合做补铁剂?
GB14880—2012《营养强化剂使用的卫生标准》中的有19 种:硫酸亚铁、葡萄糖酸亚铁、柠檬酸铁铵、富马酸亚铁、柠檬酸铁、乳酸亚铁、氯化高铁血红素、焦磷酸铁、铁卟啉、甘氨酸亚铁、还原铁、乙二胺四乙酸铁钠、羰基铁粉、碳酸亚铁、柠檬酸亚铁、延胡索酸亚铁、琥珀酸亚铁、血红素铁、电解铁
铁盐为什么也能做补铁剂?
预测Fe3+的性质 预测依据
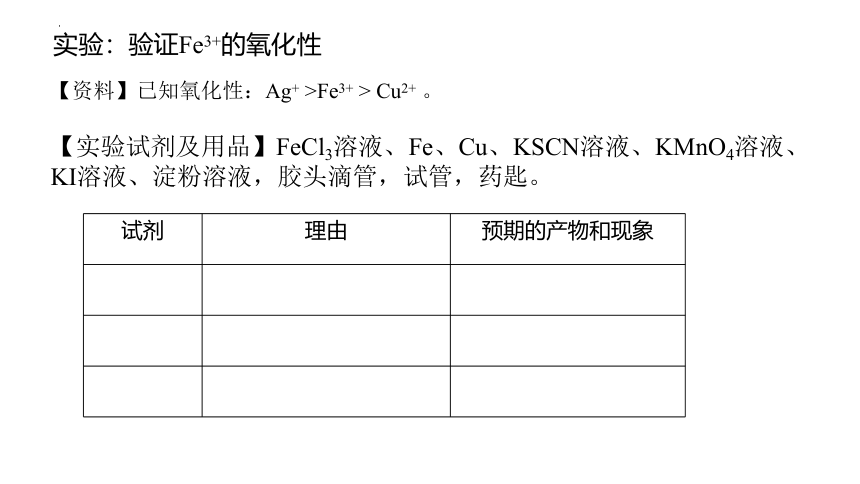
【实验试剂及用品】FeCl3溶液、Fe、Cu、KSCN溶液、KMnO4溶液、KI溶液、淀粉溶液,胶头滴管,试管,药匙。
实验:验证Fe3+的氧化性
试剂 理由 预期的产物和现象
【资料】已知氧化性:Ag+ >Fe3+ > Cu2+ 。
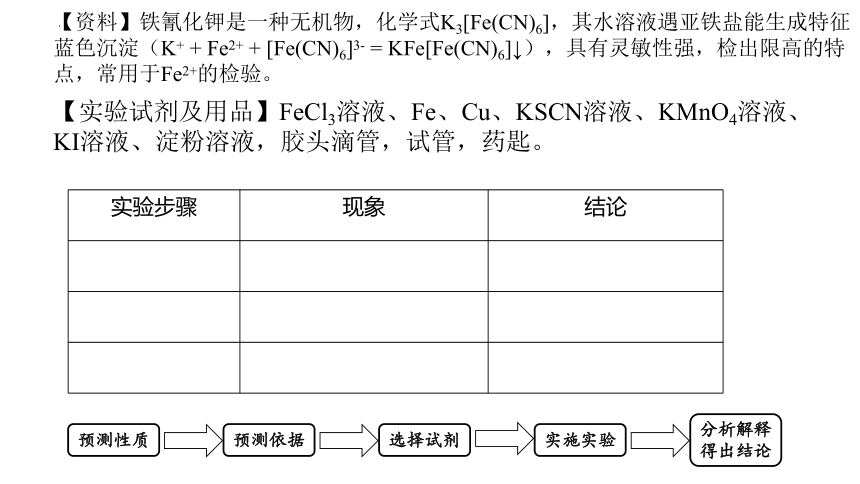
【实验试剂及用品】FeCl3溶液、Fe、Cu、KSCN溶液、KMnO4溶液、KI溶液、淀粉溶液,胶头滴管,试管,药匙。
实验步骤 现象 结论
预测性质
预测依据
选择试剂
实施实验
分析解释
得出结论
【资料】铁氰化钾是一种无机物,化学式K3[Fe(CN)6],其水溶液遇亚铁盐能生成特征蓝色沉淀(K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓),具有灵敏性强,检出限高的特点,常用于Fe2+的检验。
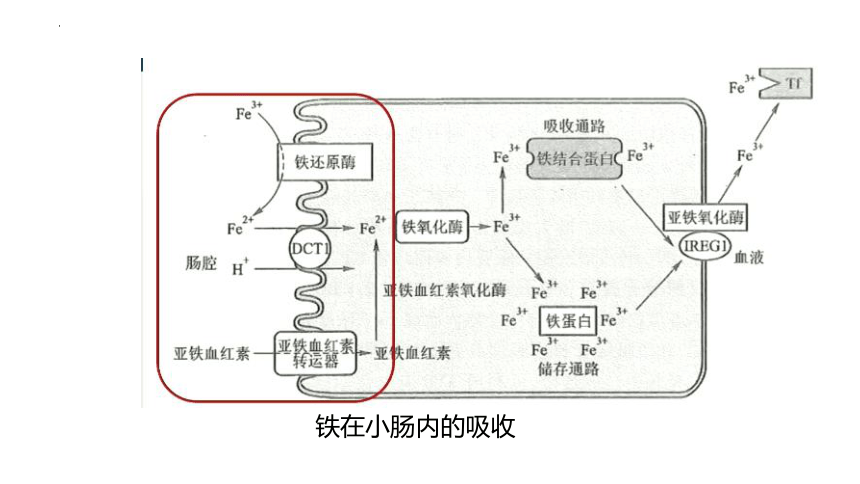
铁在小肠内的吸收
富含铁的食物
任务三:从价类两个角度优化含铁物质的分类
OH-
还原剂
S2-、I-
Zn、Fe、Cu
补铁剂的使用
铁及其化合物
任务1:预测FeSO4的性质
任务1:预测FeSO4的性质
预测FeSO4的性质 预测依据
【实验试剂及用品】FeSO4溶液、FeCl3溶液、Zn、KSCN溶液、KMnO4溶液、H2O2溶液、新制氯水、BaCl2溶液、NaOH溶液,胶头滴管,试管,药匙。
试剂 理由 预期的产物和现象
任务2:设计实验方案验证预测
实验步骤 现象 结论
【实验试剂及用品】FeSO4溶液、FeCl3溶液、Zn、KSCN溶液、KMnO4溶液、H2O2溶液、新制氯水、BaCl2溶液、NaOH溶液,胶头滴管,试管,药匙。
【资料】硫氰化钾是一种无机物,化学式KSCN,其水溶液遇Fe3+能生成红色的Fe(SCN)3( Fe3+ + 3SCN)- = Fe(SCN)3),具有灵敏性强,检出限高的特点,常用于Fe3+的检验。
任务3:硫酸亚铁补铁剂的使用和保存
结合硫酸亚铁的性质,硫酸亚铁补铁剂应如何使用和保存。
小组讨论
任务3:硫酸亚铁补铁剂的使用和保存
任务4:如何高效使用含Fe3+的食物或补铁剂
富含铁的食物
第三代补铁剂(大分子复合物)
第一代补铁剂的代表是硫酸亚铁、第二代补铁剂的代表是葡萄酸亚铁。均为Fe2+,但Fe2+对肠胃的刺激较强,有一定的副作用。
任务5:如何科学补铁
不挑食,遵医嘱。
阅读拓展材料,思考科学补铁的方法。
任务6:梳理二维图中含铁物质的性质
知识梳理
铁及其化合物
自然界中的铁元素
铁元素在地壳中的含量排在第四位,仅次于氧硅铝,是含量第二多的金属元素
来自天上的铁元素
人类最早使用的铁,就是来自太空的陨铁
来自地下的铁元素
西周---玉柄铁剑
战国时期的铁器——铁火盆
来自古代的铁
人体中的铁元素
缺铁性贫血Fe2+
血红蛋白
食品药品中的铁
铁是人体内含量最多的必需微量元素
成人每天摄入铁的适宜量为15-20mg。
据最新数据显示,中国缺铁性贫血发生率高达20%。
铁摄入不足,就会引起贫血。
生活中的铁元素
涂料 Fe2O3
Fe2O3
FeO
青砖
常见的铁矿石
黄铁矿
(FeS2)
赤铁矿
(Fe2O3)
菱铁矿
(FeCO3)
磁铁矿
(Fe3O4)
铁的冶炼
铁的冶炼
1. 冶炼方法:用还原的方法把铁从铁矿石中提炼出来
2. 高炉炼铁
Fe2O3 + 3CO 2Fe + 3CO2
其中生成CO的反应是
C + O2 CO2
CO2 + C 2CO
原料:铁矿石、焦炭、空气、石灰石
思考:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,这是为什么呢?
淬火:打铁的工艺之一,为了增强铁器的硬度、
稳定性等性能。
铁及其化合物
3. Fe与水蒸气的反应
实验装置
操作及现象
实验结论
A、B、C三处设计有何意图
铁及其化合物
3. Fe与水蒸气的反应
实验装置
操作及现象
实验结论
用火柴点燃肥皂泡,听到爆鸣声,反应后试管内固体仍为黑色
红热的铁能与水蒸气反应:
3Fe+4H2O(g) Fe3O4+4H2
A产生水蒸气、B提供反应所需高温、C检验反应产物
A、B、C三处设计有何意图
化学式 FeO Fe2O3 Fe3O4
俗名
矿石
颜色状态 ____色粉末 ____色粉末 ____色晶体
化合价
溶解性 用途
一、铁的氧化物
1. 物理性质
铁红
磁性氧化铁
赤铁矿
磁铁矿
+2
+3
+2,+3
不溶于水
红色油漆和涂料
炼铁原料
黑
红棕
黑
FeO不稳定,在空气中受热:__________________________________。
6 FeO + O2 ==== 2 Fe3O4
△
②从价态角度分析三种氧化物的性质
化学式 FeO Fe2O3 Fe3O4
化合价 +2 +3 +2、+3
性质
氧化性、还原性
氧化性
氧化性、还原性
二、铁的氢氧化物
预测它们可能存在的化学性质
化学式 Fe(OH)2 Fe(OH)3
化合价 +2 +3
性质?
实验室如何进行制备?阅读实验3—1
通常操作:
FeSO4
NaOH
原因分析:
1.亚铁盐易变质
2.溶液中溶解了少量的O2
3.滴加试剂过程中带入O2
如何克服?
有白色浑浊,白色迅速变成灰绿色,最后变成红褐色
副反应:4Fe(OH)2 +O2+2H2O=4Fe(OH)3
现象:
FeSO4溶液
NaOH溶液
实验创新
1.使用新配制的FeSO4溶液和NaOH溶液。
2.把NaOH溶液或配制溶液用的蒸馏水加热煮沸除去溶解氧
3.滴入溶液时将胶头滴管伸入液面以下
4.用植物油将反应体系与空气隔离.
具体措施
NaOH溶液
FeSO4溶液
实验创新
铁屑、稀H2SO4
NaOH溶液
以铁屑、NaOH溶液、稀H2SO4来制备Fe(OH)2
有人设计装置如下,制备Fe(OH)2可防止被氧化,请分析这样设计的思路。
试一试:设计其它方法来制备Fe(OH)2
Fe、Fe3+与Fe2+的相互转化
Fe
Fe2+
Fe3+
还原剂 如Fe、Zn、Cu、I-等
强氧化剂 如Cl2、O2、HNO3、KMnO4等
弱氧化剂 如H+、Cu2+、S等
强还原剂 如Zn、Al、CO、H2等
强氧化剂 如Cl2、HNO3、浓硫酸等
强还原剂 如Zn、Al、CO、H2等
(1)铜粉中混有铁粉:
、 。
(1)FeCl3溶液中混有FeCl2 :
、 。
(2)FeCl2溶液中混有FeCl3
、 。
Cl2
2Fe2++Cl2=2Fe3++2Cl-
Fe
Fe+2Fe3+=3Fe2+
任务1:检验硫酸亚铁糖浆中的含铁微粒
任务1:检验硫酸亚铁糖浆中的含铁微粒
从价类两个角度思考可以采用哪些方法检验硫酸亚铁糖浆中的含铁微粒
试剂 理由(方程式表示) 预期的现象
盐
+2
Fe2+
试剂 预期现象 实际现象
任务1:检验硫酸亚铁糖浆中的含铁微粒
【实验试剂及用品】糖浆稀释液、NaOH溶液、KSCN溶液、KMnO4溶液、H2O2溶液、新制氯水,胶头滴管,试管,药匙。
任务2:异常现象的分析和再验证
异常现象 猜想 实验验证 结论
【资料】铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐,其水溶液遇亚铁盐能生成特征蓝色沉淀(3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓),具有灵敏性强,检出限高的特点,常用于Fe2+的检验。
利用新试剂再次检验硫酸亚铁糖浆中的含铁微粒
步骤 现象 结论
任务3:硫酸亚铁糖浆中的含铁微粒再检验
复杂环境中离子检验的方法
补铁剂的选择
铁及其化合物
(1)经常感觉到软弱无力、疲倦困乏
(2)皮肤、粘膜、指甲、口唇等颜色苍白或苍黄
(3)稍微运动就感到心悸、气短
(4)经常有头晕眼花、四肢无力、注意力不集中
(5)头发干枯、脱落
(6)嗜睡,睡眠质量差
(7)食欲减退、食不知味
(8)女生妇女月经量多
缺铁性贫血的常见症状:
初步选铁
你知道哪些铁的单质或化合物,写出它们并进行分类
任务一:哪类物质更适合做补铁剂?
类别 离子方程式
单质
氧化物
碱
盐
优化选铁
任务二:铁的哪类盐更适合做补铁剂?
GB14880—2012《营养强化剂使用的卫生标准》中的有19 种:硫酸亚铁、葡萄糖酸亚铁、柠檬酸铁铵、富马酸亚铁、柠檬酸铁、乳酸亚铁、氯化高铁血红素、焦磷酸铁、铁卟啉、甘氨酸亚铁、还原铁、乙二胺四乙酸铁钠、羰基铁粉、碳酸亚铁、柠檬酸亚铁、延胡索酸亚铁、琥珀酸亚铁、血红素铁、电解铁
铁盐为什么也能做补铁剂?
预测Fe3+的性质 预测依据
【实验试剂及用品】FeCl3溶液、Fe、Cu、KSCN溶液、KMnO4溶液、KI溶液、淀粉溶液,胶头滴管,试管,药匙。
实验:验证Fe3+的氧化性
试剂 理由 预期的产物和现象
【资料】已知氧化性:Ag+ >Fe3+ > Cu2+ 。
【实验试剂及用品】FeCl3溶液、Fe、Cu、KSCN溶液、KMnO4溶液、KI溶液、淀粉溶液,胶头滴管,试管,药匙。
实验步骤 现象 结论
预测性质
预测依据
选择试剂
实施实验
分析解释
得出结论
【资料】铁氰化钾是一种无机物,化学式K3[Fe(CN)6],其水溶液遇亚铁盐能生成特征蓝色沉淀(K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓),具有灵敏性强,检出限高的特点,常用于Fe2+的检验。
铁在小肠内的吸收
富含铁的食物
任务三:从价类两个角度优化含铁物质的分类
OH-
还原剂
S2-、I-
Zn、Fe、Cu
补铁剂的使用
铁及其化合物
任务1:预测FeSO4的性质
任务1:预测FeSO4的性质
预测FeSO4的性质 预测依据
【实验试剂及用品】FeSO4溶液、FeCl3溶液、Zn、KSCN溶液、KMnO4溶液、H2O2溶液、新制氯水、BaCl2溶液、NaOH溶液,胶头滴管,试管,药匙。
试剂 理由 预期的产物和现象
任务2:设计实验方案验证预测
实验步骤 现象 结论
【实验试剂及用品】FeSO4溶液、FeCl3溶液、Zn、KSCN溶液、KMnO4溶液、H2O2溶液、新制氯水、BaCl2溶液、NaOH溶液,胶头滴管,试管,药匙。
【资料】硫氰化钾是一种无机物,化学式KSCN,其水溶液遇Fe3+能生成红色的Fe(SCN)3( Fe3+ + 3SCN)- = Fe(SCN)3),具有灵敏性强,检出限高的特点,常用于Fe3+的检验。
任务3:硫酸亚铁补铁剂的使用和保存
结合硫酸亚铁的性质,硫酸亚铁补铁剂应如何使用和保存。
小组讨论
任务3:硫酸亚铁补铁剂的使用和保存
任务4:如何高效使用含Fe3+的食物或补铁剂
富含铁的食物
第三代补铁剂(大分子复合物)
第一代补铁剂的代表是硫酸亚铁、第二代补铁剂的代表是葡萄酸亚铁。均为Fe2+,但Fe2+对肠胃的刺激较强,有一定的副作用。
任务5:如何科学补铁
不挑食,遵医嘱。
阅读拓展材料,思考科学补铁的方法。
任务6:梳理二维图中含铁物质的性质
知识梳理
铁及其化合物
自然界中的铁元素
铁元素在地壳中的含量排在第四位,仅次于氧硅铝,是含量第二多的金属元素
来自天上的铁元素
人类最早使用的铁,就是来自太空的陨铁
来自地下的铁元素
西周---玉柄铁剑
战国时期的铁器——铁火盆
来自古代的铁
人体中的铁元素
缺铁性贫血Fe2+
血红蛋白
食品药品中的铁
铁是人体内含量最多的必需微量元素
成人每天摄入铁的适宜量为15-20mg。
据最新数据显示,中国缺铁性贫血发生率高达20%。
铁摄入不足,就会引起贫血。
生活中的铁元素
涂料 Fe2O3
Fe2O3
FeO
青砖
常见的铁矿石
黄铁矿
(FeS2)
赤铁矿
(Fe2O3)
菱铁矿
(FeCO3)
磁铁矿
(Fe3O4)
铁的冶炼
铁的冶炼
1. 冶炼方法:用还原的方法把铁从铁矿石中提炼出来
2. 高炉炼铁
Fe2O3 + 3CO 2Fe + 3CO2
其中生成CO的反应是
C + O2 CO2
CO2 + C 2CO
原料:铁矿石、焦炭、空气、石灰石
思考:在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,这是为什么呢?
淬火:打铁的工艺之一,为了增强铁器的硬度、
稳定性等性能。
铁及其化合物
3. Fe与水蒸气的反应
实验装置
操作及现象
实验结论
A、B、C三处设计有何意图
铁及其化合物
3. Fe与水蒸气的反应
实验装置
操作及现象
实验结论
用火柴点燃肥皂泡,听到爆鸣声,反应后试管内固体仍为黑色
红热的铁能与水蒸气反应:
3Fe+4H2O(g) Fe3O4+4H2
A产生水蒸气、B提供反应所需高温、C检验反应产物
A、B、C三处设计有何意图
化学式 FeO Fe2O3 Fe3O4
俗名
矿石
颜色状态 ____色粉末 ____色粉末 ____色晶体
化合价
溶解性 用途
一、铁的氧化物
1. 物理性质
铁红
磁性氧化铁
赤铁矿
磁铁矿
+2
+3
+2,+3
不溶于水
红色油漆和涂料
炼铁原料
黑
红棕
黑
FeO不稳定,在空气中受热:__________________________________。
6 FeO + O2 ==== 2 Fe3O4
△
②从价态角度分析三种氧化物的性质
化学式 FeO Fe2O3 Fe3O4
化合价 +2 +3 +2、+3
性质
氧化性、还原性
氧化性
氧化性、还原性
二、铁的氢氧化物
预测它们可能存在的化学性质
化学式 Fe(OH)2 Fe(OH)3
化合价 +2 +3
性质?
实验室如何进行制备?阅读实验3—1
通常操作:
FeSO4
NaOH
原因分析:
1.亚铁盐易变质
2.溶液中溶解了少量的O2
3.滴加试剂过程中带入O2
如何克服?
有白色浑浊,白色迅速变成灰绿色,最后变成红褐色
副反应:4Fe(OH)2 +O2+2H2O=4Fe(OH)3
现象:
FeSO4溶液
NaOH溶液
实验创新
1.使用新配制的FeSO4溶液和NaOH溶液。
2.把NaOH溶液或配制溶液用的蒸馏水加热煮沸除去溶解氧
3.滴入溶液时将胶头滴管伸入液面以下
4.用植物油将反应体系与空气隔离.
具体措施
NaOH溶液
FeSO4溶液
实验创新
铁屑、稀H2SO4
NaOH溶液
以铁屑、NaOH溶液、稀H2SO4来制备Fe(OH)2
有人设计装置如下,制备Fe(OH)2可防止被氧化,请分析这样设计的思路。
试一试:设计其它方法来制备Fe(OH)2
Fe、Fe3+与Fe2+的相互转化
Fe
Fe2+
Fe3+
还原剂 如Fe、Zn、Cu、I-等
强氧化剂 如Cl2、O2、HNO3、KMnO4等
弱氧化剂 如H+、Cu2+、S等
强还原剂 如Zn、Al、CO、H2等
强氧化剂 如Cl2、HNO3、浓硫酸等
强还原剂 如Zn、Al、CO、H2等
(1)铜粉中混有铁粉:
、 。
(1)FeCl3溶液中混有FeCl2 :
、 。
(2)FeCl2溶液中混有FeCl3
、 。
Cl2
2Fe2++Cl2=2Fe3++2Cl-
Fe
Fe+2Fe3+=3Fe2+
任务1:检验硫酸亚铁糖浆中的含铁微粒
任务1:检验硫酸亚铁糖浆中的含铁微粒
从价类两个角度思考可以采用哪些方法检验硫酸亚铁糖浆中的含铁微粒
试剂 理由(方程式表示) 预期的现象
盐
+2
Fe2+
试剂 预期现象 实际现象
任务1:检验硫酸亚铁糖浆中的含铁微粒
【实验试剂及用品】糖浆稀释液、NaOH溶液、KSCN溶液、KMnO4溶液、H2O2溶液、新制氯水,胶头滴管,试管,药匙。
任务2:异常现象的分析和再验证
异常现象 猜想 实验验证 结论
【资料】铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐,其水溶液遇亚铁盐能生成特征蓝色沉淀(3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓),具有灵敏性强,检出限高的特点,常用于Fe2+的检验。
利用新试剂再次检验硫酸亚铁糖浆中的含铁微粒
步骤 现象 结论
任务3:硫酸亚铁糖浆中的含铁微粒再检验
复杂环境中离子检验的方法
