化学人教版(2019)必修第一册2.1钠及其化合物(共79张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1钠及其化合物(共79张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 200.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-30 08:33:02 | ||
图片预览







文档简介
(共79张PPT)
第一节 钠及其化合物
第二章 海水中的重要元素
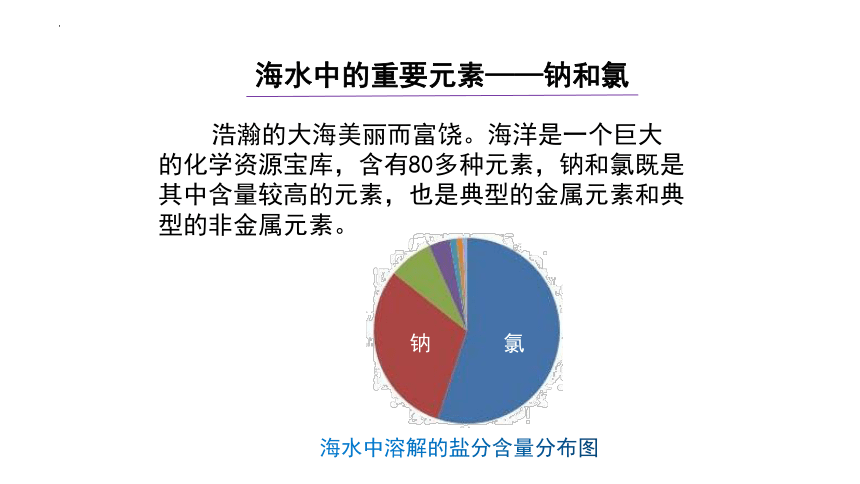
浩瀚的大海美丽而富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。
海水中的重要元素——钠和氯
海水中溶解的盐分含量分布图
氯
钠
海水
钠
海水
海水
钠
钠
海水
钠
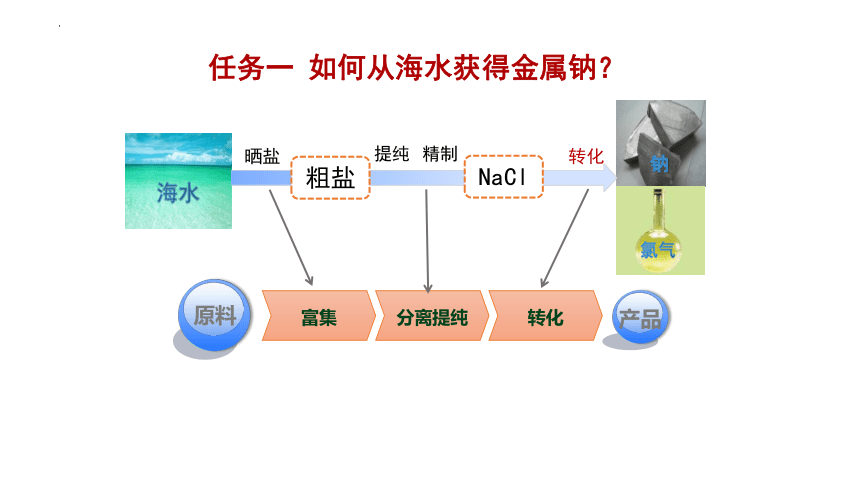
任务一 如何从海水获得金属钠?
转化
氯气
2NaCl(熔融) 2Na + Cl2 ↑
电解
晒盐
粗盐
提纯
精制
NaCl
海水
钠
海水
海水
钠
钠
海水
钠
转化
氯气
晒盐
粗盐
提纯
精制
NaCl
富集
分离提纯
转化
原料
产品
任务一 如何从海水获得金属钠?
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
资料二:工业金属钠国家标准(节选)
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
资料二:工业金属钠国家标准(节选)
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
资料二:工业金属钠国家标准(节选)
工业金属钠采用双层包装,外包装采用铁桶包装,内包装采用双层聚乙烯塑料袋,包装时将袋内空气排净后扎紧口袋。运输时,应用密闭的运输工具,严防有水进入包装桶内,运输中注意防水、防热、防撞击、远离易燃物。工业金属钠应储存于通风、阴凉、干燥、防火的库房内,要隔绝热源、火种、氧化剂、酸类等。凡与金属钠接触的操作人员应遵守下列规则,操作人员应佩戴安全防护面罩,穿化学防护服,戴橡胶手套等。在发生火灾情况下,可使用干砂,干粉石,棉布灭火,不应使用水、泡沫、酸碱、四氯化碳、二氧化碳灭火器灭火。
预测钠可能具有的性质 预测依据
任务二 预测金属钠的性质
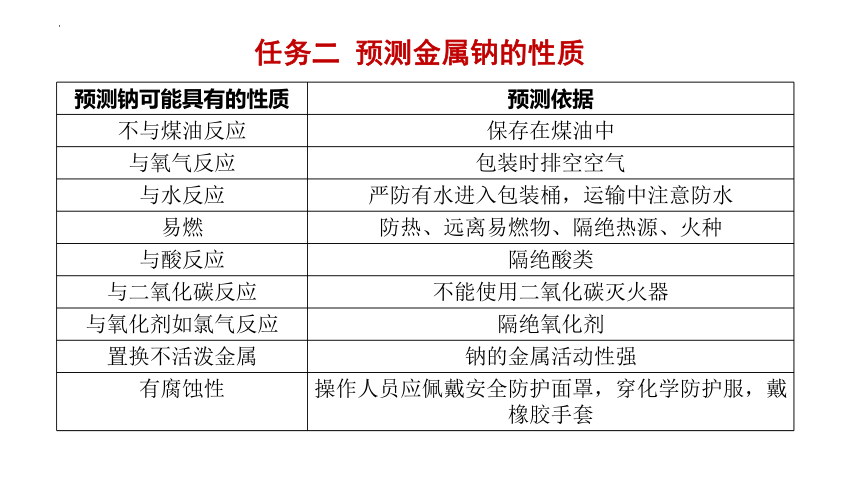
预测钠可能具有的性质 预测依据
不与煤油反应 保存在煤油中
与氧气反应 包装时排空空气
与水反应 严防有水进入包装桶,运输中注意防水
易燃 防热、远离易燃物、隔绝热源、火种
与酸反应 隔绝酸类
与二氧化碳反应 不能使用二氧化碳灭火器
与氧化剂如氯气反应 隔绝氧化剂
置换不活泼金属 钠的金属活动性强
有腐蚀性 操作人员应佩戴安全防护面罩,穿化学防护服,戴橡胶手套
任务二 预测金属钠的性质
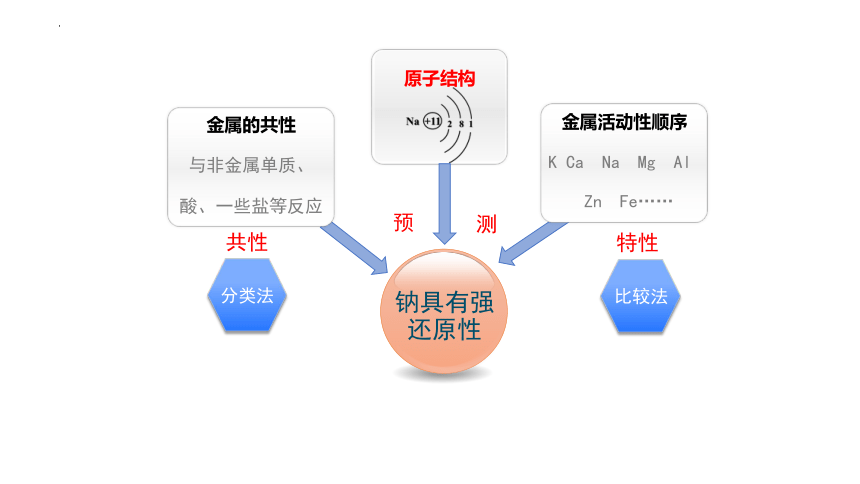
钠具有强还原性
金属的共性
与非金属单质、
酸、一些盐等反应
原子结构
预
测
金属活动性顺序
K Ca Na Mg Al
Zn Fe……
共性
分类法
特性
比较法
任务三 探究金属钠的性质
2 、钠的物理性质:
银白色固体,
有金属光泽、
质软(硬度小),
密度比水小、比煤油大,
熔点和沸点都较低
思考
新切开的钠的断面有何变化?为什么?
银白色、金属光泽; 很快变暗
实验法
观察法
4Na + O2 2Na2O
1、钠与氧气反应
任务三 探究金属钠的性质
注:本视频经过快速播放处理
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
熔点低
2Na + O2
△
任务三 探究金属钠的性质
常温:
加热:
-2
-1
条件不同
产物不同
4Na + O2 2Na2O
(灰白色)
(淡黄色)
2Na + O2 Na2O2
△
1、钠与氧气反应
任务三 探究金属钠的性质
【预测】
从物质组成及氧化还原反应的角度,
预测钠与水反应的生成物: 。
NaOH 、H2
2、钠与水的反应
任务三 探究金属钠的性质
【实验】
从钠在水中的位置、钠的形状的变化、溶液颜色的变化等方面观察和描述实验现象。分析实验现象,你能得出哪些结论?
任务三 探究金属钠的性质
实验现象 分析及结论
浮在水面
熔化成液态小球
在水面无规则游动
经过处水溶液变红
密度比水的小
反应放热,钠的熔点低
产生气体
生成可溶性碱
收集的气体可以点燃
生成可燃性气体
2Na + 2H2O 2NaOH + H2↑
2Na + 2H2O 2Na+ + 2OH + H2↑
2、钠与水的反应
任务三 探究金属钠的性质
(1)钠与石蜡油或煤油不反应,且钠的密度大于石蜡油或煤油的密度,能隔绝空气。
(2)钠可与水剧烈反应,同时放出大量热和可燃性气体氢气,故钠着火时不能用水灭火。应用干的沙土扑灭。
(1)为什么实验室里将钠保存在石蜡油或煤油中?
(2)钠着火时能否用水灭火?应如何灭火?
探究与分享
3、钠与硫酸铜溶液的反应
任务三 探究金属钠的性质
2Na + 2H2O + CuSO4 = Cu(OH)2↓ + H2↑ + Na2SO4
2Na + 2H2O + Cu2+ = Cu(OH)2↓ + H2↑ + 2Na+
金属钠不能在水溶液中置换出不活泼金属!
1.与氧气反应
2.与水反应:
化学性质非常活泼,有很强的还原性
4Na + O2 == 2Na2O(灰白色固体)
2Na + O2 == Na2O2(淡黄色固体)
2Na + 2H2O == 2NaOH + H2
【小结】
钠的化学性质:
除水剂
2
制备不活泼金属
3
制备钠-硫新型电池、制备染料、制药的中间体
4
核反应堆冷却剂
5
制备过氧化钠
1
钠的
用途
高压钠灯
6
强
还
原
性
导热性
钠的用途
2Na+O2=Na2O2
△
2Na+2H2O=2NaOH+H2↑
4Na+TiCl4(熔融)=4NaCl+Ti
性质
决定
用途
高压钠灯使用时发出金白色光,具有发光效率高、透雾能力强等优点,广泛应用于室外照明。
火箭发射后释放出钠蒸气,产生明亮的橙黄色云雾,科学家据此可以确定火箭在空中的位置。
预测
实验
解释与结论
科学探究的步骤和方法
物质类别
元素化合价
反应规律
基于实验证据
进行分析、归纳、概括、推论
分类法
类比法
对比法
观察法
实验法
归纳法
思考:将钠投入煤油和水的混合物中会发生什么样的的现象呢?
因为钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。
钠在界面与煤油中上下跳动,并与水反应产生气泡。
会跳舞的钠
判断正误,正确的画“√”,错误的画“×”。
(1)钠原子最外层只有1个电子,所以金属钠的还原性弱。( )
(2)钠是银白色金属,硬度大。( )
(3)钠在空气中燃烧,发出黄色火焰,生成淡黄色的氧化钠。( )
(4)钠与水反应过程中钠熔成小球,说明钠与水反应放出热量。( )
(5)由于钠与水反应生成具有强腐蚀性的NaOH,所以不能用手直接接触钠。( )
(6)火灾现场有大量金属钠时,应迅速用高压水枪灭火,以防止钠燃烧起来。( )
(7)在氧化还原反应中,金属钠一定只做还原剂。( )
×
×
×
√
√
√
×
练一练
二、钠的几种化合物
任务一 请从物质分类角度预测氧化钠能与哪些物质发生反应?
Na2O + H2O 2NaOH
H2O
碱性氧化物
碱
Na2O + CO2 Na2CO3
酸性氧化物
Na2O + 2HCl H2O + NaCl
酸
过氧化钠与水反应生成什么物质呢?
氧化钠与水的反应
实验操作 实验现象 结论
将1~2 mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中
用手轻轻触摸试管外壁
pH试纸检验溶液酸碱性
反应原理 剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
pH试纸变蓝
反应产生O2
生成碱
反应放热
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2H2O 4Na+ + 4OH + O2↑
过氧化钠与水反应
过氧化钠与水的反应
设计实验验证过氧化钠与水反应的机理
问题2
过氧化钠与含有CO2和水蒸汽的空气接触时,既能产生O2,又能吸收空气中的CO2。利用该技术将药板装备于潜艇、宇宙飞船、呼吸面具等密闭环境中,供人们呼吸应急使用。
2Na2O2 + 2CO2 2Na2CO3 + O2
白色
淡黄色
1∶2
1∶2
是
不是
总结
任务二 碳酸钠和碳酸氢钠的外观相似,如何鉴别?
Na2CO3
白色粉末
NaHCO3
白色细小晶体
(1)外观
在两支试管中分别加入少量Na2CO3和NaHCO3
盐 Na2CO3 NaHCO3
(2)向两支试管中分别滴入几滴水,振荡,观察现象;用手触摸试管壁,感受热量变化
结论与解释 加几滴水后,结块变成晶体;温度上升
加几滴水后,少部分溶解;温度下降
碳酸氢钠能溶于
水,并伴随吸热现象。
无水碳酸钠遇水生成有结晶水的碳酸钠晶体(Na2CO3·xH2O),并伴随放热现象。
盐 Na2CO3 NaHCO3
(3)继续向(2)的试管中分别加入5 mL水,用力振荡。
初步结论 振荡后可溶解
固体量有所减少
溶解度(20℃)
Na2CO3:21.5 g
NaHCO3:9.6 g
碳酸钠和碳酸氢钠均能溶于水,
碳酸钠溶解性更强。
盐 Na2CO3 NaHCO3
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液
初步结论 溶液变红
(较深)
溶液微红
两种物质的水溶液均呈碱性,
且碱性:Na2CO3>NaHCO3。
盐 Na2CO3 NaHCO3
(5)分别加热Na2CO3 和NaHCO3,观察现象。
初步结论 无明显现象
试管口有小液滴出现,澄清石灰水变浑浊
2NaHCO3 Na2CO3 + H2O + CO2↑
△
碳酸钠较稳定,受热不易分解。
碳酸氢钠不稳定,受热易分解
2、碳酸钠和碳酸氢钠
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
白色粉末
白色细小晶体
俗名:纯碱、苏打
俗名:小苏打
易溶于水,
溶于水时放热
比碳酸钠的溶解度要小,溶于水时吸热
其水溶液显碱性
其水溶液的碱性比碳酸钠的弱
碳酸氢钠不稳定,受热容易分解
碳酸氢钠稳定,受热不分解
2NaHCO3 == Na2CO3 + H2O + CO2↑
(1)厨房去油污,为什么建议用碳酸钠而不是用碳酸氢钠?
任务三 请结合性质解释用途
碳酸钠碱性强
(2)治疗胃酸过多为什么选用碳酸氢钠而不用碳酸钠?
NaHCO3碱性弱,对人体伤害小,且见效迅速
制作面包类食品时,常用碳酸氢钠和固体酸性材料做成的膨松剂,这种膨松剂在接触水时会产生气体,烘焙时会产生更多气体,使面包更为松软。
Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应滴加CaCl2溶液Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1化学方程式如何书写?如何判断?现象有何不同?为何不同?现象如何判断?反应原理?反应方程式?还有哪些类似的物质能否改为Ca(OH)2?现象有何不同?Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1如何判断?现象有何不同?为何不同?现象如何判断?能否改为Ca(OH)2?现象有何不同?反应原理?反应方程式?还有哪些类似的物质Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1现象有何不同?为何不同?现象如何判断?能否改为Ca(OH)2?现象有何不同?反应速度快的是NaHCO3反应速度慢的是Na2CO3反应原理?反应方程式?还有哪些类似的物质Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1现象如何判断?能否改为Ca(OH)2?现象有何不同?现象:直接产生气泡的是NaHCO3一段时间后有气泡产生的是Na2CO3。原因:反应原理?反应方程式?还有哪些类似的物质竞 争Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1能否改为Ca(OH)2?现象有何不同?现象:红色浅的是NaHCO3红色深的是Na2CO3。原因:第一步水解大于第二步水解反应原理?反应方程式?还有哪些类似的物质Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1能否改为Ca(OH)2?现象有何不同?原理:HCO3-+ AlO2-+ H2O = Al(OH)3↓ + CO32-强酸制弱酸HCO3-与AlO2-不能大量共存类似:酸性: 化工之母——纯碱
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
1.CO2 +H2O + NH3 + NaCl (饱和) NH4Cl + NaHCO3↓
2.2NaHCO3 Na2CO3 + H2O + CO2
上述原理中应用了NaHCO3的哪些性质?
侯德榜
碳酸氢钠的溶解性
△
和对热具有不稳定性
代表物
Na
Na2O和Na2O2
NaOH
研究内容
物理性质
化学性质
制法
用途
……
金属及其化合物的研究思路
物质类别
单质
氧化物
氢氧化物
盐
Na2CO3和NaHCO3
研究视角
物质分类
元素化合价
反应规律
比较法
类比法
实验法
观察法
归纳法
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
焰色试验
节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物呈现的各种艳丽色彩。
联合制碱工业
侯德榜著名科学家,杰出化学家,侯氏制碱法的创始人,中国重化学工业的开拓者。 近代化学工业的奠基人之一,是世界制碱业的权威。
20世纪20年代,突破氨碱法制碱技术的奥秘,主持建成亚洲第一座纯碱厂;30年代,领导建成了中国第一座兼产合成氨、硝酸、硫酸和硫酸铵的联合企业;40~50年代,又发明了连续生产纯碱与氯化铵的联合制碱新工艺,以及碳化法合成氨流程制碳酸氢铵化肥新工艺;并使之在60年代实现了工业化和大面积推广。
1926年,中国"红三角"牌纯碱入万国博览会,获金质奖章。侯德榜积极传播交流科学技术,培育了很多科技人才,为发展科学技术和化学工业做出了卓越贡献。
一、纯碱工业的发展史:
纯碱是重要的化工原料之一,也是大众消费品,广泛应用于玻璃工业、钢铁工业、化学工业、医药工业、搪瓷、纺织、印染、造纸、食品等多种工业的生产。用量极大,被誉为“化工之母”。 纯碱工业始于18世纪末,法国人路布兰,比利时人索尔维,中国人侯德榜等,都先后作出了突出的贡献。
资料卡:人类最初是从盐碱湖中得到纯碱的,但是,随着工业的迅速发展,已远远不能满足生产的需要。1862年,比利时化学家索尔维,创立了以食盐、石灰石、氨为主要原料的索尔维制碱法(又叫氨碱法),由于产量高、质量优、能连续生产,很快被应用于工业化生产。
索尔维制碱法
经过查阅大量资料和实验,1861年索尔维用氨溶液、二氧化碳与食盐混合制成碳酸钠(称为氨碱法)
索尔维本身既是科学家又是家底雄厚的实业家,万贯家财都捐给科学事业。索尔维提供了召开世界最高水平学术会议——“索尔维会议”的经费。
索尔维国际会议
索尔维法流程
资料背景:19世纪60年代,在欧洲食盐,石灰石已经可以大量得到,价格较低,而氨气的价格比较贵,主要通过铵盐得到。
问题2:滤液的成分是什么?
问题3:滤液中NaHCO3含量高吗?NH4Cl的含量高吗?
问题4:索尔维希望从滤液中得到什么?如何得到?
NaHCO3 和NH4Cl和少量NaCl
问题1:我们知道NaHCO3是溶于水的,
为什么会析出NaHCO3晶体呢
副产物处理: NH4Cl+Ca(OH)2反应,最后未充分利用的NaCl 和 CaCl2 作为废液处理
在索尔维制碱法中,不仅有大量的 NaCl 没有充分利用,而且要建立庞大的石灰石锻烧厂处理副产物 NH4Cl,都大大地提高了生产成本。
侯氏制碱法的流程图
侯德榜制碱背景:
1、内地盐价较贵
2、工业合成氨已经成熟,氨气价格已经大幅度降低
3、氯化铵是一种有市场潜力的化工产品和化肥
NaHCO3 和NH4Cl和少量NaCl
思考:在当时背景下侯德榜希望从滤液中得到什么?如何得到?
NaCl和NH4Cl溶解度数据
请比较侯氏制碱法和索尔维制碱法的流程图,分析二者过程的相同与不同之处
第一节 钠及其化合物
第二章 海水中的重要元素
浩瀚的大海美丽而富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯既是其中含量较高的元素,也是典型的金属元素和典型的非金属元素。
海水中的重要元素——钠和氯
海水中溶解的盐分含量分布图
氯
钠
海水
钠
海水
海水
钠
钠
海水
钠
任务一 如何从海水获得金属钠?
转化
氯气
2NaCl(熔融) 2Na + Cl2 ↑
电解
晒盐
粗盐
提纯
精制
NaCl
海水
钠
海水
海水
钠
钠
海水
钠
转化
氯气
晒盐
粗盐
提纯
精制
NaCl
富集
分离提纯
转化
原料
产品
任务一 如何从海水获得金属钠?
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
资料二:工业金属钠国家标准(节选)
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
资料二:工业金属钠国家标准(节选)
任务二 预测金属钠的性质
资料一:实验室中金属钠保存在煤油中
资料二:工业金属钠国家标准(节选)
工业金属钠采用双层包装,外包装采用铁桶包装,内包装采用双层聚乙烯塑料袋,包装时将袋内空气排净后扎紧口袋。运输时,应用密闭的运输工具,严防有水进入包装桶内,运输中注意防水、防热、防撞击、远离易燃物。工业金属钠应储存于通风、阴凉、干燥、防火的库房内,要隔绝热源、火种、氧化剂、酸类等。凡与金属钠接触的操作人员应遵守下列规则,操作人员应佩戴安全防护面罩,穿化学防护服,戴橡胶手套等。在发生火灾情况下,可使用干砂,干粉石,棉布灭火,不应使用水、泡沫、酸碱、四氯化碳、二氧化碳灭火器灭火。
预测钠可能具有的性质 预测依据
任务二 预测金属钠的性质
预测钠可能具有的性质 预测依据
不与煤油反应 保存在煤油中
与氧气反应 包装时排空空气
与水反应 严防有水进入包装桶,运输中注意防水
易燃 防热、远离易燃物、隔绝热源、火种
与酸反应 隔绝酸类
与二氧化碳反应 不能使用二氧化碳灭火器
与氧化剂如氯气反应 隔绝氧化剂
置换不活泼金属 钠的金属活动性强
有腐蚀性 操作人员应佩戴安全防护面罩,穿化学防护服,戴橡胶手套
任务二 预测金属钠的性质
钠具有强还原性
金属的共性
与非金属单质、
酸、一些盐等反应
原子结构
预
测
金属活动性顺序
K Ca Na Mg Al
Zn Fe……
共性
分类法
特性
比较法
任务三 探究金属钠的性质
2 、钠的物理性质:
银白色固体,
有金属光泽、
质软(硬度小),
密度比水小、比煤油大,
熔点和沸点都较低
思考
新切开的钠的断面有何变化?为什么?
银白色、金属光泽; 很快变暗
实验法
观察法
4Na + O2 2Na2O
1、钠与氧气反应
任务三 探究金属钠的性质
注:本视频经过快速播放处理
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
熔点低
2Na + O2
△
任务三 探究金属钠的性质
常温:
加热:
-2
-1
条件不同
产物不同
4Na + O2 2Na2O
(灰白色)
(淡黄色)
2Na + O2 Na2O2
△
1、钠与氧气反应
任务三 探究金属钠的性质
【预测】
从物质组成及氧化还原反应的角度,
预测钠与水反应的生成物: 。
NaOH 、H2
2、钠与水的反应
任务三 探究金属钠的性质
【实验】
从钠在水中的位置、钠的形状的变化、溶液颜色的变化等方面观察和描述实验现象。分析实验现象,你能得出哪些结论?
任务三 探究金属钠的性质
实验现象 分析及结论
浮在水面
熔化成液态小球
在水面无规则游动
经过处水溶液变红
密度比水的小
反应放热,钠的熔点低
产生气体
生成可溶性碱
收集的气体可以点燃
生成可燃性气体
2Na + 2H2O 2NaOH + H2↑
2Na + 2H2O 2Na+ + 2OH + H2↑
2、钠与水的反应
任务三 探究金属钠的性质
(1)钠与石蜡油或煤油不反应,且钠的密度大于石蜡油或煤油的密度,能隔绝空气。
(2)钠可与水剧烈反应,同时放出大量热和可燃性气体氢气,故钠着火时不能用水灭火。应用干的沙土扑灭。
(1)为什么实验室里将钠保存在石蜡油或煤油中?
(2)钠着火时能否用水灭火?应如何灭火?
探究与分享
3、钠与硫酸铜溶液的反应
任务三 探究金属钠的性质
2Na + 2H2O + CuSO4 = Cu(OH)2↓ + H2↑ + Na2SO4
2Na + 2H2O + Cu2+ = Cu(OH)2↓ + H2↑ + 2Na+
金属钠不能在水溶液中置换出不活泼金属!
1.与氧气反应
2.与水反应:
化学性质非常活泼,有很强的还原性
4Na + O2 == 2Na2O(灰白色固体)
2Na + O2 == Na2O2(淡黄色固体)
2Na + 2H2O == 2NaOH + H2
【小结】
钠的化学性质:
除水剂
2
制备不活泼金属
3
制备钠-硫新型电池、制备染料、制药的中间体
4
核反应堆冷却剂
5
制备过氧化钠
1
钠的
用途
高压钠灯
6
强
还
原
性
导热性
钠的用途
2Na+O2=Na2O2
△
2Na+2H2O=2NaOH+H2↑
4Na+TiCl4(熔融)=4NaCl+Ti
性质
决定
用途
高压钠灯使用时发出金白色光,具有发光效率高、透雾能力强等优点,广泛应用于室外照明。
火箭发射后释放出钠蒸气,产生明亮的橙黄色云雾,科学家据此可以确定火箭在空中的位置。
预测
实验
解释与结论
科学探究的步骤和方法
物质类别
元素化合价
反应规律
基于实验证据
进行分析、归纳、概括、推论
分类法
类比法
对比法
观察法
实验法
归纳法
思考:将钠投入煤油和水的混合物中会发生什么样的的现象呢?
因为钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。
钠在界面与煤油中上下跳动,并与水反应产生气泡。
会跳舞的钠
判断正误,正确的画“√”,错误的画“×”。
(1)钠原子最外层只有1个电子,所以金属钠的还原性弱。( )
(2)钠是银白色金属,硬度大。( )
(3)钠在空气中燃烧,发出黄色火焰,生成淡黄色的氧化钠。( )
(4)钠与水反应过程中钠熔成小球,说明钠与水反应放出热量。( )
(5)由于钠与水反应生成具有强腐蚀性的NaOH,所以不能用手直接接触钠。( )
(6)火灾现场有大量金属钠时,应迅速用高压水枪灭火,以防止钠燃烧起来。( )
(7)在氧化还原反应中,金属钠一定只做还原剂。( )
×
×
×
√
√
√
×
练一练
二、钠的几种化合物
任务一 请从物质分类角度预测氧化钠能与哪些物质发生反应?
Na2O + H2O 2NaOH
H2O
碱性氧化物
碱
Na2O + CO2 Na2CO3
酸性氧化物
Na2O + 2HCl H2O + NaCl
酸
过氧化钠与水反应生成什么物质呢?
氧化钠与水的反应
实验操作 实验现象 结论
将1~2 mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中
用手轻轻触摸试管外壁
pH试纸检验溶液酸碱性
反应原理 剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
pH试纸变蓝
反应产生O2
生成碱
反应放热
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2H2O 4Na+ + 4OH + O2↑
过氧化钠与水反应
过氧化钠与水的反应
设计实验验证过氧化钠与水反应的机理
问题2
过氧化钠与含有CO2和水蒸汽的空气接触时,既能产生O2,又能吸收空气中的CO2。利用该技术将药板装备于潜艇、宇宙飞船、呼吸面具等密闭环境中,供人们呼吸应急使用。
2Na2O2 + 2CO2 2Na2CO3 + O2
白色
淡黄色
1∶2
1∶2
是
不是
总结
任务二 碳酸钠和碳酸氢钠的外观相似,如何鉴别?
Na2CO3
白色粉末
NaHCO3
白色细小晶体
(1)外观
在两支试管中分别加入少量Na2CO3和NaHCO3
盐 Na2CO3 NaHCO3
(2)向两支试管中分别滴入几滴水,振荡,观察现象;用手触摸试管壁,感受热量变化
结论与解释 加几滴水后,结块变成晶体;温度上升
加几滴水后,少部分溶解;温度下降
碳酸氢钠能溶于
水,并伴随吸热现象。
无水碳酸钠遇水生成有结晶水的碳酸钠晶体(Na2CO3·xH2O),并伴随放热现象。
盐 Na2CO3 NaHCO3
(3)继续向(2)的试管中分别加入5 mL水,用力振荡。
初步结论 振荡后可溶解
固体量有所减少
溶解度(20℃)
Na2CO3:21.5 g
NaHCO3:9.6 g
碳酸钠和碳酸氢钠均能溶于水,
碳酸钠溶解性更强。
盐 Na2CO3 NaHCO3
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液
初步结论 溶液变红
(较深)
溶液微红
两种物质的水溶液均呈碱性,
且碱性:Na2CO3>NaHCO3。
盐 Na2CO3 NaHCO3
(5)分别加热Na2CO3 和NaHCO3,观察现象。
初步结论 无明显现象
试管口有小液滴出现,澄清石灰水变浑浊
2NaHCO3 Na2CO3 + H2O + CO2↑
△
碳酸钠较稳定,受热不易分解。
碳酸氢钠不稳定,受热易分解
2、碳酸钠和碳酸氢钠
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
白色粉末
白色细小晶体
俗名:纯碱、苏打
俗名:小苏打
易溶于水,
溶于水时放热
比碳酸钠的溶解度要小,溶于水时吸热
其水溶液显碱性
其水溶液的碱性比碳酸钠的弱
碳酸氢钠不稳定,受热容易分解
碳酸氢钠稳定,受热不分解
2NaHCO3 == Na2CO3 + H2O + CO2↑
(1)厨房去油污,为什么建议用碳酸钠而不是用碳酸氢钠?
任务三 请结合性质解释用途
碳酸钠碱性强
(2)治疗胃酸过多为什么选用碳酸氢钠而不用碳酸钠?
NaHCO3碱性弱,对人体伤害小,且见效迅速
制作面包类食品时,常用碳酸氢钠和固体酸性材料做成的膨松剂,这种膨松剂在接触水时会产生气体,烘焙时会产生更多气体,使面包更为松软。
Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应滴加CaCl2溶液Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1化学方程式如何书写?如何判断?现象有何不同?为何不同?现象如何判断?反应原理?反应方程式?还有哪些类似的物质能否改为Ca(OH)2?现象有何不同?Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1如何判断?现象有何不同?为何不同?现象如何判断?能否改为Ca(OH)2?现象有何不同?反应原理?反应方程式?还有哪些类似的物质Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1现象有何不同?为何不同?现象如何判断?能否改为Ca(OH)2?现象有何不同?反应速度快的是NaHCO3反应速度慢的是Na2CO3反应原理?反应方程式?还有哪些类似的物质Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1现象如何判断?能否改为Ca(OH)2?现象有何不同?现象:直接产生气泡的是NaHCO3一段时间后有气泡产生的是Na2CO3。原因:反应原理?反应方程式?还有哪些类似的物质竞 争Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1能否改为Ca(OH)2?现象有何不同?现象:红色浅的是NaHCO3红色深的是Na2CO3。原因:第一步水解大于第二步水解反应原理?反应方程式?还有哪些类似的物质Na2CO3和NaHCO3的鉴别固体加热固体与酸反应盐溶液与酸互滴滴加酚酞溶液与NaAlO2溶液反应a滴加CaCl2溶液1能否改为Ca(OH)2?现象有何不同?原理:HCO3-+ AlO2-+ H2O = Al(OH)3↓ + CO32-强酸制弱酸HCO3-与AlO2-不能大量共存类似:酸性: 化工之母——纯碱
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
1.CO2 +H2O + NH3 + NaCl (饱和) NH4Cl + NaHCO3↓
2.2NaHCO3 Na2CO3 + H2O + CO2
上述原理中应用了NaHCO3的哪些性质?
侯德榜
碳酸氢钠的溶解性
△
和对热具有不稳定性
代表物
Na
Na2O和Na2O2
NaOH
研究内容
物理性质
化学性质
制法
用途
……
金属及其化合物的研究思路
物质类别
单质
氧化物
氢氧化物
盐
Na2CO3和NaHCO3
研究视角
物质分类
元素化合价
反应规律
比较法
类比法
实验法
观察法
归纳法
很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
焰色试验
节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物呈现的各种艳丽色彩。
联合制碱工业
侯德榜著名科学家,杰出化学家,侯氏制碱法的创始人,中国重化学工业的开拓者。 近代化学工业的奠基人之一,是世界制碱业的权威。
20世纪20年代,突破氨碱法制碱技术的奥秘,主持建成亚洲第一座纯碱厂;30年代,领导建成了中国第一座兼产合成氨、硝酸、硫酸和硫酸铵的联合企业;40~50年代,又发明了连续生产纯碱与氯化铵的联合制碱新工艺,以及碳化法合成氨流程制碳酸氢铵化肥新工艺;并使之在60年代实现了工业化和大面积推广。
1926年,中国"红三角"牌纯碱入万国博览会,获金质奖章。侯德榜积极传播交流科学技术,培育了很多科技人才,为发展科学技术和化学工业做出了卓越贡献。
一、纯碱工业的发展史:
纯碱是重要的化工原料之一,也是大众消费品,广泛应用于玻璃工业、钢铁工业、化学工业、医药工业、搪瓷、纺织、印染、造纸、食品等多种工业的生产。用量极大,被誉为“化工之母”。 纯碱工业始于18世纪末,法国人路布兰,比利时人索尔维,中国人侯德榜等,都先后作出了突出的贡献。
资料卡:人类最初是从盐碱湖中得到纯碱的,但是,随着工业的迅速发展,已远远不能满足生产的需要。1862年,比利时化学家索尔维,创立了以食盐、石灰石、氨为主要原料的索尔维制碱法(又叫氨碱法),由于产量高、质量优、能连续生产,很快被应用于工业化生产。
索尔维制碱法
经过查阅大量资料和实验,1861年索尔维用氨溶液、二氧化碳与食盐混合制成碳酸钠(称为氨碱法)
索尔维本身既是科学家又是家底雄厚的实业家,万贯家财都捐给科学事业。索尔维提供了召开世界最高水平学术会议——“索尔维会议”的经费。
索尔维国际会议
索尔维法流程
资料背景:19世纪60年代,在欧洲食盐,石灰石已经可以大量得到,价格较低,而氨气的价格比较贵,主要通过铵盐得到。
问题2:滤液的成分是什么?
问题3:滤液中NaHCO3含量高吗?NH4Cl的含量高吗?
问题4:索尔维希望从滤液中得到什么?如何得到?
NaHCO3 和NH4Cl和少量NaCl
问题1:我们知道NaHCO3是溶于水的,
为什么会析出NaHCO3晶体呢
副产物处理: NH4Cl+Ca(OH)2反应,最后未充分利用的NaCl 和 CaCl2 作为废液处理
在索尔维制碱法中,不仅有大量的 NaCl 没有充分利用,而且要建立庞大的石灰石锻烧厂处理副产物 NH4Cl,都大大地提高了生产成本。
侯氏制碱法的流程图
侯德榜制碱背景:
1、内地盐价较贵
2、工业合成氨已经成熟,氨气价格已经大幅度降低
3、氯化铵是一种有市场潜力的化工产品和化肥
NaHCO3 和NH4Cl和少量NaCl
思考:在当时背景下侯德榜希望从滤液中得到什么?如何得到?
NaCl和NH4Cl溶解度数据
请比较侯氏制碱法和索尔维制碱法的流程图,分析二者过程的相同与不同之处
