化学人教版(2019)必修第一册2.3物质的量(共51张ppt)共3课时
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3物质的量(共51张ppt)共3课时 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-29 00:00:00 | ||
图片预览





文档简介
(共51张PPT)
第二章 第三节 物质的量
宏微结合的桥梁
C + O2 === CO2
点燃
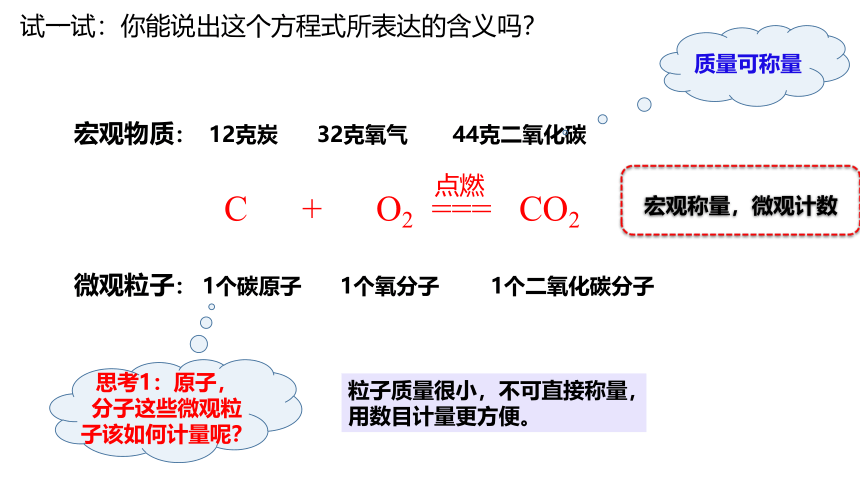
试一试:你能说出这个方程式所表达的含义吗?
宏观物质: 12克炭 32克氧气 44克二氧化碳
微观粒子: 1个碳原子 1个氧分子 1个二氧化碳分子
质量可称量
思考1:原子,分子这些微观粒子该如何计量呢?
粒子质量很小,不可直接称量,用数目计量更方便。
宏观称量,微观计数
思考2:如何准确快速的确定12 g 碳或1 mL 水中的微粒数目呢?
一滴水的讲述
一滴水的体积大约是0.05 mL,一滴水的质量大约是0.05 g,其中含有多少水分子呢?
1.67×1021 个
如果让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完。
定量微粒数目:不能逐个去数,而只能按照一定的数目标准进行“打包” 或“分堆”
来计量。
1打啤酒:12支
1包A4纸:500张
同样的道理:化学中用物质的量来表示“打包” 或“分堆” 后的微粒。
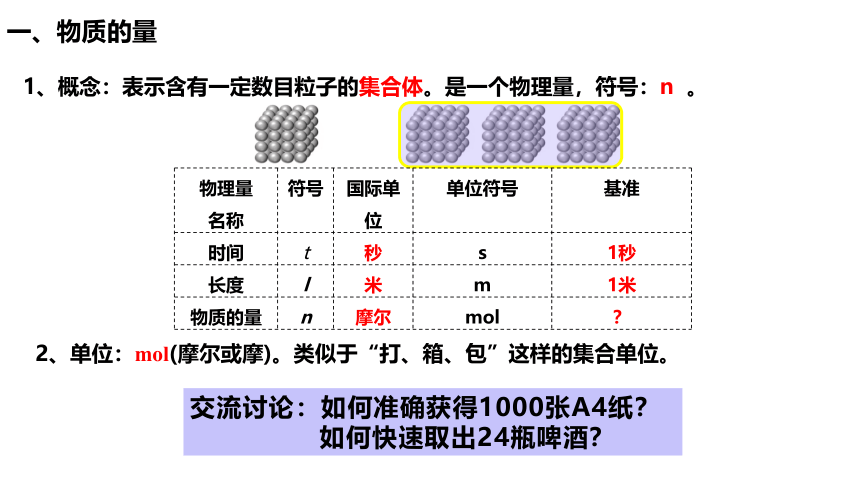
1、概念:表示含有一定数目粒子的集合体。是一个物理量,符号:n 。
2、单位:mol(摩尔或摩)。类似于“打、箱、包”这样的集合单位。
交流讨论:如何准确获得1000张A4纸?
如何快速取出24瓶啤酒?
一、物质的量
物理量 名称 符号 国际单位 单位符号 基准
时间 t 秒 s 1秒
长度 l 米 m 1米
物质的量 n 摩尔 mol ?
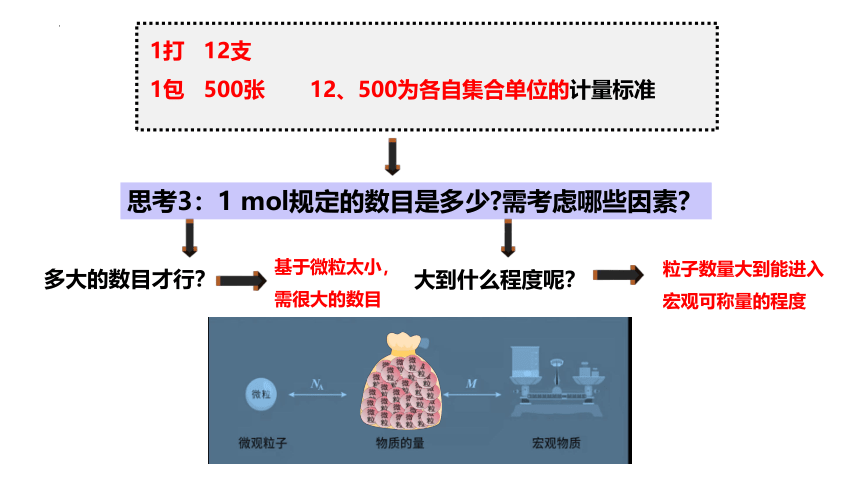
1打 12支
1包 500张 12、500为各自集合单位的计量标准
思考3:1 mol规定的数目是多少 需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
粒子数量大到能进入宏观可称量的程度
基于微粒太小,需很大的数目
20000÷299000000=0.00066889632爽
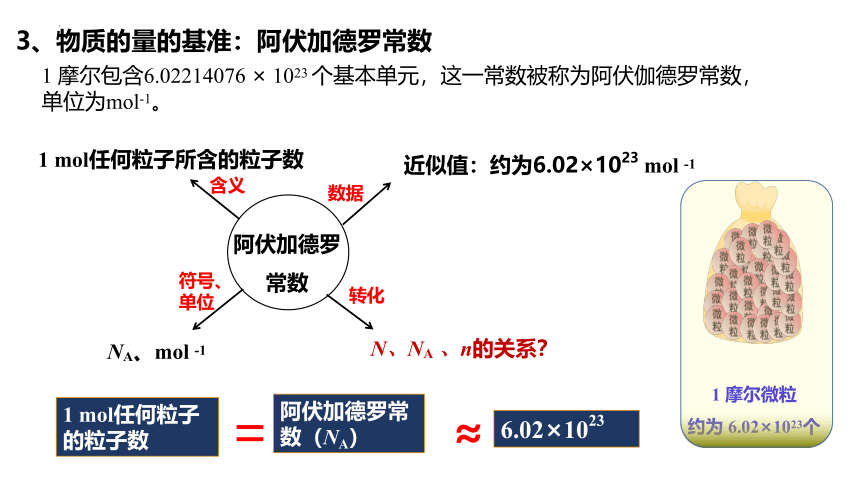
3、物质的量的基准:阿伏加德罗常数
数据
转化
阿伏加德罗 常数
1 mol任何粒子所含的粒子数
NA、mol -1
含义
符号、单位
N、NA 、n的关系?
近似值:约为6.02×1023 mol -1
1 mol任何粒子的粒子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
1 摩尔微粒
约为 6.02×1023个
1 摩尔包含6.02214076 × 1023 个基本单元,这一常数被称为阿伏伽德罗常数,单位为mol-1。
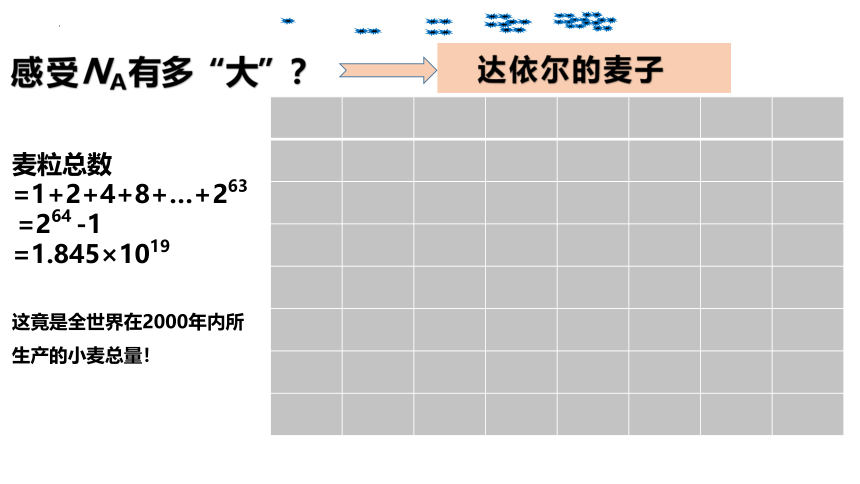
达依尔的麦子
感受NA有多“大”?
麦粒总数=1+2+4+8+…+263
=264 -1
=1.845×1019
这竟是全世界在2000年内所生产的小麦总量!
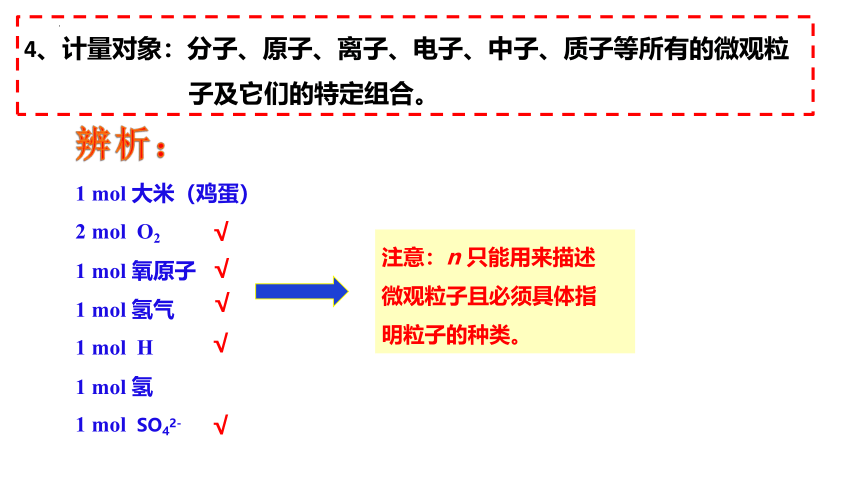
辨析:
1 mol 大米(鸡蛋)
2 mol O2
1 mol 氧原子
1 mol 氢气
1 mol H
1 mol 氢
1 mol SO42-
注意:n 只能用来描述
微观粒子且必须具体指
明粒子的种类。
4、计量对象:分子、原子、离子、电子、中子、质子等所有的微观粒
子及它们的特定组合。
√
√
√
√
√
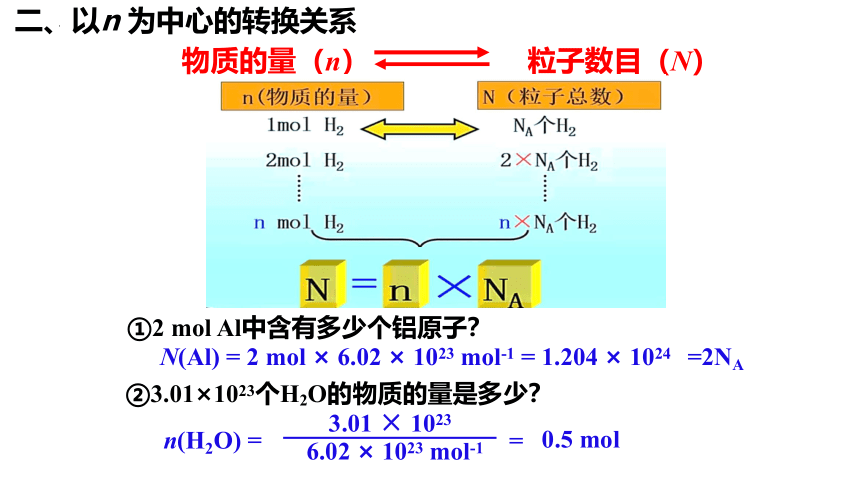
物质的量(n) 粒子数目(N)
①2 mol Al中含有多少个铝原子?
N(Al) = 2 mol × 6.02 × 1023 mol-1 = 1.204 × 1024 =2NA
②3.01×1023个H2O的物质的量是多少?
3.01 × 1023
6.02 × 1023 mol-1
n(H2O) =
=
0.5 mol
二、以n 为中心的转换关系
(1)N、NA 、n 的转换
①1.5 mol O2含有氧气分子的数目是多少?氧原子的数目是多少?
②含有3.01 × 1023 个氧原子的H2O的物质的量是多少?
课堂练习1
N = n﹒NA 或 n=
N
NA
1 mol不同物质中所含的粒子数是相同的,但由于不同微粒的质量不同,所以 1 mol不同物质的质量也不同。
计算填表:
计算1 mol H2O、1 mol 铝的质量 ,并回忆H2O、Al的相对分子(原子)质量。请思考二者之间的关系?
物质微粒 1个微粒的实际质量(g) 6.02×1023个微粒的质量(g) 相对分子(或原子)质量
H2O 2.990×10-23
Al 4.485×10-23
18
27
17.9998
26.9997
2、摩尔质量
概念:单位物质的量的物质所具有的质量。
符号:M; 单位:g/mol;
规律:1 mol任何粒子或物质的质量以克为单位时,
其数值都与其相对分子(原子)质量相等。
例如:Na的摩尔质量是23 g/mol
CO2的摩尔质量是44 g/mol
18g H2O
约6.02 ×1023个水分子
1 mol H2O
27g Al
约6.02 ×1023个铝原子
1 mol Al
(2)n、m、M的转化
课堂练习2
3、m、M、n 转换
③3.01 × 1023 个CO2的质量是多少?
④含48 g氧元素的葡萄糖(C6H12O6),其分子数目是多少?
m = n﹒M 或 n=
m
M
物质的量(n) 物质质量(m)
①计算2 mol CO2的质量是多少?
②12 g 镁的物质的量是多少?
×M
M÷
物质的量
微观
粒子个数
宏观
物质质量
×NA
÷NA
概念:集合体 符号:n 单位:mol
物质的量的基准: NA ≈ 6.02×1023 mol-1
沟通宏观与微观的桥梁
n=
m
M
=
N
NA
四、课堂小结
课堂测评
1.2018年11月13日至16日,第26届国际计量大会在巴黎召开。这次,对物质的量的单位——摩尔的定义进行了修改。下列对“摩尔”的理解正确的是( )
A.我们把含有6.02×1023个粒子的任何粒子集合体计量为1摩尔
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与所含微观粒子的数量联系起来
D.摩尔是用来描述物质所含微粒数目多少的基本物理量
2.下列对阿伏加德罗常数的理解,正确的是( )
A.阿伏加德罗常数是化学上常用的一个单位
B.8 mol NH3含有8NA个NH3分子
C.通常情况下,6.02×1023就是我们所说的阿伏加德罗常数
D.粒子的数目越多,所含该粒子的物质的量不一定越大
B
B
3.下列关于2 mol二氧化碳的叙述中,正确的是( )
A.质量为44 g B.有4 mol原子
C.分子数为6.02×1023 D.摩尔质量为44 g·mol-1
4.下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g·mol-1
C.1 g H2和1 g N2所含分子数相等
D.等质量的N2、CH4、CO、H2O中,CH4所含分子数最多
5.设NA表示阿伏加德罗常数,下列说法不正确的是( )
A.醋酸的摩尔质量与NA个醋酸分子的质量(以g为单位时)在数值上相等
B.NA个氧分子和NA个氢分子质量比等于16:1
C.2.4 g镁所含镁原子数为0.2NA
D.17 g NH3所含的原子数目为4NA
D
D
C
二、气体摩尔体积
课本P56
粒子数相同
体积相同
体积不同
体积不同
结论:
(1)相同温度和压强下,1mol不同的固态物质或液态物质的体积是不相同的。
(2)相同温度和压强下,1mol不同气体的体积几乎是相同的。
1. “了解”------ 影响物质体积的因素有哪些?
问题1:1个篮球与1个乒乓球谁占的体积大?
问题2:1个篮球与10个蓝球谁占的体积大?
问题3:10个篮球,如果分别以距离1米和
5米的间隔来摆放,谁占的体积大?
粒子大小
粒子数目
粒子间距
粒子大小
粒子数目
粒子间距
因为固体或液体物质的粒子之间距离都很小
而气体的粒子之间距离非常大,远远大于粒子本身的直径
1mol固体或液体物质的体积只与构成这种物质的粒子大小有关,由于不同的物质粒子大小不相等,
所以1mol不同的固体和液体体积大小是不同的
1mol不同气体物质的体积只与气体粒子间的距离有关,而在相同温度和相同压强下,任何气体粒子间的距离可以看成是相同的,所以1mol不同的气体体积几乎是相同的
1mol任何气体都含有相同数目的气体粒子(即气体分子数目相同);
在相同温度和相同压强下,1mol任何气体的体积也是相同的
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
阿伏加德罗定律:
气体的体积与气体分子数之间成正比:V1/V2=N1/N2
理想气体状态方程:PV=nRT
2. 气体摩尔体积
Vm= 22.4 L/mol
1mol 气体所占的体积
思考:物质的量(n)、气体摩尔体积(Vm)与气体体积(V)
之间存在什么关系?
气体体积(V) = 物质的量(n) × 气体摩尔体积(Vm)
即: V= n × Vm
或:
1、 CO2 的摩尔体积是22.4 L/mol
2、标准状况下,1mol H2O的体积约是22.4L
3、标准状况下,1mol任何物质的体积都约是22.4L
4、标准状况下,气体的摩尔体积都是22.4L。
判断对错
错 未说标准状况下。
错 标准状况下, H2O不是气态。
错 应该是1mol任何气体。
错 单位是L/mol。
5、标准状况下1mol SO3 的体积约是22.4L
6、常温常压下,1mol CO2的体积约是22.4L
7、标准状况下,0.2mol N2和0.8mol CO2的混合
气体体积约为22.4L
8、标准状况下,22.4L的任何气体都约为1mol
错 标准状况下,SO3是固态。
错 标准状况下22.4L。
对
对
气体摩尔体积的相关计算
【练习】填写下列空白(气体都处于标准状况):
(1)0.1mol O2的体积为 L
(2)3.36L的H2其质量为 g
(3)1.12L的CH4中氢元素的质量为 g
2.24
0.3
0.2
2.(1)标准状况下,33.6 L Cl2的物质的量是 ,16 g O2所占体积约是 。
(2)标准状况下,含有1.5 mol H2和0.5 mol O2的混合气体所占体积约是 。
(3)标准状况下,11.2 L二氧化碳和氧气的混合气体中含有的氧原子数是 。
1.5 mol
11.2 L
44.8 L
NA
3.(1)标准状况下,某气体的密度为1.43 g·L-1,则该气体的摩尔质量约为 。
32 g·mol-1
(2)标准状况下,0.51 g某气体的体积为672 mL,则该气体的摩尔质量为 。
17 g·mol-1
三、物质的量浓度
思考:初中化学,哪个物理量可定量表示溶液浓度大小?
m质
ω = ×100%
m液
质量分数0.9%的氯化钠溶液可作生理盐水。
但是,在很多情况下取用溶液时,一般不是称量它的质量,而是量取它的体积。并且,在日常生活生产中,很多物质具有特殊性,在浓度上的表达上也会出现不同的要求,如:
体积分数为75%的酒精溶液可用于杀菌消毒。
质量—体积浓度
物质的量浓度
1.物质的量浓度
单位体积
物质的量
CB
mol / L (或mol·L-1)
1mol·L-1
简述0.4 mol/L NaCl溶液的含义。
每升NaCl溶液中溶质的物质的量为0.4 mol
【思考】
1.所有物质都有浓度吗?比如MnO2与浓盐酸制氯气中的MnO2固体。
2.物质的量浓度为1 mol/L的NaCl溶液取出一半,其浓度会变成0.5 mol/L吗?
注意事项
1. 固体或纯液体不讨论物质的量浓度。
2. 根据溶液的均一性,溶液各处溶质的物质的量浓度相同。
我们知道了物质的量与质量的关系,以及用物质的量和溶液体积来表示浓度,就可以在实验室配制一定物质的量浓度的溶液了。
思考:如何配制100 mL 1.00 mol/L NaCl溶液。
2. 配制一定物质的量浓度的溶液
阅读:
教材P59资料卡片
----容量瓶的使用
在实验室中,我们可以直接用固体或液体试剂来配制一定物质的量浓度的溶液。如果要求比较精确,就需使用容积精确的仪器,如容量瓶。容量瓶有不同的规格,常用的有50 mL、100 mL、250 mL、500 mL 和1000 mL 等几种。
容量瓶的结构和用途
选择容量瓶的原则:“大而近,配一次”
思考:1、如果要配制480ml 1.00 mol/L 的NaCl溶液,该如何选择容量瓶?
2、如果要配制200ml 1.00 mol/L 的NaCl溶液,又该如何选择容量瓶?
注意事项:
①容量瓶属于量器,不能加热,不能在容量瓶中进行溶质的溶解,
也不能用做反应器。
②不能长期存放溶液,配制好的溶液要转移到试剂瓶中
③容量瓶使用前要 。
操作要领:装水盖塞→倒立→查漏→正立→玻璃塞旋转180 →倒立→观察
检查是否漏水
一定物质的量浓度溶液的配制过程:配制100 mL 1.00 mol/L NaCl溶液为例
(1)计算需要NaCl固体的质量: g。
(2)根据计算结果,称量NaCl固体①。
如何选择天平?
托盘天平
精度:0.1g
电子天平
精度:0.01g
分析天平
精度:0.0001g
(3)将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
(4)将烧杯中的溶液沿玻璃棒注入100 mL容量瓶(如图2-25),并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
因为烧杯的内壁和玻璃棒上还沾有少量溶液,若不用蒸馏水洗涤烧杯,容量瓶中的溶质就会减少,即容量瓶内溶质的物质的量减少,导致所配溶液中溶质的物质的量浓度偏低。
课本P60
(1)为什么要用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将洗涤液也都注入容量瓶?
(5)将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1-2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(6)
实验小结
(1)实验仪器:100mL容量瓶、托盘天平、烧杯、玻璃棒、量筒、
胶头滴管
(2)实验步骤:
一定物质的量浓度溶液的配制误差分析
还有称量误差、操作造成的误差等
(2)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
(3)如果在配制时,仰视或者俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
课本P60
因为洒出的溶液中含有溶质,导致容量瓶中的溶质就会减少,所配溶液中溶质的物质的量浓度偏低。
读数时,如果仰视刻度线则加水会过多,导致溶液中溶质的实际浓度偏小;如果俯视刻度线则加水会偏少,导致溶液中溶质的实际浓度偏大。
在用浓溶液配制稀溶液时,溶液的体积发生了变化,但溶液中溶质的
物质的量不变,即在溶液稀释前后,溶液中溶质的物质的量相等
常用下面的式子计算有关的量:
c(浓溶液)·V(浓溶液)= c(稀溶液)·V(稀溶液) 。
也可以是溶质质量(m)守恒:
m(浓溶液)· ω (浓溶液)= m(稀溶液)·ω(稀溶液)
同一物质的溶液浓度不同时,有时在某些性质上会表现出差异。我们在实验室中做化学实验或进行科学研究时,需要根据不同的情况选择不同浓度的溶液。所以,在实验室中不仅用固体物质来配制溶液,还经常要将浓溶液稀释成不同浓度的稀溶液。
练一练
第二章 第三节 物质的量
宏微结合的桥梁
C + O2 === CO2
点燃
试一试:你能说出这个方程式所表达的含义吗?
宏观物质: 12克炭 32克氧气 44克二氧化碳
微观粒子: 1个碳原子 1个氧分子 1个二氧化碳分子
质量可称量
思考1:原子,分子这些微观粒子该如何计量呢?
粒子质量很小,不可直接称量,用数目计量更方便。
宏观称量,微观计数
思考2:如何准确快速的确定12 g 碳或1 mL 水中的微粒数目呢?
一滴水的讲述
一滴水的体积大约是0.05 mL,一滴水的质量大约是0.05 g,其中含有多少水分子呢?
1.67×1021 个
如果让10亿人去数,每人每分钟数100个,日夜不停的数,需要3万年才能数完。
定量微粒数目:不能逐个去数,而只能按照一定的数目标准进行“打包” 或“分堆”
来计量。
1打啤酒:12支
1包A4纸:500张
同样的道理:化学中用物质的量来表示“打包” 或“分堆” 后的微粒。
1、概念:表示含有一定数目粒子的集合体。是一个物理量,符号:n 。
2、单位:mol(摩尔或摩)。类似于“打、箱、包”这样的集合单位。
交流讨论:如何准确获得1000张A4纸?
如何快速取出24瓶啤酒?
一、物质的量
物理量 名称 符号 国际单位 单位符号 基准
时间 t 秒 s 1秒
长度 l 米 m 1米
物质的量 n 摩尔 mol ?
1打 12支
1包 500张 12、500为各自集合单位的计量标准
思考3:1 mol规定的数目是多少 需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
粒子数量大到能进入宏观可称量的程度
基于微粒太小,需很大的数目
20000÷299000000=0.00066889632爽
3、物质的量的基准:阿伏加德罗常数
数据
转化
阿伏加德罗 常数
1 mol任何粒子所含的粒子数
NA、mol -1
含义
符号、单位
N、NA 、n的关系?
近似值:约为6.02×1023 mol -1
1 mol任何粒子的粒子数
=
阿伏加德罗常数(NA)
≈
6.02×1023
1 摩尔微粒
约为 6.02×1023个
1 摩尔包含6.02214076 × 1023 个基本单元,这一常数被称为阿伏伽德罗常数,单位为mol-1。
达依尔的麦子
感受NA有多“大”?
麦粒总数=1+2+4+8+…+263
=264 -1
=1.845×1019
这竟是全世界在2000年内所生产的小麦总量!
辨析:
1 mol 大米(鸡蛋)
2 mol O2
1 mol 氧原子
1 mol 氢气
1 mol H
1 mol 氢
1 mol SO42-
注意:n 只能用来描述
微观粒子且必须具体指
明粒子的种类。
4、计量对象:分子、原子、离子、电子、中子、质子等所有的微观粒
子及它们的特定组合。
√
√
√
√
√
物质的量(n) 粒子数目(N)
①2 mol Al中含有多少个铝原子?
N(Al) = 2 mol × 6.02 × 1023 mol-1 = 1.204 × 1024 =2NA
②3.01×1023个H2O的物质的量是多少?
3.01 × 1023
6.02 × 1023 mol-1
n(H2O) =
=
0.5 mol
二、以n 为中心的转换关系
(1)N、NA 、n 的转换
①1.5 mol O2含有氧气分子的数目是多少?氧原子的数目是多少?
②含有3.01 × 1023 个氧原子的H2O的物质的量是多少?
课堂练习1
N = n﹒NA 或 n=
N
NA
1 mol不同物质中所含的粒子数是相同的,但由于不同微粒的质量不同,所以 1 mol不同物质的质量也不同。
计算填表:
计算1 mol H2O、1 mol 铝的质量 ,并回忆H2O、Al的相对分子(原子)质量。请思考二者之间的关系?
物质微粒 1个微粒的实际质量(g) 6.02×1023个微粒的质量(g) 相对分子(或原子)质量
H2O 2.990×10-23
Al 4.485×10-23
18
27
17.9998
26.9997
2、摩尔质量
概念:单位物质的量的物质所具有的质量。
符号:M; 单位:g/mol;
规律:1 mol任何粒子或物质的质量以克为单位时,
其数值都与其相对分子(原子)质量相等。
例如:Na的摩尔质量是23 g/mol
CO2的摩尔质量是44 g/mol
18g H2O
约6.02 ×1023个水分子
1 mol H2O
27g Al
约6.02 ×1023个铝原子
1 mol Al
(2)n、m、M的转化
课堂练习2
3、m、M、n 转换
③3.01 × 1023 个CO2的质量是多少?
④含48 g氧元素的葡萄糖(C6H12O6),其分子数目是多少?
m = n﹒M 或 n=
m
M
物质的量(n) 物质质量(m)
①计算2 mol CO2的质量是多少?
②12 g 镁的物质的量是多少?
×M
M÷
物质的量
微观
粒子个数
宏观
物质质量
×NA
÷NA
概念:集合体 符号:n 单位:mol
物质的量的基准: NA ≈ 6.02×1023 mol-1
沟通宏观与微观的桥梁
n=
m
M
=
N
NA
四、课堂小结
课堂测评
1.2018年11月13日至16日,第26届国际计量大会在巴黎召开。这次,对物质的量的单位——摩尔的定义进行了修改。下列对“摩尔”的理解正确的是( )
A.我们把含有6.02×1023个粒子的任何粒子集合体计量为1摩尔
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与所含微观粒子的数量联系起来
D.摩尔是用来描述物质所含微粒数目多少的基本物理量
2.下列对阿伏加德罗常数的理解,正确的是( )
A.阿伏加德罗常数是化学上常用的一个单位
B.8 mol NH3含有8NA个NH3分子
C.通常情况下,6.02×1023就是我们所说的阿伏加德罗常数
D.粒子的数目越多,所含该粒子的物质的量不一定越大
B
B
3.下列关于2 mol二氧化碳的叙述中,正确的是( )
A.质量为44 g B.有4 mol原子
C.分子数为6.02×1023 D.摩尔质量为44 g·mol-1
4.下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g·mol-1
C.1 g H2和1 g N2所含分子数相等
D.等质量的N2、CH4、CO、H2O中,CH4所含分子数最多
5.设NA表示阿伏加德罗常数,下列说法不正确的是( )
A.醋酸的摩尔质量与NA个醋酸分子的质量(以g为单位时)在数值上相等
B.NA个氧分子和NA个氢分子质量比等于16:1
C.2.4 g镁所含镁原子数为0.2NA
D.17 g NH3所含的原子数目为4NA
D
D
C
二、气体摩尔体积
课本P56
粒子数相同
体积相同
体积不同
体积不同
结论:
(1)相同温度和压强下,1mol不同的固态物质或液态物质的体积是不相同的。
(2)相同温度和压强下,1mol不同气体的体积几乎是相同的。
1. “了解”------ 影响物质体积的因素有哪些?
问题1:1个篮球与1个乒乓球谁占的体积大?
问题2:1个篮球与10个蓝球谁占的体积大?
问题3:10个篮球,如果分别以距离1米和
5米的间隔来摆放,谁占的体积大?
粒子大小
粒子数目
粒子间距
粒子大小
粒子数目
粒子间距
因为固体或液体物质的粒子之间距离都很小
而气体的粒子之间距离非常大,远远大于粒子本身的直径
1mol固体或液体物质的体积只与构成这种物质的粒子大小有关,由于不同的物质粒子大小不相等,
所以1mol不同的固体和液体体积大小是不同的
1mol不同气体物质的体积只与气体粒子间的距离有关,而在相同温度和相同压强下,任何气体粒子间的距离可以看成是相同的,所以1mol不同的气体体积几乎是相同的
1mol任何气体都含有相同数目的气体粒子(即气体分子数目相同);
在相同温度和相同压强下,1mol任何气体的体积也是相同的
在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
阿伏加德罗定律:
气体的体积与气体分子数之间成正比:V1/V2=N1/N2
理想气体状态方程:PV=nRT
2. 气体摩尔体积
Vm= 22.4 L/mol
1mol 气体所占的体积
思考:物质的量(n)、气体摩尔体积(Vm)与气体体积(V)
之间存在什么关系?
气体体积(V) = 物质的量(n) × 气体摩尔体积(Vm)
即: V= n × Vm
或:
1、 CO2 的摩尔体积是22.4 L/mol
2、标准状况下,1mol H2O的体积约是22.4L
3、标准状况下,1mol任何物质的体积都约是22.4L
4、标准状况下,气体的摩尔体积都是22.4L。
判断对错
错 未说标准状况下。
错 标准状况下, H2O不是气态。
错 应该是1mol任何气体。
错 单位是L/mol。
5、标准状况下1mol SO3 的体积约是22.4L
6、常温常压下,1mol CO2的体积约是22.4L
7、标准状况下,0.2mol N2和0.8mol CO2的混合
气体体积约为22.4L
8、标准状况下,22.4L的任何气体都约为1mol
错 标准状况下,SO3是固态。
错 标准状况下22.4L。
对
对
气体摩尔体积的相关计算
【练习】填写下列空白(气体都处于标准状况):
(1)0.1mol O2的体积为 L
(2)3.36L的H2其质量为 g
(3)1.12L的CH4中氢元素的质量为 g
2.24
0.3
0.2
2.(1)标准状况下,33.6 L Cl2的物质的量是 ,16 g O2所占体积约是 。
(2)标准状况下,含有1.5 mol H2和0.5 mol O2的混合气体所占体积约是 。
(3)标准状况下,11.2 L二氧化碳和氧气的混合气体中含有的氧原子数是 。
1.5 mol
11.2 L
44.8 L
NA
3.(1)标准状况下,某气体的密度为1.43 g·L-1,则该气体的摩尔质量约为 。
32 g·mol-1
(2)标准状况下,0.51 g某气体的体积为672 mL,则该气体的摩尔质量为 。
17 g·mol-1
三、物质的量浓度
思考:初中化学,哪个物理量可定量表示溶液浓度大小?
m质
ω = ×100%
m液
质量分数0.9%的氯化钠溶液可作生理盐水。
但是,在很多情况下取用溶液时,一般不是称量它的质量,而是量取它的体积。并且,在日常生活生产中,很多物质具有特殊性,在浓度上的表达上也会出现不同的要求,如:
体积分数为75%的酒精溶液可用于杀菌消毒。
质量—体积浓度
物质的量浓度
1.物质的量浓度
单位体积
物质的量
CB
mol / L (或mol·L-1)
1mol·L-1
简述0.4 mol/L NaCl溶液的含义。
每升NaCl溶液中溶质的物质的量为0.4 mol
【思考】
1.所有物质都有浓度吗?比如MnO2与浓盐酸制氯气中的MnO2固体。
2.物质的量浓度为1 mol/L的NaCl溶液取出一半,其浓度会变成0.5 mol/L吗?
注意事项
1. 固体或纯液体不讨论物质的量浓度。
2. 根据溶液的均一性,溶液各处溶质的物质的量浓度相同。
我们知道了物质的量与质量的关系,以及用物质的量和溶液体积来表示浓度,就可以在实验室配制一定物质的量浓度的溶液了。
思考:如何配制100 mL 1.00 mol/L NaCl溶液。
2. 配制一定物质的量浓度的溶液
阅读:
教材P59资料卡片
----容量瓶的使用
在实验室中,我们可以直接用固体或液体试剂来配制一定物质的量浓度的溶液。如果要求比较精确,就需使用容积精确的仪器,如容量瓶。容量瓶有不同的规格,常用的有50 mL、100 mL、250 mL、500 mL 和1000 mL 等几种。
容量瓶的结构和用途
选择容量瓶的原则:“大而近,配一次”
思考:1、如果要配制480ml 1.00 mol/L 的NaCl溶液,该如何选择容量瓶?
2、如果要配制200ml 1.00 mol/L 的NaCl溶液,又该如何选择容量瓶?
注意事项:
①容量瓶属于量器,不能加热,不能在容量瓶中进行溶质的溶解,
也不能用做反应器。
②不能长期存放溶液,配制好的溶液要转移到试剂瓶中
③容量瓶使用前要 。
操作要领:装水盖塞→倒立→查漏→正立→玻璃塞旋转180 →倒立→观察
检查是否漏水
一定物质的量浓度溶液的配制过程:配制100 mL 1.00 mol/L NaCl溶液为例
(1)计算需要NaCl固体的质量: g。
(2)根据计算结果,称量NaCl固体①。
如何选择天平?
托盘天平
精度:0.1g
电子天平
精度:0.01g
分析天平
精度:0.0001g
(3)将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
(4)将烧杯中的溶液沿玻璃棒注入100 mL容量瓶(如图2-25),并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
因为烧杯的内壁和玻璃棒上还沾有少量溶液,若不用蒸馏水洗涤烧杯,容量瓶中的溶质就会减少,即容量瓶内溶质的物质的量减少,导致所配溶液中溶质的物质的量浓度偏低。
课本P60
(1)为什么要用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将洗涤液也都注入容量瓶?
(5)将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1-2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(6)
实验小结
(1)实验仪器:100mL容量瓶、托盘天平、烧杯、玻璃棒、量筒、
胶头滴管
(2)实验步骤:
一定物质的量浓度溶液的配制误差分析
还有称量误差、操作造成的误差等
(2)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
(3)如果在配制时,仰视或者俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
课本P60
因为洒出的溶液中含有溶质,导致容量瓶中的溶质就会减少,所配溶液中溶质的物质的量浓度偏低。
读数时,如果仰视刻度线则加水会过多,导致溶液中溶质的实际浓度偏小;如果俯视刻度线则加水会偏少,导致溶液中溶质的实际浓度偏大。
在用浓溶液配制稀溶液时,溶液的体积发生了变化,但溶液中溶质的
物质的量不变,即在溶液稀释前后,溶液中溶质的物质的量相等
常用下面的式子计算有关的量:
c(浓溶液)·V(浓溶液)= c(稀溶液)·V(稀溶液) 。
也可以是溶质质量(m)守恒:
m(浓溶液)· ω (浓溶液)= m(稀溶液)·ω(稀溶液)
同一物质的溶液浓度不同时,有时在某些性质上会表现出差异。我们在实验室中做化学实验或进行科学研究时,需要根据不同的情况选择不同浓度的溶液。所以,在实验室中不仅用固体物质来配制溶液,还经常要将浓溶液稀释成不同浓度的稀溶液。
练一练
