化学人教版(2019)必修第一册1.1物质的分类与转化(共37张ppt)【任务驱动】
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1物质的分类与转化(共37张ppt)【任务驱动】 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-29 10:37:22 | ||
图片预览






文档简介
(共37张PPT)
物质的分类及转化
第一章 物质及其变化
问题1:NaOH溶液的试剂瓶为什么使用橡胶塞而不使用玻璃塞?
环节一:运用分类方法认识物质
环节一:运用分类方法认识物质
资料卡片:玻璃的成分
环节一:运用分类方法认识物质
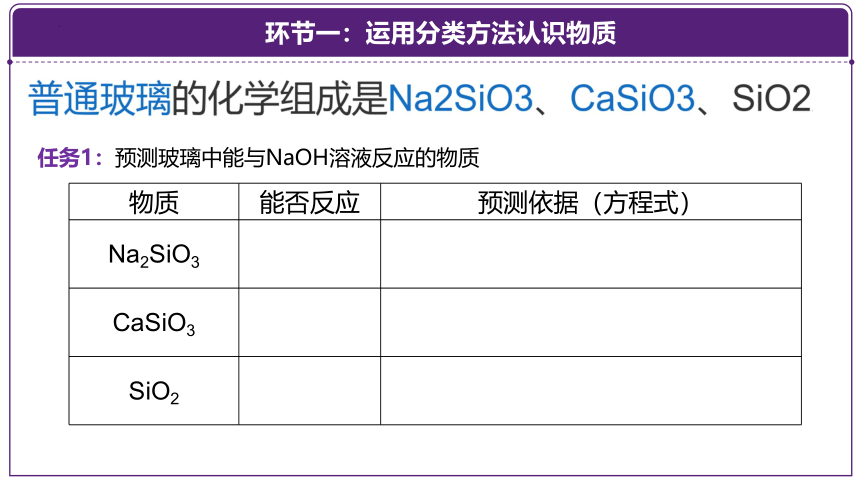
任务1:预测玻璃中能与NaOH溶液反应的物质
物质 能否反应 预测依据(方程式)
Na2SiO3
CaSiO3
SiO2
环节一:运用分类方法认识物质
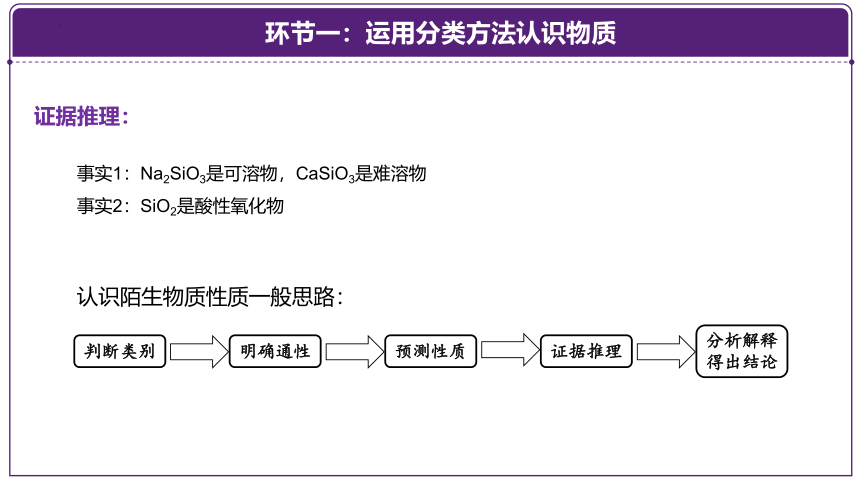
证据推理:
事实1:Na2SiO3是可溶物,CaSiO3是难溶物
事实2:SiO2是酸性氧化物
判断类别
明确通性
预测性质
证据推理
分析解释
得出结论
认识陌生物质性质一般思路:
普通玻璃(主要成分Na2SiO3、CaSiO3、SiO2)
资料卡片2:形形色色的玻璃
高硅氧玻璃(SiO2含量约95%~98%,含少量B2O3和Na2O),多用于半导体、电光源、光导通信、激光等技术和光学仪器中
铅硅酸盐玻璃(主要成分有SiO2和PbO)可用于制造灯泡、真空管芯柱等。含有大量PbO的铅玻璃能阻挡X射线和γ射线
铝硅酸盐玻璃(SiO2和Al2O3为主要成分),用于制作放电灯泡、高温玻璃温度计、化学燃烧管等
有色玻璃:普通玻璃制造过程中加入一些金属氧化物得到。Cu2O——红色;CuO——蓝绿色;CdO——浅黄色;Co2O3——蓝色;Ni2O3——墨绿色;MnO2——蓝紫色;胶体Au——红色;胶体Ag——黄色)
光学玻璃(在普通的硼硅酸盐玻璃原料中加入少量对光敏感的物质,如AgCl、AgBr等)
环节二:运用分类方法将物质分类
任务2:对玻璃中的各种添加剂进行分类,说出分类依据。
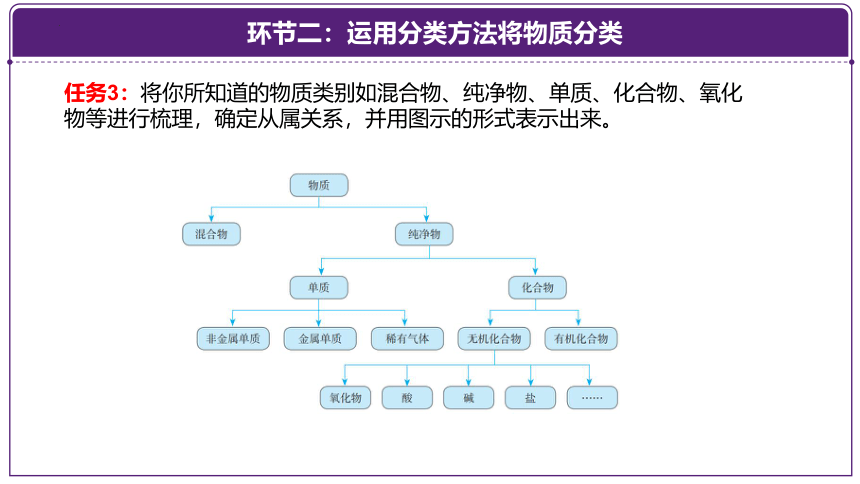
任务3:将你所知道的物质类别如混合物、纯净物、单质、化合物、氧化物等进行梳理,确定从属关系,并用图示的形式表示出来。
环节二:运用分类方法将物质分类
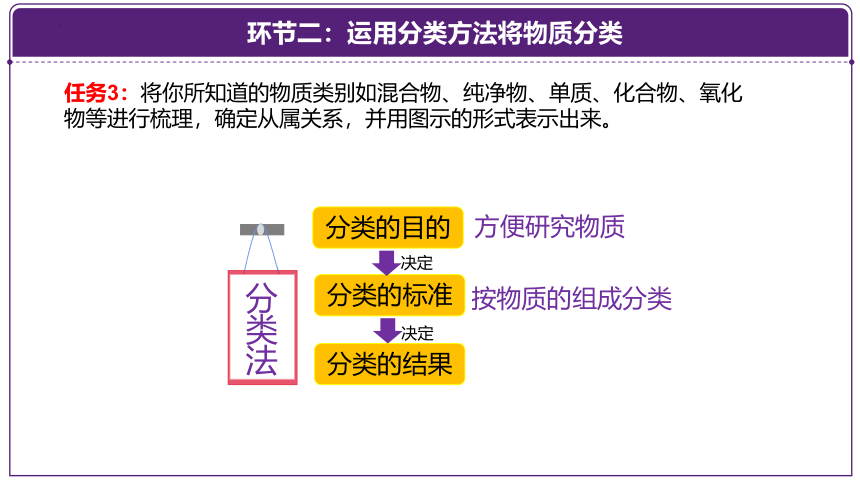
任务3:将你所知道的物质类别如混合物、纯净物、单质、化合物、氧化物等进行梳理,确定从属关系,并用图示的形式表示出来。
环节二:运用分类方法将物质分类
分类的目的
分类的标准
分类的结果
决定
决定
分类法
方便研究物质
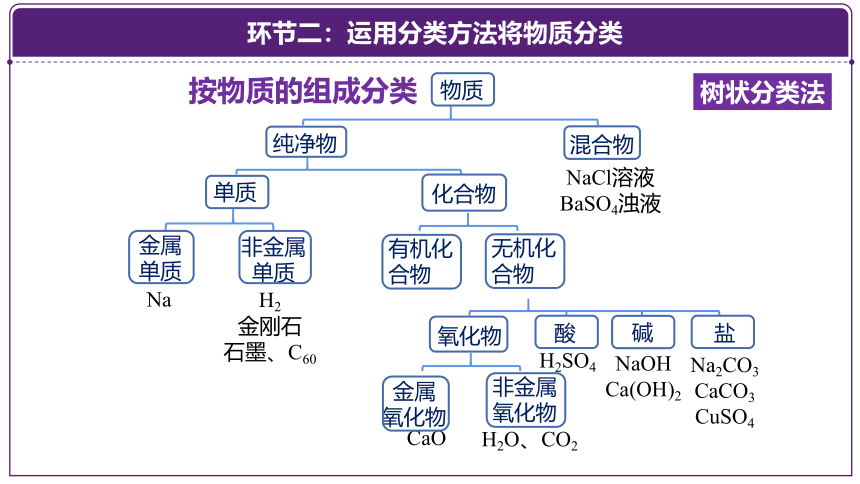
按物质的组成分类
任务4 :请对下列物质进行分类
H2、H2O、H2SO4、金刚石、石墨、C60、CO2、Na、NaCl溶液、NaOH、Na2CO3、CaO、Ca(OH)2、CuSO4、CaCO3、BaSO4浊液
环节二:运用分类方法将物质分类
氧化物
NaCl溶液
BaSO4浊液
Na
物质
纯净物
混合物
单质
金属
单质
非金属
单质
按物质的组成分类
CaO
H2O、CO2
H2SO4
NaOH Ca(OH)2
Na2CO3 CaCO3
CuSO4
金属
氧化物
非金属
氧化物
酸
碱
盐
H2
金刚石
石墨、C60
化合物
树状分类法
有机化合物
无机化合物
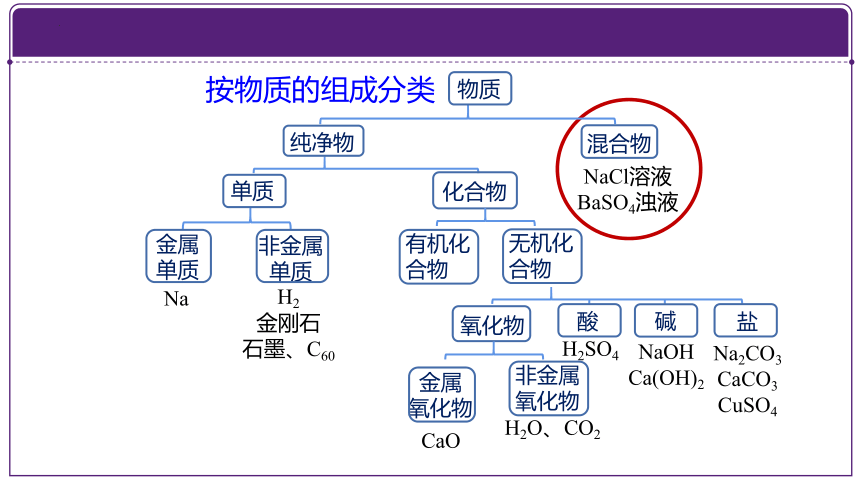
环节二:运用分类方法将物质分类
氧化物
NaCl溶液
BaSO4浊液
Na
物质
纯净物
混合物
单质
金属
单质
非金属
单质
按物质的组成分类
CaO
H2O、CO2
H2SO4
NaOH Ca(OH)2
Na2CO3 CaCO3
CuSO4
金属
氧化物
非金属
氧化物
酸
碱
盐
H2
金刚石
石墨、C60
化合物
有机化合物
无机化合物
分散系:一种物质(分散质)以粒子形式分散到另一种(或多种)物质(分散剂)中所形成的混合物。
学生A说:溶液和浊液
是同一类分散系
学生B说:溶液和浊液
不是一类分散系
哪位同学说的对?
活动6 运用分类的思想进行溶液和浊液的比较研究
CuSO4溶液
泥水浊液
观察、对比:外观有较大差异
溶液和浊液中分散质粒子直径大小不同
为什么溶液和浊液的性质存在较大差异?
活动6 运用分类的思想进行溶液和浊液的比较研究
提出问题
猜想假设
查阅资料
溶液 浊液
分散质粒子 存在形式 离子或分子 离子的集合体或分子的集合体
分散质粒子 直径大小 < 1 nm > 100 nm
结 论
溶液与浊液宏观性质的差异
与分散质粒子直径的大小有关
活动6 运用分类的思想进行溶液和浊液的比较研究
1 nm
100 nm
溶液
浊液
宏观性质
透明
均一稳定
浑浊
不稳定
微观结构
(分散质粒子直径大小)
分散系分类
透明?浑浊?
介稳状态?
二者之间是否存在另一类分散系
【资料】胶体中分散质粒子的直径为1 100 nm
粒子比较大
光反射
粒子比较小
光透射
粒子较小光散射
光束通过胶体时出现光亮
“通路”的现象称为“丁达尔效应”
【演示实验】Fe(OH)3胶体的制备及性质探究
资料
对比实验 溶液 胶体
证据 宏观性质 无丁达尔效应 有丁达尔效应
解释 微观本质 粒子直径<1 nm 粒子直径1~100 nm
结论:
1. 用丁达尔效应来区分溶液和胶体
2. 溶液和胶体的本质区别是分散质粒子直径的大小不同
【演示实验】Fe(OH)3胶体的制备及性质探究
1 nm
100 nm
溶液
浊液
宏观性质
透明
均一稳定
浑浊
不稳定
分散系分类
丁达尔效应
介稳状态
微观结构
(分散质粒子直径大小)
胶体
胶体粒子的直径大小介于溶液和浊液之间。因此胶体能够透过滤纸,◆不能透过半透膜—渗析法。
分离、提纯胶体
胶体
根据分散剂
的状态
气溶胶
液溶胶
固溶胶
Fe(OH)3胶体
环节二:运用分类方法将物质分类
环节二:运用分类方法将物质分类
思考与交流1
(1)CO2、SiO2有什么共同的化学性质?
CuO、Fe2O3有什么共同的化学性质?
写出化学方程式。
CO2 + 2NaOH Na2CO3 + H2O
SiO2 + 2NaOH Na2SiO3 + H2O
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性
氧化物
酸性
氧化物
思考:物质组成和性质之间是否存在某种关联?
基于物质类别研究物质性质
CO2
CO2+H2O H2CO3
CO2+Ca(OH)2 CaCO3↓+H2O
酸性
氧化物
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
CaO
Fe2O3
CaO + H2O Ca(OH)2
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
碱性
氧化物
酸性氧化物+碱性氧化物→盐
如何认识SO2和Na2O的性质?
环节二:运用分类方法将物质分类
思考与交流1
(1)CO2、SiO2有什么共同的化学性质?
CuO、Fe2O3有什么共同的化学性质?
写出化学方程式。
(2)是否所有的非金属氧化物都有类似CO2、SiO2的化学性质?举例说明。
是否所有的金属氧化物都有类似CuO、Fe2O3的化学性质?举例说明。
(3)阅读课本第7页和资料卡片,从物质变化(即化学性质)的角度对氧化物再次分类。
资料卡片:Cu2O+2HCl = Cu+CuCl2+H2O
Mn2O7+H2O = 2HMnO4(高锰酸)
任务5 :结合资料,归纳出金属氧化物、非金属氧化物、酸性氧化物和碱性氧化物的关系。
CaO
CO2
Fe2O3
SO3
Na2O
氧化物
金属
氧化物
非金属
氧化物
大多数非金属氧化物是酸性氧化物
大多数金属氧化物是碱性氧化物
碱性氧化物
酸性氧化物
H2O
组成
性质
环节二:运用分类方法将物质分类
环节二:运用分类方法将物质分类
树状分类法
交叉分类法
CO2
非金属氧化物
酸性氧化物
思考与交流2
(1)以HCl、NaOH、Na2CO3为例,列举常见的酸、碱、盐,说出它们的组成特点。
(2)回忆学过的这些酸、碱、盐的化学性质,书写化学方程式,归纳酸、碱、盐的通性。
环节二:运用分类方法将物质分类
思考与交流3
HCl、H2SO4、H2CO3从酸的类别上看,完全属于同一类酸吗?如何从物质组成和物质变化的视角对酸进行分类?碱和盐呢?
盐酸
酸
6HCl + Fe2O3 2FeCl3 + 3H2O
2HCl + Fe FeCl2 + H2↑
HCl + NaOH NaCl + H2O
2HCl+Na2CO3 2NaCl+H2O+CO2↑
能使紫色石蕊变红
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使酸碱指示剂变色
环节二:运用分类方法将物质分类
思考与交流3
HCl、H2SO4、H2CO3从酸的类别上看,完全属于同一类酸吗?如何从物质组成和物质变化的视角对酸进行分类?碱和盐呢?
NaOH
Ca(OH)2
碱
使紫色石蕊变蓝;使无色酚酞变红
2NaOH + CO2 Na2CO3 + H2O
NaOH + HCl NaCl + H2O
Ca(OH)2+Na2CO3 CaCO3↓+2NaOH
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
环节二:运用分类方法将物质分类
思考与交流3
HCl、H2SO4、H2CO3从酸的类别上看,完全属于同一类酸吗?如何从物质组成和物质变化的视角对酸进行分类?碱和盐呢?
Na2CO3
CuSO4
盐
CuSO4 + Fe FeSO4 + Cu
Na2CO3+2HCl 2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+CaCl2 CaCO3↓+2NaCl
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
环节二:运用分类方法将物质分类
环节三:运用分类方法制备物质
资料卡片
CuCl2常用作玻璃工艺中的着色剂,能使玻璃呈现美丽的颜色。
任务6:运用分类观念,从物质组成和物质变化两个视角思考,讨论交流和设计制备CuCl2的方案
选择试剂 理由(方程式)
实验方案确立
Cu Cl
盐
CuCl2
CuO
Cu(OH)2
Cu2(OH)2CO3
CuSO4
碱性氧化物
碱
盐
HCl
酸
BaCl2
盐
实验验证
实验 方案 现象
Ⅰ 向盛有氧化铜的试管中滴加稀盐酸,震荡
Ⅱ 向盛有碱式碳酸铜的试管中滴加稀盐酸,震荡
Ⅲ 向盛有CuSO4溶液的试管中逐滴滴加BaCl2溶液
震荡后黑色固体溶解,
溶液由无色变为蓝色
震荡后绿色固体溶解,
溶液由无色变为蓝色
蓝色溶液中有白色沉淀产生,
静置后,上层为蓝色溶液。
工业上以辉铜矿石为原料制备CuCl2·2H2O晶体的工艺流程如下:
查阅相关资料得知:①辉铜矿主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。
②常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
金属离子 氢氧化物开始沉淀时的pH 氢氧化物完全沉淀时的pH
Fe3+ 1.9 3.2
Cu2+ 4.7 6.7
任务7:结合所给信息,完善工业制备CuCl2·2H2O方案。
THANKS
谢谢聆听
物质的分类及转化
第一章 物质及其变化
问题1:NaOH溶液的试剂瓶为什么使用橡胶塞而不使用玻璃塞?
环节一:运用分类方法认识物质
环节一:运用分类方法认识物质
资料卡片:玻璃的成分
环节一:运用分类方法认识物质
任务1:预测玻璃中能与NaOH溶液反应的物质
物质 能否反应 预测依据(方程式)
Na2SiO3
CaSiO3
SiO2
环节一:运用分类方法认识物质
证据推理:
事实1:Na2SiO3是可溶物,CaSiO3是难溶物
事实2:SiO2是酸性氧化物
判断类别
明确通性
预测性质
证据推理
分析解释
得出结论
认识陌生物质性质一般思路:
普通玻璃(主要成分Na2SiO3、CaSiO3、SiO2)
资料卡片2:形形色色的玻璃
高硅氧玻璃(SiO2含量约95%~98%,含少量B2O3和Na2O),多用于半导体、电光源、光导通信、激光等技术和光学仪器中
铅硅酸盐玻璃(主要成分有SiO2和PbO)可用于制造灯泡、真空管芯柱等。含有大量PbO的铅玻璃能阻挡X射线和γ射线
铝硅酸盐玻璃(SiO2和Al2O3为主要成分),用于制作放电灯泡、高温玻璃温度计、化学燃烧管等
有色玻璃:普通玻璃制造过程中加入一些金属氧化物得到。Cu2O——红色;CuO——蓝绿色;CdO——浅黄色;Co2O3——蓝色;Ni2O3——墨绿色;MnO2——蓝紫色;胶体Au——红色;胶体Ag——黄色)
光学玻璃(在普通的硼硅酸盐玻璃原料中加入少量对光敏感的物质,如AgCl、AgBr等)
环节二:运用分类方法将物质分类
任务2:对玻璃中的各种添加剂进行分类,说出分类依据。
任务3:将你所知道的物质类别如混合物、纯净物、单质、化合物、氧化物等进行梳理,确定从属关系,并用图示的形式表示出来。
环节二:运用分类方法将物质分类
任务3:将你所知道的物质类别如混合物、纯净物、单质、化合物、氧化物等进行梳理,确定从属关系,并用图示的形式表示出来。
环节二:运用分类方法将物质分类
分类的目的
分类的标准
分类的结果
决定
决定
分类法
方便研究物质
按物质的组成分类
任务4 :请对下列物质进行分类
H2、H2O、H2SO4、金刚石、石墨、C60、CO2、Na、NaCl溶液、NaOH、Na2CO3、CaO、Ca(OH)2、CuSO4、CaCO3、BaSO4浊液
环节二:运用分类方法将物质分类
氧化物
NaCl溶液
BaSO4浊液
Na
物质
纯净物
混合物
单质
金属
单质
非金属
单质
按物质的组成分类
CaO
H2O、CO2
H2SO4
NaOH Ca(OH)2
Na2CO3 CaCO3
CuSO4
金属
氧化物
非金属
氧化物
酸
碱
盐
H2
金刚石
石墨、C60
化合物
树状分类法
有机化合物
无机化合物
环节二:运用分类方法将物质分类
氧化物
NaCl溶液
BaSO4浊液
Na
物质
纯净物
混合物
单质
金属
单质
非金属
单质
按物质的组成分类
CaO
H2O、CO2
H2SO4
NaOH Ca(OH)2
Na2CO3 CaCO3
CuSO4
金属
氧化物
非金属
氧化物
酸
碱
盐
H2
金刚石
石墨、C60
化合物
有机化合物
无机化合物
分散系:一种物质(分散质)以粒子形式分散到另一种(或多种)物质(分散剂)中所形成的混合物。
学生A说:溶液和浊液
是同一类分散系
学生B说:溶液和浊液
不是一类分散系
哪位同学说的对?
活动6 运用分类的思想进行溶液和浊液的比较研究
CuSO4溶液
泥水浊液
观察、对比:外观有较大差异
溶液和浊液中分散质粒子直径大小不同
为什么溶液和浊液的性质存在较大差异?
活动6 运用分类的思想进行溶液和浊液的比较研究
提出问题
猜想假设
查阅资料
溶液 浊液
分散质粒子 存在形式 离子或分子 离子的集合体或分子的集合体
分散质粒子 直径大小 < 1 nm > 100 nm
结 论
溶液与浊液宏观性质的差异
与分散质粒子直径的大小有关
活动6 运用分类的思想进行溶液和浊液的比较研究
1 nm
100 nm
溶液
浊液
宏观性质
透明
均一稳定
浑浊
不稳定
微观结构
(分散质粒子直径大小)
分散系分类
透明?浑浊?
介稳状态?
二者之间是否存在另一类分散系
【资料】胶体中分散质粒子的直径为1 100 nm
粒子比较大
光反射
粒子比较小
光透射
粒子较小光散射
光束通过胶体时出现光亮
“通路”的现象称为“丁达尔效应”
【演示实验】Fe(OH)3胶体的制备及性质探究
资料
对比实验 溶液 胶体
证据 宏观性质 无丁达尔效应 有丁达尔效应
解释 微观本质 粒子直径<1 nm 粒子直径1~100 nm
结论:
1. 用丁达尔效应来区分溶液和胶体
2. 溶液和胶体的本质区别是分散质粒子直径的大小不同
【演示实验】Fe(OH)3胶体的制备及性质探究
1 nm
100 nm
溶液
浊液
宏观性质
透明
均一稳定
浑浊
不稳定
分散系分类
丁达尔效应
介稳状态
微观结构
(分散质粒子直径大小)
胶体
胶体粒子的直径大小介于溶液和浊液之间。因此胶体能够透过滤纸,◆不能透过半透膜—渗析法。
分离、提纯胶体
胶体
根据分散剂
的状态
气溶胶
液溶胶
固溶胶
Fe(OH)3胶体
环节二:运用分类方法将物质分类
环节二:运用分类方法将物质分类
思考与交流1
(1)CO2、SiO2有什么共同的化学性质?
CuO、Fe2O3有什么共同的化学性质?
写出化学方程式。
CO2 + 2NaOH Na2CO3 + H2O
SiO2 + 2NaOH Na2SiO3 + H2O
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性
氧化物
酸性
氧化物
思考:物质组成和性质之间是否存在某种关联?
基于物质类别研究物质性质
CO2
CO2+H2O H2CO3
CO2+Ca(OH)2 CaCO3↓+H2O
酸性
氧化物
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
CaO
Fe2O3
CaO + H2O Ca(OH)2
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
碱性
氧化物
酸性氧化物+碱性氧化物→盐
如何认识SO2和Na2O的性质?
环节二:运用分类方法将物质分类
思考与交流1
(1)CO2、SiO2有什么共同的化学性质?
CuO、Fe2O3有什么共同的化学性质?
写出化学方程式。
(2)是否所有的非金属氧化物都有类似CO2、SiO2的化学性质?举例说明。
是否所有的金属氧化物都有类似CuO、Fe2O3的化学性质?举例说明。
(3)阅读课本第7页和资料卡片,从物质变化(即化学性质)的角度对氧化物再次分类。
资料卡片:Cu2O+2HCl = Cu+CuCl2+H2O
Mn2O7+H2O = 2HMnO4(高锰酸)
任务5 :结合资料,归纳出金属氧化物、非金属氧化物、酸性氧化物和碱性氧化物的关系。
CaO
CO2
Fe2O3
SO3
Na2O
氧化物
金属
氧化物
非金属
氧化物
大多数非金属氧化物是酸性氧化物
大多数金属氧化物是碱性氧化物
碱性氧化物
酸性氧化物
H2O
组成
性质
环节二:运用分类方法将物质分类
环节二:运用分类方法将物质分类
树状分类法
交叉分类法
CO2
非金属氧化物
酸性氧化物
思考与交流2
(1)以HCl、NaOH、Na2CO3为例,列举常见的酸、碱、盐,说出它们的组成特点。
(2)回忆学过的这些酸、碱、盐的化学性质,书写化学方程式,归纳酸、碱、盐的通性。
环节二:运用分类方法将物质分类
思考与交流3
HCl、H2SO4、H2CO3从酸的类别上看,完全属于同一类酸吗?如何从物质组成和物质变化的视角对酸进行分类?碱和盐呢?
盐酸
酸
6HCl + Fe2O3 2FeCl3 + 3H2O
2HCl + Fe FeCl2 + H2↑
HCl + NaOH NaCl + H2O
2HCl+Na2CO3 2NaCl+H2O+CO2↑
能使紫色石蕊变红
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使酸碱指示剂变色
环节二:运用分类方法将物质分类
思考与交流3
HCl、H2SO4、H2CO3从酸的类别上看,完全属于同一类酸吗?如何从物质组成和物质变化的视角对酸进行分类?碱和盐呢?
NaOH
Ca(OH)2
碱
使紫色石蕊变蓝;使无色酚酞变红
2NaOH + CO2 Na2CO3 + H2O
NaOH + HCl NaCl + H2O
Ca(OH)2+Na2CO3 CaCO3↓+2NaOH
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
环节二:运用分类方法将物质分类
思考与交流3
HCl、H2SO4、H2CO3从酸的类别上看,完全属于同一类酸吗?如何从物质组成和物质变化的视角对酸进行分类?碱和盐呢?
Na2CO3
CuSO4
盐
CuSO4 + Fe FeSO4 + Cu
Na2CO3+2HCl 2NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
Na2CO3+CaCl2 CaCO3↓+2NaCl
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
环节二:运用分类方法将物质分类
环节三:运用分类方法制备物质
资料卡片
CuCl2常用作玻璃工艺中的着色剂,能使玻璃呈现美丽的颜色。
任务6:运用分类观念,从物质组成和物质变化两个视角思考,讨论交流和设计制备CuCl2的方案
选择试剂 理由(方程式)
实验方案确立
Cu Cl
盐
CuCl2
CuO
Cu(OH)2
Cu2(OH)2CO3
CuSO4
碱性氧化物
碱
盐
HCl
酸
BaCl2
盐
实验验证
实验 方案 现象
Ⅰ 向盛有氧化铜的试管中滴加稀盐酸,震荡
Ⅱ 向盛有碱式碳酸铜的试管中滴加稀盐酸,震荡
Ⅲ 向盛有CuSO4溶液的试管中逐滴滴加BaCl2溶液
震荡后黑色固体溶解,
溶液由无色变为蓝色
震荡后绿色固体溶解,
溶液由无色变为蓝色
蓝色溶液中有白色沉淀产生,
静置后,上层为蓝色溶液。
工业上以辉铜矿石为原料制备CuCl2·2H2O晶体的工艺流程如下:
查阅相关资料得知:①辉铜矿主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。
②常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
金属离子 氢氧化物开始沉淀时的pH 氢氧化物完全沉淀时的pH
Fe3+ 1.9 3.2
Cu2+ 4.7 6.7
任务7:结合所给信息,完善工业制备CuCl2·2H2O方案。
THANKS
谢谢聆听
