山东省淄博市六中2015-2016学年高二上学期期中学分认定模块考试化学试题 Word版含答案
文档属性
| 名称 | 山东省淄博市六中2015-2016学年高二上学期期中学分认定模块考试化学试题 Word版含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 200.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
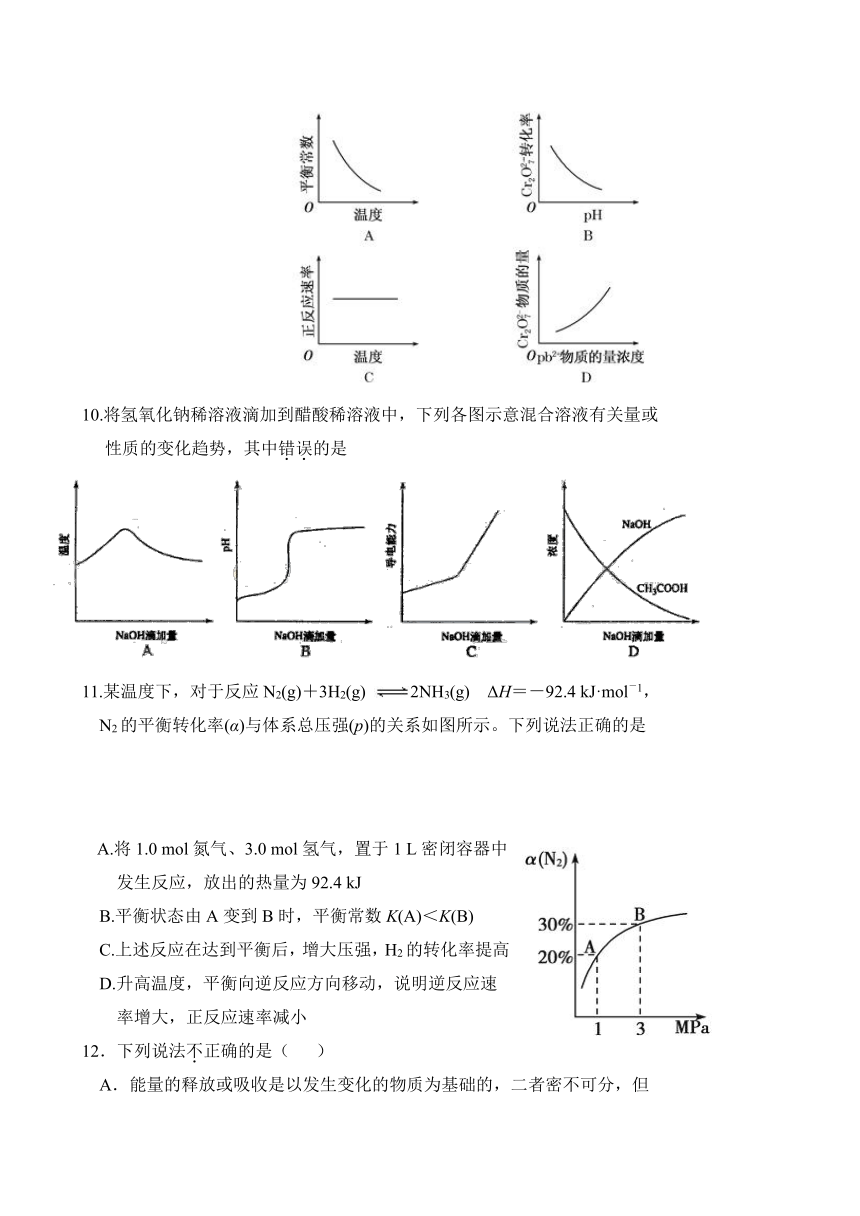
| 科目 | 化学 | ||
| 更新时间 | 2015-11-10 00:00:00 | ||
图片预览



文档简介
淄博六中2014级高二第一学期期中模块考试
(化学 学科)
注意事项:
1.答卷前,考生务必用钢笔或签字笔将自己的班别、姓名、考号填写在答题纸和答题卡的相应位置处。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
3.非选择题答案必须写在答题纸相应位置处,不按要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卡和答题纸一并收回。
第I卷(选择题 共48分)
可能用到的相对原子质量:Zn:65 Cu:64 H:1 O:16 S:32 C:12 Ba:137
一、选择题:(本大题共有16小题,每小题3分,共48分)
1.下列反应属于氧化还原反应且ΔH>0的是( )
A.铝片与稀盐酸的反应 B.灼热的炭与CO2的反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在氧气中的燃烧反应
2.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.Na2CO3溶液中加酚酞,溶液变红,加热,颜色变深
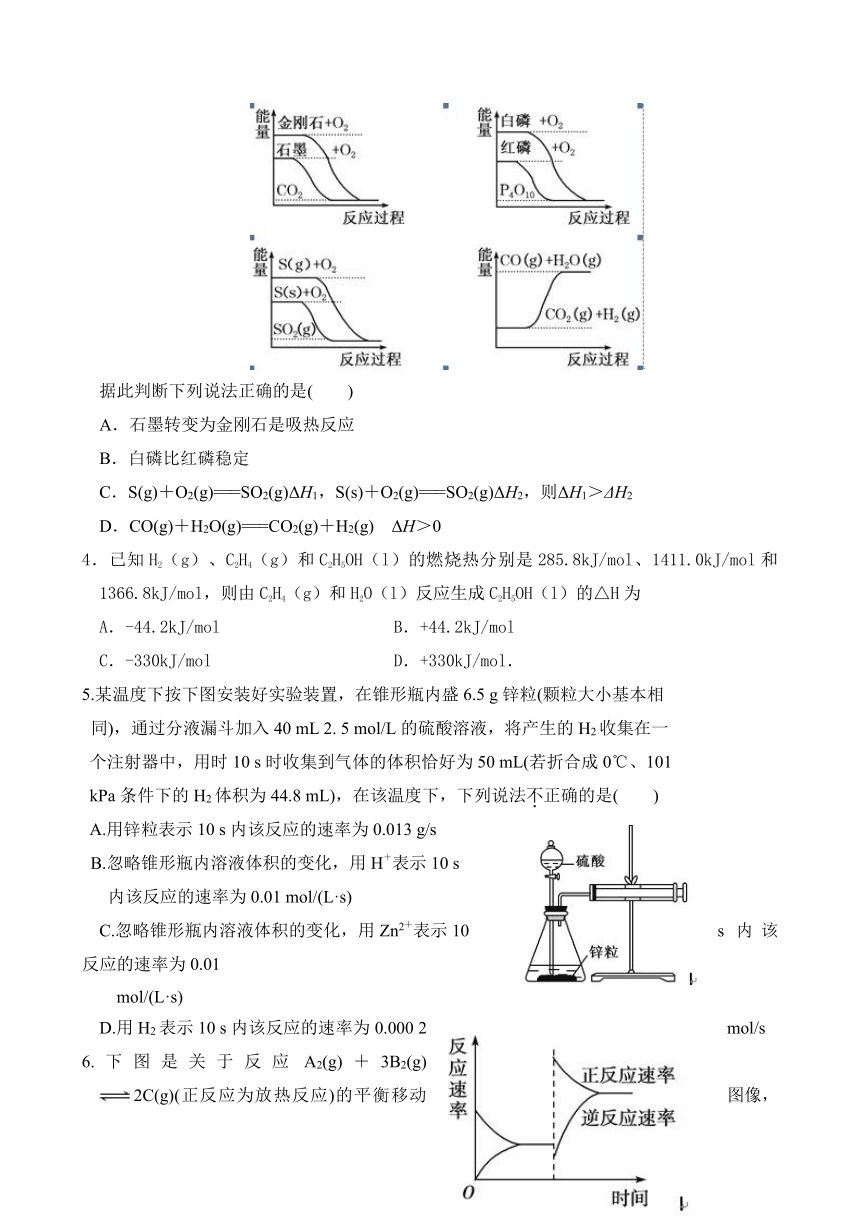
3.下列图像分别表示有关反应的反应过程与能量变化的关系:
( http: / / www.21cnjy.com )
据此判断下列说法正确的是( )
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)===SO2(g)ΔH1,S(s)+O2(g)===SO2(g)ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
4.已知H2(g)、C2H4(g)和C2 ( http: / / www.21cnjy.com )H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ/mol B.+44.2kJ/mol
C.-330kJ/mol D.+330kJ/mol.
5.某温度下按下图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相
同),通过分液漏斗加入40 mL 2. 5 mol/L的硫酸溶液,将产生的H2收集在一
个注射器中,用时10 s时收集到气体的体积恰好为50 mL(若折合成0℃、101
kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
A.用锌粒表示10 s内该反应的速率为0.013 g/s
B.忽略锥形瓶内溶液体积的变化,用H+表示10 s
内该反应的速率为0.01 mol/(L·s)
C.忽略锥形瓶内溶液体积的变化,用Zn2+表示10 s内该反应的速率为0.01
mol/(L·s)
D.用H2表示10 s内该反应的速率为0.000 2 mol/s
6.下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
7.一定温度下,在三个容积相同的密闭容器中,对反应I2(g)+H2(g) 2HI(g)进行甲、乙、丙三组实验,实验起始时容器内各组分的物质的量见下表,一段时间后,反应达到平衡。
组别物质 甲 乙 丙
I2(g) 1 mol 2 mol 1 mol
H2 1 mol 1 mol 2 mol
下列判断不正确的是( )
A.反应速率:乙>甲 B.平衡时HI的百分含量:乙=丙
C.I2的转化率:丙=甲 D.HI的平衡浓度:乙>甲
8.对于反应N2(g)+3H2(g) 2NH3(g),在一密闭容器中加入一定量的N2
和H2,达到平衡时气体压强为p1,迅速缩小体积使气体压强为p2,一段时
间后达到新的平衡,此时气体的压强为p3,则p1、p2、p3的大小关系( )
A.p2>p1<p3 B.p2>p3>p1
C.p2>p1>p3 D.p2>p1=p3
9.电镀废液中Cr2O可通过下列反应转化成铬黄(PbCrO4):
Cr2O(aq)+2Pb2+(aq)+H2O(l) 2PbCrO4(s)+2H+(aq) ΔH<0。
该反应达平衡后,改变横坐标表示的反应条件, 下列示意图正确的是( )
( http: / / www.21cnjy.com )
10.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或
性质的变化趋势,其中错误的是
11.某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1.0 mol氮气、3.0 mol氢气,置于1 L密闭容器中
发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.升高温度,平衡向逆反应方向移动,说明逆反应速
率增大,正反应速率减小
12.下列说法不正确的是( )
A.能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但
以物质为主,如果物质没有变化,就不能引发能量的变化。
B.氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,
因此很可能成为未来的主要能源。
C.对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催
化剂还可以大幅度提高目标产物在最终产物中的比率。
D.离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影
响不大,是一类不需要活化能来引发的反应,所以反应速率很高。
13.反应N2O4(g)2NO2(g)ΔH=+57 kJ·mol-1,
在温度为T1、T2时,平衡体系中NO2的体积分
数随压强变化的曲线如图所示。下列说法正确
的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B14.关于强弱电解质及非电解质的组合完全正确的是( )
选项 A B C D
强电解质 NaCl H2SO4 CaCO3 HNO3
弱电解质 HF BaSO4 HClO CH3COOH
非电解质 Cl2 CS2 C2H5OH H2CO3
5.在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加
热到600℃发生反应:2SO2 + O2 2SO3,ΔH<0。当气体的物质的
量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的
82.5%。下列有关叙述正确的是
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D.达到平衡时,SO2的转化率为90%
16.根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各
种离子浓度关系正确的是
A.c(HCO)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO)>c(H+)
C.c(HClO)+c(ClO-)= c(HCO)+c(H2CO3)
D.c(Na+)+c(H+)= c(HCO)+c(ClO-)+c(OH-)
第Ⅱ卷(非选择题 共52分)
二、非选择题(本大题共有4小题,17题10分、18题12分,19题16分,20题14分,共52分)
17.(10分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。
试判断此时的温度为________℃。此温度下加入1 mol CO2(g)和1 mol
H2(g),充分反应,达到平衡时,CO2的转化率为________。
(4)在800℃时,发生上述反应,某一时刻 ( http: / / www.21cnjy.com )测得容器内各物质的浓度分别为c(CO2)=2 mol/L,c(H2)=1.5 mol/L,c(CO)=1 mol/L,c(H2O)=3 mol/L,则正、逆反应速率的比较为v(正)________v(逆)(填“>”“<”或“=”)。
18.(12分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同
学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+)
C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-)
D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+)
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填
序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)在25℃下,将a mol·L-1的醋酸与0.01 mol·L-1的NaOH溶液等体积混
合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显_____________性
(填“酸”“碱”或“中”);则:混合前c(CH3COOH) c(NaOH)
(填“>”、“<”、或“=”),用含a的代数式表示CH3COOH的电离常数
Ka=__ __。
19.(16分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分
为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
( http: / / www.21cnjy.com )
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则
△H3= kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为 (填
曲线标记字母),其判断理由是 。
( http: / / www.21cnjy.com )
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)
与温度和压强的关系如图2所示。α(CO)值随温度升高
而 (填“增大”或“减小”),其原因是 。
图2中的压强由大到小为_____,其判断理由是___ __。
20.(14分)某市对大气进行监测,发现该 ( http: / / www.21cnjy.com )市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。
因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性
无机离子的化学组分及其平均浓度如下表:
离子 K+ Na+ NH4+ SO42- NO3- Cl-
浓度/mol·L-1 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5
根据表中数据判断PM2.5的酸碱性为_________,试样的PH值=____________。
(2)为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) H= -241.8kJ/mol
C(s)+1/2O2(g)=CO(g) H= -110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式_______________________________;
(3)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平
衡。测得NO为8×10-4mol。计算该温度下的平衡常数约为K= ___________。
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
_____________________ __________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的H>0,简述该设想能否实现的依据:_______________ ____________。
③目前,在汽车尾气系统中装 ( http: / / www.21cnjy.com )置催化转化器可减少CO和NO的污染,其化学反应方程式为____ __。
淄博六中2014级高二第一学期期中模块考试
(化学 学科)
第一卷:
1 2 3 4 5 6 7 8
B B A A C C C B
9 10 11 12 13 14 15 16
A D C B D C D A
第二卷:
17. (10分,每空2分)
(1) (2)吸热 (3)830 50% (4)<
18.(12分,每空2分)
(1)B ; (2)D; (3)CH3COOH和CH3COONa ;
(4) 中;> ; Ka=10-9/(a-0.01)mol·L-1
19.(16分,每空2分)
(1)—99;+41
(2)a;反应①为放热反应,平衡常数应随温度升高变小;
(3)减小;升高温度时,反应①为放热反 ( http: / / www.21cnjy.com )应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
20.(14分,每空2分)
(1)酸性;4
(2)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol
(3)①4×10-6;温度升高,反应速率加快,平衡右移
②该反应是焓增,熵减的反应,任何温度下均不能自发进行
③2CO+2NO2CO2+N2
(化学 学科)
注意事项:
1.答卷前,考生务必用钢笔或签字笔将自己的班别、姓名、考号填写在答题纸和答题卡的相应位置处。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
3.非选择题答案必须写在答题纸相应位置处,不按要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卡和答题纸一并收回。
第I卷(选择题 共48分)
可能用到的相对原子质量:Zn:65 Cu:64 H:1 O:16 S:32 C:12 Ba:137
一、选择题:(本大题共有16小题,每小题3分,共48分)
1.下列反应属于氧化还原反应且ΔH>0的是( )
A.铝片与稀盐酸的反应 B.灼热的炭与CO2的反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在氧气中的燃烧反应
2.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.Na2CO3溶液中加酚酞,溶液变红,加热,颜色变深
3.下列图像分别表示有关反应的反应过程与能量变化的关系:
( http: / / www.21cnjy.com )
据此判断下列说法正确的是( )
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)===SO2(g)ΔH1,S(s)+O2(g)===SO2(g)ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
4.已知H2(g)、C2H4(g)和C2 ( http: / / www.21cnjy.com )H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ/mol B.+44.2kJ/mol
C.-330kJ/mol D.+330kJ/mol.
5.某温度下按下图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相
同),通过分液漏斗加入40 mL 2. 5 mol/L的硫酸溶液,将产生的H2收集在一
个注射器中,用时10 s时收集到气体的体积恰好为50 mL(若折合成0℃、101
kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
A.用锌粒表示10 s内该反应的速率为0.013 g/s
B.忽略锥形瓶内溶液体积的变化,用H+表示10 s
内该反应的速率为0.01 mol/(L·s)
C.忽略锥形瓶内溶液体积的变化,用Zn2+表示10 s内该反应的速率为0.01
mol/(L·s)
D.用H2表示10 s内该反应的速率为0.000 2 mol/s
6.下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
7.一定温度下,在三个容积相同的密闭容器中,对反应I2(g)+H2(g) 2HI(g)进行甲、乙、丙三组实验,实验起始时容器内各组分的物质的量见下表,一段时间后,反应达到平衡。
组别物质 甲 乙 丙
I2(g) 1 mol 2 mol 1 mol
H2 1 mol 1 mol 2 mol
下列判断不正确的是( )
A.反应速率:乙>甲 B.平衡时HI的百分含量:乙=丙
C.I2的转化率:丙=甲 D.HI的平衡浓度:乙>甲
8.对于反应N2(g)+3H2(g) 2NH3(g),在一密闭容器中加入一定量的N2
和H2,达到平衡时气体压强为p1,迅速缩小体积使气体压强为p2,一段时
间后达到新的平衡,此时气体的压强为p3,则p1、p2、p3的大小关系( )
A.p2>p1<p3 B.p2>p3>p1
C.p2>p1>p3 D.p2>p1=p3
9.电镀废液中Cr2O可通过下列反应转化成铬黄(PbCrO4):
Cr2O(aq)+2Pb2+(aq)+H2O(l) 2PbCrO4(s)+2H+(aq) ΔH<0。
该反应达平衡后,改变横坐标表示的反应条件, 下列示意图正确的是( )
( http: / / www.21cnjy.com )
10.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或
性质的变化趋势,其中错误的是
11.某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1.0 mol氮气、3.0 mol氢气,置于1 L密闭容器中
发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.升高温度,平衡向逆反应方向移动,说明逆反应速
率增大,正反应速率减小
12.下列说法不正确的是( )
A.能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但
以物质为主,如果物质没有变化,就不能引发能量的变化。
B.氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,
因此很可能成为未来的主要能源。
C.对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催
化剂还可以大幅度提高目标产物在最终产物中的比率。
D.离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影
响不大,是一类不需要活化能来引发的反应,所以反应速率很高。
13.反应N2O4(g)2NO2(g)ΔH=+57 kJ·mol-1,
在温度为T1、T2时,平衡体系中NO2的体积分
数随压强变化的曲线如图所示。下列说法正确
的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B
选项 A B C D
强电解质 NaCl H2SO4 CaCO3 HNO3
弱电解质 HF BaSO4 HClO CH3COOH
非电解质 Cl2 CS2 C2H5OH H2CO3
5.在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加
热到600℃发生反应:2SO2 + O2 2SO3,ΔH<0。当气体的物质的
量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的
82.5%。下列有关叙述正确的是
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D.达到平衡时,SO2的转化率为90%
16.根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各
种离子浓度关系正确的是
A.c(HCO)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO)>c(H+)
C.c(HClO)+c(ClO-)= c(HCO)+c(H2CO3)
D.c(Na+)+c(H+)= c(HCO)+c(ClO-)+c(OH-)
第Ⅱ卷(非选择题 共52分)
二、非选择题(本大题共有4小题,17题10分、18题12分,19题16分,20题14分,共52分)
17.(10分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。
试判断此时的温度为________℃。此温度下加入1 mol CO2(g)和1 mol
H2(g),充分反应,达到平衡时,CO2的转化率为________。
(4)在800℃时,发生上述反应,某一时刻 ( http: / / www.21cnjy.com )测得容器内各物质的浓度分别为c(CO2)=2 mol/L,c(H2)=1.5 mol/L,c(CO)=1 mol/L,c(H2O)=3 mol/L,则正、逆反应速率的比较为v(正)________v(逆)(填“>”“<”或“=”)。
18.(12分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同
学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+)
C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-)
D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+)
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填
序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)在25℃下,将a mol·L-1的醋酸与0.01 mol·L-1的NaOH溶液等体积混
合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显_____________性
(填“酸”“碱”或“中”);则:混合前c(CH3COOH) c(NaOH)
(填“>”、“<”、或“=”),用含a的代数式表示CH3COOH的电离常数
Ka=__ __。
19.(16分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分
为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
( http: / / www.21cnjy.com )
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则
△H3= kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为 (填
曲线标记字母),其判断理由是 。
( http: / / www.21cnjy.com )
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)
与温度和压强的关系如图2所示。α(CO)值随温度升高
而 (填“增大”或“减小”),其原因是 。
图2中的压强由大到小为_____,其判断理由是___ __。
20.(14分)某市对大气进行监测,发现该 ( http: / / www.21cnjy.com )市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。
因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性
无机离子的化学组分及其平均浓度如下表:
离子 K+ Na+ NH4+ SO42- NO3- Cl-
浓度/mol·L-1 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5
根据表中数据判断PM2.5的酸碱性为_________,试样的PH值=____________。
(2)为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) H= -241.8kJ/mol
C(s)+1/2O2(g)=CO(g) H= -110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式_______________________________;
(3)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平
衡。测得NO为8×10-4mol。计算该温度下的平衡常数约为K= ___________。
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
_____________________ __________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的H>0,简述该设想能否实现的依据:_______________ ____________。
③目前,在汽车尾气系统中装 ( http: / / www.21cnjy.com )置催化转化器可减少CO和NO的污染,其化学反应方程式为____ __。
淄博六中2014级高二第一学期期中模块考试
(化学 学科)
第一卷:
1 2 3 4 5 6 7 8
B B A A C C C B
9 10 11 12 13 14 15 16
A D C B D C D A
第二卷:
17. (10分,每空2分)
(1) (2)吸热 (3)830 50% (4)<
18.(12分,每空2分)
(1)B ; (2)D; (3)CH3COOH和CH3COONa ;
(4) 中;> ; Ka=10-9/(a-0.01)mol·L-1
19.(16分,每空2分)
(1)—99;+41
(2)a;反应①为放热反应,平衡常数应随温度升高变小;
(3)减小;升高温度时,反应①为放热反 ( http: / / www.21cnjy.com )应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
20.(14分,每空2分)
(1)酸性;4
(2)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol
(3)①4×10-6;温度升高,反应速率加快,平衡右移
②该反应是焓增,熵减的反应,任何温度下均不能自发进行
③2CO+2NO2CO2+N2
同课章节目录
