2024年中考科学重点题型突破练习--流程题(含解析)
文档属性
| 名称 | 2024年中考科学重点题型突破练习--流程题(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 878.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-30 08:17:09 | ||
图片预览


文档简介
2024年中考科学重点题型突破练习--流程题
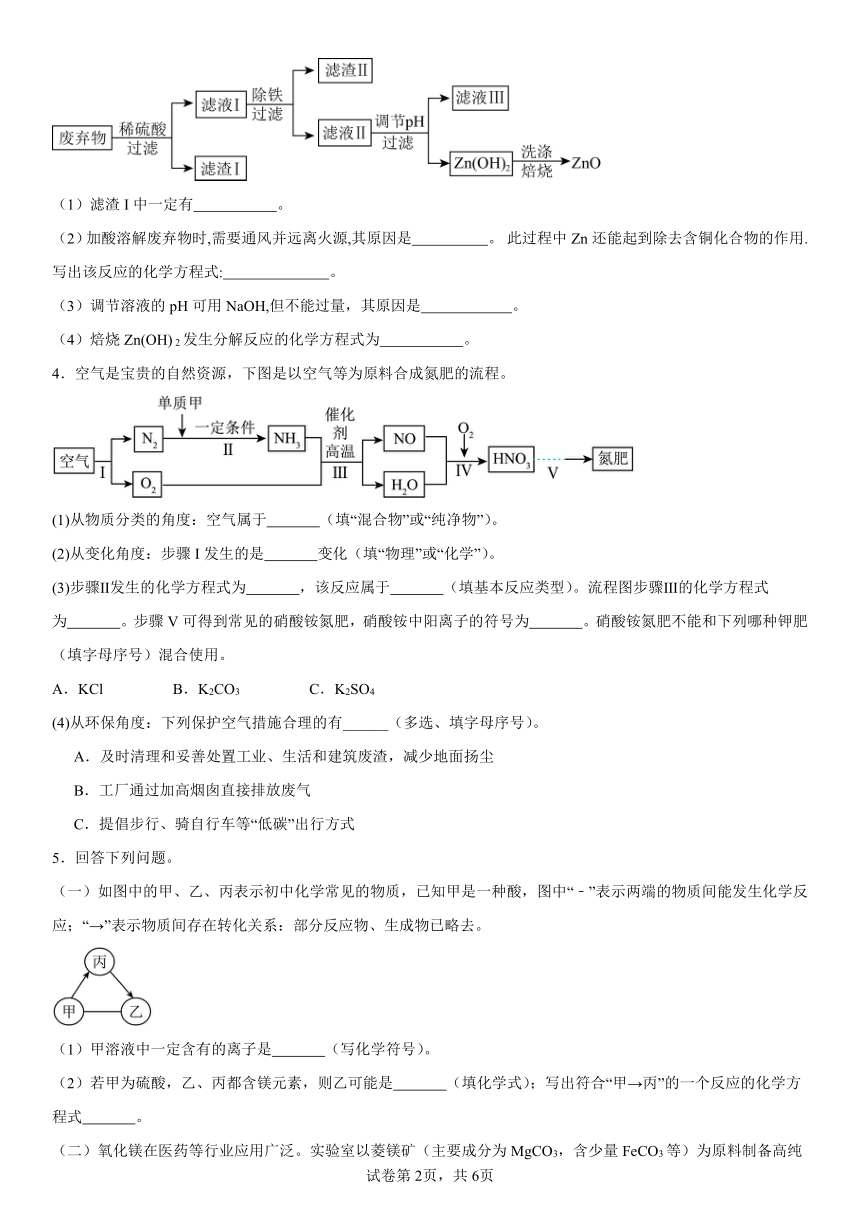
1.以某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4·7H2O,流程如下:
(1)“酸浸时,为了提高浸取率,可采取的措施有 (写出一种)此时,MnCO3发生反应的化学方程式是 。
(2)“转化时主要反应是 ,锰元素反应前后化合价变化情况是 (填“升高”或“降低”)。
(3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:
温度/℃ -3.9-1.8 1.8-48.1 48.1-67.5 67.5-200
析出晶体 MgSO4·12H2O MgSO4·7H2O MgSO4·6H2O MgSO4·H2O等
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、 、过滤、洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是 (填化学式)。
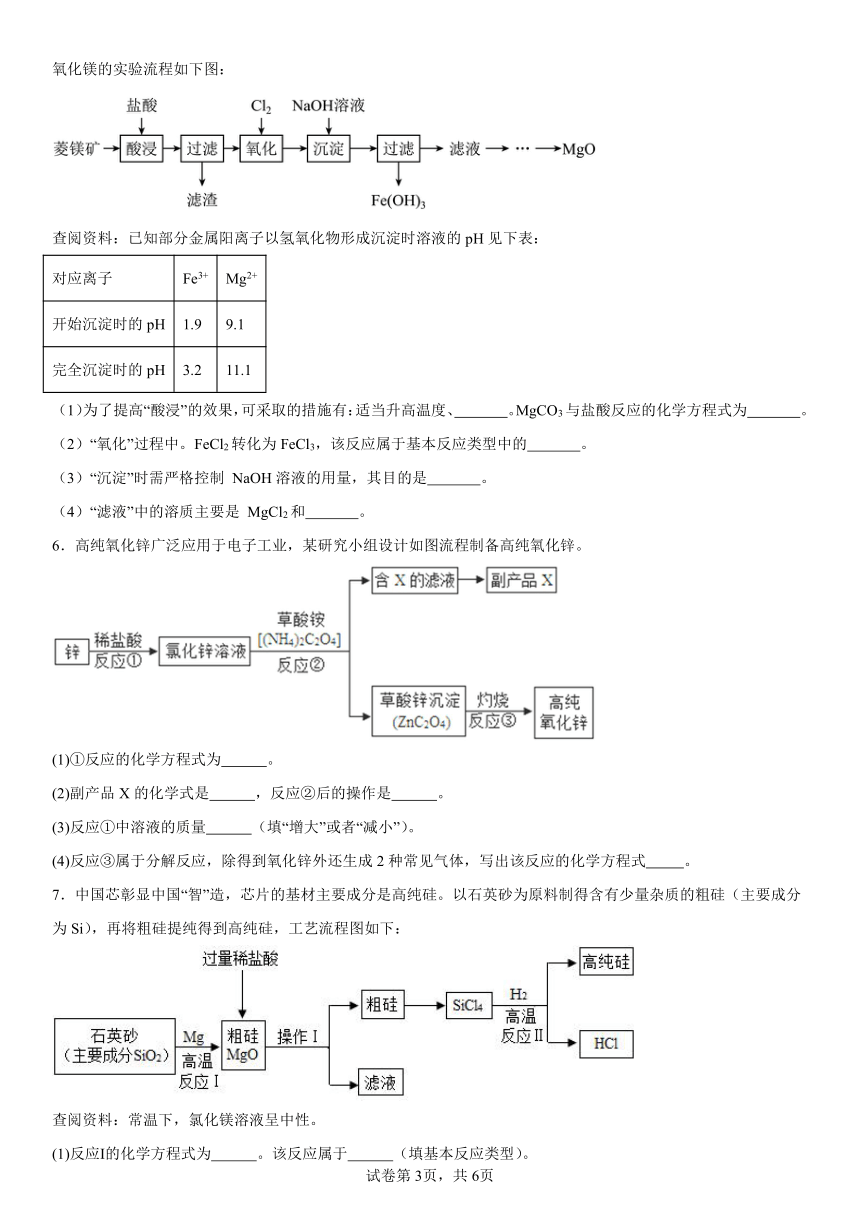
2.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 ,此反应属于 (填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
3.某合金主要成分为Zn、Fe、Cu,还含有少量这三种金属的氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如下图所示。已知: Zn(OH) 2溶于NaOH等强碱形成可溶性盐。回答相关问题:
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。 此过程中Zn还能起到除去含铜化合物的作用.写出该反应的化学方程式: 。
(3)调节溶液的pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH) 2发生分解反应的化学方程式为 。
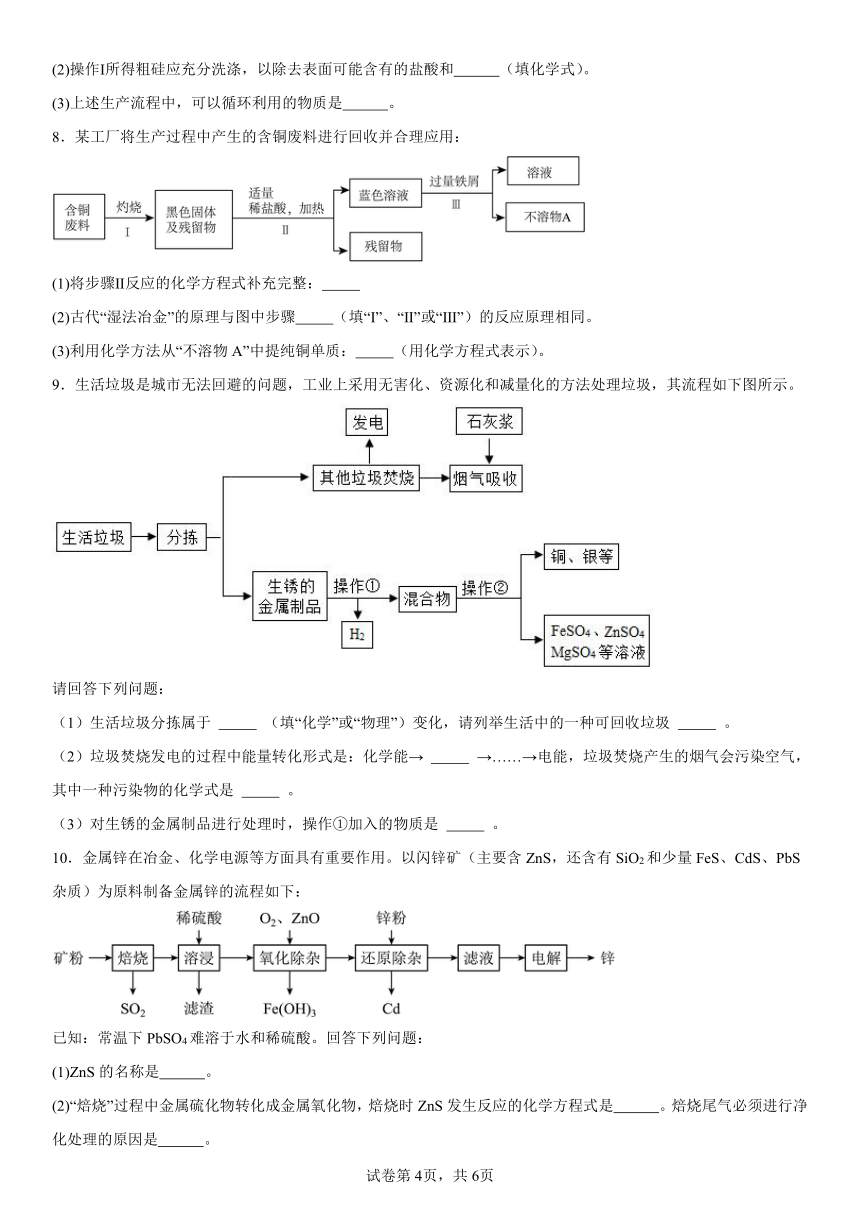
4.空气是宝贵的自然资源,下图是以空气等为原料合成氮肥的流程。
(1)从物质分类的角度:空气属于 (填“混合物”或“纯净物”)。
(2)从变化角度:步骤I发生的是 变化(填“物理”或“化学”)。
(3)步骤Ⅱ发生的化学方程式为 ,该反应属于 (填基本反应类型)。流程图步骤Ⅲ的化学方程式为 。步骤V可得到常见的硝酸铵氮肥,硝酸铵中阳离子的符号为 。硝酸铵氮肥不能和下列哪种钾肥 (填字母序号)混合使用。
A.KCl B.K2CO3 C.K2SO4
(4)从环保角度:下列保护空气措施合理的有______(多选、填字母序号)。
A.及时清理和妥善处置工业、生活和建筑废渣,减少地面扬尘
B.工厂通过加高烟囱直接排放废气
C.提倡步行、骑自行车等“低碳”出行方式
5.回答下列问题。
(一)如图中的甲、乙、丙表示初中化学常见的物质,已知甲是一种酸,图中“﹣”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系:部分反应物、生成物已略去。
(1)甲溶液中一定含有的离子是 (写化学符号)。
(2)若甲为硫酸,乙、丙都含镁元素,则乙可能是 (填化学式);写出符合“甲→丙”的一个反应的化学方程式 。
(二)氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3等)为原料制备高纯氧化镁的实验流程如下图:
查阅资料:已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 Fe3+ Mg2+
开始沉淀时的pH 1.9 9.1
完全沉淀时的pH 3.2 11.1
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、 。MgCO3与盐酸反应的化学方程式为 。
(2)“氧化”过程中。FeCl2转化为FeCl3,该反应属于基本反应类型中的 。
(3)“沉淀”时需严格控制 NaOH溶液的用量,其目的是 。
(4)“滤液”中的溶质主要是 MgCl2和 。
6.高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌。
(1)①反应的化学方程式为 。
(2)副产品X的化学式是 ,反应②后的操作是 。
(3)反应①中溶液的质量 (填“增大”或者“减小”)。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,写出该反应的化学方程式 。
7.中国芯彰显中国“智”造,芯片的基材主要成分是高纯硅。以石英砂为原料制得含有少量杂质的粗硅(主要成分为Si),再将粗硅提纯得到高纯硅,工艺流程图如下:
查阅资料:常温下,氯化镁溶液呈中性。
(1)反应Ⅰ的化学方程式为 。该反应属于 (填基本反应类型)。
(2)操作Ⅰ所得粗硅应充分洗涤,以除去表面可能含有的盐酸和 (填化学式)。
(3)上述生产流程中,可以循环利用的物质是 。
8.某工厂将生产过程中产生的含铜废料进行回收并合理应用:
(1)将步骤Ⅱ反应的化学方程式补充完整:
(2)古代“湿法冶金”的原理与图中步骤 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)的反应原理相同。
(3)利用化学方法从“不溶物A”中提纯铜单质: (用化学方程式表示)。
9.生活垃圾是城市无法回避的问题,工业上采用无害化、资源化和减量化的方法处理垃圾,其流程如下图所示。
请回答下列问题:
(1)生活垃圾分拣属于 (填“化学”或“物理”)变化,请列举生活中的一种可回收垃圾 。
(2)垃圾焚烧发电的过程中能量转化形式是:化学能→ →……→电能,垃圾焚烧产生的烟气会污染空气,其中一种污染物的化学式是 。
(3)对生锈的金属制品进行处理时,操作①加入的物质是 。
10.金属锌在冶金、化学电源等方面具有重要作用。以闪锌矿(主要含ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如下:
已知:常温下PbSO4难溶于水和稀硫酸。回答下列问题:
(1)ZnS的名称是 。
(2)“焙烧”过程中金属硫化物转化成金属氧化物,焙烧时ZnS发生反应的化学方程式是 。焙烧尾气必须进行净化处理的原因是 。
(3)“溶浸”产生的滤渣主要成分除了SiO2外还有 。
(4)“氧化除杂”的主要反应为,则x、y、z依次是 。“电解”过程的反应为:2ZnSO4+2H2O2Zn+O2↑+2H2SO4,则电解得到的溶液可返回 工序继续使用。
(5)“还原除杂”利用锌粉与CdSO4反应,其化学方程式为 ;已知Cd放入盐酸中有气体产生,则Cd、Zn、Cu的金属活动性顺序为 。
11.某化学实验室从含少量硝酸锌的硝酸银废液中提取贵金属Ag,其主要操作流程如图所示:
(1)固体A的成分有 (填化学式)。
(2)写出步骤I中发生反应的化学方程式: 。
(3)若往溶液D中加入适量某种物质后,可得到只含一种溶质的溶液,则加入的物质可能是 。
12.纯碱是重要的化工原料。如图是某工厂制作纯碱的工艺流程,请回答下列问题。
(1)判断食盐水是否饱和的方法是 。
(2)反应①是氯化钠和水以及两种气体反应,是制纯碱流程中最重要的一个环节,该反应的化学方程式为 。
(3)操作I的名称是 ;操作Ⅱ中玻璃棒的用是 。
(4)反应②的基本反应类型是 。
13.海水晒制得到的粗盐中除含NaCl外,还含有 MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是将粗盐进行提纯的实验步骤。
请回答下列问题。
(1)步骤 I和步骤II都涉及的实验操作是 。
(2)为了除去溶液 A 中的可溶性杂质,应按顺序分别加入过量的 Na2CO3溶液、NaOH 溶液、BaCl2溶液,请写出所加三种试剂的顺序 。
(3)除去溶液 B 中的杂质,不能选用稀硝酸的原因是 。
14.硫酸镁晶体(MgSO4·7H2O) 是一种重要的化工原料。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如图:
已知:①在酸性条件下,过氧化氢溶液能将Fe2+转化成Fe3+。
②Fe3+、Mg2+形成沉淀时溶液的pH见下图:
(1)“浸取”时,为了提高反应速率,除了搅拌、提高硫酸浓度外,还可采取的措施有 (写出一种)。
(2)“氧化”步骤中能生成硫酸铁和水,该反应的化学方程式是 。
(3)“沉淀”步骤中,用氨水调节pH的范围是 。
(4)“过滤” 所得滤液中含有的阳离子为 (填离子符号)。
(5)“结晶”步骤中需蒸发滤液,在实验室中蒸发结晶时使用玻璃棒搅拌的作用是 。
15.金属钛被称为铁和铝之后崛起的“第三种金属”,它是航海、化工、医疗上不可缺少的材料。工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如图所示。
(1)操作I的名称是 。
(2)向钛铁矿中加入的稀盐酸需过量,其目的是 。
(3)高温条件下,二氧化钛固体、单质碳和通入的Cl2发生反应的化学方程式为 。
(4)在流程中,可用Na代替Mg制取Ti,其原因是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 将菱镁矿石粉碎,增大反应物之间的接触面积,使反应更充分,提高浸取率,或搅拌、或提高硫酸的浓度(合理即可)
(2)升高
(3) 降温结晶(温度在1.8至48.1℃) H2SO4
【详解】(1)“酸浸时,为了提高浸取率,可采取的措施有:将菱镁矿石粉碎,增大反应物之间的接触面积,使反应更充分,提高浸取率,或搅拌、或提高硫酸的浓度;
碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水,该反应的化学方程式为: ;
(2)反应物MnSO4中硫酸根显示-2价,根据化合物中正、负化合价的代数和为零,可得锰元素显示+2价,生成物MnO2中氧元素显-2价,锰元素显示+4价,故锰元素反应前后化合价变化情况是升高;
(3)①由表中数据可知,温度在1.8至48.1℃时,析出MgSO4·7H2O,故“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、降温结晶(温度在1.8至48.1℃)、过滤、洗涤、低温干燥;
②酸浸时,硫酸是反应物,而转化时,硫酸是生成物,故“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是H2SO4。
2. Cu 反应过程中会产生氢气,防止失火或爆炸 Zn+CuSO4=Cu+ ZnSO4 置换 Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失 Zn(OH)2ZnO+ H2O
【分析】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物,根据金属活动性顺序表,Zn>Fe>Cu,Zn、Fe加入稀硫酸后形成相应的盐溶液,而铜不与稀硫酸反应,因此滤渣I为铜单质,滤液I中主要成分为硫酸锌和硫酸亚铁,可以加入锌粉进行除铁,滤渣II可以是铁粉和锌的混合物,将滤液II调节pH值使锌以氢氧化锌的形式沉淀下来,洗涤焙烧之后得到氧化锌。
【详解】(1)由分析可知,滤渣I中一定有铜。故填:Cu
(2)金属与酸反应会产生氢气,加酸溶解废弃物时,需要通风并远离火源,其原因是反应过程中会产生氢气,防止失火或爆炸。此过程中铜的氧化物与硫酸反应后,生成硫酸铜,锌与硫酸铜反应生成硫酸锌和铜单质,因此Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4=Cu+ ZnSO4,此反应属于置换反应。故填:反应过程中会产生氢气,防止失火或爆炸;Zn+CuSO4=Cu+ZnSO4;置换
(3)调节pH可用NaOH,但不能过量,是因为Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失,因此不能过量。故填:Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失
(4)氢氧化锌焙烧后发生分解反应,其化学方程式为:Zn(OH)2ZnO+ H2O;故填:Zn(OH)2ZnO+ H2O
3. 铜/Cu 反应过程中会产生氢气,氢气易燃易爆 过量的氢氧化钠溶液会使Zn(OH)2溶于NaOH等强碱形成可溶性盐
【详解】(1)该合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物,根据金属活动性顺序表,Zn>Fe>>H>Cu,Zn、Fe加入稀硫酸后形成相应的盐溶液和氢气,由于酸能和金属氧化物反应生成盐和水,所以稀硫酸可以和三种金属的氧化物反应分别生成相应的盐和水,而铜不与稀硫酸反应,所以滤渣I中一定有的为铜。
(2)金属与酸反应会产生氢气,加酸溶解废弃物时,需要通风并远离火源,其原因是反应过程中会产生氢气,氢气易燃易爆,防止失火或爆炸;
此过程中铜的氧化物与硫酸反应后,生成硫酸铜,锌与硫酸铜反应生成硫酸锌和铜单质,因此Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4=Cu+ZnSO4。
(3)调节溶液的pH可用NaOH氢氧化钠溶液,一方面除去溶液中可能存在的酸,另一方面将硫酸锌转化为氢氧化锌,但氢氧化钠溶液不能过量,是因为Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成氢氧化锌损失,因此氢氧化钠溶液不能过量。故填:过量的氢氧化钠溶液会使Zn(OH)2溶于强碱形成可溶性盐。
(4)氢氧化锌焙烧后生成氧化锌和水,反应的化学方程式为:。
4.(1)混合物
(2)物理
(3) 化合反应 B
(4)AC
【详解】(1)空气是由氮气、氧气等多种物质混合而成,属于混合物;
(2)步骤I是分离液态空气,是利用液氮和液氧沸点的不同,将其分离,无新物质生成,属于物理变化;
(3)步骤Ⅱ发生反应为氮气和单质甲在一定条件下反应生成氨气,根据质量守恒定律,化学反应前后,元素的种类不变,生成物中含氮、氢元素,反应物中含氮元素,故反应物中还应含氢元素,故单质甲为氢气,故该反应的化学方程式为: ;该反应符合“多变一”的特点,属于化合反应;
步骤III中反应为氨气和氧气在催化剂和高温下反应生成一氧化氮和水,该反应的化学方程式为: ;
硝酸铵由铵根离子和硝酸根离子构成,铵根离子属于阳离子,根据离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字,硝酸铵中阳离子的符号表示为: ;
硝酸铵中含有铵根离子,不能与碱性物质混合使用,防止生成氨气,降低肥效;氯化钾和硫酸钾均显中性,碳酸钾显碱性,所以硝酸铵氮肥不能和碳酸钾混合使用,故选:B;
(4)A、及时清理和妥善处置工业、生活和建筑废渣,减少地面扬尘,可以减少可吸入颗粒物的含量,减少空气污染,符合题意;
B、工厂通过加高烟囱直接排放废气,废气排放到了高空中,但是还是会污染空气,不符合题意;
C、提倡步行、骑自行车等“低碳”出行方式,可以减少化石燃料的使用,减少污染物的排放,保护环境,符合题意;
故选AC。
5. (或,合理即可) 适当增大盐酸浓度、边加盐酸边搅拌、增加酸浸时间等 化合反应 确保全部转化成沉淀,不转化成沉淀 NaCl
【详解】(一)甲、乙、丙表示初中化学常见的物质,已知甲是一种酸;
(1)甲溶液中一定含有的离子是氢离子,符号为。
(2)若甲为硫酸,乙、丙都含镁元素,丙是硫酸镁,则乙可能是氢氧化镁,化学式为;符合“甲→丙”的一个反应可以是镁与稀硫酸反应生成硫酸镁和氢气,反应的化学方程式为(或氧化镁与稀盐酸反应生成硫酸镁和水:,合理即可)。
(二)(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、适当增大盐酸浓度、边加盐酸边搅拌、增加酸浸时间等。MgCO3与盐酸反应生成氯化镁、水和二氧化碳,反应的化学方程式为。
(2)“氧化”过程中。转化为,该反应符合“多变一”的形式,属于化合反应。
(3)氢氧化钠溶液与氯化镁、氯化铁反应均能生成沉淀,“沉淀”时需严格控制NaOH溶液的用量,其目的是确保全部转化成沉淀,不转化成沉淀。
(4)氢氧化钠溶液与氯化铁溶液反应生成氢氧化铁沉淀和氯化钠,则“滤液”中的溶质主要是和NaCl。
故答案为:
【点睛】理解以菱镁矿为原料制备高纯氧化镁的实验流程,掌握酸与碱的化学性质是正确解答本题的关键。
6.(1)Zn+2HCl═ZnCl2+H2↑
(2) NH4Cl 过滤
(3)增大
(4)ZnC2O4ZnO+CO2↑+CO↑
【详解】(1)反应①,即锌与稀盐酸反应生成氯化锌溶液和氢气,反应的化学方程式为Zn+2HCl═ZnCl2+H2↑;
(2)氯化锌溶液与草酸铵溶液反应生成草酸锌沉淀和氯化铵,副产品X是氯化铵,其化学式为NH4Cl;反应后应将沉淀与溶液分离,反应②后的操作是过滤;
(3)参加反应的锌的质量大于生成氢气的质量,由质量守恒定律,反应①中溶液的质量增大;
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,由质量守恒定律,反应前后元素种类不变,则2种常见气体为一氧化碳、二氧化碳,该反应的化学方程式为。
7.(1) 置换反应
(2)MgCl2
(3)稀盐酸
【详解】(1)由图可知,反应Ⅰ为镁和二氧化硅在高温下反应生成氧化镁和硅,该反应的化学方程式为:;
该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
(2)向粗硅中加入过量稀盐酸,氧化镁和稀盐酸反应生成氯化镁和水,稀盐酸过量,故操作Ⅰ所得粗硅应充分洗涤,以除去表面可能含有的盐酸和MgCl2;
(3)由图可知,上述流程中,HCl既是反应物,又是生成物,可以循环利用。
8. CuO+H2SO4CuSO4+H2O Ⅲ Fe+H2SO4═FeSO4+H2↑
【分析】含铜废料灼烧会生成氧化铜,故黑色固体是氧化铜的混合物,加稀硫酸后可以和氧化铜生成蓝色硫酸铜溶液,硫酸铜加过量铁屑发生反应: ,得到Fe和Cu的混合物A。
【详解】(1)铜灼烧生成黑色氧化铜,氧化铜和稀硫酸反应生成氧化铜和水,化学方程式为:CuO+H2SO4CuSO4+H2O,故填:CuO+H2SO4CuSO4+H2O;
(2)古代“湿法冶金”的原理是用硫酸铜和铁发生反应生成铁和铜,和步骤Ⅲ原理相同,故填:Ⅲ;
(3)利用化学方法从“不溶物A”中提纯铜单质就是去除混合物中过量的铁粉,可以加稀硫酸发生反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4═FeSO4+H2↑;
9. 物理 旧报纸(合理即可) 热能 SO2 稀硫酸
【详解】(1)生活垃圾分拣没有新物质生成,属于物理变化;生活中的可回收垃圾,如旧报纸等;
故填:物理;旧报纸(合理即可)
(2)垃圾具有化学能,垃圾焚烧发电的过程中,主要是通过垃圾焚烧将化学能转变成热能,通过热机转化为机械能,再通过发电机转化为电能;垃圾焚烧产生的烟气中含有SO2等有害气体;
故填:热能;SO2
(3)对生锈的金属制品进行处理时,主要通过稀硫酸溶解生锈金属制品中表面的氧化物和活泼金属。
故填:稀硫酸
10.(1)硫化锌
(2) SO2会污染空气或形成酸雨
(3)PbSO4
(4) 6,4,4 溶浸
(5) Zn>Cd>Cu
【详解】(1)化合物从右往左读,ZnS的名称是硫化锌。
(2)由流程可知,“焙烧”过程中金属硫化物转化成金属氧化物,焙烧时ZnS发生反应为硫化锌和氧气生成氧化锌和二氧化硫,化学方程式为:;
焙烧尾气SO2会污染空气或形成酸雨,故必须进行净化处理。
(3)已知:常温下PbSO4难溶于水和稀硫酸。“溶浸”产生的滤渣主要成分除了SiO2外还有生成的PbSO4。
(4)化学方程式的配平遵循两个原则①遵循质量守恒定律(在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。)②遵循客观事实;“氧化除杂”的主要反应配平后为:,故x、y、z依次是6,4,4。
由流程可知,“电解”过程生成的硫酸溶液可以在溶浸工序继续使用。
(5)“还原除杂”利用锌粉与CdSO4反应,生成硫酸锌和Cd单质,反应方程式为,该反应也说明金属活动性Zn大于Cd;已知Cd放入盐酸中有气体产生,而铜不能和酸反应,故金属活动性Cd大于Cu;故Cd、Zn、Cu的金属活动性顺序为Zn>Cd>Cu。
11. Zn、Ag Zn(或ZnO)
【详解】(1)锌的金属活动性强于银,所以锌和硝酸银反应生成硝酸锌和银,由于是加入过量的锌粉,所以固体A的成分有剩余的Zn和生成的Ag;
(2)步骤I是锌和硝酸银反应生成硝酸锌和银,对应的化学反应方程式为Zn+2AgNO3=Zn(NO3)2+2Ag;
(3)步骤Ⅱ中,锌和稀硫酸反应生成硫酸锌和氢气,铜不和稀硫酸反应,过滤后,溶液D为硫酸锌和硫酸,加入适量的锌,可得到只含硫酸锌一种溶质的溶液。
12.(1)向该溶液中加入少量NaCl固体,充分搅拌,不再溶解,说明溶液已饱和
(2)
(3) 过滤 搅拌,防止因局部温度过高造成液滴飞溅
(4)分解反应
【详解】(1)氯化钠的饱和溶液不能继续溶解氯化钠。检验食盐水是否饱和的方法是向该溶液中加入少量NaCl固体,充分搅拌,不再溶解,说明溶液已饱和;
(2)由流程图可知,反应①是饱和食盐水、氨气和二氧化碳在常温下生成碳酸氢钠和氯化铵,其反应的化学方程式为:;
(3)操作Ⅰ能将碳酸氢钠固体与氯化铵溶液分离,操作Ⅰ的名称是过滤;操作Ⅱ是氯化铵溶液转化为氯化铵固体,故操作Ⅱ的名称为蒸发,其中玻璃棒的作用是搅拌,防止因局部温度过高造成液滴飞溅;
(4)反应②碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,符合“一变多”,其基本反应类型是分解反应。
13.(1)过滤
(2)NaOH溶液、BaCl 溶液、Na CO 溶液或BaCl 溶液、NaOH溶液、Na2CO3溶液或BaCl 溶液、Na CO 溶液、NaOH溶液
(3)会生成新的杂质硝酸钠
【详解】(1)步骤I和步骤Ⅱ均实现了固液分离,名称是过滤。
(2)粗盐中含氯化镁、氯化钙、硫酸钠等杂质,加入过量的氢氧化钠溶液,氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,可除去氯化镁,加入过量的氯化钡溶液,氯化钡和硫酸钠反应生成硫酸钡和氯化钠,可除去硫酸钠,加入过量的碳酸钠,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,碳酸钠和过量的氯化钡反应生成碳酸钡和氯化钠,可除去氯化钙和过量的氯化钡,加入碳酸钠溶液应在加入氯化钡之后,过量的氯化钡才能除去,故顺序为:NaOH溶液、BaCl2溶液、Na2CO3溶液或BaCl2溶液、NaOH溶液、Na2CO3溶液或BaCl2溶液、Na2CO3溶液、NaOH溶液。
(3)溶液B中含过量的氢氧化钠和碳酸钠杂质,如果选择稀硝酸,氢氧化钠和稀硝酸反应生成硝酸钠和水,碳酸钠和稀硝酸反应生成硝酸钠、二氧化碳和水,虽然除去了杂质,但是引入了新的杂质硝酸钠。
14.(1)将菱镁矿粉碎或提高温度或使用催化剂等(合理即可)
(2)2FeSO4+H2SO4+H2O2= Fe2(SO4)3+2H2O
(3)3.2~9.1
(4)和Mg2+
(5)防止局部温度过高,液体飞溅
【分析】 菱镁矿石(主要成分是MgCO3,并含有FeCO3和不溶性杂质)加稀硫酸浸取,过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤液中加入过氧化氢氧化、亚铁离子为铁离子,加入氨水调节溶液pH沉淀铁离子,过滤得到滤液中含有MgSO4和氯化铵,浓缩结晶、过滤洗涤,得MgSO4 7H2O晶体,以此解答该题。
【详解】(1)“浸取”时,为了提高反应速率,可采用将菱镁矿石进行粉碎,可增大反应物的接触面积,加快反应速率,适当提高温度也能加快反应速率。
(2)“氧化”步骤中利用硫酸亚铁和过氧化氢和硫酸反应生成硫酸铁和水,该反应的化学方程式为2FeSO4+H2SO4+H2O2= Fe2(SO4)3+2H2O。
(3)加入氨水,应完全除去铁离子,但不能生成氢氧化镁沉淀,由图中数据可知调节pH的范围为3.2~9.1。
(4)过滤得到滤液中含有MgSO4和硫酸铵,则“过滤” 所得滤液中含有的阳离子为Mg2+、。
(5)“结晶”步骤中需蒸发滤液,在实验室中蒸发结晶时使用玻璃棒搅拌的作用是使液体均匀受热,防止局部温度过高,造成液体飞溅。
【点睛】本题考查物质的制备,涉及实验基本操作、化学方程式的书写等知识点,综合性较强,侧重考查基本操作、基本原理,明确流程图中发生的反应、基本操作方法、物质性质是解本题关键,难点是确定各物质中成分,题目难度中等。
15. 过滤 使钛铁矿完全反应 TiO2+2C+2Cl2 TiCl4+2CO 钠比镁的活动性强(或钠比镁活泼),也能置换出金属钛
【详解】(1)从溶液中分离出固体采用过滤的方法;故填:过滤;
(2)向钛铁矿中加入的稀盐酸需过量,目的是使钛铁矿完全反应;故填:使钛铁矿完全反应;
(3)在高温的条件下,二氧化钛、碳与氯气反应生成四氯化钛和一氧化碳;故填:TiO2+2C+2Cl2 TiCl4+2CO;
(4)在金属活动性顺序中,钠排在镁的前面,所以钠比镁活泼,在流程中,可用Na代替Mg制取Ti,故填:钠比镁活泼。
答案第1页,共2页
答案第1页,共2页
1.以某菱镁矿石(主要成分是MgCO3,含少量MnCO3、SiO2)制取MgSO4·7H2O,流程如下:
(1)“酸浸时,为了提高浸取率,可采取的措施有 (写出一种)此时,MnCO3发生反应的化学方程式是 。
(2)“转化时主要反应是 ,锰元素反应前后化合价变化情况是 (填“升高”或“降低”)。
(3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:
温度/℃ -3.9-1.8 1.8-48.1 48.1-67.5 67.5-200
析出晶体 MgSO4·12H2O MgSO4·7H2O MgSO4·6H2O MgSO4·H2O等
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、 、过滤、洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是 (填化学式)。
2.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 ,此反应属于 (填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
3.某合金主要成分为Zn、Fe、Cu,还含有少量这三种金属的氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如下图所示。已知: Zn(OH) 2溶于NaOH等强碱形成可溶性盐。回答相关问题:
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。 此过程中Zn还能起到除去含铜化合物的作用.写出该反应的化学方程式: 。
(3)调节溶液的pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH) 2发生分解反应的化学方程式为 。
4.空气是宝贵的自然资源,下图是以空气等为原料合成氮肥的流程。
(1)从物质分类的角度:空气属于 (填“混合物”或“纯净物”)。
(2)从变化角度:步骤I发生的是 变化(填“物理”或“化学”)。
(3)步骤Ⅱ发生的化学方程式为 ,该反应属于 (填基本反应类型)。流程图步骤Ⅲ的化学方程式为 。步骤V可得到常见的硝酸铵氮肥,硝酸铵中阳离子的符号为 。硝酸铵氮肥不能和下列哪种钾肥 (填字母序号)混合使用。
A.KCl B.K2CO3 C.K2SO4
(4)从环保角度:下列保护空气措施合理的有______(多选、填字母序号)。
A.及时清理和妥善处置工业、生活和建筑废渣,减少地面扬尘
B.工厂通过加高烟囱直接排放废气
C.提倡步行、骑自行车等“低碳”出行方式
5.回答下列问题。
(一)如图中的甲、乙、丙表示初中化学常见的物质,已知甲是一种酸,图中“﹣”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系:部分反应物、生成物已略去。
(1)甲溶液中一定含有的离子是 (写化学符号)。
(2)若甲为硫酸,乙、丙都含镁元素,则乙可能是 (填化学式);写出符合“甲→丙”的一个反应的化学方程式 。
(二)氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3等)为原料制备高纯氧化镁的实验流程如下图:
查阅资料:已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 Fe3+ Mg2+
开始沉淀时的pH 1.9 9.1
完全沉淀时的pH 3.2 11.1
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、 。MgCO3与盐酸反应的化学方程式为 。
(2)“氧化”过程中。FeCl2转化为FeCl3,该反应属于基本反应类型中的 。
(3)“沉淀”时需严格控制 NaOH溶液的用量,其目的是 。
(4)“滤液”中的溶质主要是 MgCl2和 。
6.高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌。
(1)①反应的化学方程式为 。
(2)副产品X的化学式是 ,反应②后的操作是 。
(3)反应①中溶液的质量 (填“增大”或者“减小”)。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,写出该反应的化学方程式 。
7.中国芯彰显中国“智”造,芯片的基材主要成分是高纯硅。以石英砂为原料制得含有少量杂质的粗硅(主要成分为Si),再将粗硅提纯得到高纯硅,工艺流程图如下:
查阅资料:常温下,氯化镁溶液呈中性。
(1)反应Ⅰ的化学方程式为 。该反应属于 (填基本反应类型)。
(2)操作Ⅰ所得粗硅应充分洗涤,以除去表面可能含有的盐酸和 (填化学式)。
(3)上述生产流程中,可以循环利用的物质是 。
8.某工厂将生产过程中产生的含铜废料进行回收并合理应用:
(1)将步骤Ⅱ反应的化学方程式补充完整:
(2)古代“湿法冶金”的原理与图中步骤 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)的反应原理相同。
(3)利用化学方法从“不溶物A”中提纯铜单质: (用化学方程式表示)。
9.生活垃圾是城市无法回避的问题,工业上采用无害化、资源化和减量化的方法处理垃圾,其流程如下图所示。
请回答下列问题:
(1)生活垃圾分拣属于 (填“化学”或“物理”)变化,请列举生活中的一种可回收垃圾 。
(2)垃圾焚烧发电的过程中能量转化形式是:化学能→ →……→电能,垃圾焚烧产生的烟气会污染空气,其中一种污染物的化学式是 。
(3)对生锈的金属制品进行处理时,操作①加入的物质是 。
10.金属锌在冶金、化学电源等方面具有重要作用。以闪锌矿(主要含ZnS,还含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如下:
已知:常温下PbSO4难溶于水和稀硫酸。回答下列问题:
(1)ZnS的名称是 。
(2)“焙烧”过程中金属硫化物转化成金属氧化物,焙烧时ZnS发生反应的化学方程式是 。焙烧尾气必须进行净化处理的原因是 。
(3)“溶浸”产生的滤渣主要成分除了SiO2外还有 。
(4)“氧化除杂”的主要反应为,则x、y、z依次是 。“电解”过程的反应为:2ZnSO4+2H2O2Zn+O2↑+2H2SO4,则电解得到的溶液可返回 工序继续使用。
(5)“还原除杂”利用锌粉与CdSO4反应,其化学方程式为 ;已知Cd放入盐酸中有气体产生,则Cd、Zn、Cu的金属活动性顺序为 。
11.某化学实验室从含少量硝酸锌的硝酸银废液中提取贵金属Ag,其主要操作流程如图所示:
(1)固体A的成分有 (填化学式)。
(2)写出步骤I中发生反应的化学方程式: 。
(3)若往溶液D中加入适量某种物质后,可得到只含一种溶质的溶液,则加入的物质可能是 。
12.纯碱是重要的化工原料。如图是某工厂制作纯碱的工艺流程,请回答下列问题。
(1)判断食盐水是否饱和的方法是 。
(2)反应①是氯化钠和水以及两种气体反应,是制纯碱流程中最重要的一个环节,该反应的化学方程式为 。
(3)操作I的名称是 ;操作Ⅱ中玻璃棒的用是 。
(4)反应②的基本反应类型是 。
13.海水晒制得到的粗盐中除含NaCl外,还含有 MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是将粗盐进行提纯的实验步骤。
请回答下列问题。
(1)步骤 I和步骤II都涉及的实验操作是 。
(2)为了除去溶液 A 中的可溶性杂质,应按顺序分别加入过量的 Na2CO3溶液、NaOH 溶液、BaCl2溶液,请写出所加三种试剂的顺序 。
(3)除去溶液 B 中的杂质,不能选用稀硝酸的原因是 。
14.硫酸镁晶体(MgSO4·7H2O) 是一种重要的化工原料。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如图:
已知:①在酸性条件下,过氧化氢溶液能将Fe2+转化成Fe3+。
②Fe3+、Mg2+形成沉淀时溶液的pH见下图:
(1)“浸取”时,为了提高反应速率,除了搅拌、提高硫酸浓度外,还可采取的措施有 (写出一种)。
(2)“氧化”步骤中能生成硫酸铁和水,该反应的化学方程式是 。
(3)“沉淀”步骤中,用氨水调节pH的范围是 。
(4)“过滤” 所得滤液中含有的阳离子为 (填离子符号)。
(5)“结晶”步骤中需蒸发滤液,在实验室中蒸发结晶时使用玻璃棒搅拌的作用是 。
15.金属钛被称为铁和铝之后崛起的“第三种金属”,它是航海、化工、医疗上不可缺少的材料。工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如图所示。
(1)操作I的名称是 。
(2)向钛铁矿中加入的稀盐酸需过量,其目的是 。
(3)高温条件下,二氧化钛固体、单质碳和通入的Cl2发生反应的化学方程式为 。
(4)在流程中,可用Na代替Mg制取Ti,其原因是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) 将菱镁矿石粉碎,增大反应物之间的接触面积,使反应更充分,提高浸取率,或搅拌、或提高硫酸的浓度(合理即可)
(2)升高
(3) 降温结晶(温度在1.8至48.1℃) H2SO4
【详解】(1)“酸浸时,为了提高浸取率,可采取的措施有:将菱镁矿石粉碎,增大反应物之间的接触面积,使反应更充分,提高浸取率,或搅拌、或提高硫酸的浓度;
碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水,该反应的化学方程式为: ;
(2)反应物MnSO4中硫酸根显示-2价,根据化合物中正、负化合价的代数和为零,可得锰元素显示+2价,生成物MnO2中氧元素显-2价,锰元素显示+4价,故锰元素反应前后化合价变化情况是升高;
(3)①由表中数据可知,温度在1.8至48.1℃时,析出MgSO4·7H2O,故“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、降温结晶(温度在1.8至48.1℃)、过滤、洗涤、低温干燥;
②酸浸时,硫酸是反应物,而转化时,硫酸是生成物,故“操作1”所得滤液中能分离出一种可循环使用的物质,该物质是H2SO4。
2. Cu 反应过程中会产生氢气,防止失火或爆炸 Zn+CuSO4=Cu+ ZnSO4 置换 Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失 Zn(OH)2ZnO+ H2O
【分析】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物,根据金属活动性顺序表,Zn>Fe>Cu,Zn、Fe加入稀硫酸后形成相应的盐溶液,而铜不与稀硫酸反应,因此滤渣I为铜单质,滤液I中主要成分为硫酸锌和硫酸亚铁,可以加入锌粉进行除铁,滤渣II可以是铁粉和锌的混合物,将滤液II调节pH值使锌以氢氧化锌的形式沉淀下来,洗涤焙烧之后得到氧化锌。
【详解】(1)由分析可知,滤渣I中一定有铜。故填:Cu
(2)金属与酸反应会产生氢气,加酸溶解废弃物时,需要通风并远离火源,其原因是反应过程中会产生氢气,防止失火或爆炸。此过程中铜的氧化物与硫酸反应后,生成硫酸铜,锌与硫酸铜反应生成硫酸锌和铜单质,因此Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4=Cu+ ZnSO4,此反应属于置换反应。故填:反应过程中会产生氢气,防止失火或爆炸;Zn+CuSO4=Cu+ZnSO4;置换
(3)调节pH可用NaOH,但不能过量,是因为Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失,因此不能过量。故填:Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失
(4)氢氧化锌焙烧后发生分解反应,其化学方程式为:Zn(OH)2ZnO+ H2O;故填:Zn(OH)2ZnO+ H2O
3. 铜/Cu 反应过程中会产生氢气,氢气易燃易爆 过量的氢氧化钠溶液会使Zn(OH)2溶于NaOH等强碱形成可溶性盐
【详解】(1)该合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物,根据金属活动性顺序表,Zn>Fe>>H>Cu,Zn、Fe加入稀硫酸后形成相应的盐溶液和氢气,由于酸能和金属氧化物反应生成盐和水,所以稀硫酸可以和三种金属的氧化物反应分别生成相应的盐和水,而铜不与稀硫酸反应,所以滤渣I中一定有的为铜。
(2)金属与酸反应会产生氢气,加酸溶解废弃物时,需要通风并远离火源,其原因是反应过程中会产生氢气,氢气易燃易爆,防止失火或爆炸;
此过程中铜的氧化物与硫酸反应后,生成硫酸铜,锌与硫酸铜反应生成硫酸锌和铜单质,因此Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4=Cu+ZnSO4。
(3)调节溶液的pH可用NaOH氢氧化钠溶液,一方面除去溶液中可能存在的酸,另一方面将硫酸锌转化为氢氧化锌,但氢氧化钠溶液不能过量,是因为Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成氢氧化锌损失,因此氢氧化钠溶液不能过量。故填:过量的氢氧化钠溶液会使Zn(OH)2溶于强碱形成可溶性盐。
(4)氢氧化锌焙烧后生成氧化锌和水,反应的化学方程式为:。
4.(1)混合物
(2)物理
(3) 化合反应 B
(4)AC
【详解】(1)空气是由氮气、氧气等多种物质混合而成,属于混合物;
(2)步骤I是分离液态空气,是利用液氮和液氧沸点的不同,将其分离,无新物质生成,属于物理变化;
(3)步骤Ⅱ发生反应为氮气和单质甲在一定条件下反应生成氨气,根据质量守恒定律,化学反应前后,元素的种类不变,生成物中含氮、氢元素,反应物中含氮元素,故反应物中还应含氢元素,故单质甲为氢气,故该反应的化学方程式为: ;该反应符合“多变一”的特点,属于化合反应;
步骤III中反应为氨气和氧气在催化剂和高温下反应生成一氧化氮和水,该反应的化学方程式为: ;
硝酸铵由铵根离子和硝酸根离子构成,铵根离子属于阳离子,根据离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字,硝酸铵中阳离子的符号表示为: ;
硝酸铵中含有铵根离子,不能与碱性物质混合使用,防止生成氨气,降低肥效;氯化钾和硫酸钾均显中性,碳酸钾显碱性,所以硝酸铵氮肥不能和碳酸钾混合使用,故选:B;
(4)A、及时清理和妥善处置工业、生活和建筑废渣,减少地面扬尘,可以减少可吸入颗粒物的含量,减少空气污染,符合题意;
B、工厂通过加高烟囱直接排放废气,废气排放到了高空中,但是还是会污染空气,不符合题意;
C、提倡步行、骑自行车等“低碳”出行方式,可以减少化石燃料的使用,减少污染物的排放,保护环境,符合题意;
故选AC。
5. (或,合理即可) 适当增大盐酸浓度、边加盐酸边搅拌、增加酸浸时间等 化合反应 确保全部转化成沉淀,不转化成沉淀 NaCl
【详解】(一)甲、乙、丙表示初中化学常见的物质,已知甲是一种酸;
(1)甲溶液中一定含有的离子是氢离子,符号为。
(2)若甲为硫酸,乙、丙都含镁元素,丙是硫酸镁,则乙可能是氢氧化镁,化学式为;符合“甲→丙”的一个反应可以是镁与稀硫酸反应生成硫酸镁和氢气,反应的化学方程式为(或氧化镁与稀盐酸反应生成硫酸镁和水:,合理即可)。
(二)(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、适当增大盐酸浓度、边加盐酸边搅拌、增加酸浸时间等。MgCO3与盐酸反应生成氯化镁、水和二氧化碳,反应的化学方程式为。
(2)“氧化”过程中。转化为,该反应符合“多变一”的形式,属于化合反应。
(3)氢氧化钠溶液与氯化镁、氯化铁反应均能生成沉淀,“沉淀”时需严格控制NaOH溶液的用量,其目的是确保全部转化成沉淀,不转化成沉淀。
(4)氢氧化钠溶液与氯化铁溶液反应生成氢氧化铁沉淀和氯化钠,则“滤液”中的溶质主要是和NaCl。
故答案为:
【点睛】理解以菱镁矿为原料制备高纯氧化镁的实验流程,掌握酸与碱的化学性质是正确解答本题的关键。
6.(1)Zn+2HCl═ZnCl2+H2↑
(2) NH4Cl 过滤
(3)增大
(4)ZnC2O4ZnO+CO2↑+CO↑
【详解】(1)反应①,即锌与稀盐酸反应生成氯化锌溶液和氢气,反应的化学方程式为Zn+2HCl═ZnCl2+H2↑;
(2)氯化锌溶液与草酸铵溶液反应生成草酸锌沉淀和氯化铵,副产品X是氯化铵,其化学式为NH4Cl;反应后应将沉淀与溶液分离,反应②后的操作是过滤;
(3)参加反应的锌的质量大于生成氢气的质量,由质量守恒定律,反应①中溶液的质量增大;
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,由质量守恒定律,反应前后元素种类不变,则2种常见气体为一氧化碳、二氧化碳,该反应的化学方程式为。
7.(1) 置换反应
(2)MgCl2
(3)稀盐酸
【详解】(1)由图可知,反应Ⅰ为镁和二氧化硅在高温下反应生成氧化镁和硅,该反应的化学方程式为:;
该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应;
(2)向粗硅中加入过量稀盐酸,氧化镁和稀盐酸反应生成氯化镁和水,稀盐酸过量,故操作Ⅰ所得粗硅应充分洗涤,以除去表面可能含有的盐酸和MgCl2;
(3)由图可知,上述流程中,HCl既是反应物,又是生成物,可以循环利用。
8. CuO+H2SO4CuSO4+H2O Ⅲ Fe+H2SO4═FeSO4+H2↑
【分析】含铜废料灼烧会生成氧化铜,故黑色固体是氧化铜的混合物,加稀硫酸后可以和氧化铜生成蓝色硫酸铜溶液,硫酸铜加过量铁屑发生反应: ,得到Fe和Cu的混合物A。
【详解】(1)铜灼烧生成黑色氧化铜,氧化铜和稀硫酸反应生成氧化铜和水,化学方程式为:CuO+H2SO4CuSO4+H2O,故填:CuO+H2SO4CuSO4+H2O;
(2)古代“湿法冶金”的原理是用硫酸铜和铁发生反应生成铁和铜,和步骤Ⅲ原理相同,故填:Ⅲ;
(3)利用化学方法从“不溶物A”中提纯铜单质就是去除混合物中过量的铁粉,可以加稀硫酸发生反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4═FeSO4+H2↑;
9. 物理 旧报纸(合理即可) 热能 SO2 稀硫酸
【详解】(1)生活垃圾分拣没有新物质生成,属于物理变化;生活中的可回收垃圾,如旧报纸等;
故填:物理;旧报纸(合理即可)
(2)垃圾具有化学能,垃圾焚烧发电的过程中,主要是通过垃圾焚烧将化学能转变成热能,通过热机转化为机械能,再通过发电机转化为电能;垃圾焚烧产生的烟气中含有SO2等有害气体;
故填:热能;SO2
(3)对生锈的金属制品进行处理时,主要通过稀硫酸溶解生锈金属制品中表面的氧化物和活泼金属。
故填:稀硫酸
10.(1)硫化锌
(2) SO2会污染空气或形成酸雨
(3)PbSO4
(4) 6,4,4 溶浸
(5) Zn>Cd>Cu
【详解】(1)化合物从右往左读,ZnS的名称是硫化锌。
(2)由流程可知,“焙烧”过程中金属硫化物转化成金属氧化物,焙烧时ZnS发生反应为硫化锌和氧气生成氧化锌和二氧化硫,化学方程式为:;
焙烧尾气SO2会污染空气或形成酸雨,故必须进行净化处理。
(3)已知:常温下PbSO4难溶于水和稀硫酸。“溶浸”产生的滤渣主要成分除了SiO2外还有生成的PbSO4。
(4)化学方程式的配平遵循两个原则①遵循质量守恒定律(在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。)②遵循客观事实;“氧化除杂”的主要反应配平后为:,故x、y、z依次是6,4,4。
由流程可知,“电解”过程生成的硫酸溶液可以在溶浸工序继续使用。
(5)“还原除杂”利用锌粉与CdSO4反应,生成硫酸锌和Cd单质,反应方程式为,该反应也说明金属活动性Zn大于Cd;已知Cd放入盐酸中有气体产生,而铜不能和酸反应,故金属活动性Cd大于Cu;故Cd、Zn、Cu的金属活动性顺序为Zn>Cd>Cu。
11. Zn、Ag Zn(或ZnO)
【详解】(1)锌的金属活动性强于银,所以锌和硝酸银反应生成硝酸锌和银,由于是加入过量的锌粉,所以固体A的成分有剩余的Zn和生成的Ag;
(2)步骤I是锌和硝酸银反应生成硝酸锌和银,对应的化学反应方程式为Zn+2AgNO3=Zn(NO3)2+2Ag;
(3)步骤Ⅱ中,锌和稀硫酸反应生成硫酸锌和氢气,铜不和稀硫酸反应,过滤后,溶液D为硫酸锌和硫酸,加入适量的锌,可得到只含硫酸锌一种溶质的溶液。
12.(1)向该溶液中加入少量NaCl固体,充分搅拌,不再溶解,说明溶液已饱和
(2)
(3) 过滤 搅拌,防止因局部温度过高造成液滴飞溅
(4)分解反应
【详解】(1)氯化钠的饱和溶液不能继续溶解氯化钠。检验食盐水是否饱和的方法是向该溶液中加入少量NaCl固体,充分搅拌,不再溶解,说明溶液已饱和;
(2)由流程图可知,反应①是饱和食盐水、氨气和二氧化碳在常温下生成碳酸氢钠和氯化铵,其反应的化学方程式为:;
(3)操作Ⅰ能将碳酸氢钠固体与氯化铵溶液分离,操作Ⅰ的名称是过滤;操作Ⅱ是氯化铵溶液转化为氯化铵固体,故操作Ⅱ的名称为蒸发,其中玻璃棒的作用是搅拌,防止因局部温度过高造成液滴飞溅;
(4)反应②碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,符合“一变多”,其基本反应类型是分解反应。
13.(1)过滤
(2)NaOH溶液、BaCl 溶液、Na CO 溶液或BaCl 溶液、NaOH溶液、Na2CO3溶液或BaCl 溶液、Na CO 溶液、NaOH溶液
(3)会生成新的杂质硝酸钠
【详解】(1)步骤I和步骤Ⅱ均实现了固液分离,名称是过滤。
(2)粗盐中含氯化镁、氯化钙、硫酸钠等杂质,加入过量的氢氧化钠溶液,氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,可除去氯化镁,加入过量的氯化钡溶液,氯化钡和硫酸钠反应生成硫酸钡和氯化钠,可除去硫酸钠,加入过量的碳酸钠,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,碳酸钠和过量的氯化钡反应生成碳酸钡和氯化钠,可除去氯化钙和过量的氯化钡,加入碳酸钠溶液应在加入氯化钡之后,过量的氯化钡才能除去,故顺序为:NaOH溶液、BaCl2溶液、Na2CO3溶液或BaCl2溶液、NaOH溶液、Na2CO3溶液或BaCl2溶液、Na2CO3溶液、NaOH溶液。
(3)溶液B中含过量的氢氧化钠和碳酸钠杂质,如果选择稀硝酸,氢氧化钠和稀硝酸反应生成硝酸钠和水,碳酸钠和稀硝酸反应生成硝酸钠、二氧化碳和水,虽然除去了杂质,但是引入了新的杂质硝酸钠。
14.(1)将菱镁矿粉碎或提高温度或使用催化剂等(合理即可)
(2)2FeSO4+H2SO4+H2O2= Fe2(SO4)3+2H2O
(3)3.2~9.1
(4)和Mg2+
(5)防止局部温度过高,液体飞溅
【分析】 菱镁矿石(主要成分是MgCO3,并含有FeCO3和不溶性杂质)加稀硫酸浸取,过滤得到滤液为硫酸镁,硫酸亚铁溶液,滤液中加入过氧化氢氧化、亚铁离子为铁离子,加入氨水调节溶液pH沉淀铁离子,过滤得到滤液中含有MgSO4和氯化铵,浓缩结晶、过滤洗涤,得MgSO4 7H2O晶体,以此解答该题。
【详解】(1)“浸取”时,为了提高反应速率,可采用将菱镁矿石进行粉碎,可增大反应物的接触面积,加快反应速率,适当提高温度也能加快反应速率。
(2)“氧化”步骤中利用硫酸亚铁和过氧化氢和硫酸反应生成硫酸铁和水,该反应的化学方程式为2FeSO4+H2SO4+H2O2= Fe2(SO4)3+2H2O。
(3)加入氨水,应完全除去铁离子,但不能生成氢氧化镁沉淀,由图中数据可知调节pH的范围为3.2~9.1。
(4)过滤得到滤液中含有MgSO4和硫酸铵,则“过滤” 所得滤液中含有的阳离子为Mg2+、。
(5)“结晶”步骤中需蒸发滤液,在实验室中蒸发结晶时使用玻璃棒搅拌的作用是使液体均匀受热,防止局部温度过高,造成液体飞溅。
【点睛】本题考查物质的制备,涉及实验基本操作、化学方程式的书写等知识点,综合性较强,侧重考查基本操作、基本原理,明确流程图中发生的反应、基本操作方法、物质性质是解本题关键,难点是确定各物质中成分,题目难度中等。
15. 过滤 使钛铁矿完全反应 TiO2+2C+2Cl2 TiCl4+2CO 钠比镁的活动性强(或钠比镁活泼),也能置换出金属钛
【详解】(1)从溶液中分离出固体采用过滤的方法;故填:过滤;
(2)向钛铁矿中加入的稀盐酸需过量,目的是使钛铁矿完全反应;故填:使钛铁矿完全反应;
(3)在高温的条件下,二氧化钛、碳与氯气反应生成四氯化钛和一氧化碳;故填:TiO2+2C+2Cl2 TiCl4+2CO;
(4)在金属活动性顺序中,钠排在镁的前面,所以钠比镁活泼,在流程中,可用Na代替Mg制取Ti,故填:钠比镁活泼。
答案第1页,共2页
答案第1页,共2页
