2024年中考科学重点题型突破--流程题(4)(含解析)
文档属性
| 名称 | 2024年中考科学重点题型突破--流程题(4)(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1008.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-30 08:26:02 | ||
图片预览



文档简介
2024年中考科学重点题型突破--流程题(4)
1.金属钨(W)可作白炽灯泡的灯丝。工业上用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示
(1)金属钨可用作灯丝,是因为钨的 高;H2WO4中钨的化合价为 。
(2)反应①的化学方程式,X的化学式为 ;反应③属于 反应(填基本反应类型)。
(3)反应④的化学方程式为 该反应中氢气表现出的性质是 。
2.在粗盐的提纯实验中
(1)除去粗盐中难溶性杂质,其主要操作步骤顺序 。
①过滤 ②溶解 ③蒸发 ④计算产率
(2)下列关于蒸发的操作中说法正确的是 (填序号)。
a 该操作中用到的玻璃仪器有酒精灯、玻璃、蒸发皿、铁架台
b 该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅
c 当蒸发皿中出现较多固体时,停止加热
d 停止加热后,立即将蒸发皿直接放在试验台上
(3)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质Na2SO4、CaCl2得到纯净的NaCl,可采用如下图所示流程:
①上图中所用甲、乙、丙三种试剂依次是 (填序号)。
A BaCl2溶液、Na2CO3溶液、稀盐酸
B Na2CO3溶液、BaCl2溶液、稀盐酸
C 稀硫酸、BaCl2溶液、Na2CO3溶液
②反思交流:通过以上规范操作,制得氯化钠的质量比原粗盐样品中含氯化钠的质量 (填“增多”、“减少”、“不变”)。
3.某NaCl溶液中含有较多CaCl2,按下图方案提纯得到NaCl晶体(提示:CaCO3难溶)。
(1)试剂A的化学
(2)加入足量稀盐酸的目的为
(3)操作Ⅰ、Ⅱ的名称分别为 、
4.某氯碱工厂以粗盐(主要成分是NaCl,含少量泥沙、CaCl2、MgCl2)为原料生产NaOH,主要的工艺流程如图所示:
(1)加入试剂X可把MgCl2转化为沉淀,X的化学式是 。
(2)处理池中除去CaCl2的化学方程式是 。
(3)电解池中电解饱和NaCl溶液化学方程式是 。
(4)脱盐池是利用NaCl和NaOH在溶解度上的差异,通过 、趁热过滤分离得到NaCl晶体和NaOH溶液。
(5)该工业流程中可循环利用的物质是 。(写化学式)
(6)该工艺生产的NaOH样品中常含有少量NaCl、Na2CO3等杂质。你认为样品中含有Na2CO3的原因是 (用化学方程式表示)。
(7)写出该工业副产品H2的一种用途 。
(8)NaOH有强烈的腐蚀性,如果不慎沾到皮肤,要 。
5.化工生产中的废弃物再利用,可以有效节约资源、保护环境,下图是某化工厂利用废硫酸制备K2SO4的工艺流程图:
(1)生产上将CaCO3研成粉末的目的是 ;
(2)写出反应的化学方程式 ;
(3)反应②充分反应后物质分离的方法是 ;
(4)上述流程中,M溶液中溶质的主要成分是 (填写化学式);
(5)分析下表所示数据,则反应③在常温下可实现的原因是 ;
物质 KCl K2SO4 NH4Cl (NH4)2SO4
溶解度/g(20℃) 34.2 11.1 37.2 75.4
(6)洗涤反应③所得晶体最适宜的试剂是 (填序号);
AH2O B饱和K2SO4溶液 C 不饱和K2SO4溶液 D三者均可
(7)检验K2SO4晶体是否洗涤干净的方法是 。
(8)取50t质量分数为9.8%废硫酸用于该工艺制备K2SO4,理论可得到K2SO4质量为 t。
6.锂被誉为“新能源金属”、“金属味精”和“推动世界前进的金属”,具有极高的战略价值。碳酸锂是生产金属锂制品的基础材料。以锂辉石为原料,用硫酸焙烧法制取碳酸锂的工艺流程(部分试剂和步骤等已略去)如下。
【资料】
①锂辉石的主要成分是,含少量、元素。
②
(1)工业上将锂辉石磨至粒径为左右,再送入酸化炉的原因是 。
(2)“调”步骤中,加入的作用是 。
(3)在“除镁除钙”步骤中,先加入石灰乳,再加入溶液。添加试剂的顺序不能调换,其原因是 。
(4)操作I后得到的滤渣②的成分是 。
(5)和的溶解度如表所示:
20 40 60 80
1.33 1.17 0.01 0.85
34.2 32.8 31.9 30.7
为了提高产品的纯度,需要将得到的晶体洗涤,需选用 的水。
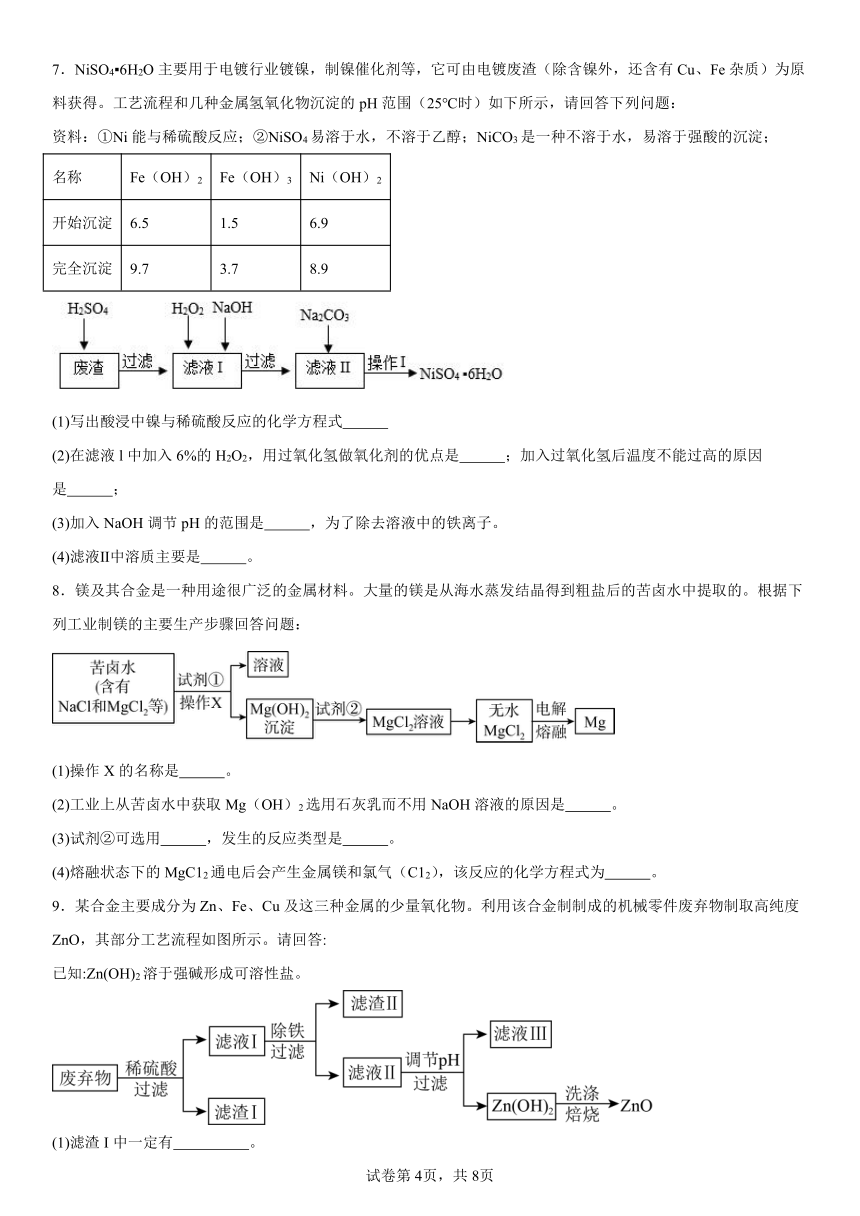
7.NiSO4 6H2O主要用于电镀行业镀镍,制镍催化剂等,它可由电镀废渣(除含镍外,还含有Cu、Fe杂质)为原料获得。工艺流程和几种金属氢氧化物沉淀的pH范围(25℃时)如下所示,请回答下列问题:
资料:①Ni能与稀硫酸反应;②NiSO4易溶于水,不溶于乙醇;NiCO3是一种不溶于水,易溶于强酸的沉淀;
名称 Fe(OH)2 Fe(OH)3 Ni(OH)2
开始沉淀 6.5 1.5 6.9
完全沉淀 9.7 3.7 8.9
(1)写出酸浸中镍与稀硫酸反应的化学方程式
(2)在滤液l中加入6%的H2O2,用过氧化氢做氧化剂的优点是 ;加入过氧化氢后温度不能过高的原因是 ;
(3)加入NaOH调节pH的范围是 ,为了除去溶液中的铁离子。
(4)滤液Ⅱ中溶质主要是 。
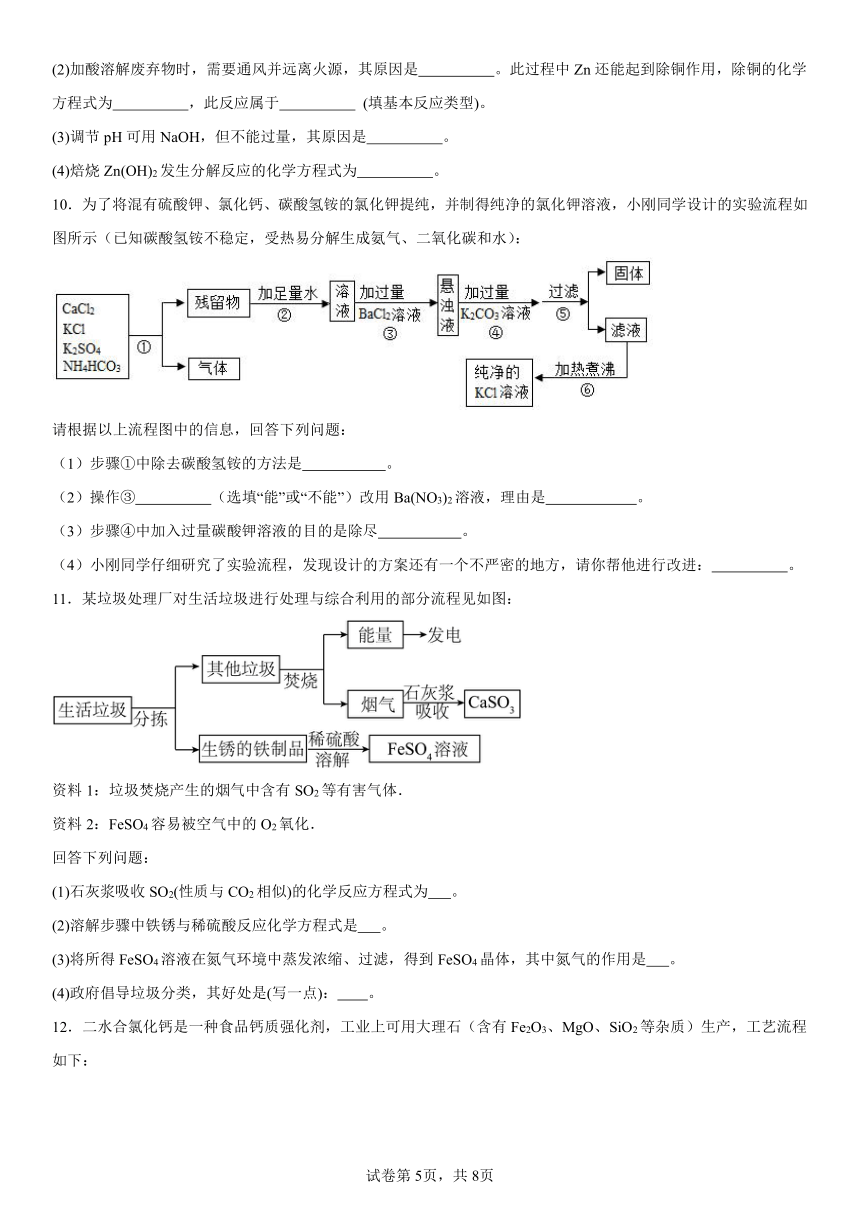
8.镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题:
(1)操作X的名称是 。
(2)工业上从苦卤水中获取Mg(OH)2选用石灰乳而不用NaOH溶液的原因是 。
(3)试剂②可选用 ,发生的反应类型是 。
(4)熔融状态下的MgC12通电后会产生金属镁和氯气(C12),该反应的化学方程式为 。
9.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 ,此反应属于 (填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
10.为了将混有硫酸钾、氯化钙、碳酸氢铵的氯化钾提纯,并制得纯净的氯化钾溶液,小刚同学设计的实验流程如图所示(已知碳酸氢铵不稳定,受热易分解生成氨气、二氧化碳和水):
请根据以上流程图中的信息,回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是 。
(2)操作③ (选填“能”或“不能”)改用Ba(NO3)2溶液,理由是 。
(3)步骤④中加入过量碳酸钾溶液的目的是除尽 。
(4)小刚同学仔细研究了实验流程,发现设计的方案还有一个不严密的地方,请你帮他进行改进: 。
11.某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体.
资料2:FeSO4容易被空气中的O2氧化.
回答下列问题:
(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为 。
(2)溶解步骤中铁锈与稀硫酸反应化学方程式是 。
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、过滤,得到FeSO4晶体,其中氮气的作用是 。
(4)政府倡导垃圾分类,其好处是(写一点): 。
12.二水合氯化钙是一种食品钙质强化剂,工业上可用大理石(含有Fe2O3、MgO、SiO2等杂质)生产,工艺流程如下:
查阅资料可知:二氧化硅不溶于水,也不与酸反应。
(1)滤渣a的化学式为 ,固体b俗称 。
(2)大理石反应完全的现象是: 。
(3)“②调节pH”时,溶液的pH变 (填“大”“小”或“不变”);其中发生中和反应的化学方程式是: ;滤渣b是: 。
(4)“③结晶”过程的操作为:蒸发浓缩、 、过滤、洗涤、干燥。实验室进行蒸发时,玻璃棒搅拌的作用是: 。
13.氢氧化钠(NaOH)的用途极广。用于生产纸、肥皂、染料、人造丝,冶炼金属、石油精制、棉织品整理、煤焦油产物的提纯,以及食品加工、木材加工及机械工业等方面。
Ⅰ.氢氧化钠的制备
某同学设计的工业制备氢氧化钠的流程如下图。
资料: ,两电极,一端得到NaOH和一种气体X,另一端得到Cl2。
(1)请写出气体X的化学式 。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和 。
(3)C12可用于生产84消毒液(有效成分NaClO),反应原理为 ,标出NaClO中氯元素的化合价为 。
(4)实验测定水的组成,不能加入NaCl增强水的导电性的理由是 。
Ⅱ.氢氧化钠的保存
已知NaOH容易与空气中的CO2作用而变质。小军同学在实验室发现一瓶敞口放置的体后,设计两套方案,对这瓶NaOH固体变质情况进行了如下实验探究,回答下列问题:
(1)根据上述实验现象可以确定该固体 变质(选填“已”或“未”)。
(2)步骤③中加过量氯化钙溶液的目的是 ,反应的化学方程式为 。
(3)若测得E的PH>7,则A的成分 。
Ⅲ.氢氧化钠的定量检验
某工厂刚生产一批氢氧化钠固体,瓶子说明书如图,取样品10g加足量的稀硝酸,恰好完全反应,取反应后所得溶液蒸发得到11.7g固体。通过计算判断纯度是否符合说明书?
14.碱式碳酸铜在催化剂、防腐剂领域有诸多用途,其分解温度为220℃,分解产物为三种常见的氧化物。碱式碳酸铜存在Cu(OH)2·CuCO3和Cu(OH)2·2CuCO3两种晶型。某工厂利用氯化铜蚀刻废液(含有CuCl2和HCl)制备碱式碳酸铜的流程如图1所示。
(1)操作1的名称是 。
(2)向溶液A中加入碳酸钠固体反应时溶液pH (填“升高”“降低”或“无明显变化”),碳酸钠固体与废液中所含酸的反应方程式为 。
(3)干燥固体C时较为适合的温度为 (填序号)。
a.20℃ b.55℃ c.105℃ d.230℃
(4)该流程获得的碱式碳酸铜中会含有一定量的Cl-而影响产品纯度,反应的pH和反应时间对产品中ω(C1-)、ω(Cu2+)的影响如图2、图3所示。根据图像分析可知要获得较高纯度的产品,适宜的pH为 ,反应时间为 。
友情提醒:
①ω(Cl-)代表曲线有标注。
②Cu(OH)2·2CuCO3晶型表示晶体中“Cu(OH)2分子”和“CuCO3分子”以1:2的个数比结合成的晶体。
(5)热重分析可用于产品的检测,请写出Cu(OH)2·2CuCO3晶型受热分解的化学方程式: 。
(6)已知,某碱式碳酸铜样品充分加热后的失重率为27.9%,则其晶型主要是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. 熔点 +6价 CO2 分解 3H2+WO33H2O+W 还原性
【详解】(1)金属钨可用作灯丝,是因为钨的熔点高;H2WO4中氢元素为+1价,氧元素为-2价,设钨的化合价为x,根据化合物中正负化合价的代数和为零可得,(+1)×2+x+(-2)×4=0,x=+6,钨的化合价为+6价。
(2)反应①的化学方程式为4FeWO4+4Na2CO3+O2=4Na2WO4+2Fe2O3+4X,反应前Fe为4,W为4,O为30,Na为8,C为4,反应后现有Fe为4,W为4,O为22,Na为8,C为0,少 O为8,C为4,包含在4个X分子中,所以每个X分子含有一个碳原子和两个氧原子,所以X的化学式为 CO2;
反应③是H2WO4H2O+WO3,为一变多,符合分解反应的特征,属于分解反应。
(3)反应④是氢气和氧化钨反应生成水和钨,对应的化学方程式为 3H2+WO33H2O+W,该反应中氢气得氧为还原剂,体现还原性。
故答案为
(1)熔点;+6价。
(2)CO2;分解。
(3)3H2+WO33H2O+W;还原性。
2. ②①③④ bc A 增多
【详解】(1)除去粗盐中难溶性杂质,先要溶解粗盐,然后过滤难溶性杂质,蒸发食盐水,计算产率,则主要操作步骤顺序②①③④。
(2) a、该操作中用到的玻璃仪器有酒精灯、玻璃、蒸发皿,铁架台不是玻璃仪器,故a不正确;
b、该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅,故b正确;
c、当蒸发皿中出现较多固体时,停止加热,利用余热加热,故c正确;
d、停止加热后,等蒸发皿冷却后,将蒸发皿直接放在试验台上,故d不正确。
故选bc。
(3)①A、先加入氯化钡溶液,和硫酸钠反应生成硫酸钡和氯化钠,后加入碳酸钠溶液,氯化钙和碳酸钠反应生成碳酸钙和氯化钠,氯化钡和碳酸钠反应生成碳酸钡和氯化钠,加入稀盐酸可以除去多余的碳酸钠,故A正确;
B、先加入碳酸钠溶液,氯化钙和碳酸钠反应生成碳酸钙和氯化钠,然后加入氯化钡溶液,和硫酸钠反应生成硫酸钡和氯化钠,稀盐酸不能除去多余的氯化钡,故B不正确;
C、加入稀硫酸不能除去杂质,使溶液显酸性,加入氯化钡溶液,除去了硫酸根离子,生成盐酸和氯化钠,加入碳酸钠溶液除去盐酸,但引入了碳酸钠杂质,故C不正确。
故选A。
②反思交流:通过以上规范操作,反应生成了新的氯化钠,则制得氯化钠的质量比原粗盐样品中含氯化钠的质量增多。
3.(1)Na2CO3
(2)除去溶液中多余的Na2CO3
(3) 过滤 蒸发
【详解】(1)因为提纯氯化钠除去氯化钙,根据除杂原则试剂A的化学式为Na2CO3,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(2)加入足量稀盐酸的目的为除去溶液中多余的Na2CO3,碳酸钠和盐酸反应生成氯化钠、水、二氧化碳;
(3)操作Ⅰ是将固液分离,是过滤;操作Ⅱ是从溶液中得到氯化钠晶体,为蒸发结晶。
4.(1)NaOH
(2)
(3)
(4)蒸发浓缩
(5)NaCl、NaOH
(6)
(7)作燃料
(8)立刻用大量水冲洗,再涂上硼酸溶液
【分析】粗盐加水溶解后,加入氢氧化钠除去氯化镁、加入碳酸钠除去氯化钙,过滤得到氯化钠溶液,通电分解生成氢氧化钠、氢气、氯气,含有氢氧化钠、氯化钠的溶液蒸发浓缩、趁热过滤分离得到NaCl晶体和NaOH溶液。
【详解】(1)以粗盐为原料生产NaOH,碱能和氯化镁反应生成氢氧化镁沉淀,X可把MgCl2转化为沉淀,则X为氢氧化钠,氢氧化钠和氯化镁生成氢氧化镁沉淀和氯化钠;
(2)处理池中加入了碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠:;
(3)由流程可知,电解池中电解饱和NaCl溶液生成氢气、氯气和氢氧化钠,反应为;
(4)操作中有趁热过滤,且脱盐池中溶液浓度变大,故需要首先蒸发浓缩,故操作为蒸发浓缩、趁热过滤分离得到NaCl晶体和NaOH溶液。
(5)该工业流程中氯化钠、氢氧化钠既是反应物又是生成物,则可循环利用的物质是NaCl、NaOH;
(6)样品中含有Na2CO3的原因是氢氧化钠和空气中二氧化碳反应生成碳酸钠和水:;
(7)氢气具有可燃性,可用于作燃料;
(8)NaOH有强烈的腐蚀性,如果不慎沾到皮肤,要立刻用大量水冲洗,再涂上硼酸溶液。
5. 增大反应物的接触面积,加快反应速率,使其充分反应 H2SO4+CaCO3=CaSO4+H2O+CO2↑ 过滤 (NH4)2SO4 常温下K2SO4的溶解度小 B 取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净。 8.7
【详解】(1)将CaCO3 研成粉末,可以增大反应物的接触面积,其目的是加快反应速率,使其充分反应;
(2)碳酸钙与硫酸反应生成硫酸钙、水和二氧化碳,反应方程式为:H2SO4+CaCO3=CaSO4+H2O+CO2↑;
(3)反应②充分反应后得到难溶性物质和溶液,将难溶性物质与可溶性物质分离的方法是过滤;
(4)硫酸钙与氨气、二氧化碳反应生成碳酸钙沉淀和硫酸铵,M溶液中溶质的主要成分是(NH4)2SO4;
(5)根据复分解反应发生的条件,反应Ⅲ中虽没有不溶物,但常温下K2SO4 的溶解度小,在生成物中会以沉淀的形式出现,所以反应可以进行;
(6)在洗涤K2SO4晶体时,为了可防止K2SO4 晶体溶解、不引入其他的物质,应用饱和K2SO4溶液,故选B;
(7)检验K2SO4晶体是否洗涤干净的方法是取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净;
(8)设理论可得到K2SO4质量为x,根据质量守恒定律列关系式:
x=8.7t。
【点睛】本题难度比较大,全面考查了学生对知识的掌握和应用能力,解答时一定要注意知识的联系和综合运用。
6.(1)增大接触面积,加快反应速率
(2)除去反应中过量的
(3)碳酸钠能除去反应过量的氢氧化钙
(4)、
(5)80
【详解】(1)石磨至粒径为0.125mm左右,再送入酸化炉的原因是增大接触面积,加快反应速率;
(2)碳酸钙粉末能与硫酸反应生成硫酸钙、水和二氧化碳,“调pH”步骤中,加入CaCO3的作用是除去反应中过量的H2SO4;
(3)镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的石灰乳之后,这样碳酸钠能除去反应过量的氢氧化钙;
(4)石灰乳可以将镁离子能生成氢氧化镁沉淀,钙离子与碳酸根离子转化为碳酸钙沉淀,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,因此滤渣②的成分是Mg(OH)2、CaCO3;
(5)根据表可知,Li2CO3、Li2SO4的溶解度随着温度的升高而减小,因此为了提高产品的纯度,需要将得到的晶体洗涤,需选用80℃的水,碳酸锂的溶解度更小。
7.(1)Ni+H2SO4=NiSO4+H2↑
(2) 不会引入新的杂质等 防止过氧化氢分解
(3)3.7~6.9
(4)NiSO4、Na2SO4、H2SO4
【详解】(1)镍与稀硫酸反应生成NiSO4和氢气,化学方程式为。
(2)从过氧化氢制氧气产物是水和氧气推测,过氧化氢做氧化剂除提供氧外生成水,所以优点是不会引入新的杂质等。过氧化氢温度越高分解越快,所以加入过氧化氢后温度不能过高的原因是防止过氧化氢分解。
(3)从过滤后保存滤液,最终得到NiSO4 6H2O可知,加入氢氧化钠使铁离子沉淀而Ni2+不沉淀,从表中可知pH要在3.7~6.9之间,使铁离子全部沉淀而Ni2+未开始沉淀。
(4)加入硫酸,铁、镍和硫酸反应,过滤后滤液Ⅰ中有NiSO4和FeSO4,根据加入氢氧化钠调节的pH范围可知还有硫酸剩余。加入过氧化氢将FeSO4氧化为硫酸铁,硫酸铁和氢氧化钠反应生成硫酸钠和氢氧化铁沉淀将铁除去。根据调节pH的范围,有硫酸剩余,过于后滤液Ⅱ中的溶质主要有NiSO4、Na2SO4、H2SO4。
8.(1)过滤
(2)Ca(OH)2廉价易得
(3) 稀盐酸 复分解反应
(4)
【详解】(1)操作X后得到固体和液体,可知操作X为过滤操作,故填:过滤;
(2)氢氧化钙属于建筑材料,所以石灰乳而不用NaOH溶液更廉价易得,故填:Ca(OH)2廉价易得;
(3)氢氧化镁转化为氯化镁,应加入稀盐酸,稀盐酸与氢氧化镁反应生成氯化镁和水,是两种化合物交换成分生成两种化合物的反应,属于复分解反应,故填:稀盐酸;复分解反应;
(4)氯化镁通电生成金属镁和氯气,故填:。
9. Cu 反应过程中会产生氢气,防止失火或爆炸 Zn+CuSO4=Cu+ ZnSO4 置换 Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失 Zn(OH)2ZnO+ H2O
【分析】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物,根据金属活动性顺序表,Zn>Fe>Cu,Zn、Fe加入稀硫酸后形成相应的盐溶液,而铜不与稀硫酸反应,因此滤渣I为铜单质,滤液I中主要成分为硫酸锌和硫酸亚铁,可以加入锌粉进行除铁,滤渣II可以是铁粉和锌的混合物,将滤液II调节pH值使锌以氢氧化锌的形式沉淀下来,洗涤焙烧之后得到氧化锌。
【详解】(1)由分析可知,滤渣I中一定有铜。故填:Cu
(2)金属与酸反应会产生氢气,加酸溶解废弃物时,需要通风并远离火源,其原因是反应过程中会产生氢气,防止失火或爆炸。此过程中铜的氧化物与硫酸反应后,生成硫酸铜,锌与硫酸铜反应生成硫酸锌和铜单质,因此Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4=Cu+ ZnSO4,此反应属于置换反应。故填:反应过程中会产生氢气,防止失火或爆炸;Zn+CuSO4=Cu+ZnSO4;置换
(3)调节pH可用NaOH,但不能过量,是因为Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失,因此不能过量。故填:Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失
(4)氢氧化锌焙烧后发生分解反应,其化学方程式为:Zn(OH)2ZnO+ H2O;故填:Zn(OH)2ZnO+ H2O
10. 加热 不能 改用Ba(NO3)2 溶液会使溶液中引入新的杂质离子 氯化钙和过量的氯化钡 向步骤⑤所得滤液中加入过量的稀盐酸之后再加热煮沸
【详解】(1)碳酸氢铵加热易分解为水、二氧化碳、氨气等气体,因此步骤①可以用加热的方法除去碳酸氢铵;
(2)操作③不能改用Ba(NO3)2溶液,原因是改用有Ba(NO3)2 溶液会使溶液中引入新的杂质离子 NO3- ,不符合除杂的原则;
(3)加入过量的碳酸钾,会与氯化钙、氯化钡反应生成沉淀和氯化钾,可以除去氯化钙和过量的氯化钡;
(4)由于加入的碳酸钾是过量的,所以向步骤⑤所得滤液中加入过量的稀盐酸之后再加热煮沸,这可以除去碳酸钾,并将其转化为氯化钾。
11. Ca(OH)2+SO2=CaSO3↓+H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 隔绝空气,防止FeSO4被氧化 为快速处理不同垃圾提供便利(合理均可)
【详解】(1)石灰浆的主要成分是氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,而石灰浆和二氧化硫反应与和二氧化碳反应类似,可以推测出氢氧化钙和二氧化硫反应生成亚硫酸钙沉淀和水。故答案为Ca(OH)2+SO2=CaSO3↓+H2O;
(2)铁锈的主要成分是三氧化二铁,三氧化二铁和硫酸反应生成硫酸铁和水。故答案为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)将FeSO4溶液得到FeSO4结晶,操作流程为蒸发浓缩,降温结晶,过滤。得到的FeSO4晶体中铁元素的化合价为+2价,很容易被空气中的氧气氧化为+3价,而氮气的化学性质稳定,而且可以隔绝空气中的氧气。所以在氮气环境中进行操作,氮气可以隔绝空气,防止FeSO4被氧化。故答案为隔绝空气,防止FeSO4被氧化;
(4)政府倡导垃圾分类,其好处是为快速处理不同垃圾提供便利,减少占地,减少环境污染。故答案为为快速处理不同垃圾提供便利(合理均可)。
12.(1) 干冰
(2)不再有气泡产生
(3) 大 氢氧化铁、氢氧化镁/ 、
(4) 降温结晶 防止局部温度过高,使得液体飞溅
【分析】由流程可知,大理石加入足量稀盐酸,生成二氧化碳气体、氯化钙和水,稀盐酸和杂质氧化铁反应生成氯化铁和水,和氧化镁反应生成氯化镁和水,二氧化硅不和稀盐酸反应,故气体a为二氧化碳,滤液a中含有盐酸、氯化铁和氯化镁,滤渣a为二氧化硅;之后二氧化碳加压降温形成固体二氧化碳,则固体b为干冰;滤液a中加入氢氧化钙调节pH,氯化铁和氢氧化钙反应生呈氢氧化铁沉淀和氯化钙,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,则滤渣b中含有氢氧化铁和氢氧化镁,滤液b中含有氯化钙。
【详解】(1)由分析可知,滤渣a的成分为二氧化硅,故填SiO2;
固体b为固态二氧化碳,俗称干冰,故填干冰;
(2)大理石和稀盐酸反应有气泡产生,当大理石和稀盐酸完全反应时,不再有气泡产生。故填不再有气泡产生;
(3)调节pH时,加入氢氧化钙后,滤液a中的盐酸不断被消耗殆尽,溶液酸性减弱,故pH增大,故填大;
其中盐酸和氢氧化钙生成氯化钙和水的反应为中和反应,方程式为
;
由分析可知,滤渣b中含有氢氧化镁和氢氧化铁,故填氢氧化镁和氢氧化铁;
(4)氯化钙结晶过程中,先蒸发浓缩,再降温结晶,之后过滤、洗涤、干燥,故填降温结晶;
蒸发时,需要用玻璃棒搅拌,防止局部温度过高,液体飞溅。故填防止局部温度过高,使得液体飞溅。
13. H2 蒸发皿 +1 氯化钠电解会生成氯气,干扰实验结果 已 除尽溶液中的碳酸钠 Na2CO3、NaOH; 设氢氧化钠固体纯度为x
解得x=80%,故纯度符合说明书
【详解】Ⅰ.氢氧化钠的制备:(1)化学反应前后元素种类、原子种类、总通电个数和质量都不变,由,可知,反应前后氯原子都是2个,钠原子都是2个,反应前氧后原子是2个,反应前氢原子是4个,反应后应该是4个,其中2个在NaOH中,2个包含在X中,X的化学式为H2;
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和蒸发皿,蒸发溶液时应在蒸发皿中进行;
(3)化合物中元素化合价代数和为零,NaClO中钠元素化合价是+1,氧元素化合价是-2,所以次氯酸钠中氯元素化合价是+1;
(4)根据资料:,两电极,一端得到NaOH和一种气体H2,另一端得到Cl2,氯化钠电解会生成氯气,干扰实验结果;
Ⅱ.氢氧化钠的保存:(1)②中滴加稀盐酸产生气体,是碳酸钠和 盐酸反应产生的二氧化碳,因此可以判断有碳酸钠的存在,所以氢氧化钠固体已经发生变质;
(2)为探究固体中是否还含有NaOH,由于碳酸钠溶液也显碱性,故要先排除碳酸钠的干扰;因此过量的CaCl2溶液可将碳酸钠全部反应掉,滴加足量的CaCl2溶液目的是除尽溶液中的碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:;
(3)因为碳酸钠和氯化钙反应产生碳酸钙沉淀和氯化钠,若测定溶液的pH>7,说明溶液中有氢氧化钠,氢氧化钠没有完全变质成碳酸钠,则A的成分Na2CO3、NaOH;
Ⅲ.氢氧化钠的定量检验:符合,过程见答案
故答案为:①H2;②蒸发皿;③+1;④氯化钠电解会生成氯气,干扰实验结果;⑤已;⑥除尽溶液中的碳酸钠;⑦;⑧Na2CO3、NaOH;⑨符合。
14.(1)过滤
(2) 升高
(3)C
(4) 7 1h
(5)
(6)Cu(OH)2·CuCO3
【详解】(1)操作1实现了固液分离,名称是过滤;
(2)溶液A中含CuCl2和HCl,向溶液A中加入碳酸钠固体,碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,盐酸被消耗,故溶液pH升高;
碳酸钠固体与废液中所含酸的反应为碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:;
(3)碱式碳酸铜分解温度为220℃,故干燥温度应低于220℃,且水的沸点为100℃,故应选择105℃。
故选c;
(4)由图可知,pH为7时,氯离子含量较低,反应时间为1h时,氯离子含量较低,故要获得较高纯度的产品,适宜的pH为7,反应时间为1h;
(5)分解产物为三种氧化物,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Cu、H、C、O,故生成物为氧化铜、水、二氧化碳,该反应的化学方程式为:;
(6)加热后减少的质量为反应生成水和二氧化碳的质量之和,由化学方程式可知,Cu(OH)2·2CuCO3晶型的失重率为:,Cu(OH)2·CuCO3受热分解的化学方程式为:,则Cu(OH)2·CuCO3的失重率为:,则其晶型主要是Cu(OH)2·CuCO3。
答案第1页,共2页
答案第1页,共2页
1.金属钨(W)可作白炽灯泡的灯丝。工业上用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示
(1)金属钨可用作灯丝,是因为钨的 高;H2WO4中钨的化合价为 。
(2)反应①的化学方程式,X的化学式为 ;反应③属于 反应(填基本反应类型)。
(3)反应④的化学方程式为 该反应中氢气表现出的性质是 。
2.在粗盐的提纯实验中
(1)除去粗盐中难溶性杂质,其主要操作步骤顺序 。
①过滤 ②溶解 ③蒸发 ④计算产率
(2)下列关于蒸发的操作中说法正确的是 (填序号)。
a 该操作中用到的玻璃仪器有酒精灯、玻璃、蒸发皿、铁架台
b 该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅
c 当蒸发皿中出现较多固体时,停止加热
d 停止加热后,立即将蒸发皿直接放在试验台上
(3)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质Na2SO4、CaCl2得到纯净的NaCl,可采用如下图所示流程:
①上图中所用甲、乙、丙三种试剂依次是 (填序号)。
A BaCl2溶液、Na2CO3溶液、稀盐酸
B Na2CO3溶液、BaCl2溶液、稀盐酸
C 稀硫酸、BaCl2溶液、Na2CO3溶液
②反思交流:通过以上规范操作,制得氯化钠的质量比原粗盐样品中含氯化钠的质量 (填“增多”、“减少”、“不变”)。
3.某NaCl溶液中含有较多CaCl2,按下图方案提纯得到NaCl晶体(提示:CaCO3难溶)。
(1)试剂A的化学
(2)加入足量稀盐酸的目的为
(3)操作Ⅰ、Ⅱ的名称分别为 、
4.某氯碱工厂以粗盐(主要成分是NaCl,含少量泥沙、CaCl2、MgCl2)为原料生产NaOH,主要的工艺流程如图所示:
(1)加入试剂X可把MgCl2转化为沉淀,X的化学式是 。
(2)处理池中除去CaCl2的化学方程式是 。
(3)电解池中电解饱和NaCl溶液化学方程式是 。
(4)脱盐池是利用NaCl和NaOH在溶解度上的差异,通过 、趁热过滤分离得到NaCl晶体和NaOH溶液。
(5)该工业流程中可循环利用的物质是 。(写化学式)
(6)该工艺生产的NaOH样品中常含有少量NaCl、Na2CO3等杂质。你认为样品中含有Na2CO3的原因是 (用化学方程式表示)。
(7)写出该工业副产品H2的一种用途 。
(8)NaOH有强烈的腐蚀性,如果不慎沾到皮肤,要 。
5.化工生产中的废弃物再利用,可以有效节约资源、保护环境,下图是某化工厂利用废硫酸制备K2SO4的工艺流程图:
(1)生产上将CaCO3研成粉末的目的是 ;
(2)写出反应的化学方程式 ;
(3)反应②充分反应后物质分离的方法是 ;
(4)上述流程中,M溶液中溶质的主要成分是 (填写化学式);
(5)分析下表所示数据,则反应③在常温下可实现的原因是 ;
物质 KCl K2SO4 NH4Cl (NH4)2SO4
溶解度/g(20℃) 34.2 11.1 37.2 75.4
(6)洗涤反应③所得晶体最适宜的试剂是 (填序号);
AH2O B饱和K2SO4溶液 C 不饱和K2SO4溶液 D三者均可
(7)检验K2SO4晶体是否洗涤干净的方法是 。
(8)取50t质量分数为9.8%废硫酸用于该工艺制备K2SO4,理论可得到K2SO4质量为 t。
6.锂被誉为“新能源金属”、“金属味精”和“推动世界前进的金属”,具有极高的战略价值。碳酸锂是生产金属锂制品的基础材料。以锂辉石为原料,用硫酸焙烧法制取碳酸锂的工艺流程(部分试剂和步骤等已略去)如下。
【资料】
①锂辉石的主要成分是,含少量、元素。
②
(1)工业上将锂辉石磨至粒径为左右,再送入酸化炉的原因是 。
(2)“调”步骤中,加入的作用是 。
(3)在“除镁除钙”步骤中,先加入石灰乳,再加入溶液。添加试剂的顺序不能调换,其原因是 。
(4)操作I后得到的滤渣②的成分是 。
(5)和的溶解度如表所示:
20 40 60 80
1.33 1.17 0.01 0.85
34.2 32.8 31.9 30.7
为了提高产品的纯度,需要将得到的晶体洗涤,需选用 的水。
7.NiSO4 6H2O主要用于电镀行业镀镍,制镍催化剂等,它可由电镀废渣(除含镍外,还含有Cu、Fe杂质)为原料获得。工艺流程和几种金属氢氧化物沉淀的pH范围(25℃时)如下所示,请回答下列问题:
资料:①Ni能与稀硫酸反应;②NiSO4易溶于水,不溶于乙醇;NiCO3是一种不溶于水,易溶于强酸的沉淀;
名称 Fe(OH)2 Fe(OH)3 Ni(OH)2
开始沉淀 6.5 1.5 6.9
完全沉淀 9.7 3.7 8.9
(1)写出酸浸中镍与稀硫酸反应的化学方程式
(2)在滤液l中加入6%的H2O2,用过氧化氢做氧化剂的优点是 ;加入过氧化氢后温度不能过高的原因是 ;
(3)加入NaOH调节pH的范围是 ,为了除去溶液中的铁离子。
(4)滤液Ⅱ中溶质主要是 。
8.镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题:
(1)操作X的名称是 。
(2)工业上从苦卤水中获取Mg(OH)2选用石灰乳而不用NaOH溶液的原因是 。
(3)试剂②可选用 ,发生的反应类型是 。
(4)熔融状态下的MgC12通电后会产生金属镁和氯气(C12),该反应的化学方程式为 。
9.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有 。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是 。此过程中Zn还能起到除铜作用,除铜的化学方程式为 ,此反应属于 (填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是 。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 。
10.为了将混有硫酸钾、氯化钙、碳酸氢铵的氯化钾提纯,并制得纯净的氯化钾溶液,小刚同学设计的实验流程如图所示(已知碳酸氢铵不稳定,受热易分解生成氨气、二氧化碳和水):
请根据以上流程图中的信息,回答下列问题:
(1)步骤①中除去碳酸氢铵的方法是 。
(2)操作③ (选填“能”或“不能”)改用Ba(NO3)2溶液,理由是 。
(3)步骤④中加入过量碳酸钾溶液的目的是除尽 。
(4)小刚同学仔细研究了实验流程,发现设计的方案还有一个不严密的地方,请你帮他进行改进: 。
11.某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体.
资料2:FeSO4容易被空气中的O2氧化.
回答下列问题:
(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为 。
(2)溶解步骤中铁锈与稀硫酸反应化学方程式是 。
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、过滤,得到FeSO4晶体,其中氮气的作用是 。
(4)政府倡导垃圾分类,其好处是(写一点): 。
12.二水合氯化钙是一种食品钙质强化剂,工业上可用大理石(含有Fe2O3、MgO、SiO2等杂质)生产,工艺流程如下:
查阅资料可知:二氧化硅不溶于水,也不与酸反应。
(1)滤渣a的化学式为 ,固体b俗称 。
(2)大理石反应完全的现象是: 。
(3)“②调节pH”时,溶液的pH变 (填“大”“小”或“不变”);其中发生中和反应的化学方程式是: ;滤渣b是: 。
(4)“③结晶”过程的操作为:蒸发浓缩、 、过滤、洗涤、干燥。实验室进行蒸发时,玻璃棒搅拌的作用是: 。
13.氢氧化钠(NaOH)的用途极广。用于生产纸、肥皂、染料、人造丝,冶炼金属、石油精制、棉织品整理、煤焦油产物的提纯,以及食品加工、木材加工及机械工业等方面。
Ⅰ.氢氧化钠的制备
某同学设计的工业制备氢氧化钠的流程如下图。
资料: ,两电极,一端得到NaOH和一种气体X,另一端得到Cl2。
(1)请写出气体X的化学式 。
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和 。
(3)C12可用于生产84消毒液(有效成分NaClO),反应原理为 ,标出NaClO中氯元素的化合价为 。
(4)实验测定水的组成,不能加入NaCl增强水的导电性的理由是 。
Ⅱ.氢氧化钠的保存
已知NaOH容易与空气中的CO2作用而变质。小军同学在实验室发现一瓶敞口放置的体后,设计两套方案,对这瓶NaOH固体变质情况进行了如下实验探究,回答下列问题:
(1)根据上述实验现象可以确定该固体 变质(选填“已”或“未”)。
(2)步骤③中加过量氯化钙溶液的目的是 ,反应的化学方程式为 。
(3)若测得E的PH>7,则A的成分 。
Ⅲ.氢氧化钠的定量检验
某工厂刚生产一批氢氧化钠固体,瓶子说明书如图,取样品10g加足量的稀硝酸,恰好完全反应,取反应后所得溶液蒸发得到11.7g固体。通过计算判断纯度是否符合说明书?
14.碱式碳酸铜在催化剂、防腐剂领域有诸多用途,其分解温度为220℃,分解产物为三种常见的氧化物。碱式碳酸铜存在Cu(OH)2·CuCO3和Cu(OH)2·2CuCO3两种晶型。某工厂利用氯化铜蚀刻废液(含有CuCl2和HCl)制备碱式碳酸铜的流程如图1所示。
(1)操作1的名称是 。
(2)向溶液A中加入碳酸钠固体反应时溶液pH (填“升高”“降低”或“无明显变化”),碳酸钠固体与废液中所含酸的反应方程式为 。
(3)干燥固体C时较为适合的温度为 (填序号)。
a.20℃ b.55℃ c.105℃ d.230℃
(4)该流程获得的碱式碳酸铜中会含有一定量的Cl-而影响产品纯度,反应的pH和反应时间对产品中ω(C1-)、ω(Cu2+)的影响如图2、图3所示。根据图像分析可知要获得较高纯度的产品,适宜的pH为 ,反应时间为 。
友情提醒:
①ω(Cl-)代表曲线有标注。
②Cu(OH)2·2CuCO3晶型表示晶体中“Cu(OH)2分子”和“CuCO3分子”以1:2的个数比结合成的晶体。
(5)热重分析可用于产品的检测,请写出Cu(OH)2·2CuCO3晶型受热分解的化学方程式: 。
(6)已知,某碱式碳酸铜样品充分加热后的失重率为27.9%,则其晶型主要是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1. 熔点 +6价 CO2 分解 3H2+WO33H2O+W 还原性
【详解】(1)金属钨可用作灯丝,是因为钨的熔点高;H2WO4中氢元素为+1价,氧元素为-2价,设钨的化合价为x,根据化合物中正负化合价的代数和为零可得,(+1)×2+x+(-2)×4=0,x=+6,钨的化合价为+6价。
(2)反应①的化学方程式为4FeWO4+4Na2CO3+O2=4Na2WO4+2Fe2O3+4X,反应前Fe为4,W为4,O为30,Na为8,C为4,反应后现有Fe为4,W为4,O为22,Na为8,C为0,少 O为8,C为4,包含在4个X分子中,所以每个X分子含有一个碳原子和两个氧原子,所以X的化学式为 CO2;
反应③是H2WO4H2O+WO3,为一变多,符合分解反应的特征,属于分解反应。
(3)反应④是氢气和氧化钨反应生成水和钨,对应的化学方程式为 3H2+WO33H2O+W,该反应中氢气得氧为还原剂,体现还原性。
故答案为
(1)熔点;+6价。
(2)CO2;分解。
(3)3H2+WO33H2O+W;还原性。
2. ②①③④ bc A 增多
【详解】(1)除去粗盐中难溶性杂质,先要溶解粗盐,然后过滤难溶性杂质,蒸发食盐水,计算产率,则主要操作步骤顺序②①③④。
(2) a、该操作中用到的玻璃仪器有酒精灯、玻璃、蒸发皿,铁架台不是玻璃仪器,故a不正确;
b、该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅,故b正确;
c、当蒸发皿中出现较多固体时,停止加热,利用余热加热,故c正确;
d、停止加热后,等蒸发皿冷却后,将蒸发皿直接放在试验台上,故d不正确。
故选bc。
(3)①A、先加入氯化钡溶液,和硫酸钠反应生成硫酸钡和氯化钠,后加入碳酸钠溶液,氯化钙和碳酸钠反应生成碳酸钙和氯化钠,氯化钡和碳酸钠反应生成碳酸钡和氯化钠,加入稀盐酸可以除去多余的碳酸钠,故A正确;
B、先加入碳酸钠溶液,氯化钙和碳酸钠反应生成碳酸钙和氯化钠,然后加入氯化钡溶液,和硫酸钠反应生成硫酸钡和氯化钠,稀盐酸不能除去多余的氯化钡,故B不正确;
C、加入稀硫酸不能除去杂质,使溶液显酸性,加入氯化钡溶液,除去了硫酸根离子,生成盐酸和氯化钠,加入碳酸钠溶液除去盐酸,但引入了碳酸钠杂质,故C不正确。
故选A。
②反思交流:通过以上规范操作,反应生成了新的氯化钠,则制得氯化钠的质量比原粗盐样品中含氯化钠的质量增多。
3.(1)Na2CO3
(2)除去溶液中多余的Na2CO3
(3) 过滤 蒸发
【详解】(1)因为提纯氯化钠除去氯化钙,根据除杂原则试剂A的化学式为Na2CO3,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
(2)加入足量稀盐酸的目的为除去溶液中多余的Na2CO3,碳酸钠和盐酸反应生成氯化钠、水、二氧化碳;
(3)操作Ⅰ是将固液分离,是过滤;操作Ⅱ是从溶液中得到氯化钠晶体,为蒸发结晶。
4.(1)NaOH
(2)
(3)
(4)蒸发浓缩
(5)NaCl、NaOH
(6)
(7)作燃料
(8)立刻用大量水冲洗,再涂上硼酸溶液
【分析】粗盐加水溶解后,加入氢氧化钠除去氯化镁、加入碳酸钠除去氯化钙,过滤得到氯化钠溶液,通电分解生成氢氧化钠、氢气、氯气,含有氢氧化钠、氯化钠的溶液蒸发浓缩、趁热过滤分离得到NaCl晶体和NaOH溶液。
【详解】(1)以粗盐为原料生产NaOH,碱能和氯化镁反应生成氢氧化镁沉淀,X可把MgCl2转化为沉淀,则X为氢氧化钠,氢氧化钠和氯化镁生成氢氧化镁沉淀和氯化钠;
(2)处理池中加入了碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠:;
(3)由流程可知,电解池中电解饱和NaCl溶液生成氢气、氯气和氢氧化钠,反应为;
(4)操作中有趁热过滤,且脱盐池中溶液浓度变大,故需要首先蒸发浓缩,故操作为蒸发浓缩、趁热过滤分离得到NaCl晶体和NaOH溶液。
(5)该工业流程中氯化钠、氢氧化钠既是反应物又是生成物,则可循环利用的物质是NaCl、NaOH;
(6)样品中含有Na2CO3的原因是氢氧化钠和空气中二氧化碳反应生成碳酸钠和水:;
(7)氢气具有可燃性,可用于作燃料;
(8)NaOH有强烈的腐蚀性,如果不慎沾到皮肤,要立刻用大量水冲洗,再涂上硼酸溶液。
5. 增大反应物的接触面积,加快反应速率,使其充分反应 H2SO4+CaCO3=CaSO4+H2O+CO2↑ 过滤 (NH4)2SO4 常温下K2SO4的溶解度小 B 取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净。 8.7
【详解】(1)将CaCO3 研成粉末,可以增大反应物的接触面积,其目的是加快反应速率,使其充分反应;
(2)碳酸钙与硫酸反应生成硫酸钙、水和二氧化碳,反应方程式为:H2SO4+CaCO3=CaSO4+H2O+CO2↑;
(3)反应②充分反应后得到难溶性物质和溶液,将难溶性物质与可溶性物质分离的方法是过滤;
(4)硫酸钙与氨气、二氧化碳反应生成碳酸钙沉淀和硫酸铵,M溶液中溶质的主要成分是(NH4)2SO4;
(5)根据复分解反应发生的条件,反应Ⅲ中虽没有不溶物,但常温下K2SO4 的溶解度小,在生成物中会以沉淀的形式出现,所以反应可以进行;
(6)在洗涤K2SO4晶体时,为了可防止K2SO4 晶体溶解、不引入其他的物质,应用饱和K2SO4溶液,故选B;
(7)检验K2SO4晶体是否洗涤干净的方法是取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净;
(8)设理论可得到K2SO4质量为x,根据质量守恒定律列关系式:
x=8.7t。
【点睛】本题难度比较大,全面考查了学生对知识的掌握和应用能力,解答时一定要注意知识的联系和综合运用。
6.(1)增大接触面积,加快反应速率
(2)除去反应中过量的
(3)碳酸钠能除去反应过量的氢氧化钙
(4)、
(5)80
【详解】(1)石磨至粒径为0.125mm左右,再送入酸化炉的原因是增大接触面积,加快反应速率;
(2)碳酸钙粉末能与硫酸反应生成硫酸钙、水和二氧化碳,“调pH”步骤中,加入CaCO3的作用是除去反应中过量的H2SO4;
(3)镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的石灰乳之后,这样碳酸钠能除去反应过量的氢氧化钙;
(4)石灰乳可以将镁离子能生成氢氧化镁沉淀,钙离子与碳酸根离子转化为碳酸钙沉淀,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,因此滤渣②的成分是Mg(OH)2、CaCO3;
(5)根据表可知,Li2CO3、Li2SO4的溶解度随着温度的升高而减小,因此为了提高产品的纯度,需要将得到的晶体洗涤,需选用80℃的水,碳酸锂的溶解度更小。
7.(1)Ni+H2SO4=NiSO4+H2↑
(2) 不会引入新的杂质等 防止过氧化氢分解
(3)3.7~6.9
(4)NiSO4、Na2SO4、H2SO4
【详解】(1)镍与稀硫酸反应生成NiSO4和氢气,化学方程式为。
(2)从过氧化氢制氧气产物是水和氧气推测,过氧化氢做氧化剂除提供氧外生成水,所以优点是不会引入新的杂质等。过氧化氢温度越高分解越快,所以加入过氧化氢后温度不能过高的原因是防止过氧化氢分解。
(3)从过滤后保存滤液,最终得到NiSO4 6H2O可知,加入氢氧化钠使铁离子沉淀而Ni2+不沉淀,从表中可知pH要在3.7~6.9之间,使铁离子全部沉淀而Ni2+未开始沉淀。
(4)加入硫酸,铁、镍和硫酸反应,过滤后滤液Ⅰ中有NiSO4和FeSO4,根据加入氢氧化钠调节的pH范围可知还有硫酸剩余。加入过氧化氢将FeSO4氧化为硫酸铁,硫酸铁和氢氧化钠反应生成硫酸钠和氢氧化铁沉淀将铁除去。根据调节pH的范围,有硫酸剩余,过于后滤液Ⅱ中的溶质主要有NiSO4、Na2SO4、H2SO4。
8.(1)过滤
(2)Ca(OH)2廉价易得
(3) 稀盐酸 复分解反应
(4)
【详解】(1)操作X后得到固体和液体,可知操作X为过滤操作,故填:过滤;
(2)氢氧化钙属于建筑材料,所以石灰乳而不用NaOH溶液更廉价易得,故填:Ca(OH)2廉价易得;
(3)氢氧化镁转化为氯化镁,应加入稀盐酸,稀盐酸与氢氧化镁反应生成氯化镁和水,是两种化合物交换成分生成两种化合物的反应,属于复分解反应,故填:稀盐酸;复分解反应;
(4)氯化镁通电生成金属镁和氯气,故填:。
9. Cu 反应过程中会产生氢气,防止失火或爆炸 Zn+CuSO4=Cu+ ZnSO4 置换 Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失 Zn(OH)2ZnO+ H2O
【分析】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物,根据金属活动性顺序表,Zn>Fe>Cu,Zn、Fe加入稀硫酸后形成相应的盐溶液,而铜不与稀硫酸反应,因此滤渣I为铜单质,滤液I中主要成分为硫酸锌和硫酸亚铁,可以加入锌粉进行除铁,滤渣II可以是铁粉和锌的混合物,将滤液II调节pH值使锌以氢氧化锌的形式沉淀下来,洗涤焙烧之后得到氧化锌。
【详解】(1)由分析可知,滤渣I中一定有铜。故填:Cu
(2)金属与酸反应会产生氢气,加酸溶解废弃物时,需要通风并远离火源,其原因是反应过程中会产生氢气,防止失火或爆炸。此过程中铜的氧化物与硫酸反应后,生成硫酸铜,锌与硫酸铜反应生成硫酸锌和铜单质,因此Zn还能起到除铜作用,除铜的化学方程式为:Zn+CuSO4=Cu+ ZnSO4,此反应属于置换反应。故填:反应过程中会产生氢气,防止失火或爆炸;Zn+CuSO4=Cu+ZnSO4;置换
(3)调节pH可用NaOH,但不能过量,是因为Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失,因此不能过量。故填:Zn(OH)2溶于强碱形成可溶性盐,为了防止溶解造成损失
(4)氢氧化锌焙烧后发生分解反应,其化学方程式为:Zn(OH)2ZnO+ H2O;故填:Zn(OH)2ZnO+ H2O
10. 加热 不能 改用Ba(NO3)2 溶液会使溶液中引入新的杂质离子 氯化钙和过量的氯化钡 向步骤⑤所得滤液中加入过量的稀盐酸之后再加热煮沸
【详解】(1)碳酸氢铵加热易分解为水、二氧化碳、氨气等气体,因此步骤①可以用加热的方法除去碳酸氢铵;
(2)操作③不能改用Ba(NO3)2溶液,原因是改用有Ba(NO3)2 溶液会使溶液中引入新的杂质离子 NO3- ,不符合除杂的原则;
(3)加入过量的碳酸钾,会与氯化钙、氯化钡反应生成沉淀和氯化钾,可以除去氯化钙和过量的氯化钡;
(4)由于加入的碳酸钾是过量的,所以向步骤⑤所得滤液中加入过量的稀盐酸之后再加热煮沸,这可以除去碳酸钾,并将其转化为氯化钾。
11. Ca(OH)2+SO2=CaSO3↓+H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 隔绝空气,防止FeSO4被氧化 为快速处理不同垃圾提供便利(合理均可)
【详解】(1)石灰浆的主要成分是氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,而石灰浆和二氧化硫反应与和二氧化碳反应类似,可以推测出氢氧化钙和二氧化硫反应生成亚硫酸钙沉淀和水。故答案为Ca(OH)2+SO2=CaSO3↓+H2O;
(2)铁锈的主要成分是三氧化二铁,三氧化二铁和硫酸反应生成硫酸铁和水。故答案为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(3)将FeSO4溶液得到FeSO4结晶,操作流程为蒸发浓缩,降温结晶,过滤。得到的FeSO4晶体中铁元素的化合价为+2价,很容易被空气中的氧气氧化为+3价,而氮气的化学性质稳定,而且可以隔绝空气中的氧气。所以在氮气环境中进行操作,氮气可以隔绝空气,防止FeSO4被氧化。故答案为隔绝空气,防止FeSO4被氧化;
(4)政府倡导垃圾分类,其好处是为快速处理不同垃圾提供便利,减少占地,减少环境污染。故答案为为快速处理不同垃圾提供便利(合理均可)。
12.(1) 干冰
(2)不再有气泡产生
(3) 大 氢氧化铁、氢氧化镁/ 、
(4) 降温结晶 防止局部温度过高,使得液体飞溅
【分析】由流程可知,大理石加入足量稀盐酸,生成二氧化碳气体、氯化钙和水,稀盐酸和杂质氧化铁反应生成氯化铁和水,和氧化镁反应生成氯化镁和水,二氧化硅不和稀盐酸反应,故气体a为二氧化碳,滤液a中含有盐酸、氯化铁和氯化镁,滤渣a为二氧化硅;之后二氧化碳加压降温形成固体二氧化碳,则固体b为干冰;滤液a中加入氢氧化钙调节pH,氯化铁和氢氧化钙反应生呈氢氧化铁沉淀和氯化钙,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,则滤渣b中含有氢氧化铁和氢氧化镁,滤液b中含有氯化钙。
【详解】(1)由分析可知,滤渣a的成分为二氧化硅,故填SiO2;
固体b为固态二氧化碳,俗称干冰,故填干冰;
(2)大理石和稀盐酸反应有气泡产生,当大理石和稀盐酸完全反应时,不再有气泡产生。故填不再有气泡产生;
(3)调节pH时,加入氢氧化钙后,滤液a中的盐酸不断被消耗殆尽,溶液酸性减弱,故pH增大,故填大;
其中盐酸和氢氧化钙生成氯化钙和水的反应为中和反应,方程式为
;
由分析可知,滤渣b中含有氢氧化镁和氢氧化铁,故填氢氧化镁和氢氧化铁;
(4)氯化钙结晶过程中,先蒸发浓缩,再降温结晶,之后过滤、洗涤、干燥,故填降温结晶;
蒸发时,需要用玻璃棒搅拌,防止局部温度过高,液体飞溅。故填防止局部温度过高,使得液体飞溅。
13. H2 蒸发皿 +1 氯化钠电解会生成氯气,干扰实验结果 已 除尽溶液中的碳酸钠 Na2CO3、NaOH; 设氢氧化钠固体纯度为x
解得x=80%,故纯度符合说明书
【详解】Ⅰ.氢氧化钠的制备:(1)化学反应前后元素种类、原子种类、总通电个数和质量都不变,由,可知,反应前后氯原子都是2个,钠原子都是2个,反应前氧后原子是2个,反应前氢原子是4个,反应后应该是4个,其中2个在NaOH中,2个包含在X中,X的化学式为H2;
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和蒸发皿,蒸发溶液时应在蒸发皿中进行;
(3)化合物中元素化合价代数和为零,NaClO中钠元素化合价是+1,氧元素化合价是-2,所以次氯酸钠中氯元素化合价是+1;
(4)根据资料:,两电极,一端得到NaOH和一种气体H2,另一端得到Cl2,氯化钠电解会生成氯气,干扰实验结果;
Ⅱ.氢氧化钠的保存:(1)②中滴加稀盐酸产生气体,是碳酸钠和 盐酸反应产生的二氧化碳,因此可以判断有碳酸钠的存在,所以氢氧化钠固体已经发生变质;
(2)为探究固体中是否还含有NaOH,由于碳酸钠溶液也显碱性,故要先排除碳酸钠的干扰;因此过量的CaCl2溶液可将碳酸钠全部反应掉,滴加足量的CaCl2溶液目的是除尽溶液中的碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:;
(3)因为碳酸钠和氯化钙反应产生碳酸钙沉淀和氯化钠,若测定溶液的pH>7,说明溶液中有氢氧化钠,氢氧化钠没有完全变质成碳酸钠,则A的成分Na2CO3、NaOH;
Ⅲ.氢氧化钠的定量检验:符合,过程见答案
故答案为:①H2;②蒸发皿;③+1;④氯化钠电解会生成氯气,干扰实验结果;⑤已;⑥除尽溶液中的碳酸钠;⑦;⑧Na2CO3、NaOH;⑨符合。
14.(1)过滤
(2) 升高
(3)C
(4) 7 1h
(5)
(6)Cu(OH)2·CuCO3
【详解】(1)操作1实现了固液分离,名称是过滤;
(2)溶液A中含CuCl2和HCl,向溶液A中加入碳酸钠固体,碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,盐酸被消耗,故溶液pH升高;
碳酸钠固体与废液中所含酸的反应为碳酸钠和盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:;
(3)碱式碳酸铜分解温度为220℃,故干燥温度应低于220℃,且水的沸点为100℃,故应选择105℃。
故选c;
(4)由图可知,pH为7时,氯离子含量较低,反应时间为1h时,氯离子含量较低,故要获得较高纯度的产品,适宜的pH为7,反应时间为1h;
(5)分解产物为三种氧化物,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Cu、H、C、O,故生成物为氧化铜、水、二氧化碳,该反应的化学方程式为:;
(6)加热后减少的质量为反应生成水和二氧化碳的质量之和,由化学方程式可知,Cu(OH)2·2CuCO3晶型的失重率为:,Cu(OH)2·CuCO3受热分解的化学方程式为:,则Cu(OH)2·CuCO3的失重率为:,则其晶型主要是Cu(OH)2·CuCO3。
答案第1页,共2页
答案第1页,共2页
