2024年中考科学重点题型突破--推断题(2)(含解析)
文档属性
| 名称 | 2024年中考科学重点题型突破--推断题(2)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 551.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-04-30 08:27:38 | ||
图片预览


文档简介
2024年中考科学重点题型突破--推断题(2)
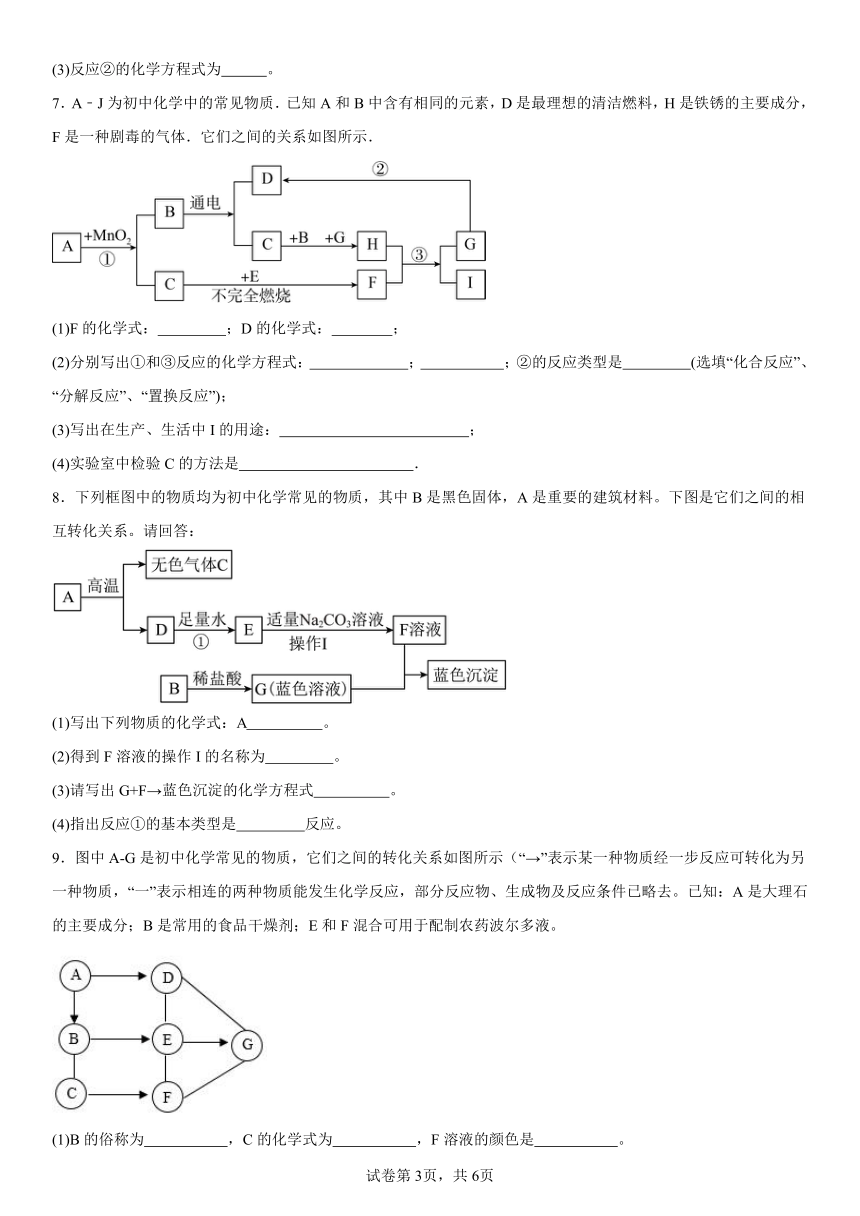
1.初中化学常见的五种不同类别的物质A、B、C、D、E分别属于单质、氧化物、酸、碱、盐中的一种,且有如图所示的关系,“一”表示两物质间能发生反应,“→”表示两物质间存在一步转化关系。其中,A为金属氧化物,D是大理石的主要成分,E中含有两种元素。
(1)写出物质的化学式:D ,E 。
(2)实验室区分B溶液与E溶液,常用试剂是 。
(3)A→C常用于工业炼铁,其化学原理为(用化学方程式表示) 。
(4)若B→D属于复分解反应,其化学方程式为 。
2.A、B、C、D、E、F为初中常见的六种物质,图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行),已知A、B、C、D、F五种不同类别的物质,且C、E、F均由两种元素组成,D可用于改良酸性土壤。请回答下列问题:
(1)写出D物质的化学式 。
(2)写出C与D发生反应的化学方程式 。
(3)写出A转化为C的化学方程式 。
(4)在上述转化过程中发生的基本反应类型最多有 种。
3.有一包白色固体,可能含有K2CO3、Ca(OH)2、CaCO3、AgCl中的一种或几种,小明同学为了探究其组成,取少量该固体进行如图实验。
(1)由步骤②可知原白色固体中一定含有 (填化学式),判断理由是 。
(2)步骤③中产生气泡的化学方程式为 。
(3)由以上实验分析可知,原白色固体的组成可能有 种组合。
4.某化学兴趣小组的同学用初中化学常见的A—F六种物质做转盘的猜谜游戏,已知A是一种气体,C是生活中常见的液体。它们之间有如图所示的转化关系(“→”表示前一种物质经一步反应可转化为后一种物质,“一”表示相连的两种物质能发生化学反应,部分反应物、生成物及反应条件已略去)。
(1)若A、D、E都是单质,且E是紫红色固体,B、C、F的物质类别相同,则A的化学式是 ,F→E的化学方程式是 。
(2)若A和C的物质类别相同,B是大理石的主要成分,则F的俗称是 ,C→D是 (填“放热”或“吸热”)反应,写出D的一种用途 。
5.某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如下图所示(废水中的其他物质不参与反应):
(1)过程①和过程②充分反应后都需进行的操作是 。
(2)写出过程①和过程②中发生反应的化学方程式:
① ; ② ;
6.A~G 是初中化学常见的物质,A、B、C、D、E、F 中都含有氧元素,其中A、C 含有钠元素,且 A 是一种盐,D、E 为氧化物,且 D 是导致温室效应的主要气体,G 是人体胃液的主要成分。它们之间的相互关系如图所示,其中“—”表示相连的两种物质之间可以发生反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)物质 D 的化学式为 。
(2)反应①的化学方程式为 ,它的基本反应类型是 。
(3)反应②的化学方程式为 。
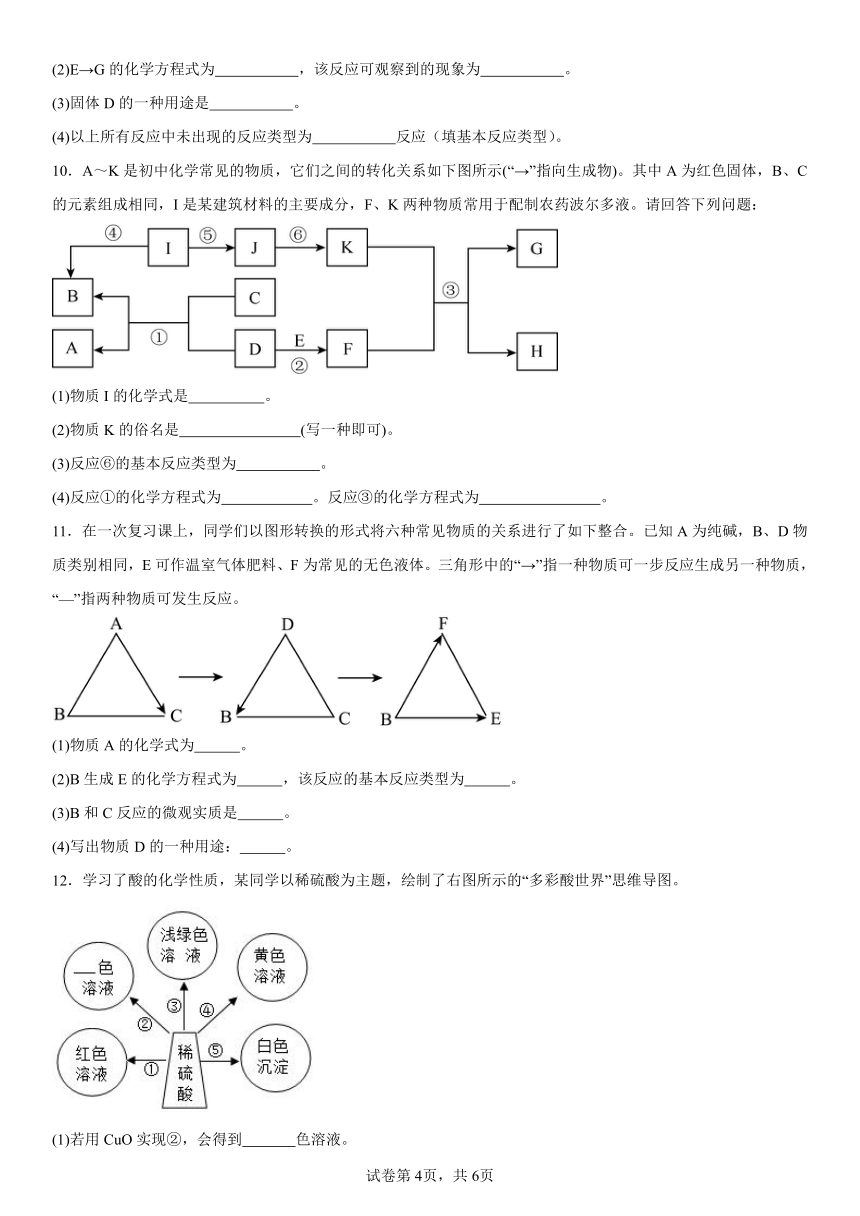
7.A﹣J为初中化学中的常见物质.已知A和B中含有相同的元素,D是最理想的清洁燃料,H是铁锈的主要成分,F是一种剧毒的气体.它们之间的关系如图所示.
(1)F的化学式: ;D的化学式: ;
(2)分别写出①和③反应的化学方程式: ; ;②的反应类型是 (选填“化合反应”、“分解反应”、“置换反应”);
(3)写出在生产、生活中I的用途: ;
(4)实验室中检验C的方法是 .
8.下列框图中的物质均为初中化学常见的物质,其中B是黑色固体,A是重要的建筑材料。下图是它们之间的相互转化关系。请回答:
(1)写出下列物质的化学式:A 。
(2)得到F溶液的操作I的名称为 。
(3)请写出G+F→蓝色沉淀的化学方程式 。
(4)指出反应①的基本类型是 反应。
9.图中A-G是初中化学常见的物质,它们之间的转化关系如图所示(“→”表示某一种物质经一步反应可转化为另一种物质,“一”表示相连的两种物质能发生化学反应,部分反应物、生成物及反应条件已略去。已知:A是大理石的主要成分;B是常用的食品干燥剂;E和F混合可用于配制农药波尔多液。
(1)B的俗称为 ,C的化学式为 ,F溶液的颜色是 。
(2)E→G的化学方程式为 ,该反应可观察到的现象为 。
(3)固体D的一种用途是 。
(4)以上所有反应中未出现的反应类型为 反应(填基本反应类型)。
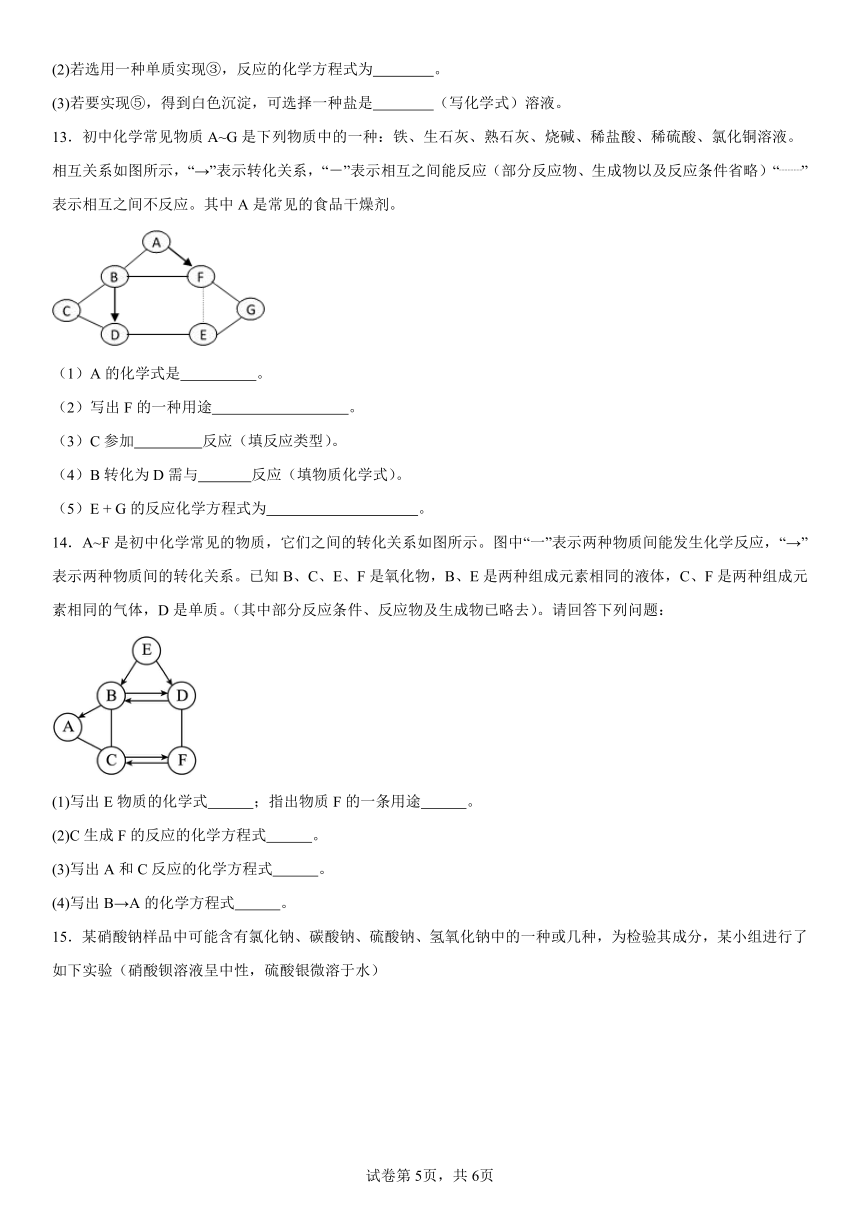
10.A~K是初中化学常见的物质,它们之间的转化关系如下图所示(“→”指向生成物)。其中A为红色固体,B、C的元素组成相同,I是某建筑材料的主要成分,F、K两种物质常用于配制农药波尔多液。请回答下列问题:
(1)物质I的化学式是 。
(2)物质K的俗名是 (写一种即可)。
(3)反应⑥的基本反应类型为 。
(4)反应①的化学方程式为 。反应③的化学方程式为 。
11.在一次复习课上,同学们以图形转换的形式将六种常见物质的关系进行了如下整合。已知A为纯碱,B、D物质类别相同,E可作温室气体肥料、F为常见的无色液体。三角形中的“→”指一种物质可一步反应生成另一种物质,“—”指两种物质可发生反应。
(1)物质A的化学式为 。
(2)B生成E的化学方程式为 ,该反应的基本反应类型为 。
(3)B和C反应的微观实质是 。
(4)写出物质D的一种用途: 。
12.学习了酸的化学性质,某同学以稀硫酸为主题,绘制了右图所示的“多彩酸世界”思维导图。
(1)若用CuO实现②,会得到 色溶液。
(2)若选用一种单质实现③,反应的化学方程式为 。
(3)若要实现⑤,得到白色沉淀,可选择一种盐是 (写化学式)溶液。
13.初中化学常见物质A~G是下列物质中的一种:铁、生石灰、熟石灰、烧碱、稀盐酸、稀硫酸、氯化铜溶液。相互关系如图所示,“→”表示转化关系,“-”表示相互之间能反应(部分反应物、生成物以及反应条件省略)“”表示相互之间不反应。其中A是常见的食品干燥剂。
(1)A的化学式是 。
(2)写出F的一种用途 。
(3)C参加 反应(填反应类型)。
(4)B转化为D需与 反应(填物质化学式)。
(5)E + G的反应化学方程式为 。
14.A~F是初中化学常见的物质,它们之间的转化关系如图所示。图中“一”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系。已知B、C、E、F是氧化物,B、E是两种组成元素相同的液体,C、F是两种组成元素相同的气体,D是单质。(其中部分反应条件、反应物及生成物已略去)。请回答下列问题:
(1)写出E物质的化学式 ;指出物质F的一条用途 。
(2)C生成F的反应的化学方程式 。
(3)写出A和C反应的化学方程式 。
(4)写出B→A的化学方程式 。
15.某硝酸钠样品中可能含有氯化钠、碳酸钠、硫酸钠、氢氧化钠中的一种或几种,为检验其成分,某小组进行了如下实验(硝酸钡溶液呈中性,硫酸银微溶于水)
①无色气体 D 是 ,白色固体 F 是 ,操作 M 是
②步骤Ⅴ中发生反应的化学方程式是
③步骤Ⅱ加入硝酸钡溶液时需过量,“过量”对步骤Ⅴ目的达成的作用是
④上述实验不能确定样品中是否含有氢氧化钠,改进上述实验方案加以证明
改进方案 可能的现象及结论
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) CaCO3 HCI
(2)酚酞试液(石蕊试液、Fe、Zn、Mg等,合理即可)
(3)
(4)
【分析】由题意可知,D为大理石的主要成分,故D为碳酸钙,属于盐。E能与碳酸钙及其他物质发生反应,则E为酸,E中含有两种元素,则E为盐酸;因A能够生成C且A为金属氧化物,则C为单质,则B为碱,且该碱能生成碳酸钙,故B为氢氧化钙。
【详解】(1)由分析可知,D为碳酸钙,E为盐酸,故填CaCO3;HCl;
(2)由分析可知,B为氢氧化钙,水溶液呈碱性,E为盐酸,溶液呈酸性,故可用酸碱指示剂区分,也可利用酸能和活泼金属发生反应生成气泡的现象来区分,故填酚酞试液(或石蕊试液、Fe、Zn等,合理即可)
(3)A转化成C用于工业炼铁,即使用氧化铁和一氧化碳反应生成铁单质和二氧化碳,方程式为 ;
(4)B转化成D的过程为氢氧化钙生成碳酸钙的过程,可用氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,方程式为;
2.(1)Ca(OH)2
(2)
(3)
(4)3
【分析】A、B、C、D、E、F为初中常见的六种物质,A、B、C、D、F为五种不同类别的物质,且C、E、F均由两种元素组成,D可用于改良酸性土壤,所以D是氢氧化钙,F会与氢氧化钙反应,会转化成C,C也会与氢氧化钙反应,所以C是二氧化碳,F是盐酸,二氧化碳和B可以相互转化,B会与氢氧化钙反应,所以B是碳酸钠,盐酸会转化成E,二氧化碳也会转化成E,二氧化碳也会与E反应,所以E是水,A会与水、二氧化碳相互转化,所以A是氧气,经过验证,推导正确。
【详解】(1)由分析可知,D为氢氧化钙,化学式为:Ca(OH)2;
(2)C与D反应为二氧化碳与氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:;
(3)A转化为C为碳在氧气中燃烧生成二氧化碳,该反应的化学方程式为:;
(4)A转化为C为碳在氧气中燃烧生成二氧化碳,该反应符合“多变一”的特点,属于化合反应;
C转化为A为二氧化碳和水在叶绿体和光的作用下转化为葡萄糖和氧气,不属于基本反应类型;
A转化为E为氢气燃烧生成水,该反应符合“多变一”的特点,属于化合反应;
E转化为A为水在通电的条件下反应生成氢气和氧气,该反应符合“一变多”的特点,属于分解反应;
E和C反应为二氧化碳和水反应生成碳酸,该反应符合“多变一”的特点,属于化合反应;
C转化为E为二氧化碳和氢氧化钠反应生成碳酸钠和水,该反应不属于基本反应类型;
C转化为B为二氧化碳和氢氧化钠反应生成碳酸钠和水,该反应不属于基本反应类型;
B转化为C为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
B与D反应为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
C与D反应为二氧化碳和氢氧化钙反应生成碳酸钙和水,不属于基本反应类型;
B与F反应为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
D与F反应为氢氧化钙和稀盐酸反应生成氯化钙和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
F转化为C为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
F转化为E为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
所以在上述转化过程中发生的基本反应类型最多有3种。
3.(1) AgCl 白色固体A部分消失
(2)K2CO3+2HNO3=2KNO3+H2O+CO2↑
(3)3
【详解】(1)白色固体A中加入稀硝酸后固体部分消失,即未溶解的固体不溶于稀硝酸,上述物质中,不溶于稀硝酸的物质是氯化银,则原白色固体中一定含有氯化银,其化学式为AgCl,判断理由是:白色固体A部分消失。
(2)由步骤③可知,无色溶液A中加入足量稀硝酸后溶液中产生气泡,则无色溶液A中含有可溶性碳酸盐,即含有碳酸钾,所以其中的反应是碳酸钾与稀硝酸反应生成硝酸钾、水和二氧化碳,故反应的化学方程式写为:K2CO3+2HNO3=2KNO3+H2O+CO2↑。
(3)由步骤②③可知,原白色固体中一定含有氯化银和碳酸钾,由步骤②可知,向白色固体A中加入稀硝酸后固体部分消失且产生气泡,说明消失的固体是碳酸钙,原固体中可能含有碳酸钙,碳酸钙也可能是由碳酸钾与氢氧化钙反应生成,还可能既含有原有的碳酸钙和碳酸钾与氢氧化钙反应生成的碳酸钙,所以原白色固体的组成可能是K2CO3、CaCO3、AgCl,也可能是K2CO3、Ca(OH)2、AgCl,还可能是K2CO3、Ca(OH)2、CaCO3、AgCl,即原白色固体的组成可能有3种组合方式,故填3。
4. O2 纯碱(苏打) 放热 改良酸性土壤(建筑材料、制波尔多液等)
【详解】(1)由题目信息可知C为水,E为铜,而A可以生成C水,也可以与E铜反应,所以可知A为氧气,水可以生成D,D可以与A氧气反应且是单质,则D为氢气,F可生成E铜,且能与氧气反应,可知F为一氧化碳,一氧化碳可以生成B,氧气也可以生成B,B为二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可以由二氧化碳制得水,故A为氧气,B为二氧化碳,C为水,D为氢气,E为铜,F为一氧化碳,代入检验,推断合理;
F一氧化碳转化为E铜,可以通过一氧化碳与氧化铜在加热条件下反应生成铜和二氧化碳,反应的化学方程式为:CO+CuOCu+CO2;
故填:O2:CO+CuOCu+CO2
(2)C为水,为氧化物,而A与C都是氧化物,B为碳酸钙,而A可以生成碳酸钙,所以A为二氧化碳,水可以转化为D,且D与A二氧化碳可以反应,则D可以为氢氧化钙,而D又可以生成E,且E可与A二氧化碳反应,氢氧化钙可以与碳酸钠反应生成氢氧化钠和碳酸钙,所以E为氢氧化钠,F可以生成氢氧化钠,又可以生成碳酸钙,所以F含有碳酸根和钠离子,因此F为碳酸钠,所以A为氧化碳,B为碳酸钙,C为水,D为氢氧化钙,E为氢氧化钠,F为碳酸钠,代入检验,推断合理;
F为碳酸钠,俗称为纯碱(苏打);水变为氢氧化钙,可以用氧化钙与水反应生成氢氧化钙,反应为放热反应;D氢氧化钙为碱,可以用于改良酸性土壤(建筑材料、制波尔多液等);
故填:纯碱(苏打);放热;改良酸性土壤(建筑材料、制波尔多液等)
【点睛】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
5.(1)过滤
(2) Fe + CuSO4= FeSO4+Cu Fe + H2SO4= FeSO4+H2↑
【分析】根据题意,废水中加入铁,硫酸铜和铁反应生成硫酸亚铁和铜,为了确保铜全被置换,需要加入过量的铁,因此固体C中含有铁盒铜,除去铁用酸,最后得到纯净的铜。
【详解】(1)过程①和过程②充分反应后,多出现固液分离的情况,故需进行的操作是过滤;
(2)①发生的是硫酸铜和铁的反应:Fe + CuSO4 = FeSO4 +Cu,②是铁和硫酸的反应:Fe + H2SO4 = FeSO4 +H2↑。
【点睛】结合金属的性质分析即可。
6.(1)CO2
(2) CaCO3 CaO+CO2↑ 分解反应
(3)BaCl2+H2SO4═BaSO4↓+2HCl
【分析】D、E 为氧化物,且 D 是导致温室效应的主要气体,G 是人体胃液的主要成分,所以D是二氧化碳,G是盐酸;
G(盐酸)能与E、B反应,B能转化为E,B能转化D(二氧化碳),氧化钙和盐酸反应生成氯化钙和水,碳酸钙与盐酸反应能生成二氧化碳,碳酸钙在高温条件下能分解生成氧化钙和二氧化碳,所以B是碳酸钙,E是氧化钙;
A 是一种盐,A能转化D(二氧化碳)、B(碳酸钙),A能与F反应,F能转化为D(二氧化碳),碳酸钠与盐酸能转化为二氧化碳,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,所以A是碳酸钠,F可能是硫酸。
C能转化为A(碳酸钠)能与F(硫酸)反应,氢氧化钠和二氧化碳反应生成碳酸钠和水,和稀硫酸反应生成硫酸钠和水,所以C为氢氧化钠。将猜想代入关系图,猜想成立。
【详解】(1)物质 D是二氧化碳,化学式为CO2;
(2)反应①中,碳酸钙在高温条件下分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3 CaO+CO2↑,该反应是由一种物质生成两种物质的反应,基本反应类型是分解反应;
(3)反应②中,可以是氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,反应的化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl。
7. CO H2 2H2O22H2O+O2↑ 置换反应 生产中可以用作气肥,生活中可以用来灭火 用带火星的木条检验,如果木条复燃则可知该气体就是氧气
【详解】水在通电条件下能发生分解反应,A和B中含有相同的元素,A加入二氧化锰可以生成B,则A是H2O2,B是H2O,D是最理想的清洁燃料,则D是H2,C为O2,H是铁锈的主要成分,则H是Fe2O3。碳不完全燃烧生成CO,CO是一种剧毒的气体.则F是CO,E是碳,CO和Fe2O3反应可以生成CO2和Fe,G可以反应生成DH2,所以G是Fe,I是CO2。
(1)由分析知F是CO,D是H2;
(2)由分析可知①的反应的化学方程式是:2H2O22H2O+O2↑、②的反应的化学方程式是:Fe+2HCl==FeCl2+H2↑或 Fe+H2SO4==FeSO4+H2↑,由一种单质和一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。
(3)I是二氧化碳,在农业生产中二氧化碳是一种气体肥料、生活中可以用来灭火;
(4)C是氧气,鉴别氧气用带火星的木条,将带火星的木条伸入集气瓶中,如果木条复燃则该气体是氧气。
【点睛】要顺利解决推断题,就要熟练掌握物质的性质、特点、用途、常发生的化学反应,甚至反应条件等。初中阶段见过的反应中通电条件的只有水的分解反应、铁锈的主要成分是氧化铁、氢气是最理想的清洁燃料是该题的突破口。
8.(1)CaCO3
(2)过滤
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl
(4)化合
【分析】A是重要建筑材料,又能高温分解,说明是碳酸钙,高温得到气体C为二氧化碳,D为氧化钙,氧化钙和水反应生成E为氢氧化钙,氢氧化钙和碳酸钠反应得F为氢氧化钠,B为黑色固体能和盐酸反应得蓝色溶液,则B为氧化铜,G为氯化铜;
【详解】(1)A是重要建筑材料,又能高温分解,说明是碳酸钙,化学式为CaCO3;
(2)E为氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,操作I是将固体和液体分离,所以为过滤;
(3)B是黑色固体,能和盐酸反应生成蓝色溶液,说明G中有铜离子,B中有铜元素,又是黑色固体说明是氧化铜,所以G为氯化铜,氯化铜和氢氧化钠反应生氢氧化铜和氯化钠,化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)D是氧化钙,氧化钙和水反应生成氢氧化钙,符合“多变一”的特点,属于化合反应。
9.(1) 生石灰 H2SO4 蓝色
(2) Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH 产生白色沉淀
(3)灭火/人工降雨/制造舞台云雾
(4)置换
【分析】A是大理石的主要成分,A是碳酸钙;B是常用的食品干燥剂,B是氧化钙;E和F混合可用于配制农药波尔多液,且B→E,则E是氢氧化钙,F是硫酸铜。C既可与氧化钙反应,又可用发生反应生成硫酸铜,则C是稀硫酸,碳酸钙可发生反应生成D,D又可与G反应,E→G,硫酸铜又能与G反应,则D是二氧化碳,G可是氢氧化钠或氢氧化钾。
【详解】(1)B是氧化钙,俗称为生石灰,C是稀硫酸,其化学式为H2SO4,F是硫酸铜,F溶液的颜色是蓝色;
(2)E→G的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH,该反应可观察到产生白色沉淀;
(3)固体D是二氧化碳,可用来灭火、人工降雨或制造舞台云雾;
(4)以上所有反应中未出现的反应类型为置换反应。
10. CaCO3 熟石灰/消石灰 化合反应
【分析】红色固体有铜和氧化铁,根据C与D反应生成B和A,推测A是铜;反应①生成铜,且B、C的元素组成相同,可知C是一氧化碳,B是二氧化碳,D是氧化铜;
I是某建筑材料的主要成分,故I是碳酸钙,碳酸钙分解生成二氧化碳和氧化钙;
农药波尔多液的主要成分是氢氧化钙和硫酸铜,氧化铜与E反应可生成F,则F是硫酸铜,K是氢氧化钙,E是硫酸;氧化钙与水反应生成氢氧化钙,故J是氧化钙。氢氧化钙和硫酸铜反应生成氢氧化铜沉淀和硫酸钙,GH是氢氧化铜和硫酸钙中的一种,代入验证无误。
【详解】(1)I是碳酸钙,化学式为CaCO3;
(2)K为氢氧化钙,俗称熟石灰,消石灰;
(3)⑥是氧化钙和水生成氢氧化钙的反应,符合“多变一”的特点,属于化合反应;
(4)反应①是一氧化碳与氧化铜的反应,化学方程式为:,反应③是氢氧化钙与硫酸铜的反应,化学方程式为:。
11.(1)Na2CO3
(2) CaCO3+2HCl=CaCl2+H2O+CO2↑(合理即可) 复分解反应
(3)氢离子和氢氧根离子结合生成水
(4)除铁锈(合理即可)
【分析】A为纯碱,则A为碳酸钠;E可作温室气体肥料,则E为二氧化碳;F为常见的无色液体,则F可以为水;B能转化为水、二氧化碳,则B为酸,B能与A(碳酸钠)、C反应,且A(碳酸钠)能转化为C,则B可以为盐酸,C为氢氧化钠;B、D物质类别相同,D能转化为B(盐酸),且能与C(氢氧化钠)反应,则D为硫酸,代入检验,推断合理。
【详解】(1)由分析可知,A为碳酸钠,其化学式为Na2CO3,故填:Na2CO3;
(2)B为盐酸,E为二氧化碳,B生成E可以为盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应符合“两种化合物互相交换成分,生成另外两种化合物”的特点,属于复分解反应,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑(合理即可);复分解反应;
(3)B为盐酸,C为氢氧化钠,B和C反应的微观实质是盐酸中的氢离子和氢氧化钠中的氢氧根离子结合生成水,故填:氢离子和氢氧根离子结合生成水;
(4)D为硫酸,可用于除铁锈,故填:除铁锈(合理即可)。
12.(1)蓝
(2)
(3)BaCl2或Ba(NO3)2
【详解】(1)若用CuO实现②,也就是氧化铜与稀硫酸反应生成硫酸铜和水,所以会得到蓝色溶液。
(2)若选用一种单质实现③,要得到浅绿色溶液(含有亚铁离子的溶液),所以是铁和稀硫酸反应生成硫酸亚铁和氢气,对应反应的化学方程式为。
(3)若要实现⑤,也就是和稀硫酸反应可以得到白色沉淀,也就是硫酸钡沉淀,所以可选择一种盐是氯化钡或者硝酸钡溶液,对应化学式为BaCl2或Ba(NO3)2。
13. CaO 建筑材料、改良酸性土壤等(合理
即可) 置换反应 CuO或Cu(OH)2 2NaOH + H2SO4 = Na2SO4 + 2H2O
【详解】本题是框图型推断题。在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
A~G是下列物质中的一种:铁、生石灰、熟石灰、烧碱、稀盐酸、稀硫酸、氯化铜溶液。A是常见的食品干燥剂,根据题中提供的信息,A是铁或氧化钙,A能转化为F,F可能是氢氧化钙,F与E不能反应,说明E、F可能是同类物质,E可能是氢氧化钠(烧碱);氧化钙能与B反应,B是酸,可能是盐酸或硫酸,B能转化为D,酸与金属氧化物或碱反应生成盐和水,根据题中提供物质,D可能是氯化铜,则B是盐酸,C能与盐酸、氯化铜反应,则C可能铁,氯化铜能与氢氧化钠反应,硫酸能与氢氧化钠、氢氧化钙反应,G可能是硫酸,将假设代入框图,假设成立。因此:
(1)A是氧化钙,化学式是CaO ;
(2)F是氢氧化钙,氢氧化钙可用建筑材料、改良酸性土壤等;
(3)C是铁,铁参加的反应是铁与氯化铜反应,铁与盐酸反应,这两个反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,属于置换反应;
(4)B转化为D可能是盐酸与金属氧化物或碱反应,所以需与CuO或Cu(OH)2反应;
(5)E + G的反应是氢氧化钠与硫酸反应生成硫酸铜和水,化学方程式为2NaOH + H2SO4 = Na2SO4 + 2H2O。
14.(1) H2O2 工业炼铁(作燃料)
(2)
(3);
(4)
【分析】 B、E是两种组成元素相同的液体,E能转化为B、D,B、D能相互转化,可推出E为过氧化氢,B为水,D为氧气;C、F是两种组成元素相同的气体,B能与C反应,可推出C为二氧化碳,F为一氧化碳;水能转化为A,A能与二氧化碳反应,推断A为氢氧化钙,代入验证,符合题意。
【详解】(1)根据分析可知,E为过氧化氢,化学式为:H2O2;物质F为一氧化碳,具有可燃性,可作燃料,一氧化碳能还原金属氧化物,能冶炼金属;
(2)C生成F的反应为二氧化碳和碳在高温下反应生成一氧化碳,反应的化学方程式为:;
(3)A和C:氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:;
(4)B→A:水和氧化钙反应生成氢氧化钙,反应的化学方程式为:。
15. CO2 BaSO4 过滤 将硫酸钠除尽,防止硫酸钠与硝酸银反应生成硫酸银,影响氯化钠的验证 向溶液C中滴加无色酚酞试液 溶液变红,说明含氢氧化钠,否则不含
【分析】某硝酸钠样品中可能含有氯化钠、碳酸钠、硫酸钠、氢氧化钠中的一种或几种,加水溶解,加过量硝酸钡,生成白色固体B和溶液C,硝酸钡能与碳酸钠反应生成碳酸钡和硝酸钠,硝酸钡能与硫酸钠反应生成硫酸钡和硝酸钠,向固体B中加过量稀盐酸,生成无色气体D、无色溶液E,白色固体F,碳酸钡能与稀盐酸反应生成二氧化碳、氯化钡和水,硫酸钡与稀盐酸不反应,故硝酸钠固体中一定含碳酸钠、硫酸钠,生成的无色气体D为二氧化碳,白色固体F为硫酸钡,向溶液C中加入过量稀硝酸,然后加入硝酸银溶液,生成白色固体G 和溶液H,硝酸银能与氯化钠反应生成氯化银和硝酸钠,故硝酸钠固体中一定含有氯化钠。
【详解】①由分析可知,无色气体D是二氧化碳,化学式为:CO2;白色固体F是硫酸钡,化学式为:BaSO4;
操作M实现了固液分离,故操作M是过滤;
②步骤Ⅴ中发生的反应为氯化钠与硝酸银反应生成氯化银和硝酸钠,该反应的化学方程式为:;
③步骤Ⅱ加入硝酸钡溶液时需过量,这样可将硫酸钠完全除去,防止硫酸钠剩余,硫酸钠与硝酸银反应生成硫酸银,硫酸银微溶于水,含量较多时,也会产生白色沉淀,会影响氯化钠的验证,故填:将硫酸钠除尽,防止硫酸钠与硝酸银反应生成硫酸银,影响氯化钠的验证;
④由以上分析可知,该样品中含有碳酸钠,碳酸钠显碱性,会影响氢氧化钠的验证,故可在加过量硝酸钡将碳酸钠除尽后,向溶液C中滴加无色酚酞试液,氢氧化钠显碱性,能使无色酚酞试液变红,故若溶液变红,说明含氢氧化钠,否则不含,故填:向溶液C中滴加无色酚酞试液,溶液变红,说明含氢氧化钠,否则不含。
答案第1页,共2页
答案第1页,共2页
1.初中化学常见的五种不同类别的物质A、B、C、D、E分别属于单质、氧化物、酸、碱、盐中的一种,且有如图所示的关系,“一”表示两物质间能发生反应,“→”表示两物质间存在一步转化关系。其中,A为金属氧化物,D是大理石的主要成分,E中含有两种元素。
(1)写出物质的化学式:D ,E 。
(2)实验室区分B溶液与E溶液,常用试剂是 。
(3)A→C常用于工业炼铁,其化学原理为(用化学方程式表示) 。
(4)若B→D属于复分解反应,其化学方程式为 。
2.A、B、C、D、E、F为初中常见的六种物质,图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行),已知A、B、C、D、F五种不同类别的物质,且C、E、F均由两种元素组成,D可用于改良酸性土壤。请回答下列问题:
(1)写出D物质的化学式 。
(2)写出C与D发生反应的化学方程式 。
(3)写出A转化为C的化学方程式 。
(4)在上述转化过程中发生的基本反应类型最多有 种。
3.有一包白色固体,可能含有K2CO3、Ca(OH)2、CaCO3、AgCl中的一种或几种,小明同学为了探究其组成,取少量该固体进行如图实验。
(1)由步骤②可知原白色固体中一定含有 (填化学式),判断理由是 。
(2)步骤③中产生气泡的化学方程式为 。
(3)由以上实验分析可知,原白色固体的组成可能有 种组合。
4.某化学兴趣小组的同学用初中化学常见的A—F六种物质做转盘的猜谜游戏,已知A是一种气体,C是生活中常见的液体。它们之间有如图所示的转化关系(“→”表示前一种物质经一步反应可转化为后一种物质,“一”表示相连的两种物质能发生化学反应,部分反应物、生成物及反应条件已略去)。
(1)若A、D、E都是单质,且E是紫红色固体,B、C、F的物质类别相同,则A的化学式是 ,F→E的化学方程式是 。
(2)若A和C的物质类别相同,B是大理石的主要成分,则F的俗称是 ,C→D是 (填“放热”或“吸热”)反应,写出D的一种用途 。
5.某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如下图所示(废水中的其他物质不参与反应):
(1)过程①和过程②充分反应后都需进行的操作是 。
(2)写出过程①和过程②中发生反应的化学方程式:
① ; ② ;
6.A~G 是初中化学常见的物质,A、B、C、D、E、F 中都含有氧元素,其中A、C 含有钠元素,且 A 是一种盐,D、E 为氧化物,且 D 是导致温室效应的主要气体,G 是人体胃液的主要成分。它们之间的相互关系如图所示,其中“—”表示相连的两种物质之间可以发生反应,“→”表示物质间存在转化关系(部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)物质 D 的化学式为 。
(2)反应①的化学方程式为 ,它的基本反应类型是 。
(3)反应②的化学方程式为 。
7.A﹣J为初中化学中的常见物质.已知A和B中含有相同的元素,D是最理想的清洁燃料,H是铁锈的主要成分,F是一种剧毒的气体.它们之间的关系如图所示.
(1)F的化学式: ;D的化学式: ;
(2)分别写出①和③反应的化学方程式: ; ;②的反应类型是 (选填“化合反应”、“分解反应”、“置换反应”);
(3)写出在生产、生活中I的用途: ;
(4)实验室中检验C的方法是 .
8.下列框图中的物质均为初中化学常见的物质,其中B是黑色固体,A是重要的建筑材料。下图是它们之间的相互转化关系。请回答:
(1)写出下列物质的化学式:A 。
(2)得到F溶液的操作I的名称为 。
(3)请写出G+F→蓝色沉淀的化学方程式 。
(4)指出反应①的基本类型是 反应。
9.图中A-G是初中化学常见的物质,它们之间的转化关系如图所示(“→”表示某一种物质经一步反应可转化为另一种物质,“一”表示相连的两种物质能发生化学反应,部分反应物、生成物及反应条件已略去。已知:A是大理石的主要成分;B是常用的食品干燥剂;E和F混合可用于配制农药波尔多液。
(1)B的俗称为 ,C的化学式为 ,F溶液的颜色是 。
(2)E→G的化学方程式为 ,该反应可观察到的现象为 。
(3)固体D的一种用途是 。
(4)以上所有反应中未出现的反应类型为 反应(填基本反应类型)。
10.A~K是初中化学常见的物质,它们之间的转化关系如下图所示(“→”指向生成物)。其中A为红色固体,B、C的元素组成相同,I是某建筑材料的主要成分,F、K两种物质常用于配制农药波尔多液。请回答下列问题:
(1)物质I的化学式是 。
(2)物质K的俗名是 (写一种即可)。
(3)反应⑥的基本反应类型为 。
(4)反应①的化学方程式为 。反应③的化学方程式为 。
11.在一次复习课上,同学们以图形转换的形式将六种常见物质的关系进行了如下整合。已知A为纯碱,B、D物质类别相同,E可作温室气体肥料、F为常见的无色液体。三角形中的“→”指一种物质可一步反应生成另一种物质,“—”指两种物质可发生反应。
(1)物质A的化学式为 。
(2)B生成E的化学方程式为 ,该反应的基本反应类型为 。
(3)B和C反应的微观实质是 。
(4)写出物质D的一种用途: 。
12.学习了酸的化学性质,某同学以稀硫酸为主题,绘制了右图所示的“多彩酸世界”思维导图。
(1)若用CuO实现②,会得到 色溶液。
(2)若选用一种单质实现③,反应的化学方程式为 。
(3)若要实现⑤,得到白色沉淀,可选择一种盐是 (写化学式)溶液。
13.初中化学常见物质A~G是下列物质中的一种:铁、生石灰、熟石灰、烧碱、稀盐酸、稀硫酸、氯化铜溶液。相互关系如图所示,“→”表示转化关系,“-”表示相互之间能反应(部分反应物、生成物以及反应条件省略)“”表示相互之间不反应。其中A是常见的食品干燥剂。
(1)A的化学式是 。
(2)写出F的一种用途 。
(3)C参加 反应(填反应类型)。
(4)B转化为D需与 反应(填物质化学式)。
(5)E + G的反应化学方程式为 。
14.A~F是初中化学常见的物质,它们之间的转化关系如图所示。图中“一”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系。已知B、C、E、F是氧化物,B、E是两种组成元素相同的液体,C、F是两种组成元素相同的气体,D是单质。(其中部分反应条件、反应物及生成物已略去)。请回答下列问题:
(1)写出E物质的化学式 ;指出物质F的一条用途 。
(2)C生成F的反应的化学方程式 。
(3)写出A和C反应的化学方程式 。
(4)写出B→A的化学方程式 。
15.某硝酸钠样品中可能含有氯化钠、碳酸钠、硫酸钠、氢氧化钠中的一种或几种,为检验其成分,某小组进行了如下实验(硝酸钡溶液呈中性,硫酸银微溶于水)
①无色气体 D 是 ,白色固体 F 是 ,操作 M 是
②步骤Ⅴ中发生反应的化学方程式是
③步骤Ⅱ加入硝酸钡溶液时需过量,“过量”对步骤Ⅴ目的达成的作用是
④上述实验不能确定样品中是否含有氢氧化钠,改进上述实验方案加以证明
改进方案 可能的现象及结论
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1) CaCO3 HCI
(2)酚酞试液(石蕊试液、Fe、Zn、Mg等,合理即可)
(3)
(4)
【分析】由题意可知,D为大理石的主要成分,故D为碳酸钙,属于盐。E能与碳酸钙及其他物质发生反应,则E为酸,E中含有两种元素,则E为盐酸;因A能够生成C且A为金属氧化物,则C为单质,则B为碱,且该碱能生成碳酸钙,故B为氢氧化钙。
【详解】(1)由分析可知,D为碳酸钙,E为盐酸,故填CaCO3;HCl;
(2)由分析可知,B为氢氧化钙,水溶液呈碱性,E为盐酸,溶液呈酸性,故可用酸碱指示剂区分,也可利用酸能和活泼金属发生反应生成气泡的现象来区分,故填酚酞试液(或石蕊试液、Fe、Zn等,合理即可)
(3)A转化成C用于工业炼铁,即使用氧化铁和一氧化碳反应生成铁单质和二氧化碳,方程式为 ;
(4)B转化成D的过程为氢氧化钙生成碳酸钙的过程,可用氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,方程式为;
2.(1)Ca(OH)2
(2)
(3)
(4)3
【分析】A、B、C、D、E、F为初中常见的六种物质,A、B、C、D、F为五种不同类别的物质,且C、E、F均由两种元素组成,D可用于改良酸性土壤,所以D是氢氧化钙,F会与氢氧化钙反应,会转化成C,C也会与氢氧化钙反应,所以C是二氧化碳,F是盐酸,二氧化碳和B可以相互转化,B会与氢氧化钙反应,所以B是碳酸钠,盐酸会转化成E,二氧化碳也会转化成E,二氧化碳也会与E反应,所以E是水,A会与水、二氧化碳相互转化,所以A是氧气,经过验证,推导正确。
【详解】(1)由分析可知,D为氢氧化钙,化学式为:Ca(OH)2;
(2)C与D反应为二氧化碳与氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:;
(3)A转化为C为碳在氧气中燃烧生成二氧化碳,该反应的化学方程式为:;
(4)A转化为C为碳在氧气中燃烧生成二氧化碳,该反应符合“多变一”的特点,属于化合反应;
C转化为A为二氧化碳和水在叶绿体和光的作用下转化为葡萄糖和氧气,不属于基本反应类型;
A转化为E为氢气燃烧生成水,该反应符合“多变一”的特点,属于化合反应;
E转化为A为水在通电的条件下反应生成氢气和氧气,该反应符合“一变多”的特点,属于分解反应;
E和C反应为二氧化碳和水反应生成碳酸,该反应符合“多变一”的特点,属于化合反应;
C转化为E为二氧化碳和氢氧化钠反应生成碳酸钠和水,该反应不属于基本反应类型;
C转化为B为二氧化碳和氢氧化钠反应生成碳酸钠和水,该反应不属于基本反应类型;
B转化为C为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
B与D反应为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
C与D反应为二氧化碳和氢氧化钙反应生成碳酸钙和水,不属于基本反应类型;
B与F反应为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
D与F反应为氢氧化钙和稀盐酸反应生成氯化钙和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
F转化为C为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
F转化为E为碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,为复分解反应;
所以在上述转化过程中发生的基本反应类型最多有3种。
3.(1) AgCl 白色固体A部分消失
(2)K2CO3+2HNO3=2KNO3+H2O+CO2↑
(3)3
【详解】(1)白色固体A中加入稀硝酸后固体部分消失,即未溶解的固体不溶于稀硝酸,上述物质中,不溶于稀硝酸的物质是氯化银,则原白色固体中一定含有氯化银,其化学式为AgCl,判断理由是:白色固体A部分消失。
(2)由步骤③可知,无色溶液A中加入足量稀硝酸后溶液中产生气泡,则无色溶液A中含有可溶性碳酸盐,即含有碳酸钾,所以其中的反应是碳酸钾与稀硝酸反应生成硝酸钾、水和二氧化碳,故反应的化学方程式写为:K2CO3+2HNO3=2KNO3+H2O+CO2↑。
(3)由步骤②③可知,原白色固体中一定含有氯化银和碳酸钾,由步骤②可知,向白色固体A中加入稀硝酸后固体部分消失且产生气泡,说明消失的固体是碳酸钙,原固体中可能含有碳酸钙,碳酸钙也可能是由碳酸钾与氢氧化钙反应生成,还可能既含有原有的碳酸钙和碳酸钾与氢氧化钙反应生成的碳酸钙,所以原白色固体的组成可能是K2CO3、CaCO3、AgCl,也可能是K2CO3、Ca(OH)2、AgCl,还可能是K2CO3、Ca(OH)2、CaCO3、AgCl,即原白色固体的组成可能有3种组合方式,故填3。
4. O2 纯碱(苏打) 放热 改良酸性土壤(建筑材料、制波尔多液等)
【详解】(1)由题目信息可知C为水,E为铜,而A可以生成C水,也可以与E铜反应,所以可知A为氧气,水可以生成D,D可以与A氧气反应且是单质,则D为氢气,F可生成E铜,且能与氧气反应,可知F为一氧化碳,一氧化碳可以生成B,氧气也可以生成B,B为二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可以由二氧化碳制得水,故A为氧气,B为二氧化碳,C为水,D为氢气,E为铜,F为一氧化碳,代入检验,推断合理;
F一氧化碳转化为E铜,可以通过一氧化碳与氧化铜在加热条件下反应生成铜和二氧化碳,反应的化学方程式为:CO+CuOCu+CO2;
故填:O2:CO+CuOCu+CO2
(2)C为水,为氧化物,而A与C都是氧化物,B为碳酸钙,而A可以生成碳酸钙,所以A为二氧化碳,水可以转化为D,且D与A二氧化碳可以反应,则D可以为氢氧化钙,而D又可以生成E,且E可与A二氧化碳反应,氢氧化钙可以与碳酸钠反应生成氢氧化钠和碳酸钙,所以E为氢氧化钠,F可以生成氢氧化钠,又可以生成碳酸钙,所以F含有碳酸根和钠离子,因此F为碳酸钠,所以A为氧化碳,B为碳酸钙,C为水,D为氢氧化钙,E为氢氧化钠,F为碳酸钠,代入检验,推断合理;
F为碳酸钠,俗称为纯碱(苏打);水变为氢氧化钙,可以用氧化钙与水反应生成氢氧化钙,反应为放热反应;D氢氧化钙为碱,可以用于改良酸性土壤(建筑材料、制波尔多液等);
故填:纯碱(苏打);放热;改良酸性土壤(建筑材料、制波尔多液等)
【点睛】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
5.(1)过滤
(2) Fe + CuSO4= FeSO4+Cu Fe + H2SO4= FeSO4+H2↑
【分析】根据题意,废水中加入铁,硫酸铜和铁反应生成硫酸亚铁和铜,为了确保铜全被置换,需要加入过量的铁,因此固体C中含有铁盒铜,除去铁用酸,最后得到纯净的铜。
【详解】(1)过程①和过程②充分反应后,多出现固液分离的情况,故需进行的操作是过滤;
(2)①发生的是硫酸铜和铁的反应:Fe + CuSO4 = FeSO4 +Cu,②是铁和硫酸的反应:Fe + H2SO4 = FeSO4 +H2↑。
【点睛】结合金属的性质分析即可。
6.(1)CO2
(2) CaCO3 CaO+CO2↑ 分解反应
(3)BaCl2+H2SO4═BaSO4↓+2HCl
【分析】D、E 为氧化物,且 D 是导致温室效应的主要气体,G 是人体胃液的主要成分,所以D是二氧化碳,G是盐酸;
G(盐酸)能与E、B反应,B能转化为E,B能转化D(二氧化碳),氧化钙和盐酸反应生成氯化钙和水,碳酸钙与盐酸反应能生成二氧化碳,碳酸钙在高温条件下能分解生成氧化钙和二氧化碳,所以B是碳酸钙,E是氧化钙;
A 是一种盐,A能转化D(二氧化碳)、B(碳酸钙),A能与F反应,F能转化为D(二氧化碳),碳酸钠与盐酸能转化为二氧化碳,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,所以A是碳酸钠,F可能是硫酸。
C能转化为A(碳酸钠)能与F(硫酸)反应,氢氧化钠和二氧化碳反应生成碳酸钠和水,和稀硫酸反应生成硫酸钠和水,所以C为氢氧化钠。将猜想代入关系图,猜想成立。
【详解】(1)物质 D是二氧化碳,化学式为CO2;
(2)反应①中,碳酸钙在高温条件下分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3 CaO+CO2↑,该反应是由一种物质生成两种物质的反应,基本反应类型是分解反应;
(3)反应②中,可以是氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,反应的化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl。
7. CO H2 2H2O22H2O+O2↑ 置换反应 生产中可以用作气肥,生活中可以用来灭火 用带火星的木条检验,如果木条复燃则可知该气体就是氧气
【详解】水在通电条件下能发生分解反应,A和B中含有相同的元素,A加入二氧化锰可以生成B,则A是H2O2,B是H2O,D是最理想的清洁燃料,则D是H2,C为O2,H是铁锈的主要成分,则H是Fe2O3。碳不完全燃烧生成CO,CO是一种剧毒的气体.则F是CO,E是碳,CO和Fe2O3反应可以生成CO2和Fe,G可以反应生成DH2,所以G是Fe,I是CO2。
(1)由分析知F是CO,D是H2;
(2)由分析可知①的反应的化学方程式是:2H2O22H2O+O2↑、②的反应的化学方程式是:Fe+2HCl==FeCl2+H2↑或 Fe+H2SO4==FeSO4+H2↑,由一种单质和一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。
(3)I是二氧化碳,在农业生产中二氧化碳是一种气体肥料、生活中可以用来灭火;
(4)C是氧气,鉴别氧气用带火星的木条,将带火星的木条伸入集气瓶中,如果木条复燃则该气体是氧气。
【点睛】要顺利解决推断题,就要熟练掌握物质的性质、特点、用途、常发生的化学反应,甚至反应条件等。初中阶段见过的反应中通电条件的只有水的分解反应、铁锈的主要成分是氧化铁、氢气是最理想的清洁燃料是该题的突破口。
8.(1)CaCO3
(2)过滤
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl
(4)化合
【分析】A是重要建筑材料,又能高温分解,说明是碳酸钙,高温得到气体C为二氧化碳,D为氧化钙,氧化钙和水反应生成E为氢氧化钙,氢氧化钙和碳酸钠反应得F为氢氧化钠,B为黑色固体能和盐酸反应得蓝色溶液,则B为氧化铜,G为氯化铜;
【详解】(1)A是重要建筑材料,又能高温分解,说明是碳酸钙,化学式为CaCO3;
(2)E为氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,操作I是将固体和液体分离,所以为过滤;
(3)B是黑色固体,能和盐酸反应生成蓝色溶液,说明G中有铜离子,B中有铜元素,又是黑色固体说明是氧化铜,所以G为氯化铜,氯化铜和氢氧化钠反应生氢氧化铜和氯化钠,化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)D是氧化钙,氧化钙和水反应生成氢氧化钙,符合“多变一”的特点,属于化合反应。
9.(1) 生石灰 H2SO4 蓝色
(2) Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH 产生白色沉淀
(3)灭火/人工降雨/制造舞台云雾
(4)置换
【分析】A是大理石的主要成分,A是碳酸钙;B是常用的食品干燥剂,B是氧化钙;E和F混合可用于配制农药波尔多液,且B→E,则E是氢氧化钙,F是硫酸铜。C既可与氧化钙反应,又可用发生反应生成硫酸铜,则C是稀硫酸,碳酸钙可发生反应生成D,D又可与G反应,E→G,硫酸铜又能与G反应,则D是二氧化碳,G可是氢氧化钠或氢氧化钾。
【详解】(1)B是氧化钙,俗称为生石灰,C是稀硫酸,其化学式为H2SO4,F是硫酸铜,F溶液的颜色是蓝色;
(2)E→G的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH或K2CO3+Ca(OH)2=CaCO3↓+2KOH,该反应可观察到产生白色沉淀;
(3)固体D是二氧化碳,可用来灭火、人工降雨或制造舞台云雾;
(4)以上所有反应中未出现的反应类型为置换反应。
10. CaCO3 熟石灰/消石灰 化合反应
【分析】红色固体有铜和氧化铁,根据C与D反应生成B和A,推测A是铜;反应①生成铜,且B、C的元素组成相同,可知C是一氧化碳,B是二氧化碳,D是氧化铜;
I是某建筑材料的主要成分,故I是碳酸钙,碳酸钙分解生成二氧化碳和氧化钙;
农药波尔多液的主要成分是氢氧化钙和硫酸铜,氧化铜与E反应可生成F,则F是硫酸铜,K是氢氧化钙,E是硫酸;氧化钙与水反应生成氢氧化钙,故J是氧化钙。氢氧化钙和硫酸铜反应生成氢氧化铜沉淀和硫酸钙,GH是氢氧化铜和硫酸钙中的一种,代入验证无误。
【详解】(1)I是碳酸钙,化学式为CaCO3;
(2)K为氢氧化钙,俗称熟石灰,消石灰;
(3)⑥是氧化钙和水生成氢氧化钙的反应,符合“多变一”的特点,属于化合反应;
(4)反应①是一氧化碳与氧化铜的反应,化学方程式为:,反应③是氢氧化钙与硫酸铜的反应,化学方程式为:。
11.(1)Na2CO3
(2) CaCO3+2HCl=CaCl2+H2O+CO2↑(合理即可) 复分解反应
(3)氢离子和氢氧根离子结合生成水
(4)除铁锈(合理即可)
【分析】A为纯碱,则A为碳酸钠;E可作温室气体肥料,则E为二氧化碳;F为常见的无色液体,则F可以为水;B能转化为水、二氧化碳,则B为酸,B能与A(碳酸钠)、C反应,且A(碳酸钠)能转化为C,则B可以为盐酸,C为氢氧化钠;B、D物质类别相同,D能转化为B(盐酸),且能与C(氢氧化钠)反应,则D为硫酸,代入检验,推断合理。
【详解】(1)由分析可知,A为碳酸钠,其化学式为Na2CO3,故填:Na2CO3;
(2)B为盐酸,E为二氧化碳,B生成E可以为盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,该反应符合“两种化合物互相交换成分,生成另外两种化合物”的特点,属于复分解反应,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑(合理即可);复分解反应;
(3)B为盐酸,C为氢氧化钠,B和C反应的微观实质是盐酸中的氢离子和氢氧化钠中的氢氧根离子结合生成水,故填:氢离子和氢氧根离子结合生成水;
(4)D为硫酸,可用于除铁锈,故填:除铁锈(合理即可)。
12.(1)蓝
(2)
(3)BaCl2或Ba(NO3)2
【详解】(1)若用CuO实现②,也就是氧化铜与稀硫酸反应生成硫酸铜和水,所以会得到蓝色溶液。
(2)若选用一种单质实现③,要得到浅绿色溶液(含有亚铁离子的溶液),所以是铁和稀硫酸反应生成硫酸亚铁和氢气,对应反应的化学方程式为。
(3)若要实现⑤,也就是和稀硫酸反应可以得到白色沉淀,也就是硫酸钡沉淀,所以可选择一种盐是氯化钡或者硝酸钡溶液,对应化学式为BaCl2或Ba(NO3)2。
13. CaO 建筑材料、改良酸性土壤等(合理
即可) 置换反应 CuO或Cu(OH)2 2NaOH + H2SO4 = Na2SO4 + 2H2O
【详解】本题是框图型推断题。在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
A~G是下列物质中的一种:铁、生石灰、熟石灰、烧碱、稀盐酸、稀硫酸、氯化铜溶液。A是常见的食品干燥剂,根据题中提供的信息,A是铁或氧化钙,A能转化为F,F可能是氢氧化钙,F与E不能反应,说明E、F可能是同类物质,E可能是氢氧化钠(烧碱);氧化钙能与B反应,B是酸,可能是盐酸或硫酸,B能转化为D,酸与金属氧化物或碱反应生成盐和水,根据题中提供物质,D可能是氯化铜,则B是盐酸,C能与盐酸、氯化铜反应,则C可能铁,氯化铜能与氢氧化钠反应,硫酸能与氢氧化钠、氢氧化钙反应,G可能是硫酸,将假设代入框图,假设成立。因此:
(1)A是氧化钙,化学式是CaO ;
(2)F是氢氧化钙,氢氧化钙可用建筑材料、改良酸性土壤等;
(3)C是铁,铁参加的反应是铁与氯化铜反应,铁与盐酸反应,这两个反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,属于置换反应;
(4)B转化为D可能是盐酸与金属氧化物或碱反应,所以需与CuO或Cu(OH)2反应;
(5)E + G的反应是氢氧化钠与硫酸反应生成硫酸铜和水,化学方程式为2NaOH + H2SO4 = Na2SO4 + 2H2O。
14.(1) H2O2 工业炼铁(作燃料)
(2)
(3);
(4)
【分析】 B、E是两种组成元素相同的液体,E能转化为B、D,B、D能相互转化,可推出E为过氧化氢,B为水,D为氧气;C、F是两种组成元素相同的气体,B能与C反应,可推出C为二氧化碳,F为一氧化碳;水能转化为A,A能与二氧化碳反应,推断A为氢氧化钙,代入验证,符合题意。
【详解】(1)根据分析可知,E为过氧化氢,化学式为:H2O2;物质F为一氧化碳,具有可燃性,可作燃料,一氧化碳能还原金属氧化物,能冶炼金属;
(2)C生成F的反应为二氧化碳和碳在高温下反应生成一氧化碳,反应的化学方程式为:;
(3)A和C:氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:;
(4)B→A:水和氧化钙反应生成氢氧化钙,反应的化学方程式为:。
15. CO2 BaSO4 过滤 将硫酸钠除尽,防止硫酸钠与硝酸银反应生成硫酸银,影响氯化钠的验证 向溶液C中滴加无色酚酞试液 溶液变红,说明含氢氧化钠,否则不含
【分析】某硝酸钠样品中可能含有氯化钠、碳酸钠、硫酸钠、氢氧化钠中的一种或几种,加水溶解,加过量硝酸钡,生成白色固体B和溶液C,硝酸钡能与碳酸钠反应生成碳酸钡和硝酸钠,硝酸钡能与硫酸钠反应生成硫酸钡和硝酸钠,向固体B中加过量稀盐酸,生成无色气体D、无色溶液E,白色固体F,碳酸钡能与稀盐酸反应生成二氧化碳、氯化钡和水,硫酸钡与稀盐酸不反应,故硝酸钠固体中一定含碳酸钠、硫酸钠,生成的无色气体D为二氧化碳,白色固体F为硫酸钡,向溶液C中加入过量稀硝酸,然后加入硝酸银溶液,生成白色固体G 和溶液H,硝酸银能与氯化钠反应生成氯化银和硝酸钠,故硝酸钠固体中一定含有氯化钠。
【详解】①由分析可知,无色气体D是二氧化碳,化学式为:CO2;白色固体F是硫酸钡,化学式为:BaSO4;
操作M实现了固液分离,故操作M是过滤;
②步骤Ⅴ中发生的反应为氯化钠与硝酸银反应生成氯化银和硝酸钠,该反应的化学方程式为:;
③步骤Ⅱ加入硝酸钡溶液时需过量,这样可将硫酸钠完全除去,防止硫酸钠剩余,硫酸钠与硝酸银反应生成硫酸银,硫酸银微溶于水,含量较多时,也会产生白色沉淀,会影响氯化钠的验证,故填:将硫酸钠除尽,防止硫酸钠与硝酸银反应生成硫酸银,影响氯化钠的验证;
④由以上分析可知,该样品中含有碳酸钠,碳酸钠显碱性,会影响氢氧化钠的验证,故可在加过量硝酸钡将碳酸钠除尽后,向溶液C中滴加无色酚酞试液,氢氧化钠显碱性,能使无色酚酞试液变红,故若溶液变红,说明含氢氧化钠,否则不含,故填:向溶液C中滴加无色酚酞试液,溶液变红,说明含氢氧化钠,否则不含。
答案第1页,共2页
答案第1页,共2页
