高中化学专题9金属与人类文明专题共享 学案 (含答案)苏教版(2019)必修第二册
文档属性
| 名称 | 高中化学专题9金属与人类文明专题共享 学案 (含答案)苏教版(2019)必修第二册 |
|
|
| 格式 | doc | ||
| 文件大小 | 460.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-01 00:00:00 | ||
图片预览



文档简介
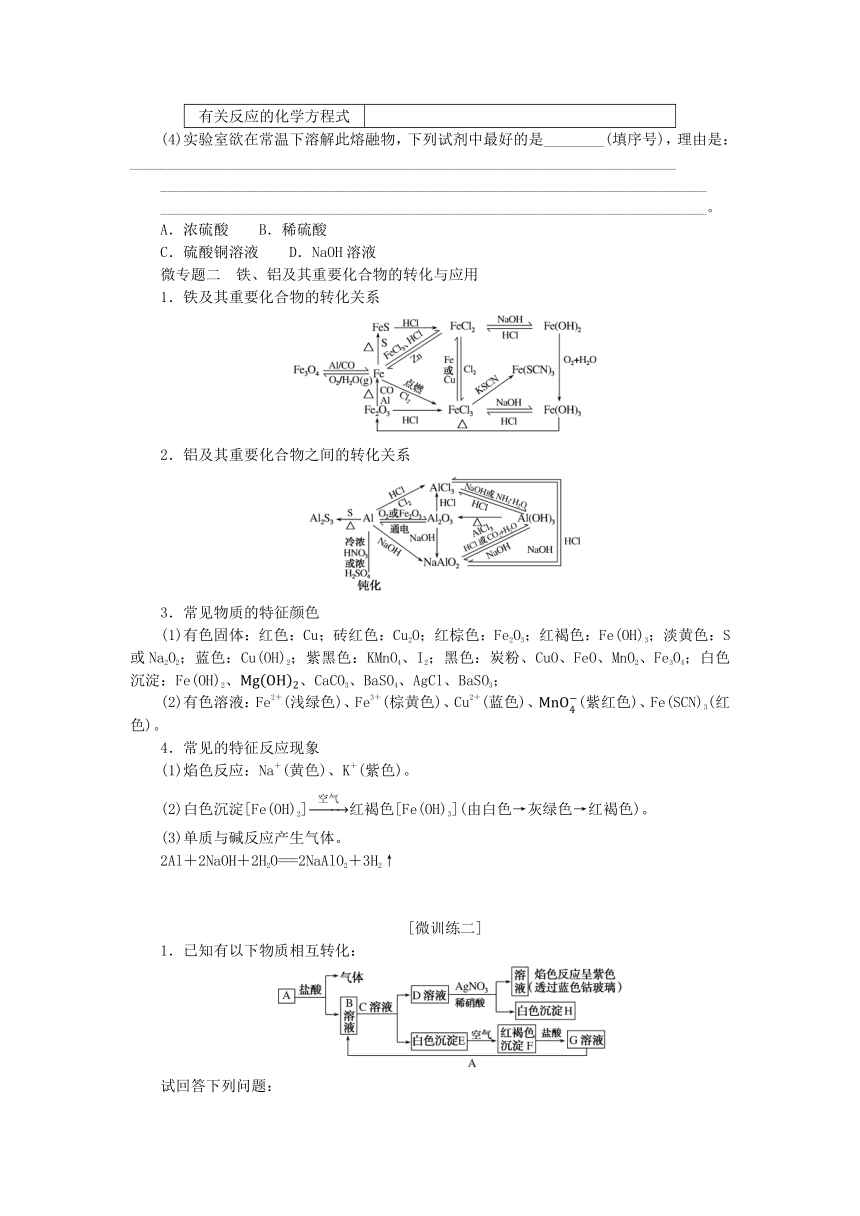
专题9 专题共享
微专题一 金属的冶炼
1.金属冶炼方法与金属活动性的关系
金属的活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属原子失电子能力 强→弱
金属离子得电子能力 弱→强
自然界中的存在形态 化合态 多数是化合态、 极少数是游离态 游离态
主要冶炼方法 电解法 高温 还原法 热分 解法 物理 方法
2.几种常用金属冶炼方法的比较
特别提醒
炼铁时,CO来源于焦炭与空气中O2的反应,会在金属中含有碳元素,形成含碳的合金。
[微训练一]
1.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法中不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
2.下列在炼铁高炉中所发生的反应及其作用与实际不相符的是( )
3.我国古代制得的“药金”外观与金相似,常被误认为是金子。其冶炼方法是将炉甘石(ZnCO3)和赤铜矿(Cu2O)以及木炭按一定比例混合,加热至800 ℃左右,即炼出闪烁着金子般光泽的“药金”。下列有关叙述正确的是( )
①“药金”是铜锌合金 ②冶炼过程中炉甘石直接被木炭还原,有锌生成 ③用灼烧法可区分黄金和“药金” ④用稀硝酸能区别黄金和“药金” ⑤表面有黑色氧化物的是“药金”,用稀硫酸洗涤后可去掉黑色膜,但可能显示出铜红色
A.①② B.①③④⑤
C.①②③④ D.①②③④⑤
4.冶炼金属一般有下列四种方法:①焦炭法 ②水煤气(或氢气,或一氧化碳)法 ③活泼金属置换法 ④电解法。
(1)请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入表中空格:
火烧孔雀 石炼铜 湿法炼铜 铝热法炼铬 从光卤石 中炼镁
火烧孔雀石炼铜所发生反应的化学方程式(写主要的两个):________________________________________________________________________、
________________________________________________________________________。
(2)请再举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):
①________________________________________________________________________、
②________________________________________________________________________、
③________________________________________________________________________、
④________________________________________________________________________。
5.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2 054 1 535 1 462
沸点/℃ 2 467 2 980 2 750 —
(1)铝热反应方程式为_________________________________________
________________________________________________________________________。
(2)下列能与Al发生铝热反应的有________(填序号)。
A.MnO2 B.Na2O
C.MgO D.FeO
(3)某同学推测,铝热反应所得的熔融物应是铁铝合金。设计实验方案,证明所得的块状熔融物中含有金属铝。
所用试剂
实验操作及现象
有关反应的化学方程式
(4)实验室欲在常温下溶解此熔融物,下列试剂中最好的是________(填序号),理由是:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
A.浓硫酸 B.稀硫酸
C.硫酸铜溶液 D.NaOH溶液
微专题二 铁、铝及其重要化合物的转化与应用
1.铁及其重要化合物的转化关系
2.铝及其重要化合物之间的转化关系
3.常见物质的特征颜色
(1)有色固体:红色:Cu;砖红色:Cu2O;红棕色:Fe2O3;红褐色:Fe(OH)3;淡黄色:S或Na2O2;蓝色:Cu(OH)2;紫黑色:KMnO4、I2;黑色:炭粉、CuO、FeO、MnO2、Fe3O4;白色沉淀:Fe(OH)2、、CaCO3、BaSO4、AgCl、BaSO3;
(2)有色溶液:Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、(紫红色)、Fe(SCN)3(红色)。
4.常见的特征反应现象
(1)焰色反应:Na+(黄色)、K+(紫色)。
(2)白色沉淀[Fe(OH)2]红褐色[Fe(OH)3](由白色→灰绿色→红褐色)。
(3)单质与碱反应产生气体。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
[微训练二]
1.已知有以下物质相互转化:
试回答下列问题:
(1)写出B的化学式:____________,D的化学式:____________。
(2)写出由E转变成F的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式:________________________________________________________________________
________________________________________________________________________;
向G溶液中加入A的有关反应离子方程式为
________________________________________________________________________
________________________________________________________________________。
2.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图所示实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图________,写出气体甲的化学式________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________
________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是____________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式________________________,并设计实验方案验证该反应的产物________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
3.已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
(1)写出步骤③可能发生反应的离子方程式________________________________________________________________________
________________________________________________________________________
________________________________________________________________________(共有3个)。
(2)若溶液E中只有一种金属离子,则一定是________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
专题9 专题共享
微专题一
微训练一
1.解析:合金的性质与其成分金属的性质不完全相同,如硬度、强度更大,熔点更低等,A正确;因AlCl3是共价化合物,熔融时不导电,冶炼铝时应采用冰晶石(Na3AlF6)作熔剂电解熔融Al2O3的方法,B不正确;金属冶炼就是把金属阳离子还原为金属原子,C正确;越活泼的金属,其金属阳离子的氧化性越弱,越难被还原,D正确。
答案:B
2.答案:C
3.解析:ZnCO3ZnO+CO2↑,故②错误;因为“药金”是铜锌合金,故灼烧时生成CuO、ZnO且溶于稀硝酸。
答案:B
4.解析:(1)火烧孔雀石炼铜是C还原孔雀石分解得到CuO,故选①;湿法炼铜和铝热法炼铬都是利用活泼金属置换较不活泼金属,故选③;光卤石炼镁的反应为MgCl2(熔融)Mg+Cl2↑,故选④。(2)根据金属性较强金属,活泼性介于Zn~Cu之间的金属、活泼性较弱金属,分别采用电解法、高温还原法、热分解法冶炼。
答案:(1)① ③ ③ ④
CuCO3·Cu(OH)22CuO+CO2↑+H2O
C+2CuO2Cu+CO2↑
(2)①3C+2Fe2O34Fe+3CO2↑
②H2+CuOCu+H2O
③3MnO2+4Al3Mn+2Al2O3
④2NaCl(熔融)2Na+Cl2↑
5.解析:(2)根据铝的活动性比Na、Mg弱,比Mn、Fe强知,MnO2、FeO均可与Al发生铝热反应。(3)要证明所得的铁中含有单质铝,只需加入NaOH溶液,看有无气泡产生即可。(4)铝和铁遇到浓硫酸在常温下会发生钝化现象;硫酸铜溶液能够溶解两种金属,但是同时置换出单质铜;NaOH溶液不能和铁反应,只能溶解铝。
答案:(1)2Al+Fe2O32Fe+Al2O3
(2)AD
(3)氢氧化钠溶液 取适量样品置于试管中,加入NaOH溶液,有气泡产生 2Al+2NaOH+2H2O===2NaAlO2+3H2↑(其他合理答案均可)
(4)B 稀硫酸能够完全溶解此熔融物,并且不会造成环境污染
微专题二
微训练二
1.解析:解题的突破口是白色沉淀→红褐色沉淀→G溶液,即为→Fe(OH)3→FeCl3。
答案:(1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)Fe3++3SCN-===Fe(SCN)3 2Fe3++Fe===3Fe2+
2.解析:突破口1:
突破口2:
从框图可知,气体甲为CO2;由溶液1转变为白色沉淀1,白色沉淀1又能溶解在CO2水溶液中,可推断白色沉淀1为;从固体2的转化过程可知,白色沉淀2为,最终的红褐色沉淀为;由上述推断可初步确定X为含有Ca、Fe元素的碳酸盐,且其中铁元素的化合价为+2,故可推断其为CaFe(CO3)2,分解得到的固体1为CaO与FeO的混合物,应用题给数据可以进一步确认上述判断的正确性。(1)白色沉淀1中的金属元素为钙,其原子结构示意图为,气体甲为CO2。(2)X的化学式为;在惰性气流中加热至完全分解的化学反应方程式为CaFe(CO3)2CaO+FeO+2CO2↑。(3)白色沉淀2在空气中变成红褐色沉淀是因为Fe(OH)2被氧化成,反应的化学方程式为。(4)CO2气体与固体1中的FeO可能发生氧化还原反应,反应的化学方程式为2FeO+CO2Fe2O3+CO;检验产物的方法:取反应所得固体物质,加稀盐酸溶解,然后加入KSCN溶液,若溶液呈红色,说明反应产物中有Fe(Ⅲ)。将生成的气体通过灼热CuO,若黑色固体变为红色,证明生成的气体中含有CO。
答案:(1) CO2
(2)CaFe(CO3)2 CaFe(CO3)2CaO+FeO+2CO2↑
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)2FeO+CO2Fe2O3+CO 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液,若溶液显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,若黑色固体变为红色,表明产物中有CO
3.解析:(1)①步中的反应为CuO+2HCl===CuCl2+H2O、Fe2O3+6HCl===2FeCl3+3H2O,所得溶液为FeCl3、CuCl2及过量的HCl的混合溶液;步骤②得到的固体有铜、铁两种,若B是铜,根据题给的氧化性顺序可知,只有一个反应,不符合3个反应的要求,故B应是铁。(2)若溶液E中只有一种金属离子,则必然是氧化性最弱的Fe2+;若溶液E中含有两种金属离子,则为Fe2+、Cu2+。(4)根据氧化性Fe3+>Cu2+可知,腐蚀电路板的反应为2Fe3++Cu===2Fe2++Cu2+。
答案:(1)2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu、2H++Fe===Fe2++H2↑
(2)Fe2+ Fe2+、Cu2+ (3)Cu
(4)2Fe3++Cu===2Fe2++Cu2+
微专题一 金属的冶炼
1.金属冶炼方法与金属活动性的关系
金属的活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属原子失电子能力 强→弱
金属离子得电子能力 弱→强
自然界中的存在形态 化合态 多数是化合态、 极少数是游离态 游离态
主要冶炼方法 电解法 高温 还原法 热分 解法 物理 方法
2.几种常用金属冶炼方法的比较
特别提醒
炼铁时,CO来源于焦炭与空气中O2的反应,会在金属中含有碳元素,形成含碳的合金。
[微训练一]
1.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法中不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
2.下列在炼铁高炉中所发生的反应及其作用与实际不相符的是( )
3.我国古代制得的“药金”外观与金相似,常被误认为是金子。其冶炼方法是将炉甘石(ZnCO3)和赤铜矿(Cu2O)以及木炭按一定比例混合,加热至800 ℃左右,即炼出闪烁着金子般光泽的“药金”。下列有关叙述正确的是( )
①“药金”是铜锌合金 ②冶炼过程中炉甘石直接被木炭还原,有锌生成 ③用灼烧法可区分黄金和“药金” ④用稀硝酸能区别黄金和“药金” ⑤表面有黑色氧化物的是“药金”,用稀硫酸洗涤后可去掉黑色膜,但可能显示出铜红色
A.①② B.①③④⑤
C.①②③④ D.①②③④⑤
4.冶炼金属一般有下列四种方法:①焦炭法 ②水煤气(或氢气,或一氧化碳)法 ③活泼金属置换法 ④电解法。
(1)请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入表中空格:
火烧孔雀 石炼铜 湿法炼铜 铝热法炼铬 从光卤石 中炼镁
火烧孔雀石炼铜所发生反应的化学方程式(写主要的两个):________________________________________________________________________、
________________________________________________________________________。
(2)请再举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):
①________________________________________________________________________、
②________________________________________________________________________、
③________________________________________________________________________、
④________________________________________________________________________。
5.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2 054 1 535 1 462
沸点/℃ 2 467 2 980 2 750 —
(1)铝热反应方程式为_________________________________________
________________________________________________________________________。
(2)下列能与Al发生铝热反应的有________(填序号)。
A.MnO2 B.Na2O
C.MgO D.FeO
(3)某同学推测,铝热反应所得的熔融物应是铁铝合金。设计实验方案,证明所得的块状熔融物中含有金属铝。
所用试剂
实验操作及现象
有关反应的化学方程式
(4)实验室欲在常温下溶解此熔融物,下列试剂中最好的是________(填序号),理由是:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
A.浓硫酸 B.稀硫酸
C.硫酸铜溶液 D.NaOH溶液
微专题二 铁、铝及其重要化合物的转化与应用
1.铁及其重要化合物的转化关系
2.铝及其重要化合物之间的转化关系
3.常见物质的特征颜色
(1)有色固体:红色:Cu;砖红色:Cu2O;红棕色:Fe2O3;红褐色:Fe(OH)3;淡黄色:S或Na2O2;蓝色:Cu(OH)2;紫黑色:KMnO4、I2;黑色:炭粉、CuO、FeO、MnO2、Fe3O4;白色沉淀:Fe(OH)2、、CaCO3、BaSO4、AgCl、BaSO3;
(2)有色溶液:Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、(紫红色)、Fe(SCN)3(红色)。
4.常见的特征反应现象
(1)焰色反应:Na+(黄色)、K+(紫色)。
(2)白色沉淀[Fe(OH)2]红褐色[Fe(OH)3](由白色→灰绿色→红褐色)。
(3)单质与碱反应产生气体。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
[微训练二]
1.已知有以下物质相互转化:
试回答下列问题:
(1)写出B的化学式:____________,D的化学式:____________。
(2)写出由E转变成F的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式:________________________________________________________________________
________________________________________________________________________;
向G溶液中加入A的有关反应离子方程式为
________________________________________________________________________
________________________________________________________________________。
2.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图所示实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图________,写出气体甲的化学式________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________
________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是____________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式________________________,并设计实验方案验证该反应的产物________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
3.已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
(1)写出步骤③可能发生反应的离子方程式________________________________________________________________________
________________________________________________________________________
________________________________________________________________________(共有3个)。
(2)若溶液E中只有一种金属离子,则一定是________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
专题9 专题共享
微专题一
微训练一
1.解析:合金的性质与其成分金属的性质不完全相同,如硬度、强度更大,熔点更低等,A正确;因AlCl3是共价化合物,熔融时不导电,冶炼铝时应采用冰晶石(Na3AlF6)作熔剂电解熔融Al2O3的方法,B不正确;金属冶炼就是把金属阳离子还原为金属原子,C正确;越活泼的金属,其金属阳离子的氧化性越弱,越难被还原,D正确。
答案:B
2.答案:C
3.解析:ZnCO3ZnO+CO2↑,故②错误;因为“药金”是铜锌合金,故灼烧时生成CuO、ZnO且溶于稀硝酸。
答案:B
4.解析:(1)火烧孔雀石炼铜是C还原孔雀石分解得到CuO,故选①;湿法炼铜和铝热法炼铬都是利用活泼金属置换较不活泼金属,故选③;光卤石炼镁的反应为MgCl2(熔融)Mg+Cl2↑,故选④。(2)根据金属性较强金属,活泼性介于Zn~Cu之间的金属、活泼性较弱金属,分别采用电解法、高温还原法、热分解法冶炼。
答案:(1)① ③ ③ ④
CuCO3·Cu(OH)22CuO+CO2↑+H2O
C+2CuO2Cu+CO2↑
(2)①3C+2Fe2O34Fe+3CO2↑
②H2+CuOCu+H2O
③3MnO2+4Al3Mn+2Al2O3
④2NaCl(熔融)2Na+Cl2↑
5.解析:(2)根据铝的活动性比Na、Mg弱,比Mn、Fe强知,MnO2、FeO均可与Al发生铝热反应。(3)要证明所得的铁中含有单质铝,只需加入NaOH溶液,看有无气泡产生即可。(4)铝和铁遇到浓硫酸在常温下会发生钝化现象;硫酸铜溶液能够溶解两种金属,但是同时置换出单质铜;NaOH溶液不能和铁反应,只能溶解铝。
答案:(1)2Al+Fe2O32Fe+Al2O3
(2)AD
(3)氢氧化钠溶液 取适量样品置于试管中,加入NaOH溶液,有气泡产生 2Al+2NaOH+2H2O===2NaAlO2+3H2↑(其他合理答案均可)
(4)B 稀硫酸能够完全溶解此熔融物,并且不会造成环境污染
微专题二
微训练二
1.解析:解题的突破口是白色沉淀→红褐色沉淀→G溶液,即为→Fe(OH)3→FeCl3。
答案:(1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)Fe3++3SCN-===Fe(SCN)3 2Fe3++Fe===3Fe2+
2.解析:突破口1:
突破口2:
从框图可知,气体甲为CO2;由溶液1转变为白色沉淀1,白色沉淀1又能溶解在CO2水溶液中,可推断白色沉淀1为;从固体2的转化过程可知,白色沉淀2为,最终的红褐色沉淀为;由上述推断可初步确定X为含有Ca、Fe元素的碳酸盐,且其中铁元素的化合价为+2,故可推断其为CaFe(CO3)2,分解得到的固体1为CaO与FeO的混合物,应用题给数据可以进一步确认上述判断的正确性。(1)白色沉淀1中的金属元素为钙,其原子结构示意图为,气体甲为CO2。(2)X的化学式为;在惰性气流中加热至完全分解的化学反应方程式为CaFe(CO3)2CaO+FeO+2CO2↑。(3)白色沉淀2在空气中变成红褐色沉淀是因为Fe(OH)2被氧化成,反应的化学方程式为。(4)CO2气体与固体1中的FeO可能发生氧化还原反应,反应的化学方程式为2FeO+CO2Fe2O3+CO;检验产物的方法:取反应所得固体物质,加稀盐酸溶解,然后加入KSCN溶液,若溶液呈红色,说明反应产物中有Fe(Ⅲ)。将生成的气体通过灼热CuO,若黑色固体变为红色,证明生成的气体中含有CO。
答案:(1) CO2
(2)CaFe(CO3)2 CaFe(CO3)2CaO+FeO+2CO2↑
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)2FeO+CO2Fe2O3+CO 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液,若溶液显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,若黑色固体变为红色,表明产物中有CO
3.解析:(1)①步中的反应为CuO+2HCl===CuCl2+H2O、Fe2O3+6HCl===2FeCl3+3H2O,所得溶液为FeCl3、CuCl2及过量的HCl的混合溶液;步骤②得到的固体有铜、铁两种,若B是铜,根据题给的氧化性顺序可知,只有一个反应,不符合3个反应的要求,故B应是铁。(2)若溶液E中只有一种金属离子,则必然是氧化性最弱的Fe2+;若溶液E中含有两种金属离子,则为Fe2+、Cu2+。(4)根据氧化性Fe3+>Cu2+可知,腐蚀电路板的反应为2Fe3++Cu===2Fe2++Cu2+。
答案:(1)2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu、2H++Fe===Fe2++H2↑
(2)Fe2+ Fe2+、Cu2+ (3)Cu
(4)2Fe3++Cu===2Fe2++Cu2+
