北京师范大学附属实验中学2023-2024学年高二下学期期中考试化学试题(PDF版含答案)
文档属性
| 名称 | 北京师范大学附属实验中学2023-2024学年高二下学期期中考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-01 12:02:00 | ||
图片预览

文档简介
北师大实验中学 2022级高二下学期化学期中考试
班级_ 姓名_ _学号_ _成绩_
试卷说明:
1. 考试时间:90分钟;试卷分值:100分。
2. 试卷10 页,答题纸2页,共 4大张纸。
3. 请将正确的答案填写在答题纸上,在试卷上作答视为无效。
本试卷可能用到的相对原子质量:
H 1 Be 9 C 12 0 16 Na 23 Mg 24 S 32 Ca 40
第一部分 (选择题 共42 分)
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求
的一项。
1. 下列化学用语或图示表达正确的是
A. 丙烯的结构简式为C3H6
B. SO2的空间结构示意图为
C. 基态 Si原子的价层电子轨道表示式为 t4| t4
3s 3p
D. HF分子中σ键的形成示意图为
2.氯吡格雷(C16H16CINO S)可用于防治动脉硬化。下列关于该有机物的说法正确的是
A. 属于烃类
B. 可发生加成反应
C. 分子中含有3个苯环
D. 能形成分子内氢键
3. 比较下列各组物质的沸点,正确的是 氯吡格雷
A. 乙醇>丙烷 B. 异戊烷>正戊烷 C.1-丁烯>1-庚烯 D. 乙二醇>丙三醇
4. 下列有关醇类物质说法正确的是
A. 所有的醇均能溶于水
B. 乙醇可以用作提取溴水中溴单质的萃取剂
C.1-丙醇在加热的条件下能在NaOH乙醇溶液中反应生成丙烯
D. 2-甲基-2-丁醇不能被催化氧化成醛或酮
1
5.下列对于物质结构和性质的分析不.正.确.的是
A.碳的原子半径小于硅,使金刚石熔点高于晶体硅
B.邻羟基苯甲醛形成了分子内氢键,其沸点高于对羟基苯甲醛
C.氟的电负性大于氯,导致三氟乙酸的酸性强于三氯乙酸
D.卤代烃中C—X键极性较强,使卤素原子易被取代
6.下列比较正确的是
A.第一电离能:Be > B B.热稳定性:H2S > H2O
C.碱性:Al(OH)3 > Mg(OH)2 D.电负性:N > O
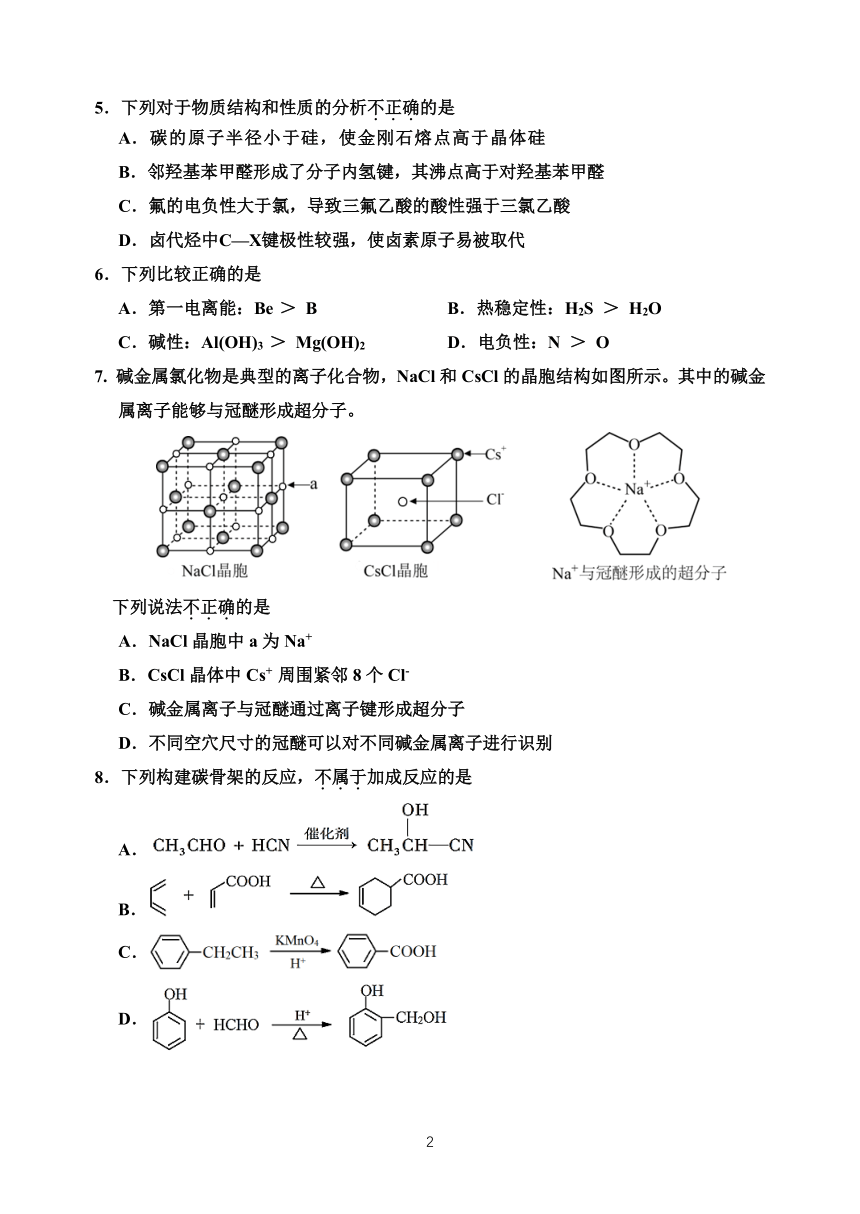
7. 碱金属氯化物是典型的离子化合物,NaCl 和 CsCl 的晶胞结构如图所示。其中的碱金
属离子能够与冠醚形成超分子。
下列说法不.正.确.的是
A.NaCl 晶胞中 a 为 Na+
B.CsCl 晶体中 Cs+ 周围紧邻 8 个 Cl-
C.碱金属离子与冠醚通过离子键形成超分子
D.不同空穴尺寸的冠醚可以对不同碱金属离子进行识别
8.下列构建碳骨架的反应,不.属.于.加成反应的是
A.
B.
C.
D.
2
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
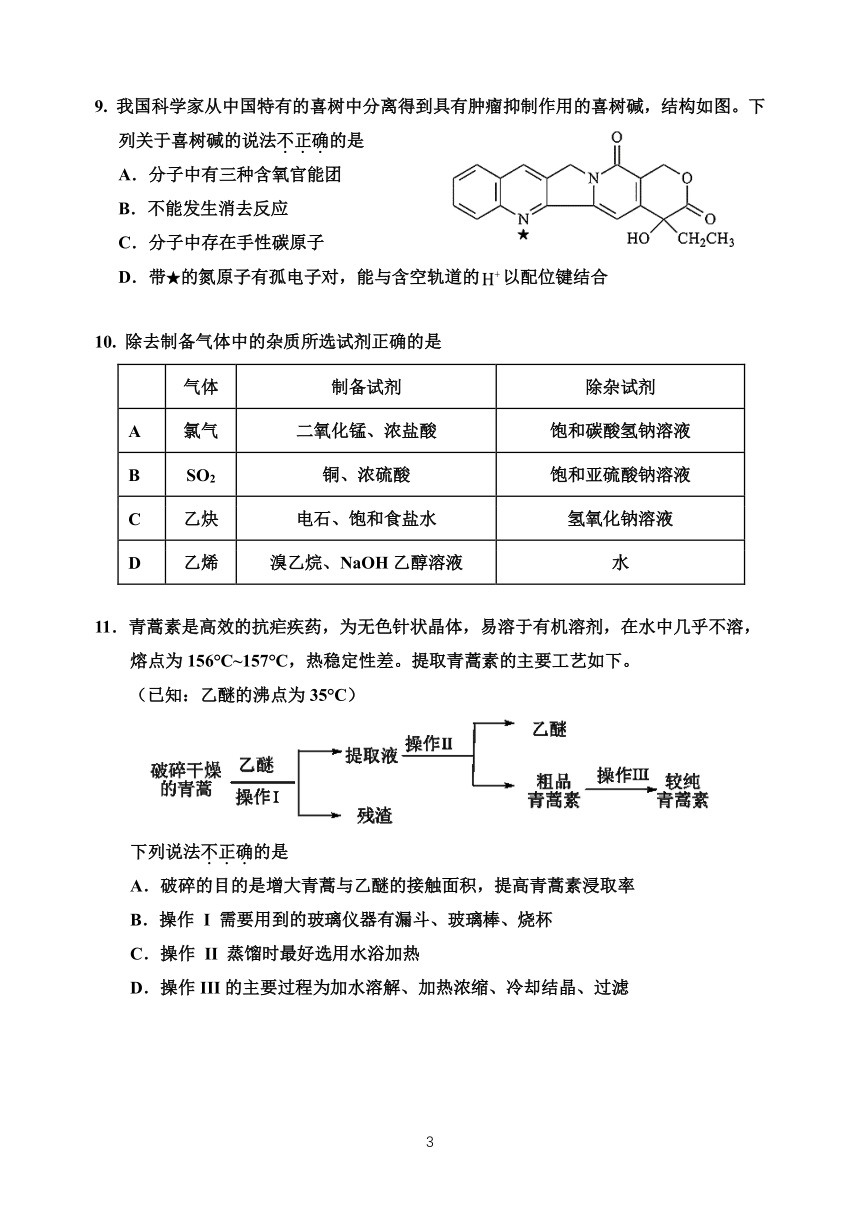
9. 我国科学家从中国特有的喜树中分离得到具有肿瘤抑制作用的喜树碱,结构如图。下
列关于喜树碱的说法不.正.确.的是
A.分子中有三种含氧官能团
B.不能发生消去反应
C.分子中存在手性碳原子
D.带★的氮原子有孤电子对,能与含空轨道的H+以配位键结合
10. 除去制备气体中的杂质所选试剂正确的是
气体 制备试剂 除杂试剂
A 氯气 二氧化锰、浓盐酸 饱和碳酸氢钠溶液
B SO2 铜、浓硫酸 饱和亚硫酸钠溶液
C 乙炔 电石、饱和食盐水 氢氧化钠溶液
D 乙烯 溴乙烷、NaOH 乙醇溶液 水
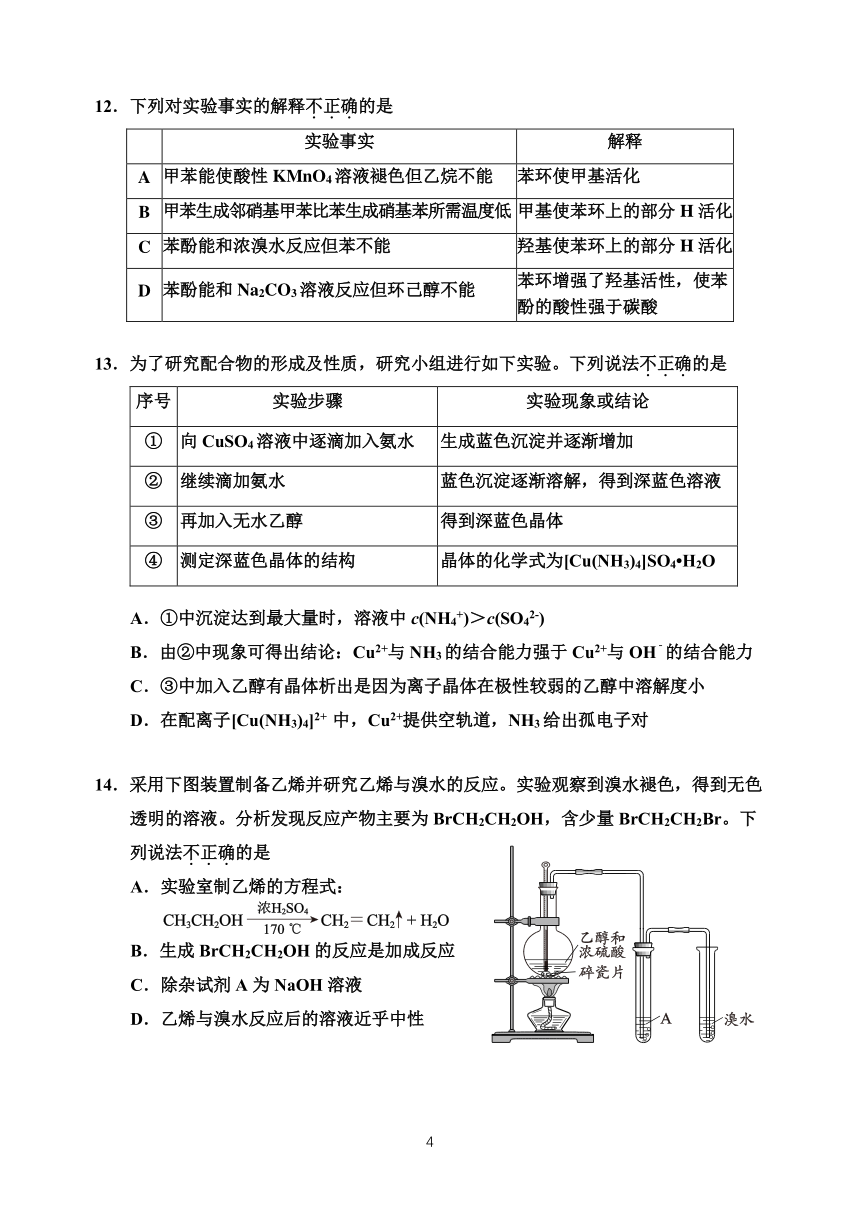
11.青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于有机溶剂,在水中几乎不溶,
熔点为 156°C~157°C,热稳定性差。提取青蒿素的主要工艺如下。
(已知:乙醚的沸点为 35°C)
下列说法不.正.确.的是
A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
B.操作 I 需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
C.操作 II 蒸馏时最好选用水浴加热
D.操作 III 的主要过程为加水溶解、加热浓缩、冷却结晶、过滤
3
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
12.下列对实验事实的解释不.正.确.的是
实验事实 解释
A 甲苯能使酸性 KMnO4溶液褪色但乙烷不能 苯环使甲基活化
B 甲苯生成邻硝基甲苯比苯生成硝基苯所需温度低 甲基使苯环上的部分 H 活化
C 苯酚能和浓溴水反应但苯不能 羟基使苯环上的部分 H 活化
苯环增强了羟基活性,使苯
D 苯酚能和 Na2CO3溶液反应但环己醇不能
酚的酸性强于碳酸
13.为了研究配合物的形成及性质,研究小组进行如下实验。下列说法不.正.确.的是
序号 实验步骤 实验现象或结论
① 向 CuSO4溶液中逐滴加入氨水 生成蓝色沉淀并逐渐增加
② 继续滴加氨水 蓝色沉淀逐渐溶解,得到深蓝色溶液
③ 再加入无水乙醇 得到深蓝色晶体
④ 测定深蓝色晶体的结构 晶体的化学式为[Cu(NH3)4]SO4 H2O
A.①中沉淀达到最大量时,溶液中 c(NH +4 )>c(SO 2-4 )
﹣
B.由②中现象可得出结论:Cu2+与 NH3的结合能力强于 Cu2+与 OH 的结合能力
C.③中加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
D.在配离子[Cu(NH 2+ 2+3)4] 中,Cu 提供空轨道,NH3 给出孤电子对
14.采用下图装置制备乙烯并研究乙烯与溴水的反应。实验观察到溴水褪色,得到无色
透明的溶液。分析发现反应产物主要为 BrCH2CH2OH,含少量 BrCH2CH2Br。下
列说法不.正.确.的是
A.实验室制乙烯的方程式:
B.生成 BrCH2CH2OH 的反应是加成反应
C.除杂试剂 A 为 NaOH 溶液
D.乙烯与溴水反应后的溶液近乎中性
4
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
第二部分 填空题 (共 58 分)
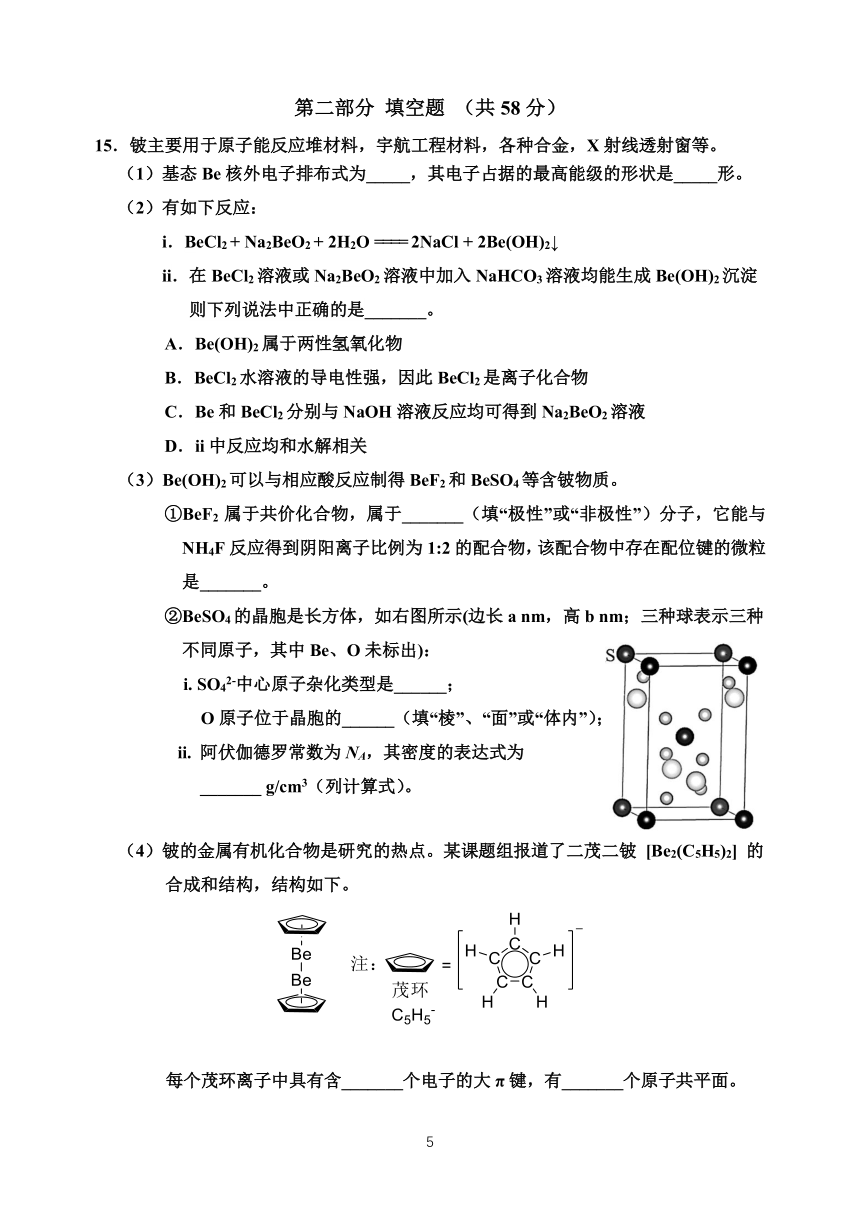
15.铍主要用于原子能反应堆材料,宇航工程材料,各种合金,X 射线透射窗等。
(1)基态 Be 核外电子排布式为_____,其电子占据的最高能级的形状是_____形。
(2)有如下反应:
i.BeCl2 + Na2BeO2 + 2H2O ==== 2NaCl + 2Be(OH)2↓
ii.在 BeCl2溶液或 Na2BeO2 溶液中加入 NaHCO3溶液均能生成 Be(OH)2沉淀
则下列说法中正确的是_______。
A.Be(OH)2属于两性氢氧化物
B.BeCl2水溶液的导电性强,因此 BeCl2是离子化合物
C.Be 和 BeCl2分别与 NaOH 溶液反应均可得到 Na2BeO2溶液
D.ii 中反应均和水解相关
(3)Be(OH)2可以与相应酸反应制得 BeF2和 BeSO4等含铍物质。
①BeF2 属于共价化合物,属于_______(填“极性”或“非极性”)分子,它能与
NH4F 反应得到阴阳离子比例为 1:2 的配合物,该配合物中存在配位键的微粒
是_______。
②BeSO4的晶胞是长方体,如右图所示(边长 a nm,高 b nm;三种球表示三种
不同原子,其中 Be、O 未标出):
i. SO 2-4 中心原子杂化类型是______;
O 原子位于晶胞的______(填“棱”、“面”或“体内”);
ii. 阿伏伽德罗常数为 NA,其密度的表达式为
_______ g/cm3(列计算式)。
(4)铍的金属有机化合物是研究的热点。某课题组报道了二茂二铍 [Be2(C5H5)2] 的
合成和结构,结构如下。
每个茂环离子中具有含_______个电子的大 π 键,有_______个原子共平面。
5
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
16.艾瑞昔布是中国具有自主知识产权的新药,具有低毒、高效的抗炎止痛作用。艾瑞
昔布的前体 J 的一种合成路线如下(部分试剂和反应条件已略去)。
(1)A 是 1,4-二甲苯,E 能发生银镜反应。
① A 的结构简式是______。
② A→B 的反应条件是______。
③ D 的结构简式是______。
(2)D→E 发生氧化反应,有多种条件可实现此转化。
① 实验室可用 O2在______条件下将 D 氧化为 E。
② 当用一定浓度的 HNO3将 D 氧化为 E,会生成副产物 X。X 的相对分子质
量比 E 的相对分子质量大 16,能与 NaHCO3溶液反应生成 CO2。则 X 的
结构简式是______。
(3)F 能使 Br2的 CCl4溶液褪色,F→G 发生取代反应。
① F 的结构简式是______。
② 不饱和碳原子上的 C-H 不易发生取代反应,但在 F→G 的反应中,F 中不
饱和碳原子上的 C-H 发生了取代反应。原因是______。
(4)G 与 M(C7H8S)在一定条件下发生反应生成 I。
① M 的结构简式是______。
② M 与 D 相对分子质量接近,但在 25℃时,D 为固体,而 M 为液体,解释
其原因:______。
6
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
17.8 羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图
是 8 羟基喹啉的合成路线。
已知:i.
ii.同一个碳原子上连有 2 个羟基的分子不稳定。
(1)B 的官能团名称是 ______。
(2)C→D 的化学方程式是 ______。
(3)E 的结构简式是 ______。
(4)F 对应的钠盐溶液可与 CO2反应,反应的化学方程式是 ______。
(5)J 的结构简式是 ______。
(6)将下列 K→L 的流程图补充完整:
(7)合成 8 羟基喹啉时,L 发生了氧化反应,反应时还生成了水。则 L 与 G 物质
的量之比为 ______。
7
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
18.苯巴比妥是一种镇静剂及安眠药。其合成路线如下图(部分试剂和产物略)。
已知:
(1)A→B 的反应类型为______反应。
(2)C→D 的化学方程式为______。
(3)试剂 X 为______(写结构简式)。
(4)E 中所含官能团的名称为______。
(5)已知苯巴比妥的分子结构中含有 2 个六元环,其结构简式为______。
(6)符合下列条件的 D 的同分异构体共有______种(不考虑立体异构)。
① 属于芳香族化合物; ②能与 FeCl3溶液显色;
③ 能发生银镜反应; ④苯环上有两个取代基
(7)乙基巴比妥也是一种常用镇静剂,将合成路线补充完整:
注:在“( )”和“□”中注明物质与条件。
8
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
19.研究溴水与苯酚溶液的反应:
向苯酚溶液中滴加浓溴水,开始时生成少量白色沉淀后立即溶解,溴水滴加到
一定量时开始出现大量白色沉淀,浓溴水过量时沉淀转变为黄色。
查阅相关资料:苯酚与溴水反应时会有以下五种物质生成:
产物 2-溴苯酚 4-溴苯酚 2,4-二溴苯酚 2,6-二溴苯酚 2,4,6-三溴苯酚
水中溶解性 微溶 微溶 不溶 不溶 不溶
CCl4中溶解性 溶 溶 溶 溶 溶
(1)写出苯酚与溴水反应生成 2,4,6-三溴苯酚的化学方程式______。
(2)进一步研究苯酚与溴的物质的量之比 α 对反应的影响。
经气相色谱分析得出,不同 α 下反应后混合体系中每种物质的物质的量百分数 n%
如下:
物质
2,4,6-三溴
n% 苯酚 X Y 4-溴苯酚 2-溴苯酚
苯酚
α
1:1 17.1 2.1 0 11.7 55.6 13.5
1:2 0 14.2 2.7 68.8 14.3 0
1:3 0 100 0 0 0 0
①X 和 Y 的核磁共振氢谱峰面积比分别为 1:2:1 和 1:1:1:1, Y 是______。
②由此实验得出结论:随 α 减小,______。
③通过此实验可推测,羟基对苯环上不同氢原子的反应活性的影响不同,具体为
______。
(3) 对于“加入过量溴水,白色沉淀转变为黄色”,猜想是因为 2,4,6-三溴苯酚吸附
了未反应的溴单质所致。为了验证该猜想,甲同学设计了如下三种方案:
a.在沉淀中加入少量的 CCl4,振荡试管后静置,如果沉淀变白,则猜想正确
b.在沉淀中加入少量 NaOH 溶液,振荡试管,如果沉淀变白,则猜想正确
c.过滤出该沉淀,低温加热一段时间,如果沉淀颜色变浅或变白,则猜想正确
上述方案中明显不合理的是:______(填序号)。
经研究,最终生成的黄色固体为一种有机化合物,结构简式为 。
9
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
(4)一种对苯酚进行定量测定的方法如下:
i. 取 5 mL 含苯酚的待测液,稀释到 20 mL 后向溶液中加入过.量.的溴水充
分反应生成 。
ii. 充分反应后加热溶液一段时间除去未反应的 Br2,冷却后加入过量 KI 溶液,
充分反应生成 2,4,6-三溴苯酚和 I2。
iii. 用 c mol/L Na2S2O3 标准溶液滴定,颜色变为浅黄色时,加入几滴淀粉溶液,
继续滴定,终点时消耗 V mL 标准液。
已知:I2 + 2S2O 2- 3 ==== 2I- + S4O 2-6
①写出 ii 中加入过量 KI 溶液的离子方程式______。
②待测液苯酚的浓度为______ mg / L。
10
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
北师大实验中学2022级高二下学期化学期中考试答案
1-5 D B A D B 6-10 A C C B D 11-14 D D B D
(除标注外每空 1 分)
15.(13 分)
(1)1s22s2 ; 球; (2)AC(2 分)
(3)①非极性; NH +4 、[BeF ]2-4 (2 分);
×
② i. sp3; 体内; ii. ;(2 分) (4)6; 10
×
16.(11 分)
(1)① ; ② 光照; ③ ; (2)①Cu,△;
(3)① ;
②受硝基的吸电子作用影响,与硝基相连的不饱和碳原子上的C-H的极性增强,
易断裂(2 分)
(4)① ;
②两者都为分子,相对分子质量接近,但相比于 M,D 分子中含有羟基,还能
形成分子间氢键,氢键作用大于范德华力,所以 D 的熔点比 M 的高。(2 分)
17.(11 分)
(1)碳碳双键、碳氯键(或氯原子)(2 分)
H2O
(2)ClCH2CHClCH2Cl + 3 NaOH CH2(OH)CH(OH)CH2OH + 3NaCl△
(2 分)
(3)CH2=CHCHO(2 分) (4)
(5) (6) (7)3∶1
1
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
18.(11 分)
(1)取代
浓H2SO4
(2) CH2COOH + CH3CH2OH CH2COOCH2CH3 + H2O(2 分)
(3)CH3CH2Br (4)酯基
O
CH3CH2 C NH
C C O
(5) C NH (2 分) (6)15
O
(7)
(3 分)
19.(12 分)
(1)
(2)① 2,4-二溴苯酚
② 生成一溴代物逐渐减少,生成三溴代物逐渐增多,生成的二溴代物先增多后
减少,当 1:3 时,全部生成三溴代物。(合理均可)(2 分)
③活化程度最大的是羟基对位的氢原子,然后是邻位;而间位的氢被钝化(不
参与反应)(2 分)
(3)a b(2 分)
(4)① (2 分)
② 9400cV(2 分)
2
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
班级_ 姓名_ _学号_ _成绩_
试卷说明:
1. 考试时间:90分钟;试卷分值:100分。
2. 试卷10 页,答题纸2页,共 4大张纸。
3. 请将正确的答案填写在答题纸上,在试卷上作答视为无效。
本试卷可能用到的相对原子质量:
H 1 Be 9 C 12 0 16 Na 23 Mg 24 S 32 Ca 40
第一部分 (选择题 共42 分)
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求
的一项。
1. 下列化学用语或图示表达正确的是
A. 丙烯的结构简式为C3H6
B. SO2的空间结构示意图为
C. 基态 Si原子的价层电子轨道表示式为 t4| t4
3s 3p
D. HF分子中σ键的形成示意图为
2.氯吡格雷(C16H16CINO S)可用于防治动脉硬化。下列关于该有机物的说法正确的是
A. 属于烃类
B. 可发生加成反应
C. 分子中含有3个苯环
D. 能形成分子内氢键
3. 比较下列各组物质的沸点,正确的是 氯吡格雷
A. 乙醇>丙烷 B. 异戊烷>正戊烷 C.1-丁烯>1-庚烯 D. 乙二醇>丙三醇
4. 下列有关醇类物质说法正确的是
A. 所有的醇均能溶于水
B. 乙醇可以用作提取溴水中溴单质的萃取剂
C.1-丙醇在加热的条件下能在NaOH乙醇溶液中反应生成丙烯
D. 2-甲基-2-丁醇不能被催化氧化成醛或酮
1
5.下列对于物质结构和性质的分析不.正.确.的是
A.碳的原子半径小于硅,使金刚石熔点高于晶体硅
B.邻羟基苯甲醛形成了分子内氢键,其沸点高于对羟基苯甲醛
C.氟的电负性大于氯,导致三氟乙酸的酸性强于三氯乙酸
D.卤代烃中C—X键极性较强,使卤素原子易被取代
6.下列比较正确的是
A.第一电离能:Be > B B.热稳定性:H2S > H2O
C.碱性:Al(OH)3 > Mg(OH)2 D.电负性:N > O
7. 碱金属氯化物是典型的离子化合物,NaCl 和 CsCl 的晶胞结构如图所示。其中的碱金
属离子能够与冠醚形成超分子。
下列说法不.正.确.的是
A.NaCl 晶胞中 a 为 Na+
B.CsCl 晶体中 Cs+ 周围紧邻 8 个 Cl-
C.碱金属离子与冠醚通过离子键形成超分子
D.不同空穴尺寸的冠醚可以对不同碱金属离子进行识别
8.下列构建碳骨架的反应,不.属.于.加成反应的是
A.
B.
C.
D.
2
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
9. 我国科学家从中国特有的喜树中分离得到具有肿瘤抑制作用的喜树碱,结构如图。下
列关于喜树碱的说法不.正.确.的是
A.分子中有三种含氧官能团
B.不能发生消去反应
C.分子中存在手性碳原子
D.带★的氮原子有孤电子对,能与含空轨道的H+以配位键结合
10. 除去制备气体中的杂质所选试剂正确的是
气体 制备试剂 除杂试剂
A 氯气 二氧化锰、浓盐酸 饱和碳酸氢钠溶液
B SO2 铜、浓硫酸 饱和亚硫酸钠溶液
C 乙炔 电石、饱和食盐水 氢氧化钠溶液
D 乙烯 溴乙烷、NaOH 乙醇溶液 水
11.青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于有机溶剂,在水中几乎不溶,
熔点为 156°C~157°C,热稳定性差。提取青蒿素的主要工艺如下。
(已知:乙醚的沸点为 35°C)
下列说法不.正.确.的是
A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
B.操作 I 需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
C.操作 II 蒸馏时最好选用水浴加热
D.操作 III 的主要过程为加水溶解、加热浓缩、冷却结晶、过滤
3
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
12.下列对实验事实的解释不.正.确.的是
实验事实 解释
A 甲苯能使酸性 KMnO4溶液褪色但乙烷不能 苯环使甲基活化
B 甲苯生成邻硝基甲苯比苯生成硝基苯所需温度低 甲基使苯环上的部分 H 活化
C 苯酚能和浓溴水反应但苯不能 羟基使苯环上的部分 H 活化
苯环增强了羟基活性,使苯
D 苯酚能和 Na2CO3溶液反应但环己醇不能
酚的酸性强于碳酸
13.为了研究配合物的形成及性质,研究小组进行如下实验。下列说法不.正.确.的是
序号 实验步骤 实验现象或结论
① 向 CuSO4溶液中逐滴加入氨水 生成蓝色沉淀并逐渐增加
② 继续滴加氨水 蓝色沉淀逐渐溶解,得到深蓝色溶液
③ 再加入无水乙醇 得到深蓝色晶体
④ 测定深蓝色晶体的结构 晶体的化学式为[Cu(NH3)4]SO4 H2O
A.①中沉淀达到最大量时,溶液中 c(NH +4 )>c(SO 2-4 )
﹣
B.由②中现象可得出结论:Cu2+与 NH3的结合能力强于 Cu2+与 OH 的结合能力
C.③中加入乙醇有晶体析出是因为离子晶体在极性较弱的乙醇中溶解度小
D.在配离子[Cu(NH 2+ 2+3)4] 中,Cu 提供空轨道,NH3 给出孤电子对
14.采用下图装置制备乙烯并研究乙烯与溴水的反应。实验观察到溴水褪色,得到无色
透明的溶液。分析发现反应产物主要为 BrCH2CH2OH,含少量 BrCH2CH2Br。下
列说法不.正.确.的是
A.实验室制乙烯的方程式:
B.生成 BrCH2CH2OH 的反应是加成反应
C.除杂试剂 A 为 NaOH 溶液
D.乙烯与溴水反应后的溶液近乎中性
4
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
第二部分 填空题 (共 58 分)
15.铍主要用于原子能反应堆材料,宇航工程材料,各种合金,X 射线透射窗等。
(1)基态 Be 核外电子排布式为_____,其电子占据的最高能级的形状是_____形。
(2)有如下反应:
i.BeCl2 + Na2BeO2 + 2H2O ==== 2NaCl + 2Be(OH)2↓
ii.在 BeCl2溶液或 Na2BeO2 溶液中加入 NaHCO3溶液均能生成 Be(OH)2沉淀
则下列说法中正确的是_______。
A.Be(OH)2属于两性氢氧化物
B.BeCl2水溶液的导电性强,因此 BeCl2是离子化合物
C.Be 和 BeCl2分别与 NaOH 溶液反应均可得到 Na2BeO2溶液
D.ii 中反应均和水解相关
(3)Be(OH)2可以与相应酸反应制得 BeF2和 BeSO4等含铍物质。
①BeF2 属于共价化合物,属于_______(填“极性”或“非极性”)分子,它能与
NH4F 反应得到阴阳离子比例为 1:2 的配合物,该配合物中存在配位键的微粒
是_______。
②BeSO4的晶胞是长方体,如右图所示(边长 a nm,高 b nm;三种球表示三种
不同原子,其中 Be、O 未标出):
i. SO 2-4 中心原子杂化类型是______;
O 原子位于晶胞的______(填“棱”、“面”或“体内”);
ii. 阿伏伽德罗常数为 NA,其密度的表达式为
_______ g/cm3(列计算式)。
(4)铍的金属有机化合物是研究的热点。某课题组报道了二茂二铍 [Be2(C5H5)2] 的
合成和结构,结构如下。
每个茂环离子中具有含_______个电子的大 π 键,有_______个原子共平面。
5
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
16.艾瑞昔布是中国具有自主知识产权的新药,具有低毒、高效的抗炎止痛作用。艾瑞
昔布的前体 J 的一种合成路线如下(部分试剂和反应条件已略去)。
(1)A 是 1,4-二甲苯,E 能发生银镜反应。
① A 的结构简式是______。
② A→B 的反应条件是______。
③ D 的结构简式是______。
(2)D→E 发生氧化反应,有多种条件可实现此转化。
① 实验室可用 O2在______条件下将 D 氧化为 E。
② 当用一定浓度的 HNO3将 D 氧化为 E,会生成副产物 X。X 的相对分子质
量比 E 的相对分子质量大 16,能与 NaHCO3溶液反应生成 CO2。则 X 的
结构简式是______。
(3)F 能使 Br2的 CCl4溶液褪色,F→G 发生取代反应。
① F 的结构简式是______。
② 不饱和碳原子上的 C-H 不易发生取代反应,但在 F→G 的反应中,F 中不
饱和碳原子上的 C-H 发生了取代反应。原因是______。
(4)G 与 M(C7H8S)在一定条件下发生反应生成 I。
① M 的结构简式是______。
② M 与 D 相对分子质量接近,但在 25℃时,D 为固体,而 M 为液体,解释
其原因:______。
6
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
17.8 羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图
是 8 羟基喹啉的合成路线。
已知:i.
ii.同一个碳原子上连有 2 个羟基的分子不稳定。
(1)B 的官能团名称是 ______。
(2)C→D 的化学方程式是 ______。
(3)E 的结构简式是 ______。
(4)F 对应的钠盐溶液可与 CO2反应,反应的化学方程式是 ______。
(5)J 的结构简式是 ______。
(6)将下列 K→L 的流程图补充完整:
(7)合成 8 羟基喹啉时,L 发生了氧化反应,反应时还生成了水。则 L 与 G 物质
的量之比为 ______。
7
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
18.苯巴比妥是一种镇静剂及安眠药。其合成路线如下图(部分试剂和产物略)。
已知:
(1)A→B 的反应类型为______反应。
(2)C→D 的化学方程式为______。
(3)试剂 X 为______(写结构简式)。
(4)E 中所含官能团的名称为______。
(5)已知苯巴比妥的分子结构中含有 2 个六元环,其结构简式为______。
(6)符合下列条件的 D 的同分异构体共有______种(不考虑立体异构)。
① 属于芳香族化合物; ②能与 FeCl3溶液显色;
③ 能发生银镜反应; ④苯环上有两个取代基
(7)乙基巴比妥也是一种常用镇静剂,将合成路线补充完整:
注:在“( )”和“□”中注明物质与条件。
8
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
19.研究溴水与苯酚溶液的反应:
向苯酚溶液中滴加浓溴水,开始时生成少量白色沉淀后立即溶解,溴水滴加到
一定量时开始出现大量白色沉淀,浓溴水过量时沉淀转变为黄色。
查阅相关资料:苯酚与溴水反应时会有以下五种物质生成:
产物 2-溴苯酚 4-溴苯酚 2,4-二溴苯酚 2,6-二溴苯酚 2,4,6-三溴苯酚
水中溶解性 微溶 微溶 不溶 不溶 不溶
CCl4中溶解性 溶 溶 溶 溶 溶
(1)写出苯酚与溴水反应生成 2,4,6-三溴苯酚的化学方程式______。
(2)进一步研究苯酚与溴的物质的量之比 α 对反应的影响。
经气相色谱分析得出,不同 α 下反应后混合体系中每种物质的物质的量百分数 n%
如下:
物质
2,4,6-三溴
n% 苯酚 X Y 4-溴苯酚 2-溴苯酚
苯酚
α
1:1 17.1 2.1 0 11.7 55.6 13.5
1:2 0 14.2 2.7 68.8 14.3 0
1:3 0 100 0 0 0 0
①X 和 Y 的核磁共振氢谱峰面积比分别为 1:2:1 和 1:1:1:1, Y 是______。
②由此实验得出结论:随 α 减小,______。
③通过此实验可推测,羟基对苯环上不同氢原子的反应活性的影响不同,具体为
______。
(3) 对于“加入过量溴水,白色沉淀转变为黄色”,猜想是因为 2,4,6-三溴苯酚吸附
了未反应的溴单质所致。为了验证该猜想,甲同学设计了如下三种方案:
a.在沉淀中加入少量的 CCl4,振荡试管后静置,如果沉淀变白,则猜想正确
b.在沉淀中加入少量 NaOH 溶液,振荡试管,如果沉淀变白,则猜想正确
c.过滤出该沉淀,低温加热一段时间,如果沉淀颜色变浅或变白,则猜想正确
上述方案中明显不合理的是:______(填序号)。
经研究,最终生成的黄色固体为一种有机化合物,结构简式为 。
9
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
(4)一种对苯酚进行定量测定的方法如下:
i. 取 5 mL 含苯酚的待测液,稀释到 20 mL 后向溶液中加入过.量.的溴水充
分反应生成 。
ii. 充分反应后加热溶液一段时间除去未反应的 Br2,冷却后加入过量 KI 溶液,
充分反应生成 2,4,6-三溴苯酚和 I2。
iii. 用 c mol/L Na2S2O3 标准溶液滴定,颜色变为浅黄色时,加入几滴淀粉溶液,
继续滴定,终点时消耗 V mL 标准液。
已知:I2 + 2S2O 2- 3 ==== 2I- + S4O 2-6
①写出 ii 中加入过量 KI 溶液的离子方程式______。
②待测液苯酚的浓度为______ mg / L。
10
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
北师大实验中学2022级高二下学期化学期中考试答案
1-5 D B A D B 6-10 A C C B D 11-14 D D B D
(除标注外每空 1 分)
15.(13 分)
(1)1s22s2 ; 球; (2)AC(2 分)
(3)①非极性; NH +4 、[BeF ]2-4 (2 分);
×
② i. sp3; 体内; ii. ;(2 分) (4)6; 10
×
16.(11 分)
(1)① ; ② 光照; ③ ; (2)①Cu,△;
(3)① ;
②受硝基的吸电子作用影响,与硝基相连的不饱和碳原子上的C-H的极性增强,
易断裂(2 分)
(4)① ;
②两者都为分子,相对分子质量接近,但相比于 M,D 分子中含有羟基,还能
形成分子间氢键,氢键作用大于范德华力,所以 D 的熔点比 M 的高。(2 分)
17.(11 分)
(1)碳碳双键、碳氯键(或氯原子)(2 分)
H2O
(2)ClCH2CHClCH2Cl + 3 NaOH CH2(OH)CH(OH)CH2OH + 3NaCl△
(2 分)
(3)CH2=CHCHO(2 分) (4)
(5) (6) (7)3∶1
1
{#{QQABKIYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
18.(11 分)
(1)取代
浓H2SO4
(2) CH2COOH + CH3CH2OH CH2COOCH2CH3 + H2O(2 分)
(3)CH3CH2Br (4)酯基
O
CH3CH2 C NH
C C O
(5) C NH (2 分) (6)15
O
(7)
(3 分)
19.(12 分)
(1)
(2)① 2,4-二溴苯酚
② 生成一溴代物逐渐减少,生成三溴代物逐渐增多,生成的二溴代物先增多后
减少,当 1:3 时,全部生成三溴代物。(合理均可)(2 分)
③活化程度最大的是羟基对位的氢原子,然后是邻位;而间位的氢被钝化(不
参与反应)(2 分)
(3)a b(2 分)
(4)① (2 分)
② 9400cV(2 分)
2
{#{QQABIKYYitgxEgigwgwCpASQApCAbA4ArARUh0CwACQQlAgCQAsAJIQhLkAIoEMARARACoOuhAQAIKsCAABAFIiABFKAB=C}#A} =}#}
同课章节目录
