九年级化学上册(鲁教版)同步教学课件3.2 溶液组成的定量表示(共31张PPT)
文档属性
| 名称 | 九年级化学上册(鲁教版)同步教学课件3.2 溶液组成的定量表示(共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-13 00:00:00 | ||
图片预览










文档简介
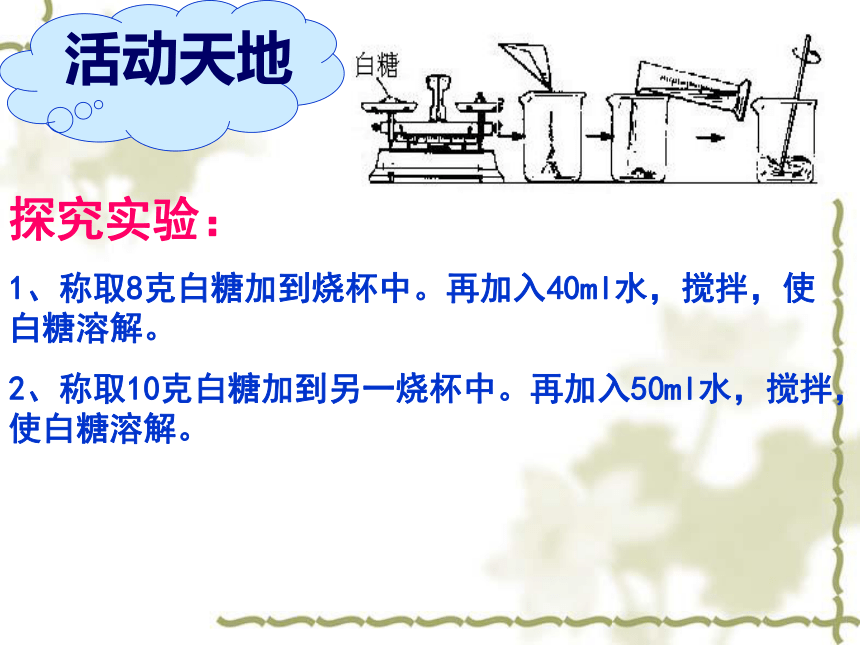
课件31张PPT。溶液组成的定量表示活动天地探究实验:
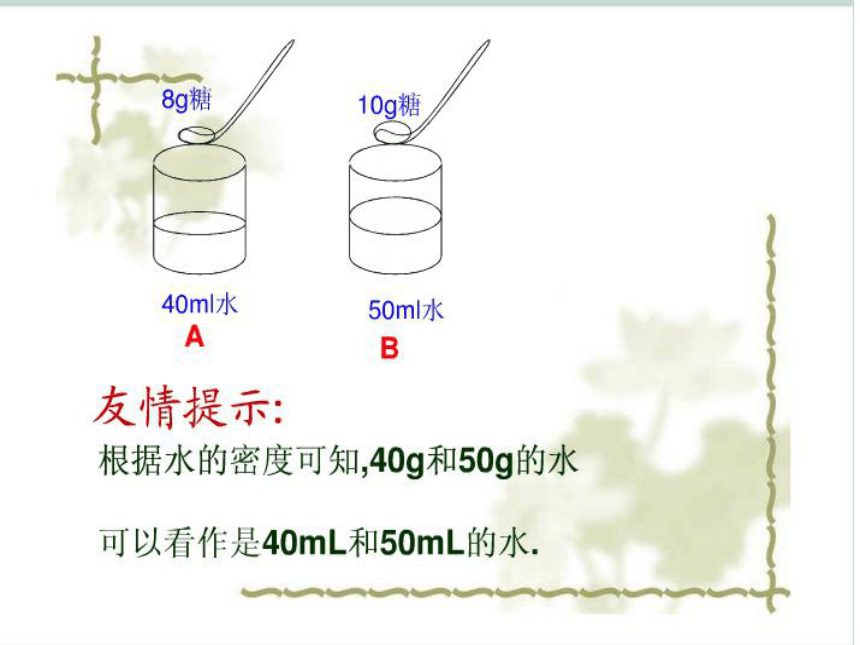
1、称取8克白糖加到烧杯中。再加入40ml水,搅拌,使白糖溶解。
2、称取10克白糖加到另一烧杯中。再加入50ml水,搅拌,使白糖溶解。
问题探究:
1、实验1、2所得两种糖水,哪种更甜?你的根据是什么?
2、如果你的结论是通过计算获得的,你列出的算式是怎样的?溶质质量分数的相关计算
(一)配制一定质量、一定溶质质量分数溶液的计算:
这类计算主要是公式及其变型的应用.
溶质质量分数= ×100%
溶质质量=溶液质量×溶质质量分数
溶剂质量=溶液质量-溶质质量例1、将50克氯化钠溶液蒸干,得12克氯化钠固体,试确定原溶液中氯化钠的质量分数。 解:氯化钠是溶质,溶液为50克,
氯化钠溶液的质量分数 (p%)=M质 M液1250×100%
=答:这种氯化钠溶液中氯化钠的质量分数为24%。 =24%×100%
有关混合的题目例2、30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
解:溶质的质量为
30%×100g+10%×100g=40g
溶质的质量分数为×100%=20%答:所得溶液的溶质的质量分数为20%。创新思维变式 农业上常用16%的氯化钠溶液来选种,现有24千克固体氯化钠能配制多少千克这种氯化钠溶液?同时需要水多少千克?
解:氯化钠溶液的质量分数(p%)=M质M液×100%
所以M液=M质p%=24Kg16%=150Kg所加水为
150Kg-24Kg
=126Kg
答:配制150千克这种氯化钠溶液,同时需要水126千克。(二)溶液稀释 增浓的计算
1.溶液稀释的计算
溶液的稀释方法有很多,最简单的是加水稀释.加入水之后,溶剂质量增加了,溶液质量也增大了,但溶质质量不变,这是我们进行这类计算的关键所在.溶液稀释的计算
[例3]化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液,要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?解:设需要水的质量为x
则 (50 g+x)×20%=50 g×98%
50 g+x=
x=245 g-50 g
x=195 g
答:需加水195 g溶液增浓的计算 例4 有100 g 10%的NaCl溶液,要使其浓度增大一倍,(1)需加入多少克氯化钠?(2)需蒸发掉多少水?
分析:
溶质质量 溶液质量 溶质质量分数
加NaCl前 100 g×10%=10 g 100 g 10%
加NaCl后 10 g+x 100 g+x 20%
解:(1)设加入NaCl质量为x,则
×100%=20%
解得: x=12.5 g
答:需加入NaCl 12.5 g
(2)解:设蒸发掉y克水
×100%=20% 解得 y=50g答:需蒸发掉50g水。与密度有关的题型例5.某工厂化验室配制5000 g 20%的盐酸,需要38%的盐酸(密度是1.19 g/cm3)多少毫升?
指导建议:此题仍然是溶液稀释问题,只是所求不是加入的水质量,而是母液的体积.母液的体积最好通过这个公式来解决,所以应先求出母液的质量 解:设需38%的盐酸质量为x
x·38%=5000 g×20%
x =
=2631.6 g
所以V(HCl)=
=2211.4毫升例6、配制500 mL质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3).需要氢氧化钠和水各多少克?
指导建议:先将体积换成质量,再进行计算.解:500 mL×1.1 g/cm3=550 g,则
m(NaOH)=550×10=55 g
m(H2O)=550-55=495 g
答:需氢氧化钠55 g,需水495 g.实际应用 冬天,人们可在皮肤上擦甘油溶液,使皮肤保持湿润。当甘油溶液中溶质的质量分数为80%时护肤效果最佳。欲配制50g这种甘油溶液,需甘油的质量是多少?水的质量是多少?解:溶质的质量=50×80%
=40g
所需水为50-40=10g
答:所需甘油40g,水10g。白酒、盐酸、硫酸等都是采用体积分数来表示溶液的组成。
生理盐水、食醋等是采用质量分数来表示溶液的组成。达标测试1、把一杯食盐水倒出一部分,没有改变的是( )
A 溶质的质量 B 溶剂的质量
C 溶液的质量 D 溶质的质量分数
2、家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( )
A 100克醋酸中含醋为10克
B 100克醋酸的水溶液中含醋酸10克
C 100克水中含醋酸为10克
D 100克醋酸的水溶液中含水10克
DB3、在餐桌上,当我们发现某种汤太咸时,通常做法是向汤中加( )。在这个过程中,一定改变的是( ),一定不变的是( )。
A 水的质量 B 汤的质量
C 盐的质量 D 盐的质量分数 ABDC你学到了什么 1、可用溶质的质量分数定量表示溶液的组成。溶液的质量2、3、有关溶质的质量分数的简单运算。
1、称取8克白糖加到烧杯中。再加入40ml水,搅拌,使白糖溶解。
2、称取10克白糖加到另一烧杯中。再加入50ml水,搅拌,使白糖溶解。
问题探究:
1、实验1、2所得两种糖水,哪种更甜?你的根据是什么?
2、如果你的结论是通过计算获得的,你列出的算式是怎样的?溶质质量分数的相关计算
(一)配制一定质量、一定溶质质量分数溶液的计算:
这类计算主要是公式及其变型的应用.
溶质质量分数= ×100%
溶质质量=溶液质量×溶质质量分数
溶剂质量=溶液质量-溶质质量例1、将50克氯化钠溶液蒸干,得12克氯化钠固体,试确定原溶液中氯化钠的质量分数。 解:氯化钠是溶质,溶液为50克,
氯化钠溶液的质量分数 (p%)=M质 M液1250×100%
=答:这种氯化钠溶液中氯化钠的质量分数为24%。 =24%×100%
有关混合的题目例2、30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
解:溶质的质量为
30%×100g+10%×100g=40g
溶质的质量分数为×100%=20%答:所得溶液的溶质的质量分数为20%。创新思维变式 农业上常用16%的氯化钠溶液来选种,现有24千克固体氯化钠能配制多少千克这种氯化钠溶液?同时需要水多少千克?
解:氯化钠溶液的质量分数(p%)=M质M液×100%
所以M液=M质p%=24Kg16%=150Kg所加水为
150Kg-24Kg
=126Kg
答:配制150千克这种氯化钠溶液,同时需要水126千克。(二)溶液稀释 增浓的计算
1.溶液稀释的计算
溶液的稀释方法有很多,最简单的是加水稀释.加入水之后,溶剂质量增加了,溶液质量也增大了,但溶质质量不变,这是我们进行这类计算的关键所在.溶液稀释的计算
[例3]化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液,要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?解:设需要水的质量为x
则 (50 g+x)×20%=50 g×98%
50 g+x=
x=245 g-50 g
x=195 g
答:需加水195 g溶液增浓的计算 例4 有100 g 10%的NaCl溶液,要使其浓度增大一倍,(1)需加入多少克氯化钠?(2)需蒸发掉多少水?
分析:
溶质质量 溶液质量 溶质质量分数
加NaCl前 100 g×10%=10 g 100 g 10%
加NaCl后 10 g+x 100 g+x 20%
解:(1)设加入NaCl质量为x,则
×100%=20%
解得: x=12.5 g
答:需加入NaCl 12.5 g
(2)解:设蒸发掉y克水
×100%=20% 解得 y=50g答:需蒸发掉50g水。与密度有关的题型例5.某工厂化验室配制5000 g 20%的盐酸,需要38%的盐酸(密度是1.19 g/cm3)多少毫升?
指导建议:此题仍然是溶液稀释问题,只是所求不是加入的水质量,而是母液的体积.母液的体积最好通过这个公式来解决,所以应先求出母液的质量 解:设需38%的盐酸质量为x
x·38%=5000 g×20%
x =
=2631.6 g
所以V(HCl)=
=2211.4毫升例6、配制500 mL质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3).需要氢氧化钠和水各多少克?
指导建议:先将体积换成质量,再进行计算.解:500 mL×1.1 g/cm3=550 g,则
m(NaOH)=550×10=55 g
m(H2O)=550-55=495 g
答:需氢氧化钠55 g,需水495 g.实际应用 冬天,人们可在皮肤上擦甘油溶液,使皮肤保持湿润。当甘油溶液中溶质的质量分数为80%时护肤效果最佳。欲配制50g这种甘油溶液,需甘油的质量是多少?水的质量是多少?解:溶质的质量=50×80%
=40g
所需水为50-40=10g
答:所需甘油40g,水10g。白酒、盐酸、硫酸等都是采用体积分数来表示溶液的组成。
生理盐水、食醋等是采用质量分数来表示溶液的组成。达标测试1、把一杯食盐水倒出一部分,没有改变的是( )
A 溶质的质量 B 溶剂的质量
C 溶液的质量 D 溶质的质量分数
2、家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( )
A 100克醋酸中含醋为10克
B 100克醋酸的水溶液中含醋酸10克
C 100克水中含醋酸为10克
D 100克醋酸的水溶液中含水10克
DB3、在餐桌上,当我们发现某种汤太咸时,通常做法是向汤中加( )。在这个过程中,一定改变的是( ),一定不变的是( )。
A 水的质量 B 汤的质量
C 盐的质量 D 盐的质量分数 ABDC你学到了什么 1、可用溶质的质量分数定量表示溶液的组成。溶液的质量2、3、有关溶质的质量分数的简单运算。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
