广东省深圳市高级中学2015-2016学年高二上学期期中考试化学试题
文档属性
| 名称 | 广东省深圳市高级中学2015-2016学年高二上学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 410.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-15 08:59:44 | ||
图片预览




文档简介
深圳高级中学2015-2016学年第一学期期中考试
高二化学
命题人:黄晓燕 ; 审题人:吴云
本试卷由二部分组成。第一部分:高考基础知 ( http: / / www.21cnjy.com )识与能力部分(占43分);第二部分:本学期知识内容(占57分),全卷共计100分,考试时间为90分钟
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 Cu-64 C-12 Cl-35.5 l-127 N-14
注意事项:
答第I卷前,考试务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动用橡皮擦干净后再涂其他答案,不能答在试卷上。
考试结束,监考人员将答题卡收回。
第一部分:高考基础知识与能力部分(占43分)
一.选择题:(每小题只有一个选项,每小题3分,共计15分)
1、化学与生活、社会密切相关,下列说法不正确的是
A.通信光缆的主要成分是SiO2 ,太阳能电池的材料主要是晶体Si
B.K2FeO4能与水作用生成Fe(OH)3 胶体和O2 ,可用于净化自来水并杀菌消毒
C.由于NaHCO3能与碱反应,所以常用作焙制糕点的膨松剂
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂
2、下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 操作 现象 结论
A 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 试纸变蓝色 NO2为酸性气体
B 将过量的CO2通入CaCl2溶液中 产生白色沉淀 酸性:HCl>H2CO3
C 向等浓度的KCl、KI混合液中滴加AgNO3溶液 先出现黄色沉淀 Ksp(AgCl)> Ksp(AgI)
D 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质
3、设表示阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4L SO3中含有的分子数为NA个
B.室温下,48.0g氧气和臭氧的混合气体中含有的原子数目为3NA
C.过氧化钠与水充分反应生成0.1mol氧气转移的电子数为0.4NA
D. 0.1mol L-1的CuCl2溶液中含有0.2NA个Cl―
4、在固态金属氧化物电解池中,高温共电解H ( http: / / www.21cnjy.com )2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ
CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
5、短周期元素X、Y、Z、W在元素周期表中的相对位置如
右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
X Y
Z W
A.最简单气态氢化物的热稳定性:Y>X>W>Z
B.最高价氧化物对应水化物的酸性:X>W>Z
C.原子半径:W>Z>Y>X
D.元素X、Z、W的最高化合价分别与其主族序数相等
二、填空题:(每小题14分,共计28分)
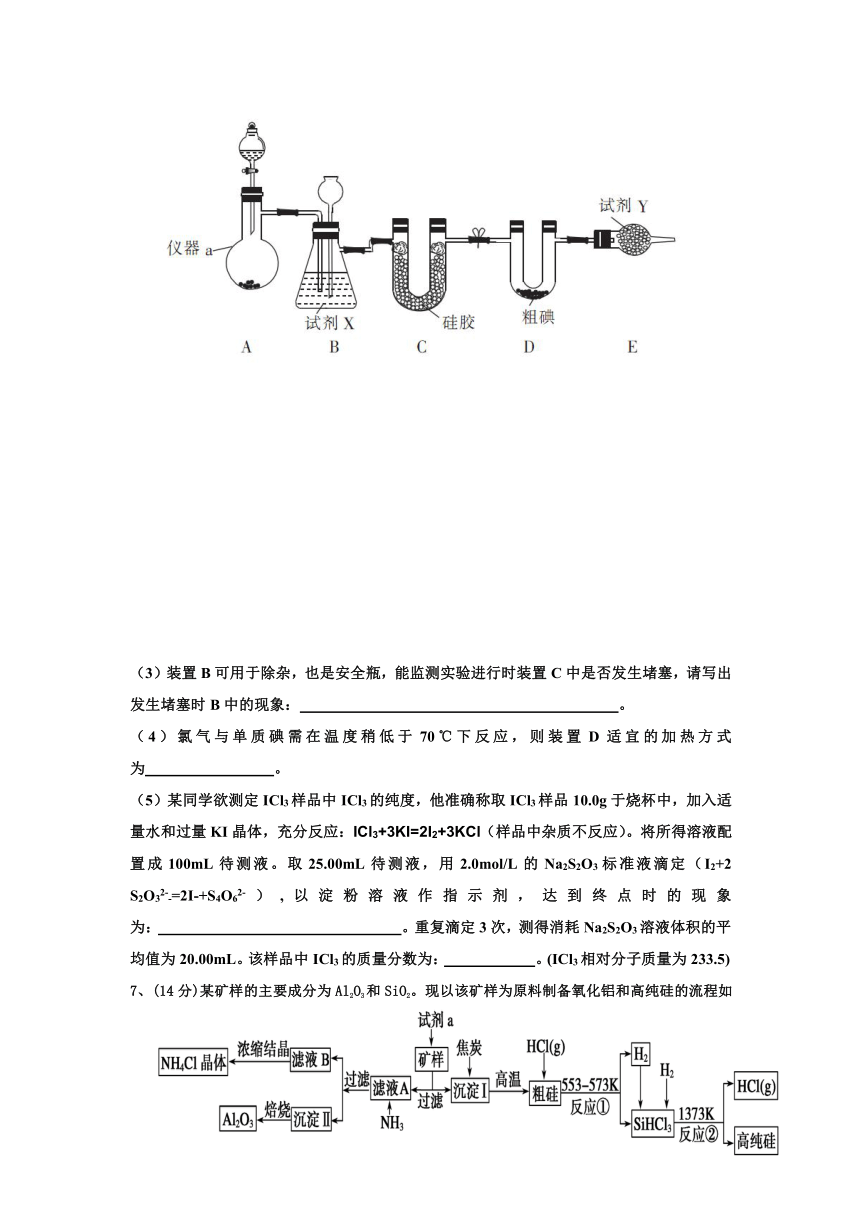
6、(14分)三氯化碘(ICl3 ,I的化 ( http: / / www.21cnjy.com )合价为+3价)在药物合成中用途非常广泛,其熔点:33℃,沸点73℃。实验室可用如图装置制取ICl3。
(1)试剂X、Y分别是: 、 。
装置E的作用是: 。
(2)制备氯气选用的药品为 ( http: / / www.21cnjy.com )漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为: 。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
(5)某同学欲测定ICl3样品中ICl ( http: / / www.21cnjy.com )3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI=2I2+3KCl(样品中杂质不反应)。将所得溶液配置成100mL待测液。取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2 S2O32--=2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为: 。重复滴定3次,测得消耗Na2S2O3溶液体积的平均值为20.00mL。该样品中ICl3的质量分数为: 。(ICl3相对分子质量为233.5)
7、(14分)某矿样的主要成分为Al2O3和SiO2。现以该矿样为原料制备氧化铝和高纯硅的流程如下:
请回答下列问题:
(1)试剂a的最佳选择为________(填代号)。
a.稀盐酸 b.氨水
c.纯碱溶液 d.醋酸
(2)由沉淀Ⅱ获得Al2O3,用到 ( http: / / www.21cnjy.com )的实验仪器除了酒精灯、泥三角、玻璃棒和铁三脚外,还需要的两种仪器是____________________________(填写仪器名称)。
(3)滤液A中通入NH3后发生反应的离子方程式为____________________________。
(4)NH4Cl是一种常用化肥的主 ( http: / / www.21cnjy.com )要成分。现有一包肥料可能是NH4Cl或(NH4)2SO4中的一种,请设计实验进行鉴别(简述操作过程) ___________________________________。
(5)如图所示实验装置,在实验室中制取氨气可选用装置____________,氨气的干燥应选用装置________(选填代号)。
第二部分:本学期知识内容(占57分)
一.选择题:(每小题只有一个选项,每小题3分,共计27分)
8、下列说法正确的是
A.往0.10 mol·L-1的氨水中加水后,NH3·H2O的电离程度和c(OH-)均增大
B.因为醋酸是弱电解质,盐酸是强电解质,因而中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多
C.25℃时,任何以水为溶剂的稀溶液中c(H+)·c(OH-)=1×10-14
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>①
9、常温下,下列各组离子在指定溶液中能大量共存的是
A.将足量CO2通入:NH4+、Na+、Al3+、NO
B.在中性的水溶液中:Fe2+、K+、NO、ClO-
C.含有大量Al3+的溶液中:Na+、NO3-、Cl-、AlO2-
D.水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、HCO3-、SO
10.下列说法正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.Na2SO3溶液中:c(H+)+ c(HSO3-)+ c(H2SO3)= c(OH-)
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.向含有AgCl固体的溶液中加入适量水使AgCl溶解又达到平衡时,在该温度下AgCl的溶度积不变,其溶解度也不变。
11、常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
12、下列说法正确的是
A.HCO3-在水溶液中的水解方程式:HCO3-+H2OH3O++CO32-
B.用加热的方法可以除去KCl溶液中的Fe3+
C.AlCl3溶液和NaAlO2溶液分别加热、蒸干,得到成分相同的固体Al(OH) 3
D.NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
13.常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;
③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)>c(NH4+)
D.四种溶液稀释100倍,溶液的pH:③>④>①>②
14.下列溶液中有关微粒的物质的量浓度关系正确的是
A.同浓度的下列溶液:①NH4Al(SO4) ( http: / / www.21cnjy.com )2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>③>④
B.相同温度下,将足量氯化 ( http: / / www.21cnjy.com )银固体分别放入相同体积的①蒸馏水②0.1 mol·L-1盐酸、 ③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.常温下将NaHSO3和NaHCO3两溶液混合后,溶液呈中性,则混合后的溶液中:
c (Na+)=c(HSO3—)+c(HCO3—)+2c(CO32—)+2c(SO32—)
D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③
15.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液浓度和混合所得溶液的pH如下表所示:
实验编号 c(HA)/ mol·L-1 c(NaOH)/ mol·L-1 混合液的pH
① 0.2 0.1 pH>7
② c 0.2 pH=7
③ 0.1 0.1 pH=9
下列说法中,不正确的是
A.由实验①可知,HA为弱酸; B.实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+)
C.实验②所得混合溶液:c(Na+)=c(A-)
D.实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9 mol·L-1
16.某温度下,Fe(O ( http: / / www.21cnjy.com )H)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断不正确的是
A.Ksp[Fe(OH)3]B.加适量NH4 Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+ )与c(OH-)乘积相等
D.Fe(OH)3 、Cu(OH)2 分别在b、c两点代表的溶液中达到饱和
二、填空题:(每小题15分,共计30分)
17(15分)、使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如下图:
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇。
①已知CO(g)、CH3OH(l)的燃 ( http: / / www.21cnjy.com )烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)此流程的第I步反应为:CH4(g) + H2O(g) CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)
100℃时,将1 mol CH4和2 ( http: / / www.21cnjy.com )mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
(3)此流程的第II步反应CO(g) + H2O(g) CO2(g) + H2(g),的平衡常数随温度的变化如下表:
温度/℃ 400 500 830
平衡常数K 10 9 1
从上表可以推断:该反应是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为 。
右图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图中t2时刻发生改变的条件是 。 (写出一种)。
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如右图,
电极为多孔惰性材料。则负极的电极反应式是
。
18(15分)、中学化学常见的滴定法包括中和滴定法、氧化还原滴定法等。
I.(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4 7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
②实验前,首先要准确配制一定物质的 ( http: / / www.21cnjy.com )量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、药匙、玻璃棒、烧杯、量筒外,还需要 (填仪器名称)。
Ⅱ.探究小组乙测定NH3 H2O的浓度及电离平衡常数Kb
常温下,探究小组量取25.00mL氨水至 ( http: / / www.21cnjy.com )锥形瓶中,用0.0500 mol L-1HCl滴定。用pH计采集数据, 溶液的pH随加入盐酸体积的变化曲线如图所示。
HYPERLINK "http://www.21cnjy.com"
(2)如图:a >7.0的理由是(用电离方程式表示)
(3)如图,当加入稀盐酸的体积为22.40mL时,此时溶液中c(Cl—) c(NH)(填<、>或=)。
当加入稀盐酸的体积至b点溶液中离子浓度大小关系为_________
(4)结合图信息,
计算氨水的浓度为 mol ( http: / / www.21cnjy.com ) L-1;写出NH3 H2O电离平衡常数Kb的表达式,Kb= ,
(5)关于该滴定实验的说法中,正确的是 。
A. 锥形瓶中有少量蒸馏水不影响测定结果
B. 锥形瓶未用氨水进行润洗会导致测得氨水的浓度偏低
C. 酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D. 滴定终点时俯视读数会导致测得氨水的浓度偏高
深圳高级中学2015-2016学年第一学期期中考试
高二化学答案
第一部分:高考基础知识与能力部分(占43分)
一.选择题:(每小题只有一个选项,每小题3分,共计15分)
1 C; 2C ; 3B; 4D; 5C
二、填空题:(每小题14分,共计28分)
6、(14分)(1)饱和食盐水、碱石灰;(2分)
吸收多余的氯气,防止污染空气。(2分)
(2)Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O(2分)
(3)吸滤瓶中液面下降,长颈漏斗中液面上升。(2分)
(4)水浴加热(2分)
(5)当加入最后一滴标准液时,溶液由蓝色变为无色且半分钟内不恢复蓝色。2分)
93.4%。(2分)
7、(14分)
(1)a (2分);(2)坩埚 坩埚钳(2分);
(3)Al3++3NH3+3H2O=Al(OH)3↓+3NH或Al3++3NH3·H2O=Al(OH)3↓+3NH(3分);
(4)取适量样品于试管中配成溶液,先滴 ( http: / / www.21cnjy.com )加过量稀盐酸,再滴加少量BaCl2溶液,若产生白色沉淀,则证明是(NH4)2SO4,若不产生白色沉淀,则证明是NH4Cl(3分,其他合理答案也得分); (5)AB (2分);CE (2分);
第二部分:本学期知识内容(占57分)
一.选择题:(每小题只有一个选项,每小题3分,共计27分)
8 C; 9A; 10D; 11D; 12D; 13A; 14C; 15D; 16B
二、填空题:(每小题15分,共计30分)
17、(15分)
(1)①CH3OH (l) + O2(g) = CO(g) + 2H2O(l) △H=-443.5 kJ·mol-1(3分)
(2)<(2分) ; 0.0225(或2.25×10-2)(2分);
(3)放热(2分) ; 75% (2分) ; 降低温度,或增加水蒸汽的量,或减少氢气的量。(2分)
(4)答案:2H2O+NO-3e-=NO3-+4H+(2分)
18(15分)(1)①B(1分) ②胶头滴管、 250mL容量瓶(2分)
(2)NH3·H2O NH +OH- (2分);
(3) =(2分);
(4)0.0450 (2分);c(NH4+)×c(OH-)/c(NH3·H2O)(2分),
c(Cl-)>c(NH4+)>(H+)>c(OH-)(2分)
(5)AC(2分)
深圳高级中学2015-2016学年第一学期期中考试
高二化学答题卡
第一部分:高考基础知识与能力部分(占43分)
一.选择题:(每小题只有一个选项,每小题3分,共计15分)
1 2 3 4 5
二、填空题:(每小题14分,共计28分)
6、(1) ; ;
;
(2) ;
(3) ;
(4) ;
(5) ;
。
7、(1) (2) ;
(3) ;
(4)
;
(5) ; 。
第二部分:本学期知识内容(占57分)
一.选择题:(每小题只有一个选项,每小题3分,共计27分)
8 9 10 11 12 13 14 15 16
二、填空题:(每小题15分,共计30分)
17、(15分)
(1) ;
(2) ; ;
(3) ; ;
;
(4) 。
18、(15分)
(I)(1)① ;② ;
(II)(2) ;
(3) ; ;
(4) ; ;
(5) ;
A
B
C
a
b
17.50
22.50
5.5
11.0
9.0
7.0
22.40
VHCl /mL
pH
高二化学
命题人:黄晓燕 ; 审题人:吴云
本试卷由二部分组成。第一部分:高考基础知 ( http: / / www.21cnjy.com )识与能力部分(占43分);第二部分:本学期知识内容(占57分),全卷共计100分,考试时间为90分钟
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 Cu-64 C-12 Cl-35.5 l-127 N-14
注意事项:
答第I卷前,考试务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动用橡皮擦干净后再涂其他答案,不能答在试卷上。
考试结束,监考人员将答题卡收回。
第一部分:高考基础知识与能力部分(占43分)
一.选择题:(每小题只有一个选项,每小题3分,共计15分)
1、化学与生活、社会密切相关,下列说法不正确的是
A.通信光缆的主要成分是SiO2 ,太阳能电池的材料主要是晶体Si
B.K2FeO4能与水作用生成Fe(OH)3 胶体和O2 ,可用于净化自来水并杀菌消毒
C.由于NaHCO3能与碱反应,所以常用作焙制糕点的膨松剂
D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂
2、下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 操作 现象 结论
A 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 试纸变蓝色 NO2为酸性气体
B 将过量的CO2通入CaCl2溶液中 产生白色沉淀 酸性:HCl>H2CO3
C 向等浓度的KCl、KI混合液中滴加AgNO3溶液 先出现黄色沉淀 Ksp(AgCl)> Ksp(AgI)
D 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质
3、设表示阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4L SO3中含有的分子数为NA个
B.室温下,48.0g氧气和臭氧的混合气体中含有的原子数目为3NA
C.过氧化钠与水充分反应生成0.1mol氧气转移的电子数为0.4NA
D. 0.1mol L-1的CuCl2溶液中含有0.2NA个Cl―
4、在固态金属氧化物电解池中,高温共电解H ( http: / / www.21cnjy.com )2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ
CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
5、短周期元素X、Y、Z、W在元素周期表中的相对位置如
右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
X Y
Z W
A.最简单气态氢化物的热稳定性:Y>X>W>Z
B.最高价氧化物对应水化物的酸性:X>W>Z
C.原子半径:W>Z>Y>X
D.元素X、Z、W的最高化合价分别与其主族序数相等
二、填空题:(每小题14分,共计28分)
6、(14分)三氯化碘(ICl3 ,I的化 ( http: / / www.21cnjy.com )合价为+3价)在药物合成中用途非常广泛,其熔点:33℃,沸点73℃。实验室可用如图装置制取ICl3。
(1)试剂X、Y分别是: 、 。
装置E的作用是: 。
(2)制备氯气选用的药品为 ( http: / / www.21cnjy.com )漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为: 。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
(5)某同学欲测定ICl3样品中ICl ( http: / / www.21cnjy.com )3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI=2I2+3KCl(样品中杂质不反应)。将所得溶液配置成100mL待测液。取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2 S2O32--=2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为: 。重复滴定3次,测得消耗Na2S2O3溶液体积的平均值为20.00mL。该样品中ICl3的质量分数为: 。(ICl3相对分子质量为233.5)
7、(14分)某矿样的主要成分为Al2O3和SiO2。现以该矿样为原料制备氧化铝和高纯硅的流程如下:
请回答下列问题:
(1)试剂a的最佳选择为________(填代号)。
a.稀盐酸 b.氨水
c.纯碱溶液 d.醋酸
(2)由沉淀Ⅱ获得Al2O3,用到 ( http: / / www.21cnjy.com )的实验仪器除了酒精灯、泥三角、玻璃棒和铁三脚外,还需要的两种仪器是____________________________(填写仪器名称)。
(3)滤液A中通入NH3后发生反应的离子方程式为____________________________。
(4)NH4Cl是一种常用化肥的主 ( http: / / www.21cnjy.com )要成分。现有一包肥料可能是NH4Cl或(NH4)2SO4中的一种,请设计实验进行鉴别(简述操作过程) ___________________________________。
(5)如图所示实验装置,在实验室中制取氨气可选用装置____________,氨气的干燥应选用装置________(选填代号)。
第二部分:本学期知识内容(占57分)
一.选择题:(每小题只有一个选项,每小题3分,共计27分)
8、下列说法正确的是
A.往0.10 mol·L-1的氨水中加水后,NH3·H2O的电离程度和c(OH-)均增大
B.因为醋酸是弱电解质,盐酸是强电解质,因而中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多
C.25℃时,任何以水为溶剂的稀溶液中c(H+)·c(OH-)=1×10-14
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>①
9、常温下,下列各组离子在指定溶液中能大量共存的是
A.将足量CO2通入:NH4+、Na+、Al3+、NO
B.在中性的水溶液中:Fe2+、K+、NO、ClO-
C.含有大量Al3+的溶液中:Na+、NO3-、Cl-、AlO2-
D.水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、HCO3-、SO
10.下列说法正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.Na2SO3溶液中:c(H+)+ c(HSO3-)+ c(H2SO3)= c(OH-)
C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
D.向含有AgCl固体的溶液中加入适量水使AgCl溶解又达到平衡时,在该温度下AgCl的溶度积不变,其溶解度也不变。
11、常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO)>c(CO)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH)>c(OH-)=c(H+)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
12、下列说法正确的是
A.HCO3-在水溶液中的水解方程式:HCO3-+H2OH3O++CO32-
B.用加热的方法可以除去KCl溶液中的Fe3+
C.AlCl3溶液和NaAlO2溶液分别加热、蒸干,得到成分相同的固体Al(OH) 3
D.NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
13.常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;
③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)>c(NH4+)
D.四种溶液稀释100倍,溶液的pH:③>④>①>②
14.下列溶液中有关微粒的物质的量浓度关系正确的是
A.同浓度的下列溶液:①NH4Al(SO4) ( http: / / www.21cnjy.com )2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>③>④
B.相同温度下,将足量氯化 ( http: / / www.21cnjy.com )银固体分别放入相同体积的①蒸馏水②0.1 mol·L-1盐酸、 ③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.常温下将NaHSO3和NaHCO3两溶液混合后,溶液呈中性,则混合后的溶液中:
c (Na+)=c(HSO3—)+c(HCO3—)+2c(CO32—)+2c(SO32—)
D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③
15.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液浓度和混合所得溶液的pH如下表所示:
实验编号 c(HA)/ mol·L-1 c(NaOH)/ mol·L-1 混合液的pH
① 0.2 0.1 pH>7
② c 0.2 pH=7
③ 0.1 0.1 pH=9
下列说法中,不正确的是
A.由实验①可知,HA为弱酸; B.实验①所得混合溶液:c(Na+)>c(A-)>c(OH-)>c(H+)
C.实验②所得混合溶液:c(Na+)=c(A-)
D.实验③所得混合溶液中由水电离出的OH-的浓度为1×10-9 mol·L-1
16.某温度下,Fe(O ( http: / / www.21cnjy.com )H)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如下图所示。据图分析,下列判断不正确的是
A.Ksp[Fe(OH)3]
C.c、d两点代表的溶液中c(H+ )与c(OH-)乘积相等
D.Fe(OH)3 、Cu(OH)2 分别在b、c两点代表的溶液中达到饱和
二、填空题:(每小题15分,共计30分)
17(15分)、使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如下图:
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇。
①已知CO(g)、CH3OH(l)的燃 ( http: / / www.21cnjy.com )烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)此流程的第I步反应为:CH4(g) + H2O(g) CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)
100℃时,将1 mol CH4和2 ( http: / / www.21cnjy.com )mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
(3)此流程的第II步反应CO(g) + H2O(g) CO2(g) + H2(g),的平衡常数随温度的变化如下表:
温度/℃ 400 500 830
平衡常数K 10 9 1
从上表可以推断:该反应是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为 。
右图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图中t2时刻发生改变的条件是 。 (写出一种)。
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如右图,
电极为多孔惰性材料。则负极的电极反应式是
。
18(15分)、中学化学常见的滴定法包括中和滴定法、氧化还原滴定法等。
I.(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4 7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
②实验前,首先要准确配制一定物质的 ( http: / / www.21cnjy.com )量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、药匙、玻璃棒、烧杯、量筒外,还需要 (填仪器名称)。
Ⅱ.探究小组乙测定NH3 H2O的浓度及电离平衡常数Kb
常温下,探究小组量取25.00mL氨水至 ( http: / / www.21cnjy.com )锥形瓶中,用0.0500 mol L-1HCl滴定。用pH计采集数据, 溶液的pH随加入盐酸体积的变化曲线如图所示。
HYPERLINK "http://www.21cnjy.com"
(2)如图:a >7.0的理由是(用电离方程式表示)
(3)如图,当加入稀盐酸的体积为22.40mL时,此时溶液中c(Cl—) c(NH)(填<、>或=)。
当加入稀盐酸的体积至b点溶液中离子浓度大小关系为_________
(4)结合图信息,
计算氨水的浓度为 mol ( http: / / www.21cnjy.com ) L-1;写出NH3 H2O电离平衡常数Kb的表达式,Kb= ,
(5)关于该滴定实验的说法中,正确的是 。
A. 锥形瓶中有少量蒸馏水不影响测定结果
B. 锥形瓶未用氨水进行润洗会导致测得氨水的浓度偏低
C. 酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D. 滴定终点时俯视读数会导致测得氨水的浓度偏高
深圳高级中学2015-2016学年第一学期期中考试
高二化学答案
第一部分:高考基础知识与能力部分(占43分)
一.选择题:(每小题只有一个选项,每小题3分,共计15分)
1 C; 2C ; 3B; 4D; 5C
二、填空题:(每小题14分,共计28分)
6、(14分)(1)饱和食盐水、碱石灰;(2分)
吸收多余的氯气,防止污染空气。(2分)
(2)Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O(2分)
(3)吸滤瓶中液面下降,长颈漏斗中液面上升。(2分)
(4)水浴加热(2分)
(5)当加入最后一滴标准液时,溶液由蓝色变为无色且半分钟内不恢复蓝色。2分)
93.4%。(2分)
7、(14分)
(1)a (2分);(2)坩埚 坩埚钳(2分);
(3)Al3++3NH3+3H2O=Al(OH)3↓+3NH或Al3++3NH3·H2O=Al(OH)3↓+3NH(3分);
(4)取适量样品于试管中配成溶液,先滴 ( http: / / www.21cnjy.com )加过量稀盐酸,再滴加少量BaCl2溶液,若产生白色沉淀,则证明是(NH4)2SO4,若不产生白色沉淀,则证明是NH4Cl(3分,其他合理答案也得分); (5)AB (2分);CE (2分);
第二部分:本学期知识内容(占57分)
一.选择题:(每小题只有一个选项,每小题3分,共计27分)
8 C; 9A; 10D; 11D; 12D; 13A; 14C; 15D; 16B
二、填空题:(每小题15分,共计30分)
17、(15分)
(1)①CH3OH (l) + O2(g) = CO(g) + 2H2O(l) △H=-443.5 kJ·mol-1(3分)
(2)<(2分) ; 0.0225(或2.25×10-2)(2分);
(3)放热(2分) ; 75% (2分) ; 降低温度,或增加水蒸汽的量,或减少氢气的量。(2分)
(4)答案:2H2O+NO-3e-=NO3-+4H+(2分)
18(15分)(1)①B(1分) ②胶头滴管、 250mL容量瓶(2分)
(2)NH3·H2O NH +OH- (2分);
(3) =(2分);
(4)0.0450 (2分);c(NH4+)×c(OH-)/c(NH3·H2O)(2分),
c(Cl-)>c(NH4+)>(H+)>c(OH-)(2分)
(5)AC(2分)
深圳高级中学2015-2016学年第一学期期中考试
高二化学答题卡
第一部分:高考基础知识与能力部分(占43分)
一.选择题:(每小题只有一个选项,每小题3分,共计15分)
1 2 3 4 5
二、填空题:(每小题14分,共计28分)
6、(1) ; ;
;
(2) ;
(3) ;
(4) ;
(5) ;
。
7、(1) (2) ;
(3) ;
(4)
;
(5) ; 。
第二部分:本学期知识内容(占57分)
一.选择题:(每小题只有一个选项,每小题3分,共计27分)
8 9 10 11 12 13 14 15 16
二、填空题:(每小题15分,共计30分)
17、(15分)
(1) ;
(2) ; ;
(3) ; ;
;
(4) 。
18、(15分)
(I)(1)① ;② ;
(II)(2) ;
(3) ; ;
(4) ; ;
(5) ;
A
B
C
a
b
17.50
22.50
5.5
11.0
9.0
7.0
22.40
VHCl /mL
pH
同课章节目录
