化学人教版(2019)必修第二册8.1.2海水资源的开发与利用(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.2海水资源的开发与利用(共18张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-04 00:00:00 | ||
图片预览


文档简介
(共18张PPT)
第八章 化学与可持续发展
第一节 自然资源的开发利用
第2课时 海水资源的开发利用
教学目标:1.以海水资源的氯化钠为原料,构建物质间质的转化关系和思维导图 。
2.通过海水制溴流程图的设计与分析,形成工业制取物质的一般思路和方法,培养学生模型认知和证据推理的能力。
氯
钠
镁
溴
碘
金
钴
钾
锡
锌
铀
锰
任务一:了解海水资源的类别及特点
二、海水资源的特点
1.海底石油:1350亿吨
2.天然气:140万亿立方米
3.镁、钾、铀、锶等矿物:5亿亿吨
4.锰结核:3万亿吨
5.供人类利用的鱼虾贝藻: 每年6亿吨
6.鱼类捕捞量: 每年9000万吨
7.波浪能:700亿千瓦
8.潮汐能:27亿千瓦
9.重水:200万吨
……
一、海水资源的类别:
1.广阔性
海水占地球表面积71%,储水量占地球总水量97%
2.多样性
元素占80多种,溶解和悬浮大量无机物和有机物
3.分散性
许多元素的富集程度很低
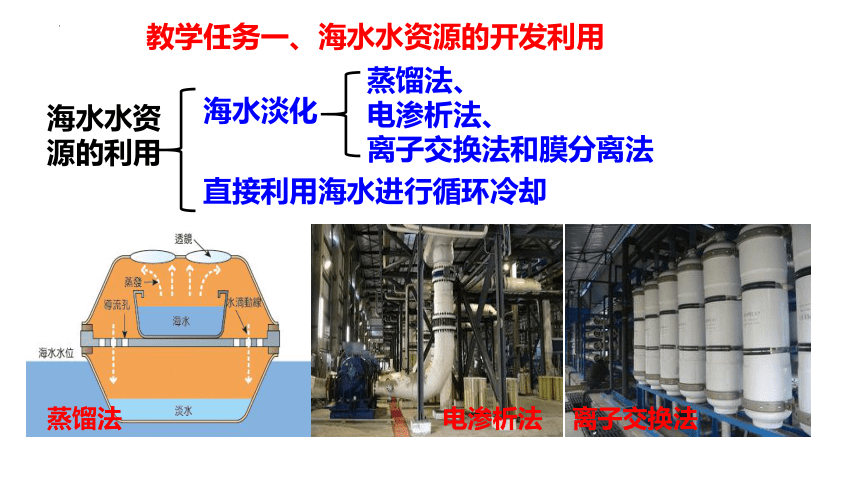
教学任务一、海水水资源的开发利用
海水水资源的利用
电渗析法
离子交换法
蒸馏法
海水淡化
直接利用海水进行循环冷却
蒸馏法、
电渗析法、
离子交换法和膜分离法
海水蒸馏法各种装置
沙漠缺水自救
海水蒸馏的实验装置与原理
(1)主要仪器
A. B. 。
C. 。
(2)冷却水的流向:
口进, 口出。
(3)B中加入碎瓷片的目的 。
(4)温度计水银球处于
_______________ 处。
冷凝管
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
蒸馏烧瓶支口
注意点:1.加热时,蒸馏烧瓶要垫上石棉网。
2.蒸馏烧瓶的液体不能超过烧瓶体积的2/3,但也不能少于1/3.
1.下列关于蒸馏实验的叙述不正确的是( )
A.蒸馏完毕后,应先停止加热,待装置冷却后,
停止通水,再拆卸蒸馏装置。
B.蒸馏时的接收装置如图
C.冷却水应该从冷凝管的下口进水上口出水
D.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
课堂练习
接收装置
接馏分的锥形瓶不能用塞子密封,否则液体无法正常流下
B
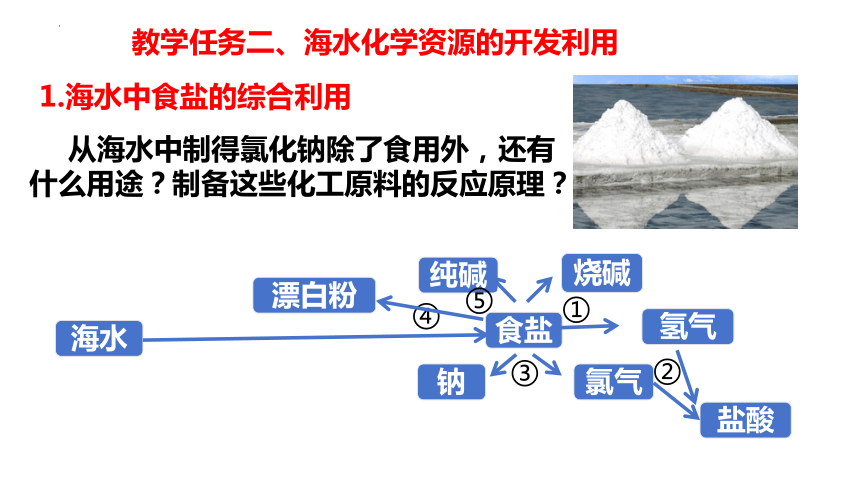
教学任务二、海水化学资源的开发利用
从海水中制得氯化钠除了食用外,还有什么用途?制备这些化工原料的反应原理?
食盐
海水
氢气
纯碱
烧碱
钠
氯气
⑤
①
②
③
④
盐酸
漂白粉
1.海水中食盐的综合利用
试一试:请同学们写出以食盐为原料直接或间接制取为烧碱、氢气、氯气、盐酸、金属钠、漂白液、纯碱的化学方程式:
3.工业制钠: 2NaCl(熔融)=2Na+Cl2↑
通电
化学反应式:
2.制盐酸: H2+Cl2= 2HCl
点燃
1.氯碱工业: 2NaCl+2H2O=2NaOH+H2↑+Cl2↑
通电
4.制①84消毒液:Cl2+2NaOH =NaCl + NaClO +H2O
②漂白粉:2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO)2+2H2O
NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl
2NaHCO3=Na2CO3+CO2↑+H2O↑
加热
5.候氏制纯碱法:
吹出塔
溴及其化合物在医药、农药、染料和阻燃剂等生产中有广泛应用。目前,人们主要从海水和盐湖中提取溴。 “吹出法”——海水提溴技术介绍:
①氧化
Cl2+2Br-=2Cl-+Br2
②吸收
Br2+SO2+2H2O=4H++SO42-+2Br-
③氧化
Cl2+2Br-=2Cl-+Br2
①酸化通Cl2
海水
冷凝器
液溴
吹出溴
(易挥发)
热空气
②SO2和水
吸收塔
溴化氢溶液
蒸馏塔
③氯气与水蒸气
2.海水中制取溴单质
蒸馏
溴的蒸气
2.海水中制取溴单质流程及化学反应原理分析
卤水
吹出塔
吸收塔
①
酸化通Cl2
热空气
②
SO2和水
蒸馏塔
冷凝器
③氯气与水蒸汽
④
蒸馏
问题2. 海水制溴共有浓缩、氧化、吹出、吸收、蒸馏等实验环节,
请写出①③两步氧化、②吸收环节主要反应的离子方程式:
氧化: Cl2+2Br-=2Cl-+Br2
吸收:Br2+SO2+2H2O=4H++SO42-+2Br-
问题1. 根据无机物制备模式,评价设计海水制溴各环节的作用
提纯、浓缩溴离子(原料预处理)
核心反应
分离提纯得到目标产物
海水淡化与化工生产、能源技术相结合
制备氯化钠
食用
工业原料
生产烧碱、纯碱、钠、氯气、盐酸、漂白粉等
制取Mg、K、Br2及其他化工产品
获得其他物质与能量:铀、重水
开发海洋药物
开发利用新能源:潮汐能、波浪能等
波浪能
潮汐能
3.海水中其他化学资源的利用
思考:下图为海水提镁的工艺流程,写出下列步骤中的化学方程式:
1.写出化学反应方程式:
① 。
② 。
③ 。
④ 。⑤ 。
CaCO3=CO2↑ +CaO
高温
Mg(OH)2
CaO
①煅烧
贝壳
②水
石灰乳
无水MgCl2
MgCl2溶液
浓缩后的海水(MgCl2)
③
过滤
Cl2
⑤电解
Mg
⑥H2
HCl盐酸
④
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2+Ca(OH)2=Mg(OH)2 ↓ +CaCl2
MgCl2(熔融)=Mg+Cl2↑
通电
CaO +H2O=Ca(OH)2
2.谈谈设计⑥的意义
原料的循环利用,既保护了环境,又提高了生产效益。
4 .海水(含碘元素)中提取碘的流程图(补充)
海带
海带灰
灼烧
滤液
30ml水溶解
煮沸
过滤
检验
萃取、分液
CCl4
问题③:滤液中加入硫酸酸化的H2O2作用是什么?实验室常用氯水代替H2O2,请写出2个离子反应方程式?
问题①:海带中碘元素的存在方式?
以化合态的形式存在于细胞液(I-)或有机物中
作氧化剂,把碘离子氧化为碘单质,
2I- + H2O2 + 2H+ = I2 + 2H2O
混合液
2mlH2SO4、
氧化
酸化
5mlH2O2
问题②:海带灼烧过程中要用到那些仪器?
实验仪器:酒精灯、三角架、泥三角、坩埚、坩埚钳。
灼烧过程
2I- + Cl2 = 2Cl- + I2
问题④:海带灰溶解、加热煮沸过程需要那些仪器?
问题⑤加热过程应不断搅拌, 。
(1) 烧杯,玻璃棒(搅拌,加快固体溶解速度)
问题⑥:怎么检验混合液中有碘单质生成?
海带
海带灰
灼烧
滤液
30ml水溶解
煮沸
过滤
检验
萃取、分液
CCl4
混合液
2mlH2SO4、
氧化
酸化
5mlH2O2
(2)铁架台(附铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳。
取混合液加入淀粉溶液,若产生蓝色,证明有碘单质生成。
问题⑦:怎么分离CCl4和I2两种物质?
因两者相互溶解,因此只能利用沸点不同,用蒸馏的方法。
防止液体受热不均而溅出
1.从海带中提取碘单质,相关实验步骤如下:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及适当的氧化剂,然后加入几滴某溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯中,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤顺序是______________(填序号)。
(2)适当的氧化剂是_________,反应的离子方程式是_____________________________________。
(3)证明含碘的操作及现象是_________________________________________________________。
③①④②
H2O2
2I- + H2O2 + 2H+ = I2 + 2H2O
取步骤②后的溶液于试管中,滴入淀粉溶液,溶液变蓝
课堂思考
2.从海水中提取镁的工艺流程如图,下列说法不正确的是
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2溶液得到金属Mg
C.制备过程中产生的氯气可以用来制备盐酸,循环使用
D.上述工艺流程中涉及化合、分解和复分解反应
B
课堂思考
3.(2022·陕西榆林高一月考)下列有关工业生产的说法错误的是 ( )
A.海水提镁时,通过电解熔融MgCl2得到镁单质
B.海水提溴的过程中涉及了氧化还原反应
C.通常用海水提取食盐后的母液为原料制取溴单质
D.目前工业上可直接从海水中提取碘单质
海水中没有单质碘
D
课堂思考
课堂小结
海水中水资源的利用
海水淡化
直接利用海水进行循环冷却
蒸馏法、
电渗析法、
离子交换法和膜分离法
海水中化学资源的利用
海水制盐
海水制碘
海水制溴
海水制镁
第八章 化学与可持续发展
第一节 自然资源的开发利用
第2课时 海水资源的开发利用
教学目标:1.以海水资源的氯化钠为原料,构建物质间质的转化关系和思维导图 。
2.通过海水制溴流程图的设计与分析,形成工业制取物质的一般思路和方法,培养学生模型认知和证据推理的能力。
氯
钠
镁
溴
碘
金
钴
钾
锡
锌
铀
锰
任务一:了解海水资源的类别及特点
二、海水资源的特点
1.海底石油:1350亿吨
2.天然气:140万亿立方米
3.镁、钾、铀、锶等矿物:5亿亿吨
4.锰结核:3万亿吨
5.供人类利用的鱼虾贝藻: 每年6亿吨
6.鱼类捕捞量: 每年9000万吨
7.波浪能:700亿千瓦
8.潮汐能:27亿千瓦
9.重水:200万吨
……
一、海水资源的类别:
1.广阔性
海水占地球表面积71%,储水量占地球总水量97%
2.多样性
元素占80多种,溶解和悬浮大量无机物和有机物
3.分散性
许多元素的富集程度很低
教学任务一、海水水资源的开发利用
海水水资源的利用
电渗析法
离子交换法
蒸馏法
海水淡化
直接利用海水进行循环冷却
蒸馏法、
电渗析法、
离子交换法和膜分离法
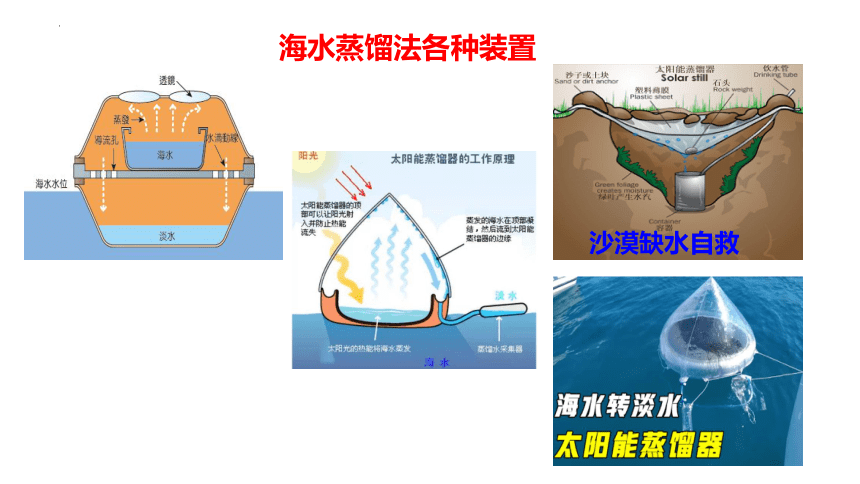
海水蒸馏法各种装置
沙漠缺水自救
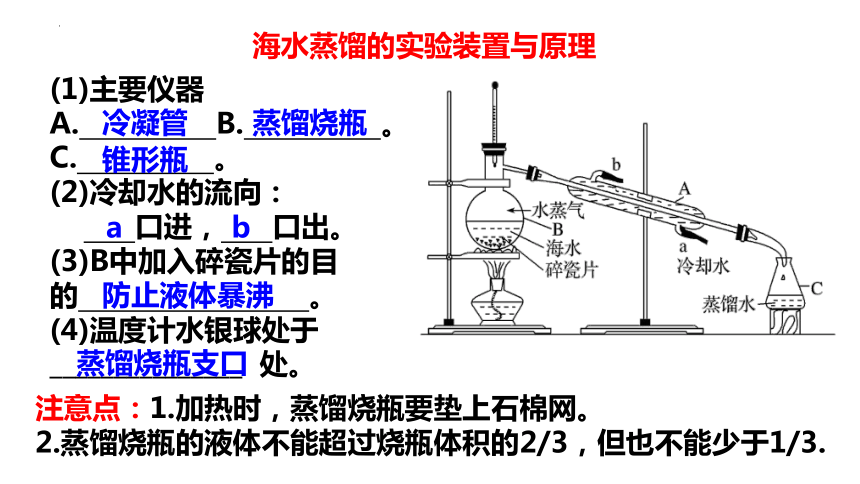
海水蒸馏的实验装置与原理
(1)主要仪器
A. B. 。
C. 。
(2)冷却水的流向:
口进, 口出。
(3)B中加入碎瓷片的目的 。
(4)温度计水银球处于
_______________ 处。
冷凝管
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
蒸馏烧瓶支口
注意点:1.加热时,蒸馏烧瓶要垫上石棉网。
2.蒸馏烧瓶的液体不能超过烧瓶体积的2/3,但也不能少于1/3.
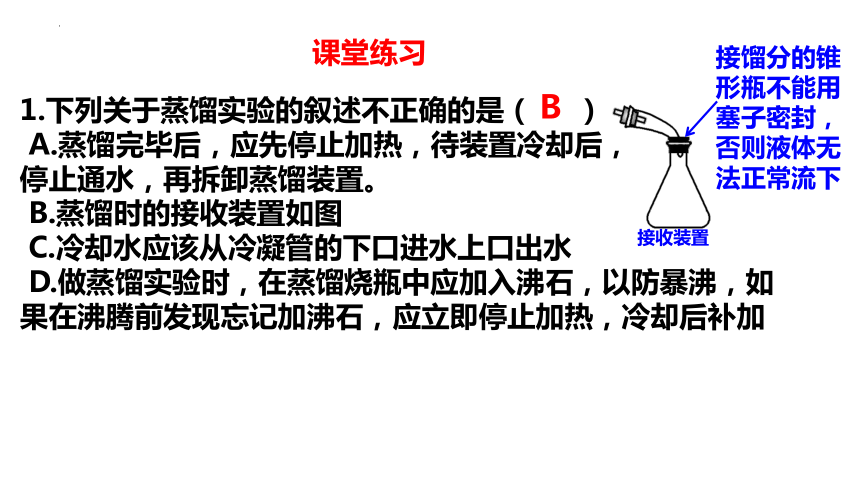
1.下列关于蒸馏实验的叙述不正确的是( )
A.蒸馏完毕后,应先停止加热,待装置冷却后,
停止通水,再拆卸蒸馏装置。
B.蒸馏时的接收装置如图
C.冷却水应该从冷凝管的下口进水上口出水
D.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
课堂练习
接收装置
接馏分的锥形瓶不能用塞子密封,否则液体无法正常流下
B
教学任务二、海水化学资源的开发利用
从海水中制得氯化钠除了食用外,还有什么用途?制备这些化工原料的反应原理?
食盐
海水
氢气
纯碱
烧碱
钠
氯气
⑤
①
②
③
④
盐酸
漂白粉
1.海水中食盐的综合利用
试一试:请同学们写出以食盐为原料直接或间接制取为烧碱、氢气、氯气、盐酸、金属钠、漂白液、纯碱的化学方程式:
3.工业制钠: 2NaCl(熔融)=2Na+Cl2↑
通电
化学反应式:
2.制盐酸: H2+Cl2= 2HCl
点燃
1.氯碱工业: 2NaCl+2H2O=2NaOH+H2↑+Cl2↑
通电
4.制①84消毒液:Cl2+2NaOH =NaCl + NaClO +H2O
②漂白粉:2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO)2+2H2O
NaCl+H2O+NH3+CO2=NaHCO3+NH4Cl
2NaHCO3=Na2CO3+CO2↑+H2O↑
加热
5.候氏制纯碱法:
吹出塔
溴及其化合物在医药、农药、染料和阻燃剂等生产中有广泛应用。目前,人们主要从海水和盐湖中提取溴。 “吹出法”——海水提溴技术介绍:
①氧化
Cl2+2Br-=2Cl-+Br2
②吸收
Br2+SO2+2H2O=4H++SO42-+2Br-
③氧化
Cl2+2Br-=2Cl-+Br2
①酸化通Cl2
海水
冷凝器
液溴
吹出溴
(易挥发)
热空气
②SO2和水
吸收塔
溴化氢溶液
蒸馏塔
③氯气与水蒸气
2.海水中制取溴单质
蒸馏
溴的蒸气
2.海水中制取溴单质流程及化学反应原理分析
卤水
吹出塔
吸收塔
①
酸化通Cl2
热空气
②
SO2和水
蒸馏塔
冷凝器
③氯气与水蒸汽
④
蒸馏
问题2. 海水制溴共有浓缩、氧化、吹出、吸收、蒸馏等实验环节,
请写出①③两步氧化、②吸收环节主要反应的离子方程式:
氧化: Cl2+2Br-=2Cl-+Br2
吸收:Br2+SO2+2H2O=4H++SO42-+2Br-
问题1. 根据无机物制备模式,评价设计海水制溴各环节的作用
提纯、浓缩溴离子(原料预处理)
核心反应
分离提纯得到目标产物
海水淡化与化工生产、能源技术相结合
制备氯化钠
食用
工业原料
生产烧碱、纯碱、钠、氯气、盐酸、漂白粉等
制取Mg、K、Br2及其他化工产品
获得其他物质与能量:铀、重水
开发海洋药物
开发利用新能源:潮汐能、波浪能等
波浪能
潮汐能
3.海水中其他化学资源的利用
思考:下图为海水提镁的工艺流程,写出下列步骤中的化学方程式:
1.写出化学反应方程式:
① 。
② 。
③ 。
④ 。⑤ 。
CaCO3=CO2↑ +CaO
高温
Mg(OH)2
CaO
①煅烧
贝壳
②水
石灰乳
无水MgCl2
MgCl2溶液
浓缩后的海水(MgCl2)
③
过滤
Cl2
⑤电解
Mg
⑥H2
HCl盐酸
④
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2+Ca(OH)2=Mg(OH)2 ↓ +CaCl2
MgCl2(熔融)=Mg+Cl2↑
通电
CaO +H2O=Ca(OH)2
2.谈谈设计⑥的意义
原料的循环利用,既保护了环境,又提高了生产效益。
4 .海水(含碘元素)中提取碘的流程图(补充)
海带
海带灰
灼烧
滤液
30ml水溶解
煮沸
过滤
检验
萃取、分液
CCl4
问题③:滤液中加入硫酸酸化的H2O2作用是什么?实验室常用氯水代替H2O2,请写出2个离子反应方程式?
问题①:海带中碘元素的存在方式?
以化合态的形式存在于细胞液(I-)或有机物中
作氧化剂,把碘离子氧化为碘单质,
2I- + H2O2 + 2H+ = I2 + 2H2O
混合液
2mlH2SO4、
氧化
酸化
5mlH2O2
问题②:海带灼烧过程中要用到那些仪器?
实验仪器:酒精灯、三角架、泥三角、坩埚、坩埚钳。
灼烧过程
2I- + Cl2 = 2Cl- + I2
问题④:海带灰溶解、加热煮沸过程需要那些仪器?
问题⑤加热过程应不断搅拌, 。
(1) 烧杯,玻璃棒(搅拌,加快固体溶解速度)
问题⑥:怎么检验混合液中有碘单质生成?
海带
海带灰
灼烧
滤液
30ml水溶解
煮沸
过滤
检验
萃取、分液
CCl4
混合液
2mlH2SO4、
氧化
酸化
5mlH2O2
(2)铁架台(附铁圈)、酒精灯、蒸发皿、玻璃棒、坩埚钳。
取混合液加入淀粉溶液,若产生蓝色,证明有碘单质生成。
问题⑦:怎么分离CCl4和I2两种物质?
因两者相互溶解,因此只能利用沸点不同,用蒸馏的方法。
防止液体受热不均而溅出
1.从海带中提取碘单质,相关实验步骤如下:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及适当的氧化剂,然后加入几滴某溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯中,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤顺序是______________(填序号)。
(2)适当的氧化剂是_________,反应的离子方程式是_____________________________________。
(3)证明含碘的操作及现象是_________________________________________________________。
③①④②
H2O2
2I- + H2O2 + 2H+ = I2 + 2H2O
取步骤②后的溶液于试管中,滴入淀粉溶液,溶液变蓝
课堂思考
2.从海水中提取镁的工艺流程如图,下列说法不正确的是
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2溶液得到金属Mg
C.制备过程中产生的氯气可以用来制备盐酸,循环使用
D.上述工艺流程中涉及化合、分解和复分解反应
B
课堂思考
3.(2022·陕西榆林高一月考)下列有关工业生产的说法错误的是 ( )
A.海水提镁时,通过电解熔融MgCl2得到镁单质
B.海水提溴的过程中涉及了氧化还原反应
C.通常用海水提取食盐后的母液为原料制取溴单质
D.目前工业上可直接从海水中提取碘单质
海水中没有单质碘
D
课堂思考
课堂小结
海水中水资源的利用
海水淡化
直接利用海水进行循环冷却
蒸馏法、
电渗析法、
离子交换法和膜分离法
海水中化学资源的利用
海水制盐
海水制碘
海水制溴
海水制镁
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
