化学人教版(2019)必修第二册8.1.1金属矿物的开发与利用(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.1金属矿物的开发与利用(共17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-04 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
教学目标
1.通过金属冶炼原理的学习和冶炼方法的归纳,理解氧化还原反应在金属矿物开发中的应用,构建金属冶炼的思维模式。
第八章 化学与可持续发展
第一节 自然资源的开发利用
第一课时 金属矿物的开发利用
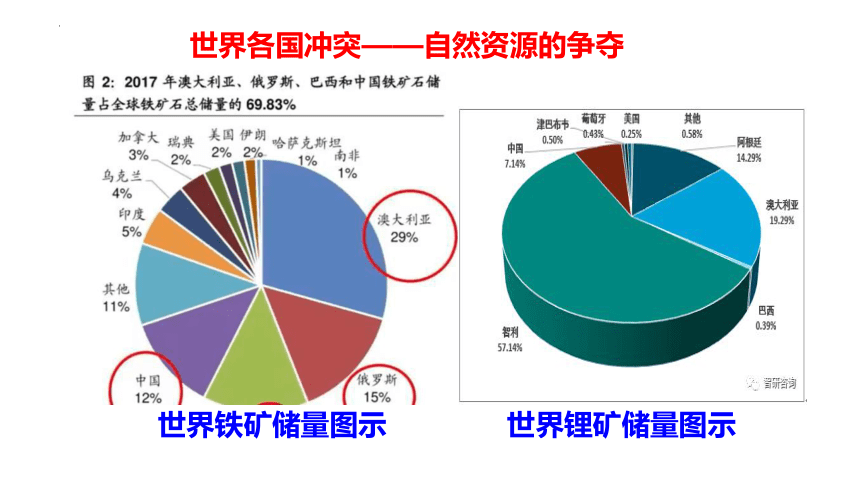
世界各国冲突——自然资源的争夺
世界铁矿储量图示
世界锂矿储量图示
常见金属元素在地壳中的存在
游离态矿物(极少量金属)
金矿石(Au)
银矿石(Ag)
铂矿石(Pt)
铜矿石(Cu)
陨铁(Fe)
常见金属元素在地壳中的存在
化合态矿物(多数金属)
赤铁矿(Fe2O3)
黄铜矿(CuFeS2)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
钙钛矿(CaTiO3)
铝土矿( AI2O3 )
任务一:了解材料历史,探寻冶金方法
1.从古到今的社会发展:
数字时代(硅)
引领社会发展
原始社会
奴隶社会
农业社会
现代社会
未来社会
发展生产力
资源争夺战
石器时代
青铜器时代
铁器时代
合金时代(钢、铝、钛等)
2.对应的材料发展:
3.材料作用:
适应自然
改造自然
现代文明需要
任务一:了解材料历史,探寻冶金方法
阅读历史文献记载,总结下列有关金属的冶炼方法:
朝代 利用矿物 历史记载的材料 冶炼方法
夏朝 金矿 “千淘万漉虽辛苦,吹尽狂沙始到金”
东晋 硫化汞矿 炼丹家葛洪《抱朴子》“丹砂(HgS)烧之成水银”。
西汉 硫酸铜矿 西汉刘安《淮南万毕术》“曾青得铁则化为铜”。
商朝 孔雀石矿 西汉贾谊《鹏鸟赋》且夫天地为炉兮,造化为工;阴阳为炭兮,万物为铜。
战国 赤铁矿 《秋浦歌》炉火照天地,红星乱紫烟。
物理富集法
热分解法
湿法炼铜
热还原法
热还原法
利用矿物 冶炼方法 化学反应方程式
丹砂硫化汞矿(HgS) 热分解法
硫酸铜矿 湿法炼铜
孔雀石矿 Cu2(OH)2CO3 热还原法
赤铁矿 热还原法
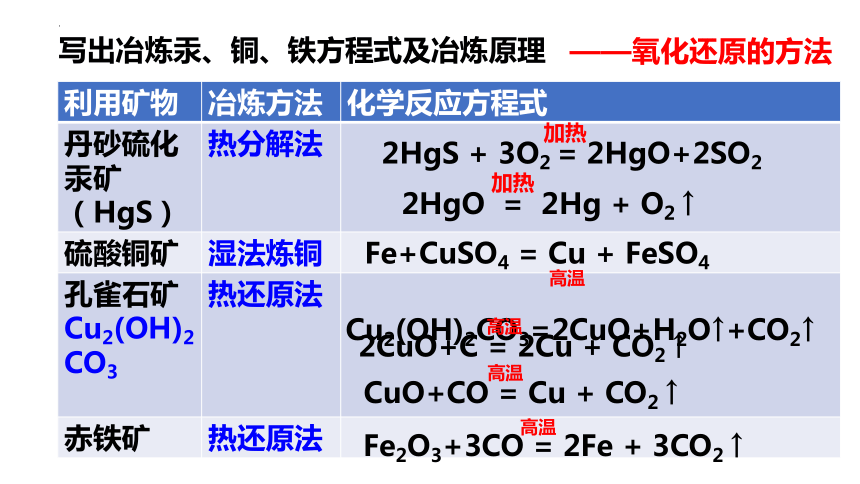
写出冶炼汞、铜、铁方程式及冶炼原理
2HgO = 2Hg + O2 ↑
加热
2HgS + 3O2 = 2HgO+2SO2
加热
Fe+CuSO4 = Cu + FeSO4
Cu2(OH)2CO3=2CuO+H2O↑+CO2↑
高温
高温
2CuO+C = 2Cu + CO2 ↑
CuO+CO = Cu + CO2 ↑
高温
Fe2O3+3CO = 2Fe + 3CO2 ↑
高温
——氧化还原的方法
热还原法:
——不起眼的木炭,开启了人类金属时代!
问题1:新石器时期,人类就发明了制陶术,窑温达1000多℃ ,请评价此窑温冶炼出的铁质量?(铁熔点1535.4℃)
问题2:热还原法中,还原CuO、Fe2O3固体时可以用木炭(C)也可以用一氧化碳(CO) ,你能评价一下这两种还原剂使用效果?
现代炼铁高炉
燃烧温度控制在
2250-2350 ℃
问题3:湿法炼铜的本质是利用铁与铜盐溶液置换出金属铜(Fe+CuSO4 = Cu + FeSO4)。你能举例说明金属在非水溶液体系中也存在的置换反应吗?
铝热反应的应用:
早期应用于野外铁轨焊接;
2.冶炼难熔金属如钨、铬、锰等。
铝热反应:
2Al+Fe2O3 = 2Fe + Al2O3
高温
Na(l)+KCl = K(g) + NaCl
高温
约850℃时反应,钾沸点比钠低,钾以气体形式离开反应体系,平衡就不断右移。
任务二:总结归纳金属冶炼规律
人类历史冶炼金属时间表:
金属 元素符号 冶炼时间 冶炼原理 冶炼条件
金 Au 前6000年 物理富集、筛选法 银 Ag 前5000年 热分解法 400℃
汞 Hg 前3000年 热分解法 500℃
铜、锡 Cu、Sn 前5000年 800℃
1200℃
铁 Fe 前2500年 锌 Zn 1746年 铝 Al 1827年
镁、钙 Mg、Ca 1808年
钠、钾 Na、K 1807年
热还原法
汉弗莱·戴维
(H.Davy,1778-1829)
?
1807年戴维用电解的方法得到钠、钾,1808年又电解得到镁、钙、锶、钡。
电解法
19世纪初,戴维成功地利用电化学方法从KOH、NaOH中制得K、Na,他也从开始尝试氧化铝中提取铝。
氧化铝
高温熔融
液态氧化铝
电解
铝
铝的制备
思考1:氯化铝熔点比氧化铝低得多,工
业上为什么不采用电解氯化铝来制备铝呢?
物质 Al2O3 AlCl3
熔点 2015℃ 195℃
制取流程:
由于氧化铝熔点(2015℃)太高,要融化耗能太多,故工业生产中往往加入冰晶石,以降低融化温度。
氯化铝的分子结构示意图
Cl Cl Cl
Cl Cl Cl
Al Al
氯化铝是分子晶体,在熔融状态下不导电!
总结并写出电解法取活泼金属钾、钙、钠、镁、铝等化学方程式?
思考2:一般情况下,同种金属的氧化物的熔点要大于氯化物的熔点。钠、镁的两种常见化合物熔点如下,四种物质都是离子化合物,则制取钠、镁单质时一般电解那类物质?
氯化镁 氧化镁 氯化钠 氧化钠
熔点 7120C 28000C 8010C 12750C
MgCl2 (熔融) = Mg + Cl2↑
电解
2Al2O3 (熔融) = 4Al + 3O2 ↑
电解
冰晶石
CaCl2 (熔融) = Ca + Cl2↑
电解
2NaCl (熔融) = 2Na + Cl2↑
电解
2KCl (熔融) = 2K + Cl2↑
电解
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
活泼
电解法
(氧化物、氯化物)
较活泼
热还原法
(C、CO、H2、Al等)
不活泼
热分解法
(氧化物)
物理方法
钒、铬、锰、钴
制备方法模型:金属使用、冶炼与金属活动性的关系
很稳定
铜、银、金器约5000年前
铁器约2500年前
铝器约200年
总结:人类使用金属年代的先后跟金属的那些因素有关?
①金属的活动性
②与人类的冶炼技术有关
例:铝土矿的主要成分为氧化铝、氧化铁和二氧化硅。工业上经过下列工艺可以冶炼金属铝:
铝土矿
a
过量的NaOH
b
盐酸 ①
②
③
c
④
d
电解
Al
⑤
请判断流程中的a、b、c、d分别是什么物质?写出反应①、②、③、④、⑤5步反应反应方程式。
任务三:了解从铝土矿提取铝的流程,明晰工业流程分析模型
Al2O3
Fe2O3
SiO2
①HCl
AlCl3
FeCl3
SiO2固体
②过量NaOH
过滤
Na[Al(OH)4]
Fe(OH)3固体
③通过量CO2
Al(OH)3
④加热
Al2O3
过滤
电解
⑤
Al
原料预处理(得到纯度高、含量高的氧化铝固体)
核心反应
无机工业制备流程的主要设计模型
原料
原料预处理
核心化学反应
反应条件的控制
目标产物
产品的分离与提纯
原料的循环利用
排放物的无害化处理
规律:“主线主产品,分支副产品,回头为循环。”
思考与讨论:
计算表明,生产1mol铝消耗的电能至少为1.8×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比较,前者的能耗仅为后者的3%~5%。通过对上述数据的分析与比较,结合书本P99的图8-1与图8-2,你想到了什么?请将你的想法与同学交流。
铝土矿
氧化铝
萤石
冰晶石
石油焦和沥青焦
碳素电极
液态铝
铝锭
阅读书本P99页
树立环保意识,践行可持续发展理念
合理开发和利用资源 ?
资源有限、环境污染、能耗很大
加强废旧金属回收再利用
提高金属矿物的利用率
开发环保高效的金属冶炼方法
防止金属的腐蚀
使用其他材料代替金属
教学目标
1.通过金属冶炼原理的学习和冶炼方法的归纳,理解氧化还原反应在金属矿物开发中的应用,构建金属冶炼的思维模式。
第八章 化学与可持续发展
第一节 自然资源的开发利用
第一课时 金属矿物的开发利用
世界各国冲突——自然资源的争夺
世界铁矿储量图示
世界锂矿储量图示
常见金属元素在地壳中的存在
游离态矿物(极少量金属)
金矿石(Au)
银矿石(Ag)
铂矿石(Pt)
铜矿石(Cu)
陨铁(Fe)
常见金属元素在地壳中的存在
化合态矿物(多数金属)
赤铁矿(Fe2O3)
黄铜矿(CuFeS2)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
钙钛矿(CaTiO3)
铝土矿( AI2O3 )
任务一:了解材料历史,探寻冶金方法
1.从古到今的社会发展:
数字时代(硅)
引领社会发展
原始社会
奴隶社会
农业社会
现代社会
未来社会
发展生产力
资源争夺战
石器时代
青铜器时代
铁器时代
合金时代(钢、铝、钛等)
2.对应的材料发展:
3.材料作用:
适应自然
改造自然
现代文明需要
任务一:了解材料历史,探寻冶金方法
阅读历史文献记载,总结下列有关金属的冶炼方法:
朝代 利用矿物 历史记载的材料 冶炼方法
夏朝 金矿 “千淘万漉虽辛苦,吹尽狂沙始到金”
东晋 硫化汞矿 炼丹家葛洪《抱朴子》“丹砂(HgS)烧之成水银”。
西汉 硫酸铜矿 西汉刘安《淮南万毕术》“曾青得铁则化为铜”。
商朝 孔雀石矿 西汉贾谊《鹏鸟赋》且夫天地为炉兮,造化为工;阴阳为炭兮,万物为铜。
战国 赤铁矿 《秋浦歌》炉火照天地,红星乱紫烟。
物理富集法
热分解法
湿法炼铜
热还原法
热还原法
利用矿物 冶炼方法 化学反应方程式
丹砂硫化汞矿(HgS) 热分解法
硫酸铜矿 湿法炼铜
孔雀石矿 Cu2(OH)2CO3 热还原法
赤铁矿 热还原法
写出冶炼汞、铜、铁方程式及冶炼原理
2HgO = 2Hg + O2 ↑
加热
2HgS + 3O2 = 2HgO+2SO2
加热
Fe+CuSO4 = Cu + FeSO4
Cu2(OH)2CO3=2CuO+H2O↑+CO2↑
高温
高温
2CuO+C = 2Cu + CO2 ↑
CuO+CO = Cu + CO2 ↑
高温
Fe2O3+3CO = 2Fe + 3CO2 ↑
高温
——氧化还原的方法
热还原法:
——不起眼的木炭,开启了人类金属时代!
问题1:新石器时期,人类就发明了制陶术,窑温达1000多℃ ,请评价此窑温冶炼出的铁质量?(铁熔点1535.4℃)
问题2:热还原法中,还原CuO、Fe2O3固体时可以用木炭(C)也可以用一氧化碳(CO) ,你能评价一下这两种还原剂使用效果?
现代炼铁高炉
燃烧温度控制在
2250-2350 ℃
问题3:湿法炼铜的本质是利用铁与铜盐溶液置换出金属铜(Fe+CuSO4 = Cu + FeSO4)。你能举例说明金属在非水溶液体系中也存在的置换反应吗?
铝热反应的应用:
早期应用于野外铁轨焊接;
2.冶炼难熔金属如钨、铬、锰等。
铝热反应:
2Al+Fe2O3 = 2Fe + Al2O3
高温
Na(l)+KCl = K(g) + NaCl
高温
约850℃时反应,钾沸点比钠低,钾以气体形式离开反应体系,平衡就不断右移。
任务二:总结归纳金属冶炼规律
人类历史冶炼金属时间表:
金属 元素符号 冶炼时间 冶炼原理 冶炼条件
金 Au 前6000年 物理富集、筛选法 银 Ag 前5000年 热分解法 400℃
汞 Hg 前3000年 热分解法 500℃
铜、锡 Cu、Sn 前5000年 800℃
1200℃
铁 Fe 前2500年 锌 Zn 1746年 铝 Al 1827年
镁、钙 Mg、Ca 1808年
钠、钾 Na、K 1807年
热还原法
汉弗莱·戴维
(H.Davy,1778-1829)
?
1807年戴维用电解的方法得到钠、钾,1808年又电解得到镁、钙、锶、钡。
电解法
19世纪初,戴维成功地利用电化学方法从KOH、NaOH中制得K、Na,他也从开始尝试氧化铝中提取铝。
氧化铝
高温熔融
液态氧化铝
电解
铝
铝的制备
思考1:氯化铝熔点比氧化铝低得多,工
业上为什么不采用电解氯化铝来制备铝呢?
物质 Al2O3 AlCl3
熔点 2015℃ 195℃
制取流程:
由于氧化铝熔点(2015℃)太高,要融化耗能太多,故工业生产中往往加入冰晶石,以降低融化温度。
氯化铝的分子结构示意图
Cl Cl Cl
Cl Cl Cl
Al Al
氯化铝是分子晶体,在熔融状态下不导电!
总结并写出电解法取活泼金属钾、钙、钠、镁、铝等化学方程式?
思考2:一般情况下,同种金属的氧化物的熔点要大于氯化物的熔点。钠、镁的两种常见化合物熔点如下,四种物质都是离子化合物,则制取钠、镁单质时一般电解那类物质?
氯化镁 氧化镁 氯化钠 氧化钠
熔点 7120C 28000C 8010C 12750C
MgCl2 (熔融) = Mg + Cl2↑
电解
2Al2O3 (熔融) = 4Al + 3O2 ↑
电解
冰晶石
CaCl2 (熔融) = Ca + Cl2↑
电解
2NaCl (熔融) = 2Na + Cl2↑
电解
2KCl (熔融) = 2K + Cl2↑
电解
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
活泼
电解法
(氧化物、氯化物)
较活泼
热还原法
(C、CO、H2、Al等)
不活泼
热分解法
(氧化物)
物理方法
钒、铬、锰、钴
制备方法模型:金属使用、冶炼与金属活动性的关系
很稳定
铜、银、金器约5000年前
铁器约2500年前
铝器约200年
总结:人类使用金属年代的先后跟金属的那些因素有关?
①金属的活动性
②与人类的冶炼技术有关
例:铝土矿的主要成分为氧化铝、氧化铁和二氧化硅。工业上经过下列工艺可以冶炼金属铝:
铝土矿
a
过量的NaOH
b
盐酸 ①
②
③
c
④
d
电解
Al
⑤
请判断流程中的a、b、c、d分别是什么物质?写出反应①、②、③、④、⑤5步反应反应方程式。
任务三:了解从铝土矿提取铝的流程,明晰工业流程分析模型
Al2O3
Fe2O3
SiO2
①HCl
AlCl3
FeCl3
SiO2固体
②过量NaOH
过滤
Na[Al(OH)4]
Fe(OH)3固体
③通过量CO2
Al(OH)3
④加热
Al2O3
过滤
电解
⑤
Al
原料预处理(得到纯度高、含量高的氧化铝固体)
核心反应
无机工业制备流程的主要设计模型
原料
原料预处理
核心化学反应
反应条件的控制
目标产物
产品的分离与提纯
原料的循环利用
排放物的无害化处理
规律:“主线主产品,分支副产品,回头为循环。”
思考与讨论:
计算表明,生产1mol铝消耗的电能至少为1.8×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比较,前者的能耗仅为后者的3%~5%。通过对上述数据的分析与比较,结合书本P99的图8-1与图8-2,你想到了什么?请将你的想法与同学交流。
铝土矿
氧化铝
萤石
冰晶石
石油焦和沥青焦
碳素电极
液态铝
铝锭
阅读书本P99页
树立环保意识,践行可持续发展理念
合理开发和利用资源 ?
资源有限、环境污染、能耗很大
加强废旧金属回收再利用
提高金属矿物的利用率
开发环保高效的金属冶炼方法
防止金属的腐蚀
使用其他材料代替金属
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
