化学人教版(2019)选择性必修1 4.1原电池——原电池工作原理(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1原电池——原电池工作原理(共23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 60.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-04 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
Chapter 04
化学反应与电能
4.1 原电池
学习目标:
1、从单液原电池工作原理,构建双液原电池工作原理
2、能设计简单的双液原电池,并书写电极反应式
3、从电池发展史体会社会“按需设计”的科学发展本质
4.1.1 原电池原理
一、回顾旧知
1. 原电池的基本概念
(1)概念:原电池是将 能转化为 能的装置。
(2)本质:氧化反应和还原反应分别在两个不同的区域进行。
(3)电极:
① 负极:________电子,发生________反应;
② 正极:________电子,发生________反应。
负极
正极
Zn
Cu
电解液
还原反应
2H++2e-=H2↑
氧化反应
Zn-2e-=Zn2+
外电路
内电路
失e-,沿导线传递,产生电流
2.工作原理
正电荷回路
负电荷回路
阴离子
阳离子
一、回顾旧知
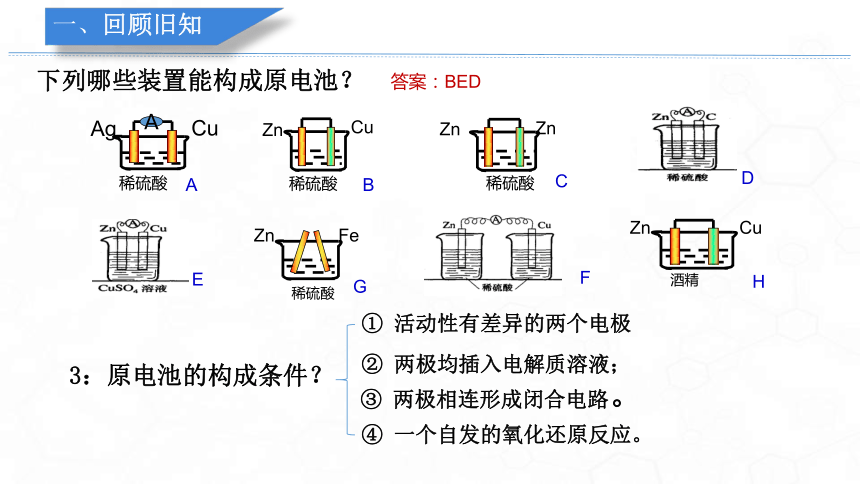
下列哪些装置能构成原电池?
A
B
D
E
F
G
稀硫酸
Zn
Fe
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
酒精
Zn
Cu
H
稀硫酸
Zn
Zn
C
3:原电池的构成条件?
① 活动性有差异的两个电极
② 两极均插入电解质溶液;
③ 两极相连形成闭合电路。
④ 一个自发的氧化还原反应。
一、回顾旧知
答案:BED
【演示实验1】
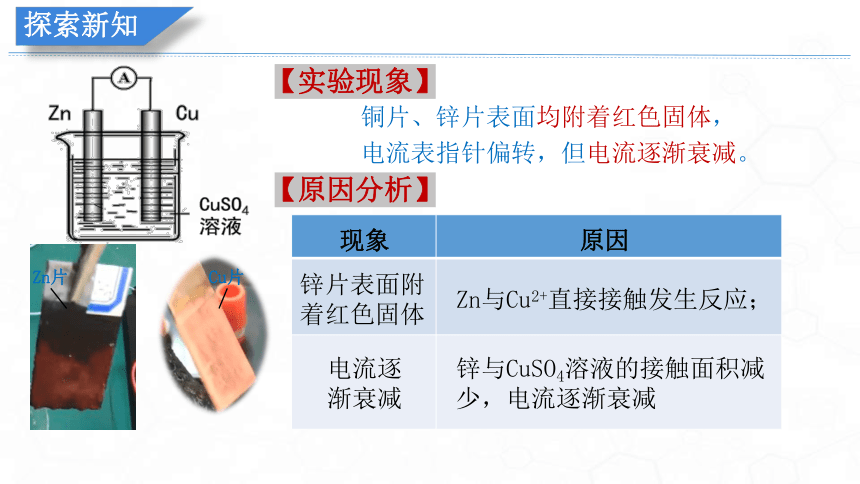
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有CuSO4溶液的烧杯中,请同学们观察锌片上现象和电流表指针变化?
重温-----锌铜原电池
【思考1】锌片上为什么有铜析出?为什么电流表读数会逐渐减小?
二、探索新知
演示实验1
铜片、锌片表面均附着红色固体,
电流表指针偏转,但电流逐渐衰减。
【实验现象】
Zn片
【原因分析】
现象
原因
锌片表面附着红色固体
电流逐渐衰减
Zn与Cu2+直接接触发生反应;
锌与CuSO4溶液的接触面积减少,电流逐渐衰减
Cu片
探索新知
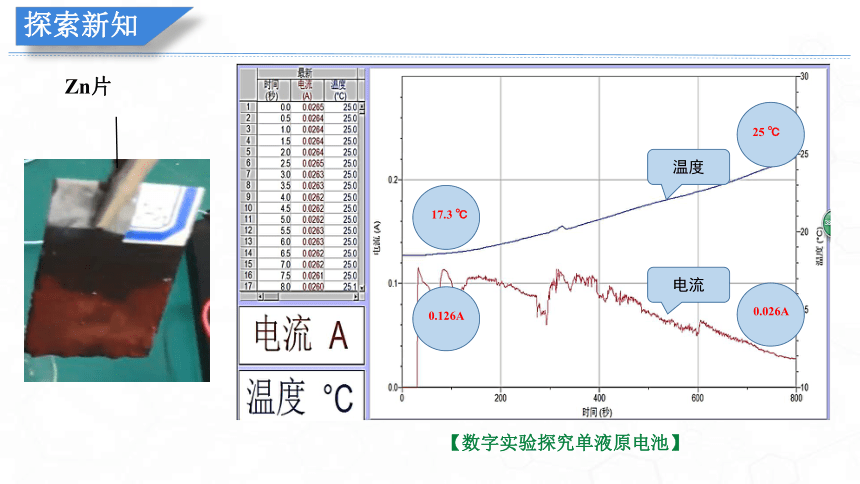
温度
电流
17.3 ℃
0.126A
25 ℃
0.026A
【数字实验探究单液原电池】
探索新知
Zn片
【思考4】这个装置形成了原电池吗? 该用什么样的物质连接装置的内电路呢?怎样能使电解质溶液连通构成原电池?
【思考2】能否阻止Cu2+在锌片表面还原
【思考3】锌片应插入什么样的溶液中?
ZnSO4
CuSO4
探索新知
【学生演示实验】
用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连。
【观察并填写实验现象】
1.电流表指针偏转情况,工作一段时间有无变化
2.电解质溶液的变化
3.电极表面的变化
4.取出盐桥后的变化
探索新知
探索新知
观察现象
1.有盐桥存在时电流表指针 ;
2.铜片表面有 析出;
3.锌片逐渐 ;
4.随着时间的延续,能产生 稳定的电流;
5.取出盐桥 电流产生;
探索新知
发生偏移
铜
溶解
持续
无
小组讨论:1.盐桥的作用?
2.盐桥中离子移动方向
3.阴阳离子在电解液中的运动方向
三、讨论与交流
Cl-
K+
盐桥
一种凝胶态的离子导体
盐桥中通常装有: 含KCl饱和溶液的琼胶, K+和Cl-可在其中自由移动。
知识拓展:
离子迁移速率
知识拓展
双液电池的工作原理
负极:Zn - 2e- = Zn2+
正极:Cu2+ + 2e- = Cu
盐桥的作用
(1)形成闭合回路;
(2)平衡电荷,使溶液呈电中性;
(3)持续稳定的产生电流,提高能量转换率
负极
氧化反应
正极
还原反应
Cl-
K+
盐桥中的离子迁移进入两侧电解质溶液,联通了两侧电解质溶液,从而形成闭合回路。
汇报与总结
三、讨论与交流
优点: 避免电极与电解质溶液直接反应,减少电流的衰减,提高原电池的工作效率。
谈谈相对单液原电池,双液原电池的优缺点?
缺点:电流强度比较小。
膜电池:
硫酸铜
硫酸锌
Zn
知识拓展
膜电池:
硫酸铜
硫酸锌
Zn
你能谈谈单液原电池、双液原电池、隔膜原电池的优缺点吗?
三、讨论与交流
名称 单液原电池 双液原电池 隔膜原电池
优点
缺点
电流强
1.能量转化率低
2.氧化剂与还原剂直接接触,寿命短
1.内阻大,电流弱
2.盐桥需要定期更换
1.能量转化率高
2.避免氧化剂与还原剂直接接触,寿命长
1.能量转化率高
2.避免氧化剂与还原剂直接接触,寿命长
3.内阻小,电流强
通过这节课你学会了什么?
单液原电池
双液原电池
隔膜原电池
隔膜原电池微型化
1.两极
2.电解质溶液
3.导线
4.自发进行的氧化还原反应
电池四要素
—离子导体
—电子导体
五、谈谈你的收获
四、学以致用
利用反应Cu + 2Fe3+ = 2Fe2+ + Cu2+ ,设计出单液与双液原电池图
负极
正极
Zn
Cu
电解液
还原反应
2H++2e-=H2↑
氧化反应
Zn-2e-=Zn2+
外电路
内电路
失e-,沿导线传递,产生电流
2.工作原理
阴离子
阳离子
天道酬勤 跬步高登
Chapter 04
化学反应与电能
4.1 原电池
学习目标:
1、从单液原电池工作原理,构建双液原电池工作原理
2、能设计简单的双液原电池,并书写电极反应式
3、从电池发展史体会社会“按需设计”的科学发展本质
4.1.1 原电池原理
一、回顾旧知
1. 原电池的基本概念
(1)概念:原电池是将 能转化为 能的装置。
(2)本质:氧化反应和还原反应分别在两个不同的区域进行。
(3)电极:
① 负极:________电子,发生________反应;
② 正极:________电子,发生________反应。
负极
正极
Zn
Cu
电解液
还原反应
2H++2e-=H2↑
氧化反应
Zn-2e-=Zn2+
外电路
内电路
失e-,沿导线传递,产生电流
2.工作原理
正电荷回路
负电荷回路
阴离子
阳离子
一、回顾旧知
下列哪些装置能构成原电池?
A
B
D
E
F
G
稀硫酸
Zn
Fe
稀硫酸
Ag
Cu
A
稀硫酸
Zn
Cu
酒精
Zn
Cu
H
稀硫酸
Zn
Zn
C
3:原电池的构成条件?
① 活动性有差异的两个电极
② 两极均插入电解质溶液;
③ 两极相连形成闭合电路。
④ 一个自发的氧化还原反应。
一、回顾旧知
答案:BED
【演示实验1】
将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有CuSO4溶液的烧杯中,请同学们观察锌片上现象和电流表指针变化?
重温-----锌铜原电池
【思考1】锌片上为什么有铜析出?为什么电流表读数会逐渐减小?
二、探索新知
演示实验1
铜片、锌片表面均附着红色固体,
电流表指针偏转,但电流逐渐衰减。
【实验现象】
Zn片
【原因分析】
现象
原因
锌片表面附着红色固体
电流逐渐衰减
Zn与Cu2+直接接触发生反应;
锌与CuSO4溶液的接触面积减少,电流逐渐衰减
Cu片
探索新知
温度
电流
17.3 ℃
0.126A
25 ℃
0.026A
【数字实验探究单液原电池】
探索新知
Zn片
【思考4】这个装置形成了原电池吗? 该用什么样的物质连接装置的内电路呢?怎样能使电解质溶液连通构成原电池?
【思考2】能否阻止Cu2+在锌片表面还原
【思考3】锌片应插入什么样的溶液中?
ZnSO4
CuSO4
探索新知
【学生演示实验】
用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连。
【观察并填写实验现象】
1.电流表指针偏转情况,工作一段时间有无变化
2.电解质溶液的变化
3.电极表面的变化
4.取出盐桥后的变化
探索新知
探索新知
观察现象
1.有盐桥存在时电流表指针 ;
2.铜片表面有 析出;
3.锌片逐渐 ;
4.随着时间的延续,能产生 稳定的电流;
5.取出盐桥 电流产生;
探索新知
发生偏移
铜
溶解
持续
无
小组讨论:1.盐桥的作用?
2.盐桥中离子移动方向
3.阴阳离子在电解液中的运动方向
三、讨论与交流
Cl-
K+
盐桥
一种凝胶态的离子导体
盐桥中通常装有: 含KCl饱和溶液的琼胶, K+和Cl-可在其中自由移动。
知识拓展:
离子迁移速率
知识拓展
双液电池的工作原理
负极:Zn - 2e- = Zn2+
正极:Cu2+ + 2e- = Cu
盐桥的作用
(1)形成闭合回路;
(2)平衡电荷,使溶液呈电中性;
(3)持续稳定的产生电流,提高能量转换率
负极
氧化反应
正极
还原反应
Cl-
K+
盐桥中的离子迁移进入两侧电解质溶液,联通了两侧电解质溶液,从而形成闭合回路。
汇报与总结
三、讨论与交流
优点: 避免电极与电解质溶液直接反应,减少电流的衰减,提高原电池的工作效率。
谈谈相对单液原电池,双液原电池的优缺点?
缺点:电流强度比较小。
膜电池:
硫酸铜
硫酸锌
Zn
知识拓展
膜电池:
硫酸铜
硫酸锌
Zn
你能谈谈单液原电池、双液原电池、隔膜原电池的优缺点吗?
三、讨论与交流
名称 单液原电池 双液原电池 隔膜原电池
优点
缺点
电流强
1.能量转化率低
2.氧化剂与还原剂直接接触,寿命短
1.内阻大,电流弱
2.盐桥需要定期更换
1.能量转化率高
2.避免氧化剂与还原剂直接接触,寿命长
1.能量转化率高
2.避免氧化剂与还原剂直接接触,寿命长
3.内阻小,电流强
通过这节课你学会了什么?
单液原电池
双液原电池
隔膜原电池
隔膜原电池微型化
1.两极
2.电解质溶液
3.导线
4.自发进行的氧化还原反应
电池四要素
—离子导体
—电子导体
五、谈谈你的收获
四、学以致用
利用反应Cu + 2Fe3+ = 2Fe2+ + Cu2+ ,设计出单液与双液原电池图
负极
正极
Zn
Cu
电解液
还原反应
2H++2e-=H2↑
氧化反应
Zn-2e-=Zn2+
外电路
内电路
失e-,沿导线传递,产生电流
2.工作原理
阴离子
阳离子
天道酬勤 跬步高登
