第44练 化学反应的方向与调控 同步练习(含答案)-2025年高考化学一轮复习
文档属性
| 名称 | 第44练 化学反应的方向与调控 同步练习(含答案)-2025年高考化学一轮复习 |

|
|
| 格式 | docx | ||
| 文件大小 | 592.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-05 00:00:00 | ||
图片预览

文档简介
1.25 ℃、1.01×105 Pa时,反应2N2O5(g)===4NO2(g)+O2(g) ΔH=109.8 kJ·mol-1,该反应能自发进行的原因是( )
A.该反应是吸热反应
B.该反应是放热反应
C.该反应是熵减小的反应
D.该反应的熵增大效应大于能量效应
2.(2023·镇江高三质检)下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)===2N2O(g) ΔH=16 kJ·mol-1
B.Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+O2(g) ΔH=91 kJ·mol-1
D.H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
3.合成氨反应达到平衡时,NH3的体积分数与温度、压强的关系如图所示。根据此图分析合成氨工业最有前途的研究方向是( )
A.提高分离技术
B.研制耐高压的合成塔
C.研制低温催化剂
D.探索不用N2和H2合成氨的新途径
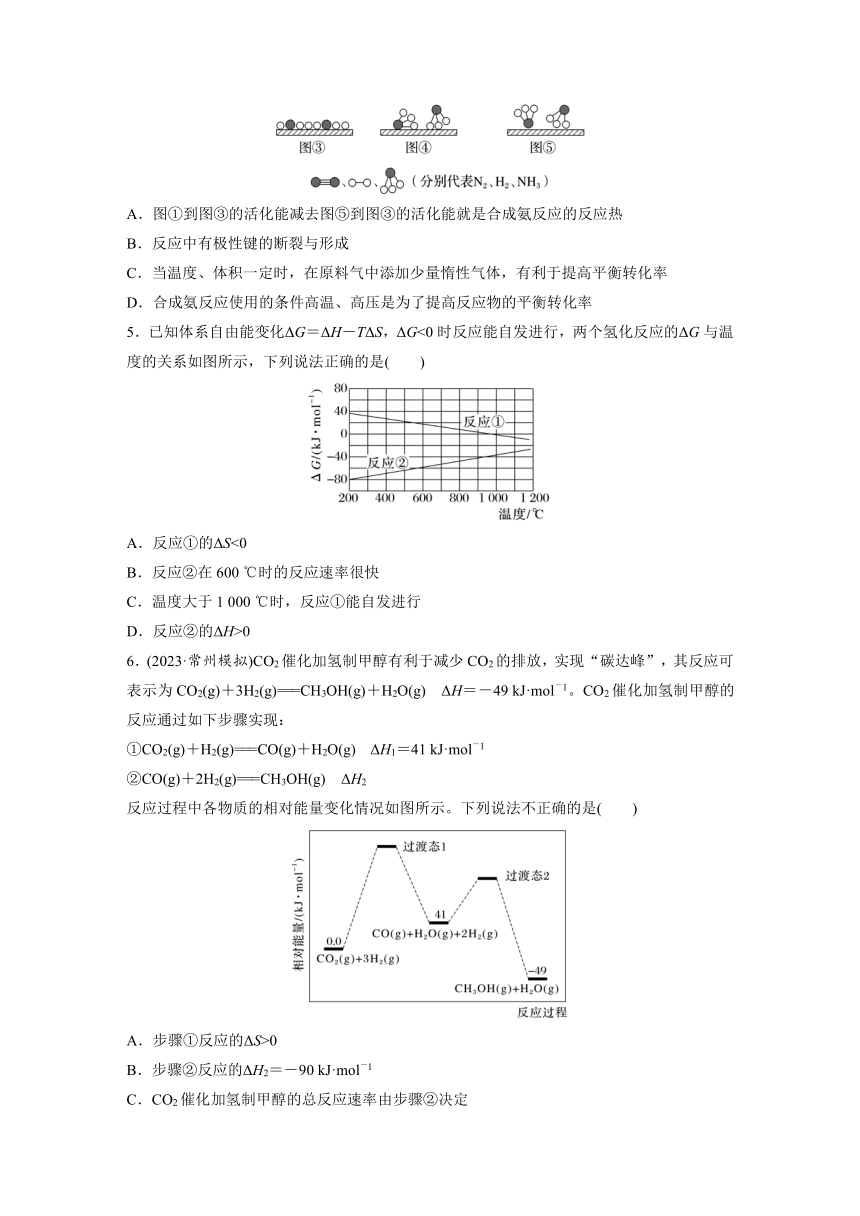
4.(2023·扬州模拟)2007年诺贝尔化学奖颁给了德国化学家格哈德·埃特尔(GerhardErtl),以表彰他在固体表面化学研究中取得的开拓性成就。他的成就之一是证实了氢气与氮气在固体催化剂表面合成氨气的反应过程,模拟示意图如图。关于合成氨工艺,下列说法正确的是( )
A.图①到图③的活化能减去图⑤到图③的活化能就是合成氨反应的反应热
B.反应中有极性键的断裂与形成
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率
D.合成氨反应使用的条件高温、高压是为了提高反应物的平衡转化率
5.已知体系自由能变化ΔG=ΔH-TΔS,ΔG<0时反应能自发进行,两个氢化反应的ΔG与温度的关系如图所示,下列说法正确的是( )
A.反应①的ΔS<0
B.反应②在600 ℃时的反应速率很快
C.温度大于1 000 ℃时,反应①能自发进行
D.反应②的ΔH>0
6.(2023·常州模拟)CO2催化加氢制甲醇有利于减少CO2的排放,实现“碳达峰”,其反应可表示为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。CO2催化加氢制甲醇的反应通过如下步骤实现:
①CO2(g)+H2(g)===CO(g)+H2O(g) ΔH1=41 kJ·mol-1
②CO(g)+2H2(g)===CH3OH(g) ΔH2
反应过程中各物质的相对能量变化情况如图所示。下列说法不正确的是( )
A.步骤①反应的ΔS>0
B.步骤②反应的ΔH2=-90 kJ·mol-1
C.CO2催化加氢制甲醇的总反应速率由步骤②决定
D.升高温度,各步骤的正、逆反应速率均增大
7.(2023·苏州高三质检)甲酸常用于橡胶、医药等工业。在一定条件下可分解生成CO和H2O,在无、有催化剂条件下的能量与反应历程的关系如图所示,下列说法不正确的是( )
A.可以通过E1和E2计算HCOOH的总键能
B.E1-E3=E4-E10
C.途径Ⅱ中H+参与反应,通过改变反应途径加快反应速率
D.途径Ⅰ未使用催化剂,但途径Ⅱ与途径Ⅰ甲酸平衡转化率相同
8.在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)LaNi5H6(s) ΔH=
-301 kJ·mol-1。在某温度下,达到平衡状态,测得氢气压强为2 MPa。下列说法不正确的是( )
A.当LaNi5的浓度不再变化时,该反应达到平衡状态
B.若温度不变,缩小容器的容积至原来的一半,重新达到平衡时H2的压强等于2 MPa
C.扩大容器的容积,重新达到平衡时n(H2)增多
D.增大压强,降低温度,有利于储氢
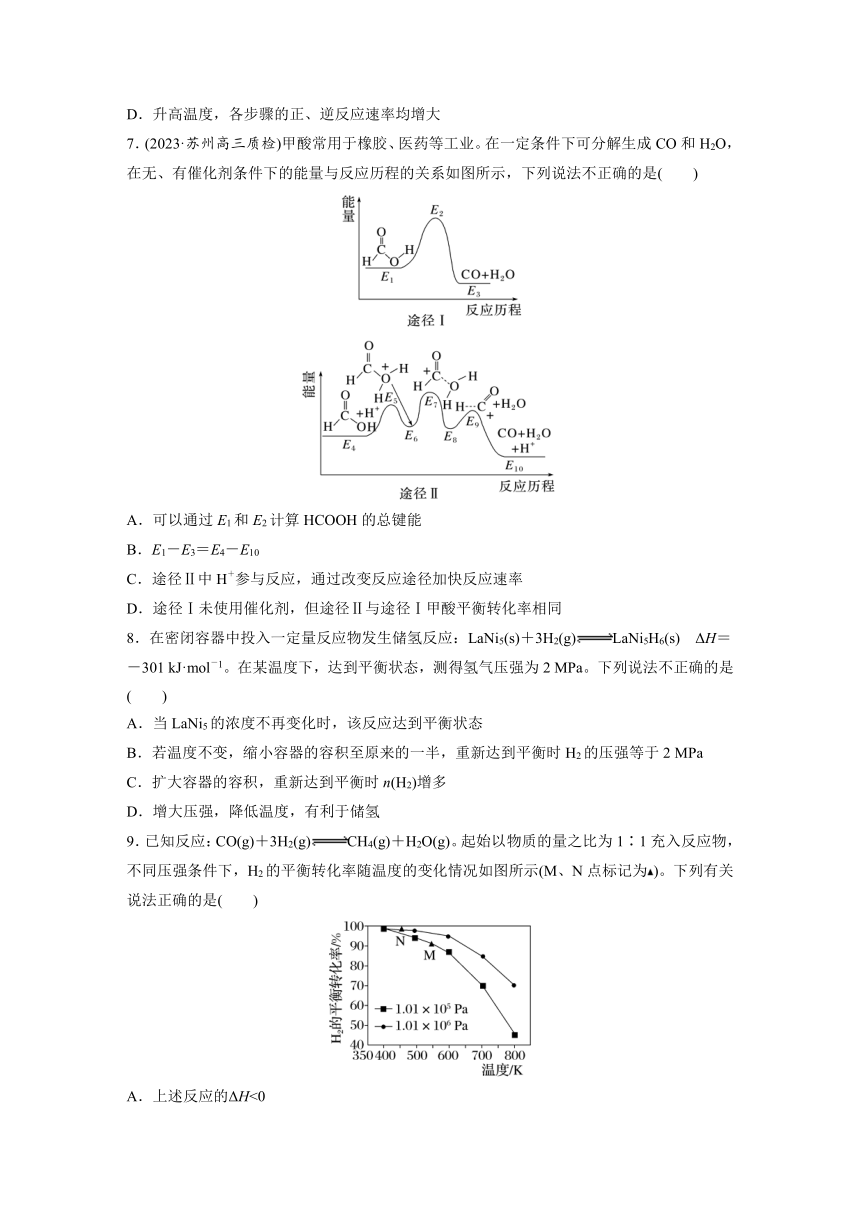
9.已知反应:CO(g)+3H2(g)CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是( )
A.上述反应的ΔH<0
B.N点时的反应速率一定比M点的快
C.降低温度,H2的转化率可达到100%
D.工业上用此法制取甲烷应采用更高的压强
10.将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105 Pa,将TiO2、C、Cl2以物质的量之比为1∶2∶2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。
下列说法不正确的是( )
A.200~1 600 ℃反应达到平衡时,TiO2的转化率均已接近100%
B.将400 ℃时的平衡体系加热至800 ℃,平衡C(s)+CO2(g)2CO(g)向正反应方向移动
C.1 000 ℃时,测得某时刻x(TiCl4)=0.2。其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4)
D.实际生产时反应温度选择900 ℃而不选择200 ℃,其主要原因是900 ℃比200 ℃时化学反应速率更快,生产效益更高
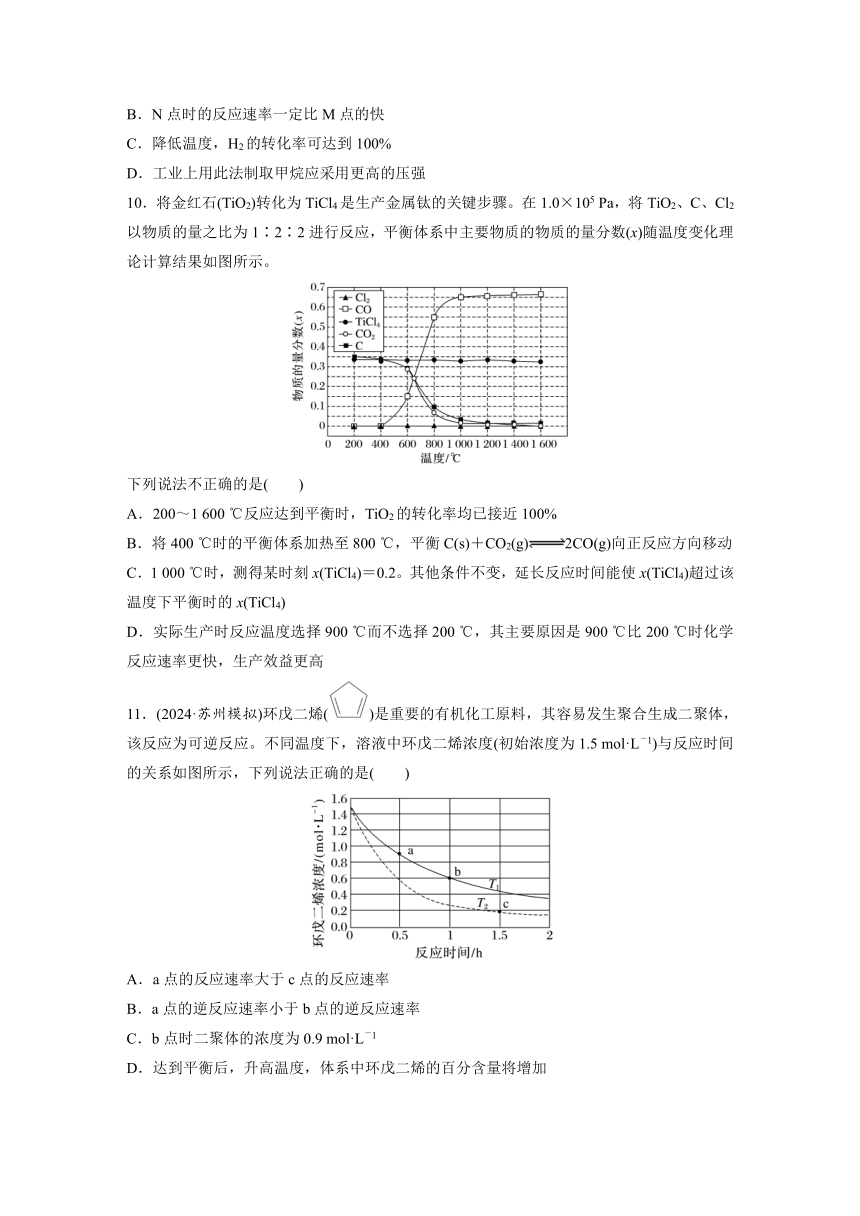
11.(2024·苏州模拟)环戊二烯()是重要的有机化工原料,其容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度(初始浓度为1.5 mol·L-1)与反应时间的关系如图所示,下列说法正确的是( )
A.a点的反应速率大于c点的反应速率
B.a点的逆反应速率小于b点的逆反应速率
C.b点时二聚体的浓度为0.9 mol·L-1
D.达到平衡后,升高温度,体系中环戊二烯的百分含量将增加
12.N2和H2生成NH3的反应为N2(g)+H2(g)NH3(g) ΔH(298 K)=-46.2 kJ·mol-1。
请回答:
(1)有利于提高合成氨平衡产率的条件有______(填字母)。
A.低温 B.高温 C.低压 D.高压
E.催化剂
(2)为各组分的平衡分压,如,p为平衡总压,为平衡系统中氨气的物质的量分数,N2、H2起始物质的量之比是1∶3,反应在恒定温度和总压强p(单位是Pa)下进行,NH3的平衡产率是w,用分压代替物质的量浓度计算平衡常数Kp=________。
13.丙烯是制备聚丙烯的单体,在催化剂作用下,可由丙烷直接脱氢或氧化脱氢制得。
反应Ⅰ(直接脱氢):
C3H8(g)C3H6(g)+H2(g) ΔH1
反应Ⅱ(氧化脱氢):
2C3H8(g)+O2(g)2C3H6(g)+2H2O(g)H2=-236 kJ·mol-1
已知:2H2(g)+O2(g)2H2O(g) ΔH3=-484 kJ·mol-1
(1)ΔH1=________kJ·mol-1。
(2)向某容器中仅通入C3H8(g),发生反应Ⅰ,达到平衡后,下列措施能提高C3H6(g)的平衡产率的有________(填字母)。
A.恒压下,充入惰性气体
B.加入高效催化剂
C.恒容下,充入C3H8
D.适当升高温度
(3)向某恒压密闭容器中通入C3H8(g)和N2(g)的混合气体(N2不参与反应),发生反应Ⅰ,反应起始时气体的总压强为100 kPa。在温度为T1 ℃时,C3H8(g)的平衡转化率与通入的混合气体中C3H8(g)的物质的量分数的关系如图所示。
①C3H8的平衡转化率随起始通入C3H8的物质的量分数增大而减小,其原因是________________________________________________________________________
________________________________________________________________________。
②T1 ℃时,反应Ⅰ的平衡常数Kp=________kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。
第44练 化学反应的方向与调控
1.D
2.D [A项,ΔH>0,ΔS<0,在任何温度下,ΔH-TΔS>0,即任何温度下反应都不能自发进行;B项,ΔH<0,ΔS<0,低温下反应能自发进行;C项,ΔH>0,ΔS>0,较高温度时能自发进行;D项,ΔH<0,ΔS>0,在任何温度下,ΔH-TΔS<0,即在任何温度下反应均能自发进行。]
3.C [由题图可知,NH3的体积分数随着温度的升高而显著下降,故要提高NH3的体积分数,必须降低温度,但目前所用催化剂铁触媒的活性最高时的温度为500 ℃,故最有前途的研究方向为研制低温催化剂。]
4.A [图①到图③为氮气和氢气中的化学键断裂的过程,图⑤到图③为氨气中化学键断裂的过程,故图①到图③的活化能减去图⑤到图③的活化能就是合成氨反应的反应热,A正确;该反应过程中只有非极性键的断裂和极性键的形成,B错误;当温度、体积一定时,在原料气中添加少量惰性气体不影响各组分的浓度,因此不影响平衡,不能提高平衡转化率,C错误;合成氨的反应是气体总体积减小的放热反应,故高压是为了提高反应物的平衡转化率,但高温不是为了提高转化率,D错误。]
5.C [反应①随温度的升高,ΔG逐渐减小,则ΔS>0,故A错误;该题可以推测自发反应时的温度,但无法推测什么温度的反应速率快慢,故B错误;反应①在温度大于1 000 ℃时ΔG<0,故此时反应①能自发进行,故C正确;根据图像和数学知识可知,反应②的ΔH<0,故D错误。]
6.C [A项,步骤①反应能自发,即ΔG=ΔH-TΔS<0,而此反应的ΔH>0,故ΔS>0,否则反应不可能自发,故A正确;步骤②反应的ΔH2=生成物的总能量-反应物的总能量=
-49 kJ·mol-1-41 kJ·mol-1=-90 kJ·mol-1,故B正确;步骤①的活化能高于步骤②,即步骤①的反应速率更慢,是总反应的决速步,故C错误;升高温度,各步骤的反应物和生成物的活化分子百分数均增大,各步骤的正、逆反应速率均增大,故D正确。]
7.A [由图可知,可以通过E1和E2计算甲酸转化为一氧化碳和水的正反应活化能,但不能计算甲酸的总键能,故A错误;催化剂能改变反应途径,但不能改变反应的焓变,则E1-E3=E4-E10,故B正确;由图可知,途径Ⅱ中氢离子先做反应物,后做生成物,是改变反应途径的催化剂,能加快反应速率,故C正确;催化剂能改变反应途径,但不能改变平衡的移动方向,则途径Ⅱ与途径Ⅰ甲酸平衡转化率相同,故D正确。]
8.A [LaNi5是固体,不能根据固体的浓度不变判断反应达到平衡状态,A错误;温度不变,缩小容器的容积至原来的一半,平衡常数Kp=不变,则重新达到平衡时H2的压强仍为2 MPa,B正确;扩大容器的容积,相当于减小压强,平衡向逆反应方向移动,则n(H2)增多,C正确;该反应的正反应是气体分子总数减小的放热反应,因此增大压强、降低温度,平衡正向移动,有利于储氢,D正确。]
9.A [根据题图,随着温度的升高,H2的平衡转化率降低,说明平衡向逆反应方向移动,故正反应为放热反应,即ΔH<0,A项正确;N点压强大于M点,M点温度高于N点,因此无法确定两点反应速率的快慢,B项错误;此反应是可逆反应,不能完全进行到底,C项错误;采用更高的压强对设备的要求更高,增加经济成本,D项错误。]
10.C [在1.0×105 Pa,将TiO2、C、Cl2以物质的量之比为1∶2∶2进行反应:TiO2+2C+2Cl2TiCl4+2CO,三者完全反应时,生成TiCl4、CO的物质的量之比为1∶2,此时TiCl4的物质的量分数约为33.3%,结合图像可知,200~1 600 ℃反应达到平衡时,TiCl4的物质的量分数约为33.3%,则TiO2转化率均已接近100%,A正确;结合图像可知,将400 ℃时的平衡体系加热至800 ℃,二氧化碳含量减小、一氧化碳含量增加,则平衡C(s)+CO2(g)??2CO(g)向正反应方向移动,B正确;延长时间不能改变平衡时物质的转化率,C错误。]
11.B [两点温度相同,环戊二烯的浓度a点大于b点, a点的逆反应速率小于b点的逆反应速率,故B正确;b点时环戊二烯的浓度减小0.9 mol·L-1,二聚体的浓度为0.45 mol·L-1,故C错误;虚线对应的反应速率快,则对应的温度高,T2温度更高,但是环戊二烯的百分含量低,说明升温平衡正向移动,达到平衡后,升高温度,体系中环戊二烯的百分含量将降低,故D错误。]
12.(1)AD (2)
解析 (2)由题意知,设起始n(N2)= mol,n(H2)= mol,列三段式:
N2(g)+H2(g)NH3(g)
起始/mol 0
转化/mol w w
平衡/mol - -w w
Kp==。
13.(1)124 (2)AD (3)①丙烷物质的量分数增大,相当于对平衡体系加压,平衡向逆反应方向移动 ②16.7
解析 (1)设已知反应为反应Ⅲ根据盖斯定律,反应Ⅰ=(反应Ⅱ-反应Ⅲ)可得ΔH1=
124 kJ·mol-1。(3)②据图可知:在温度为T1 ℃时,当通入C3H8的物质的量分数为0.4,C3H8的平衡转化率为50%,假设反应开始时通入气体物质的量为a mol,则n(C3H8)=0.4a mol,n(N2)=0.6a mol,则平衡时n(C3H8)=0.2a mol,n(C3H6)=n(H2)=0.2a mol,平衡时气体总物质的量n(总)=0.2a mol+0.2a mol+0.2a mol+0.6a mol=1.2a mol,C3H8、C3H6、H2的物质的量分数都是=,Kp==≈16.7 kPa。
A.该反应是吸热反应
B.该反应是放热反应
C.该反应是熵减小的反应
D.该反应的熵增大效应大于能量效应
2.(2023·镇江高三质检)下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)===2N2O(g) ΔH=16 kJ·mol-1
B.Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+O2(g) ΔH=91 kJ·mol-1
D.H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
3.合成氨反应达到平衡时,NH3的体积分数与温度、压强的关系如图所示。根据此图分析合成氨工业最有前途的研究方向是( )
A.提高分离技术
B.研制耐高压的合成塔
C.研制低温催化剂
D.探索不用N2和H2合成氨的新途径
4.(2023·扬州模拟)2007年诺贝尔化学奖颁给了德国化学家格哈德·埃特尔(GerhardErtl),以表彰他在固体表面化学研究中取得的开拓性成就。他的成就之一是证实了氢气与氮气在固体催化剂表面合成氨气的反应过程,模拟示意图如图。关于合成氨工艺,下列说法正确的是( )
A.图①到图③的活化能减去图⑤到图③的活化能就是合成氨反应的反应热
B.反应中有极性键的断裂与形成
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率
D.合成氨反应使用的条件高温、高压是为了提高反应物的平衡转化率
5.已知体系自由能变化ΔG=ΔH-TΔS,ΔG<0时反应能自发进行,两个氢化反应的ΔG与温度的关系如图所示,下列说法正确的是( )
A.反应①的ΔS<0
B.反应②在600 ℃时的反应速率很快
C.温度大于1 000 ℃时,反应①能自发进行
D.反应②的ΔH>0
6.(2023·常州模拟)CO2催化加氢制甲醇有利于减少CO2的排放,实现“碳达峰”,其反应可表示为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。CO2催化加氢制甲醇的反应通过如下步骤实现:
①CO2(g)+H2(g)===CO(g)+H2O(g) ΔH1=41 kJ·mol-1
②CO(g)+2H2(g)===CH3OH(g) ΔH2
反应过程中各物质的相对能量变化情况如图所示。下列说法不正确的是( )
A.步骤①反应的ΔS>0
B.步骤②反应的ΔH2=-90 kJ·mol-1
C.CO2催化加氢制甲醇的总反应速率由步骤②决定
D.升高温度,各步骤的正、逆反应速率均增大
7.(2023·苏州高三质检)甲酸常用于橡胶、医药等工业。在一定条件下可分解生成CO和H2O,在无、有催化剂条件下的能量与反应历程的关系如图所示,下列说法不正确的是( )
A.可以通过E1和E2计算HCOOH的总键能
B.E1-E3=E4-E10
C.途径Ⅱ中H+参与反应,通过改变反应途径加快反应速率
D.途径Ⅰ未使用催化剂,但途径Ⅱ与途径Ⅰ甲酸平衡转化率相同
8.在密闭容器中投入一定量反应物发生储氢反应:LaNi5(s)+3H2(g)LaNi5H6(s) ΔH=
-301 kJ·mol-1。在某温度下,达到平衡状态,测得氢气压强为2 MPa。下列说法不正确的是( )
A.当LaNi5的浓度不再变化时,该反应达到平衡状态
B.若温度不变,缩小容器的容积至原来的一半,重新达到平衡时H2的压强等于2 MPa
C.扩大容器的容积,重新达到平衡时n(H2)增多
D.增大压强,降低温度,有利于储氢
9.已知反应:CO(g)+3H2(g)CH4(g)+H2O(g)。起始以物质的量之比为1∶1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是( )
A.上述反应的ΔH<0
B.N点时的反应速率一定比M点的快
C.降低温度,H2的转化率可达到100%
D.工业上用此法制取甲烷应采用更高的压强
10.将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105 Pa,将TiO2、C、Cl2以物质的量之比为1∶2∶2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。
下列说法不正确的是( )
A.200~1 600 ℃反应达到平衡时,TiO2的转化率均已接近100%
B.将400 ℃时的平衡体系加热至800 ℃,平衡C(s)+CO2(g)2CO(g)向正反应方向移动
C.1 000 ℃时,测得某时刻x(TiCl4)=0.2。其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4)
D.实际生产时反应温度选择900 ℃而不选择200 ℃,其主要原因是900 ℃比200 ℃时化学反应速率更快,生产效益更高
11.(2024·苏州模拟)环戊二烯()是重要的有机化工原料,其容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度(初始浓度为1.5 mol·L-1)与反应时间的关系如图所示,下列说法正确的是( )
A.a点的反应速率大于c点的反应速率
B.a点的逆反应速率小于b点的逆反应速率
C.b点时二聚体的浓度为0.9 mol·L-1
D.达到平衡后,升高温度,体系中环戊二烯的百分含量将增加
12.N2和H2生成NH3的反应为N2(g)+H2(g)NH3(g) ΔH(298 K)=-46.2 kJ·mol-1。
请回答:
(1)有利于提高合成氨平衡产率的条件有______(填字母)。
A.低温 B.高温 C.低压 D.高压
E.催化剂
(2)为各组分的平衡分压,如,p为平衡总压,为平衡系统中氨气的物质的量分数,N2、H2起始物质的量之比是1∶3,反应在恒定温度和总压强p(单位是Pa)下进行,NH3的平衡产率是w,用分压代替物质的量浓度计算平衡常数Kp=________。
13.丙烯是制备聚丙烯的单体,在催化剂作用下,可由丙烷直接脱氢或氧化脱氢制得。
反应Ⅰ(直接脱氢):
C3H8(g)C3H6(g)+H2(g) ΔH1
反应Ⅱ(氧化脱氢):
2C3H8(g)+O2(g)2C3H6(g)+2H2O(g)H2=-236 kJ·mol-1
已知:2H2(g)+O2(g)2H2O(g) ΔH3=-484 kJ·mol-1
(1)ΔH1=________kJ·mol-1。
(2)向某容器中仅通入C3H8(g),发生反应Ⅰ,达到平衡后,下列措施能提高C3H6(g)的平衡产率的有________(填字母)。
A.恒压下,充入惰性气体
B.加入高效催化剂
C.恒容下,充入C3H8
D.适当升高温度
(3)向某恒压密闭容器中通入C3H8(g)和N2(g)的混合气体(N2不参与反应),发生反应Ⅰ,反应起始时气体的总压强为100 kPa。在温度为T1 ℃时,C3H8(g)的平衡转化率与通入的混合气体中C3H8(g)的物质的量分数的关系如图所示。
①C3H8的平衡转化率随起始通入C3H8的物质的量分数增大而减小,其原因是________________________________________________________________________
________________________________________________________________________。
②T1 ℃时,反应Ⅰ的平衡常数Kp=________kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。
第44练 化学反应的方向与调控
1.D
2.D [A项,ΔH>0,ΔS<0,在任何温度下,ΔH-TΔS>0,即任何温度下反应都不能自发进行;B项,ΔH<0,ΔS<0,低温下反应能自发进行;C项,ΔH>0,ΔS>0,较高温度时能自发进行;D项,ΔH<0,ΔS>0,在任何温度下,ΔH-TΔS<0,即在任何温度下反应均能自发进行。]
3.C [由题图可知,NH3的体积分数随着温度的升高而显著下降,故要提高NH3的体积分数,必须降低温度,但目前所用催化剂铁触媒的活性最高时的温度为500 ℃,故最有前途的研究方向为研制低温催化剂。]
4.A [图①到图③为氮气和氢气中的化学键断裂的过程,图⑤到图③为氨气中化学键断裂的过程,故图①到图③的活化能减去图⑤到图③的活化能就是合成氨反应的反应热,A正确;该反应过程中只有非极性键的断裂和极性键的形成,B错误;当温度、体积一定时,在原料气中添加少量惰性气体不影响各组分的浓度,因此不影响平衡,不能提高平衡转化率,C错误;合成氨的反应是气体总体积减小的放热反应,故高压是为了提高反应物的平衡转化率,但高温不是为了提高转化率,D错误。]
5.C [反应①随温度的升高,ΔG逐渐减小,则ΔS>0,故A错误;该题可以推测自发反应时的温度,但无法推测什么温度的反应速率快慢,故B错误;反应①在温度大于1 000 ℃时ΔG<0,故此时反应①能自发进行,故C正确;根据图像和数学知识可知,反应②的ΔH<0,故D错误。]
6.C [A项,步骤①反应能自发,即ΔG=ΔH-TΔS<0,而此反应的ΔH>0,故ΔS>0,否则反应不可能自发,故A正确;步骤②反应的ΔH2=生成物的总能量-反应物的总能量=
-49 kJ·mol-1-41 kJ·mol-1=-90 kJ·mol-1,故B正确;步骤①的活化能高于步骤②,即步骤①的反应速率更慢,是总反应的决速步,故C错误;升高温度,各步骤的反应物和生成物的活化分子百分数均增大,各步骤的正、逆反应速率均增大,故D正确。]
7.A [由图可知,可以通过E1和E2计算甲酸转化为一氧化碳和水的正反应活化能,但不能计算甲酸的总键能,故A错误;催化剂能改变反应途径,但不能改变反应的焓变,则E1-E3=E4-E10,故B正确;由图可知,途径Ⅱ中氢离子先做反应物,后做生成物,是改变反应途径的催化剂,能加快反应速率,故C正确;催化剂能改变反应途径,但不能改变平衡的移动方向,则途径Ⅱ与途径Ⅰ甲酸平衡转化率相同,故D正确。]
8.A [LaNi5是固体,不能根据固体的浓度不变判断反应达到平衡状态,A错误;温度不变,缩小容器的容积至原来的一半,平衡常数Kp=不变,则重新达到平衡时H2的压强仍为2 MPa,B正确;扩大容器的容积,相当于减小压强,平衡向逆反应方向移动,则n(H2)增多,C正确;该反应的正反应是气体分子总数减小的放热反应,因此增大压强、降低温度,平衡正向移动,有利于储氢,D正确。]
9.A [根据题图,随着温度的升高,H2的平衡转化率降低,说明平衡向逆反应方向移动,故正反应为放热反应,即ΔH<0,A项正确;N点压强大于M点,M点温度高于N点,因此无法确定两点反应速率的快慢,B项错误;此反应是可逆反应,不能完全进行到底,C项错误;采用更高的压强对设备的要求更高,增加经济成本,D项错误。]
10.C [在1.0×105 Pa,将TiO2、C、Cl2以物质的量之比为1∶2∶2进行反应:TiO2+2C+2Cl2TiCl4+2CO,三者完全反应时,生成TiCl4、CO的物质的量之比为1∶2,此时TiCl4的物质的量分数约为33.3%,结合图像可知,200~1 600 ℃反应达到平衡时,TiCl4的物质的量分数约为33.3%,则TiO2转化率均已接近100%,A正确;结合图像可知,将400 ℃时的平衡体系加热至800 ℃,二氧化碳含量减小、一氧化碳含量增加,则平衡C(s)+CO2(g)??2CO(g)向正反应方向移动,B正确;延长时间不能改变平衡时物质的转化率,C错误。]
11.B [两点温度相同,环戊二烯的浓度a点大于b点, a点的逆反应速率小于b点的逆反应速率,故B正确;b点时环戊二烯的浓度减小0.9 mol·L-1,二聚体的浓度为0.45 mol·L-1,故C错误;虚线对应的反应速率快,则对应的温度高,T2温度更高,但是环戊二烯的百分含量低,说明升温平衡正向移动,达到平衡后,升高温度,体系中环戊二烯的百分含量将降低,故D错误。]
12.(1)AD (2)
解析 (2)由题意知,设起始n(N2)= mol,n(H2)= mol,列三段式:
N2(g)+H2(g)NH3(g)
起始/mol 0
转化/mol w w
平衡/mol - -w w
Kp==。
13.(1)124 (2)AD (3)①丙烷物质的量分数增大,相当于对平衡体系加压,平衡向逆反应方向移动 ②16.7
解析 (1)设已知反应为反应Ⅲ根据盖斯定律,反应Ⅰ=(反应Ⅱ-反应Ⅲ)可得ΔH1=
124 kJ·mol-1。(3)②据图可知:在温度为T1 ℃时,当通入C3H8的物质的量分数为0.4,C3H8的平衡转化率为50%,假设反应开始时通入气体物质的量为a mol,则n(C3H8)=0.4a mol,n(N2)=0.6a mol,则平衡时n(C3H8)=0.2a mol,n(C3H6)=n(H2)=0.2a mol,平衡时气体总物质的量n(总)=0.2a mol+0.2a mol+0.2a mol+0.6a mol=1.2a mol,C3H8、C3H6、H2的物质的量分数都是=,Kp==≈16.7 kPa。
同课章节目录
