化学人教版(2019)必修第二册7.1.2烷烃结构与性质 同系物(共30张ppt)(任务驱动)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.1.2烷烃结构与性质 同系物(共30张ppt)(任务驱动) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-06 17:39:59 | ||
图片预览







文档简介
(共30张PPT)
课时2 烷烃的结构和性质 同系物
第七章 有机化合物
第一节 认识有机化合物
学习目标
1.以烷烃的代表物——甲烷的结构和性质为模型,认识烷烃的结构和性质。从微观的化学键视角探析有机化合物的分子结构,发展“微观探析”的学科核心素养。。
2.掌握取代反应的概念及特点,认识甲烷与氯气发生取代反应的反应原理,并从微观角度进行探析。
3、掌握同系物概念,初步了解有机物组成和结构的表示方法
新课导入
煤层气
含碳原子
个数较多的烷烃
凡士林
天然气
沼气
蜡烛
蜡笔
主要成分甲烷
请结合生活和初中化学的有关知识,想一想烷烃可能具有哪些性质?
在生活中我们接触过哪些烷烃?
探究课堂
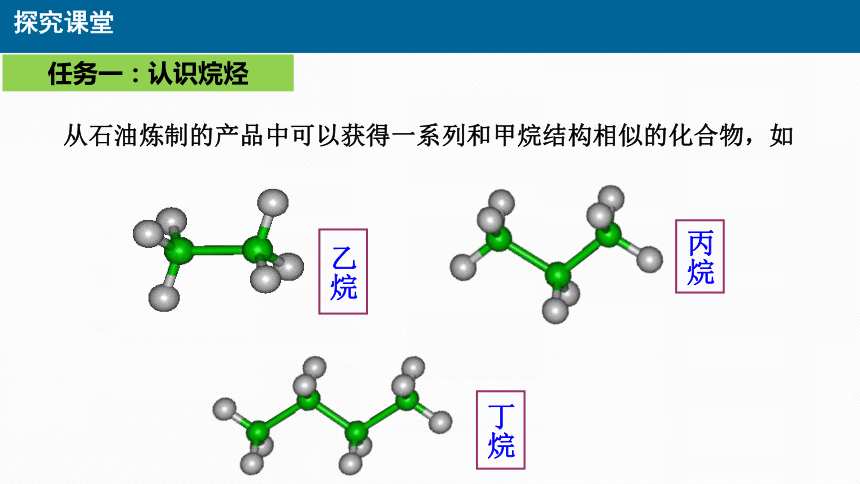
从石油炼制的产品中可以获得一系列和甲烷结构相似的化合物,如
乙烷
丙烷
丁烷
任务一:认识烷烃
探究课堂
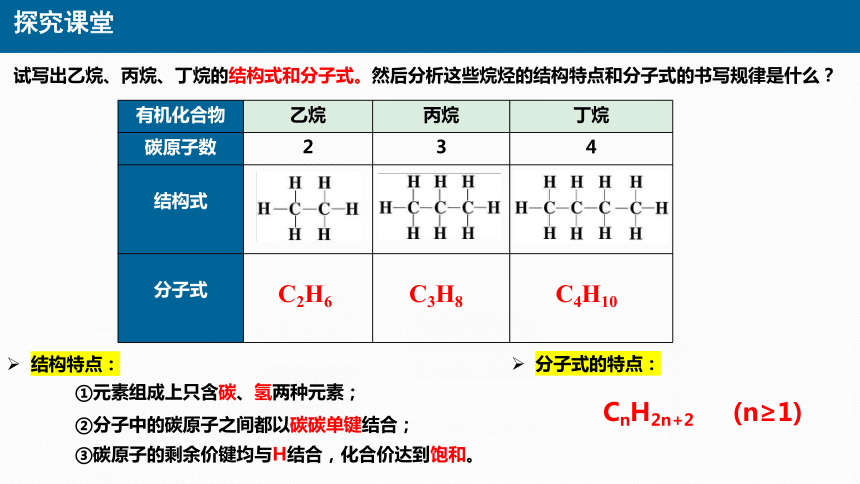
试写出乙烷、丙烷、丁烷的结构式和分子式。然后分析这些烷烃的结构特点和分子式的书写规律是什么?
有机化合物 乙烷 丙烷 丁烷
碳原子数 2 3 4
结构式
分子式
①元素组成上只含碳、氢两种元素;
②分子中的碳原子之间都以碳碳单键结合;
③碳原子的剩余价键均与H结合,化合价达到饱和。
C2H6
C3H8
C4H10
结构特点:
分子式的特点:
CnH2n+2 (n≥1)
探究课堂
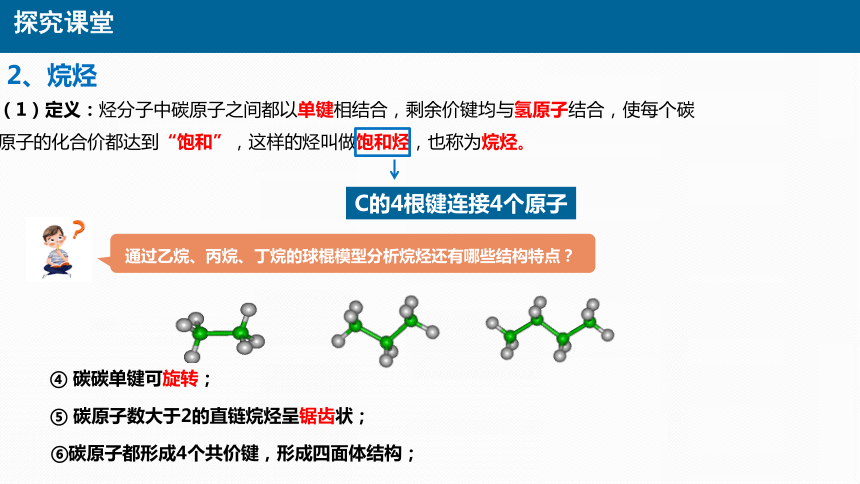
2、烷烃
(1)定义:烃分子中碳原子之间都以单键相结合,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃。
C的4根键连接4个原子
通过乙烷、丙烷、丁烷的球棍模型分析烷烃还有哪些结构特点?
④ 碳碳单键可旋转;
⑤ 碳原子数大于2的直链烷烃呈锯齿状;
⑥碳原子都形成4个共价键,形成四面体结构;
探究课堂
【例】按要求填空。
(1)下列属于链状烷烃的是________(填字母)。
A.C2H4 B.C3H4
C.C4H8 D.C5H12
E.C7H14 F.C9H20
(2)分子中含18个氢原子的链状烷烃分子式为____________。
(3)相对分子质量为58的链状烷烃分子式为__________。
(4)某链状烷烃分子中含6个碳原子,则该链状烷烃的相对分子质量为________。
D F
C8H18
C4H10
86
探究课堂
任务二:烷烃的物理性质
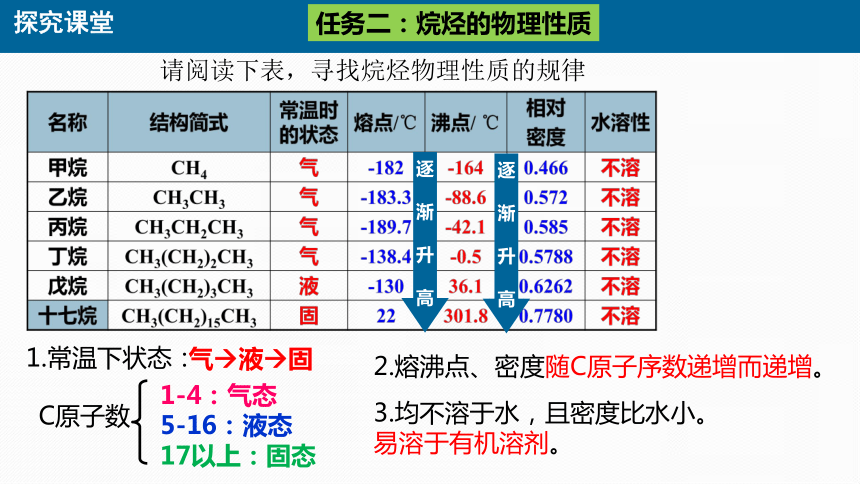
请阅读下表,寻找烷烃物理性质的规律
逐
渐
升
高
逐
渐
升
高
1-4:气态 5-16:液态 17以上:固态
C原子数
气 液 固
2.熔沸点、密度随C原子序数递增而递增。
3.均不溶于水,且密度比水小。
易溶于有机溶剂。
1.常温下状态:
探究课堂
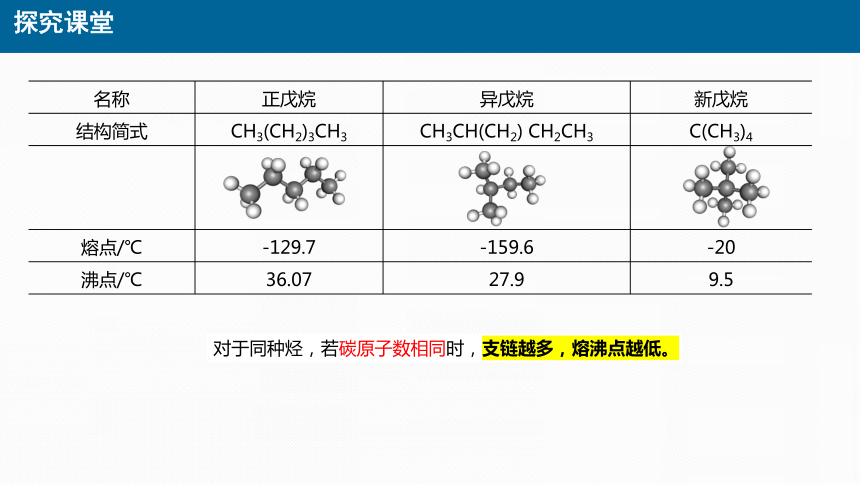
名称 正戊烷 异戊烷 新戊烷
结构简式 CH3(CH2)3CH3 CH3CH(CH2) CH2CH3 C(CH3)4
熔点/℃ -129.7 -159.6 -20
沸点/℃ 36.07 27.9 9.5
对于同种烃,若碳原子数相同时,支链越多,熔沸点越低。
探究课堂
1.下列五种烷烃:① CH3(CH2)4CH3 ②CH3CH2CH(CH3)2
③ CH3CH2CH3 ④ CH3CH3 ⑤ CH3(CH2)3CH3,其沸点按由高到低的顺序排列正确的是( )
A.①⑤②③④ B.②③④⑤①
C.⑤②①③④ D.④①②⑤③
A
探究课堂
相似性 递变性(随分子中碳原子数增加)
熔、沸点 较低 逐渐_____
密度 比水___ 逐渐_____
状态 常温下分子中碳原子数n≤4的烷烃为气态,5≤n≤16为液态,n>16为固态
溶解性 难溶于 ,易溶于汽油等________
升高
增大
小
水
有机溶剂
归纳总结:烷烃的物理性质
探究课堂
任务三:烷烃的化学性质
通常情况下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不发生反应。
浓硫酸
氢氧化钠
高锰酸钾
×
×
×
1、稳定性
探究课堂
与甲烷相似,烷烃可以在空气中完全燃烧,发生氧化反应,生成二氧化碳和水,并放出大量的热。
燃料
甲烷
丙烷
石蜡
煤油
丁烷
故烷烃都是很好的燃料
烷烃燃烧通式:
CnH2n+2 + O2 CO2 + H2O
点燃
3n+1
2
n
(n+1)
2、氧化反应——可燃性
探究课堂
在光照条件下,烷烃可与卤素单质发生取代反应:
CnH2n+2 + X2
CnH2n+1X + HX
光
3、取代反应
CH3CH3 + Cl2 CH3CH2Cl + HCl
光照
【例】 1mol乙烷在光照条件下,最多可以与多少摩尔Cl2发生取代?( )
A、4mol B、8mol C、2mol D、6mol
D
探究课堂
烷烃在较高温度下会发生分解,常应用于石油化工和天然气化工生产中。
石油裂解即石油分馏产物的深度裂化
4、分解反应
需要隔绝空气
CH4 C + 2H2
高温
C4H10 CH2= CH2(乙烯)+ CH3CH3
高温
探究课堂
CH3(CH2)9CH3
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
乙烷
丙烷
十一烷
丁烷
观察以上几种烷烃的结构简式,这些烷烃分子有什么特点,在组成上有什么差异呢?
任务四:同系物
探究课堂
CH3(CH2)9CH3
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
乙烷
丙烷
十一烷
丁烷
结构上:同类物质结构相似
分子组成:相差一个或若干个CH2原子团
同系物
(相对分子质量相差14n)
同系物所含元素种类一定相同,除C、H外其他种类元素原子数必须相同
探究课堂
同系物的特点:
同、似、差
属于同一类物质
有相同的通式
结构相似
化学性质相似
分子式不同
组成相差若干个CH2
探究课堂
【例】下列物质是否为同系物?
① CH3CH3 和 CH3COOH
② CH3-CH3 和
③ CH4 和 CH3CH3
④ CH3CH2CH3 和
CH3-CH2-CH-CH3
│
CH3
否
否
是
是
CH3
CH2
CH2
CH3
CH3
CH3
CH
CH3
⑤
否
H2C
CH2
CH2
探究课堂
【例】下列物质中属于同系物的是_________.
①CH2=CH-CH3 ②CH4 ③H2
④CH3(CH2)5CH(CH3)CH3 ⑤
CH2—CH2
CH2—CH2
②③
同系物判断的几个“一定”和“不一定”
① 同系物在分子组成上一定相差一个或若干个“CH2”原子团;
但在分子组成上相差一个或若干个“CH2”原子团的有机物不一定是同系物。
② 同系物具有同一通式,但具有同一通式的有机物不一定是同系物。
③ 同系物的化学性质一定相似,但化学性质相似的物质不一定是同系物。
④ 同系物的相对分子质量一定不相同。
探究课堂
结构简式
省略C H键,把同一碳原子上的H合并,省略横线上C C键
【注意】省略单键,但双键、三键不能省略
省略横线上
C—C键
CH3-CH3
CH3CH3
结构式
结构简式
结构简式
把同一C上的H合并
省略C—H键
任务五:有机物组成和结构的表示方法
探究课堂
【例】写出下列有机物的结构简式:
CH3CH2CH2CH3
CH3CH2CH3
CH3
CH3-CH-CH3或CH3CH(CH3 )CH3
探究课堂
表示物质组成的各元素原子最简整数比的式子。
分子式
最简式(实验式)
如 C4H10 的最简式为
C2H5
结构式
用短线来表示原子间的共用电子对
电子式
用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目
用小黑点等符号代替电子,表示原子最外层电子成键情况的式子
探究课堂
键线式
省略碳、氢元素符号,只写碳碳键;通常相邻碳碳键之间的夹角画成120°,每个端点和转折点都表示碳原子,除C、H以外原子都保留下来。
CH3CH2CH3 键线式可表示为__________________
键线式可表示为__________________
CH3CH=CHCH3 键线式可表示为__________________
探究课堂
分子模型
空间填充模型
球棍模型
最能反映真实结构
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
烷烃的结构与甲烷的相似
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
课堂小结
1、标准状况下,0.1 mol某烷烃完全燃烧生成11.2 L CO2。
(1)写出该烷烃的分子式:_________。
(2)写出该烷烃燃烧的化学方程式:______________________________。
(3)该烷烃的同分异构体有多种,写出分子中含有4个甲基(-CH3)的结构
简式:___________。
课堂达标
C5H12
C5H12+8O2 5CO2+6H2O
点燃
2.某有机化合物的结构简式为
下列说法中不正确的是( )
A.该有机化合物属于烷烃
B.1 mol该烃最多能与14 mol氯气发生取代反应
C.该烃的密度大于CH3—CH3,但小于水的密度
D.该烃的最简单同系物的二氯取代物有两种
D
课堂达标
3.丁烷有两种不同结构,分别为正丁烷和异丁烷,均可用作制冷剂,下列关于丁烷的说法正确的是( )
A.异丁烷的沸点高于正丁烷的沸点
B.正丁烷和异丁烷中碳原子均不可能共平面
C.可以通过酸性KMnO4溶液鉴别正丁烷和异丁烷
D.丁烷的一氯取代物共有4种结构(不包含立体异构)
D
课堂达标
课时2 烷烃的结构和性质 同系物
第七章 有机化合物
第一节 认识有机化合物
学习目标
1.以烷烃的代表物——甲烷的结构和性质为模型,认识烷烃的结构和性质。从微观的化学键视角探析有机化合物的分子结构,发展“微观探析”的学科核心素养。。
2.掌握取代反应的概念及特点,认识甲烷与氯气发生取代反应的反应原理,并从微观角度进行探析。
3、掌握同系物概念,初步了解有机物组成和结构的表示方法
新课导入
煤层气
含碳原子
个数较多的烷烃
凡士林
天然气
沼气
蜡烛
蜡笔
主要成分甲烷
请结合生活和初中化学的有关知识,想一想烷烃可能具有哪些性质?
在生活中我们接触过哪些烷烃?
探究课堂
从石油炼制的产品中可以获得一系列和甲烷结构相似的化合物,如
乙烷
丙烷
丁烷
任务一:认识烷烃
探究课堂
试写出乙烷、丙烷、丁烷的结构式和分子式。然后分析这些烷烃的结构特点和分子式的书写规律是什么?
有机化合物 乙烷 丙烷 丁烷
碳原子数 2 3 4
结构式
分子式
①元素组成上只含碳、氢两种元素;
②分子中的碳原子之间都以碳碳单键结合;
③碳原子的剩余价键均与H结合,化合价达到饱和。
C2H6
C3H8
C4H10
结构特点:
分子式的特点:
CnH2n+2 (n≥1)
探究课堂
2、烷烃
(1)定义:烃分子中碳原子之间都以单键相结合,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃。
C的4根键连接4个原子
通过乙烷、丙烷、丁烷的球棍模型分析烷烃还有哪些结构特点?
④ 碳碳单键可旋转;
⑤ 碳原子数大于2的直链烷烃呈锯齿状;
⑥碳原子都形成4个共价键,形成四面体结构;
探究课堂
【例】按要求填空。
(1)下列属于链状烷烃的是________(填字母)。
A.C2H4 B.C3H4
C.C4H8 D.C5H12
E.C7H14 F.C9H20
(2)分子中含18个氢原子的链状烷烃分子式为____________。
(3)相对分子质量为58的链状烷烃分子式为__________。
(4)某链状烷烃分子中含6个碳原子,则该链状烷烃的相对分子质量为________。
D F
C8H18
C4H10
86
探究课堂
任务二:烷烃的物理性质
请阅读下表,寻找烷烃物理性质的规律
逐
渐
升
高
逐
渐
升
高
1-4:气态 5-16:液态 17以上:固态
C原子数
气 液 固
2.熔沸点、密度随C原子序数递增而递增。
3.均不溶于水,且密度比水小。
易溶于有机溶剂。
1.常温下状态:
探究课堂
名称 正戊烷 异戊烷 新戊烷
结构简式 CH3(CH2)3CH3 CH3CH(CH2) CH2CH3 C(CH3)4
熔点/℃ -129.7 -159.6 -20
沸点/℃ 36.07 27.9 9.5
对于同种烃,若碳原子数相同时,支链越多,熔沸点越低。
探究课堂
1.下列五种烷烃:① CH3(CH2)4CH3 ②CH3CH2CH(CH3)2
③ CH3CH2CH3 ④ CH3CH3 ⑤ CH3(CH2)3CH3,其沸点按由高到低的顺序排列正确的是( )
A.①⑤②③④ B.②③④⑤①
C.⑤②①③④ D.④①②⑤③
A
探究课堂
相似性 递变性(随分子中碳原子数增加)
熔、沸点 较低 逐渐_____
密度 比水___ 逐渐_____
状态 常温下分子中碳原子数n≤4的烷烃为气态,5≤n≤16为液态,n>16为固态
溶解性 难溶于 ,易溶于汽油等________
升高
增大
小
水
有机溶剂
归纳总结:烷烃的物理性质
探究课堂
任务三:烷烃的化学性质
通常情况下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强氧化剂不发生反应。
浓硫酸
氢氧化钠
高锰酸钾
×
×
×
1、稳定性
探究课堂
与甲烷相似,烷烃可以在空气中完全燃烧,发生氧化反应,生成二氧化碳和水,并放出大量的热。
燃料
甲烷
丙烷
石蜡
煤油
丁烷
故烷烃都是很好的燃料
烷烃燃烧通式:
CnH2n+2 + O2 CO2 + H2O
点燃
3n+1
2
n
(n+1)
2、氧化反应——可燃性
探究课堂
在光照条件下,烷烃可与卤素单质发生取代反应:
CnH2n+2 + X2
CnH2n+1X + HX
光
3、取代反应
CH3CH3 + Cl2 CH3CH2Cl + HCl
光照
【例】 1mol乙烷在光照条件下,最多可以与多少摩尔Cl2发生取代?( )
A、4mol B、8mol C、2mol D、6mol
D
探究课堂
烷烃在较高温度下会发生分解,常应用于石油化工和天然气化工生产中。
石油裂解即石油分馏产物的深度裂化
4、分解反应
需要隔绝空气
CH4 C + 2H2
高温
C4H10 CH2= CH2(乙烯)+ CH3CH3
高温
探究课堂
CH3(CH2)9CH3
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
乙烷
丙烷
十一烷
丁烷
观察以上几种烷烃的结构简式,这些烷烃分子有什么特点,在组成上有什么差异呢?
任务四:同系物
探究课堂
CH3(CH2)9CH3
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
乙烷
丙烷
十一烷
丁烷
结构上:同类物质结构相似
分子组成:相差一个或若干个CH2原子团
同系物
(相对分子质量相差14n)
同系物所含元素种类一定相同,除C、H外其他种类元素原子数必须相同
探究课堂
同系物的特点:
同、似、差
属于同一类物质
有相同的通式
结构相似
化学性质相似
分子式不同
组成相差若干个CH2
探究课堂
【例】下列物质是否为同系物?
① CH3CH3 和 CH3COOH
② CH3-CH3 和
③ CH4 和 CH3CH3
④ CH3CH2CH3 和
CH3-CH2-CH-CH3
│
CH3
否
否
是
是
CH3
CH2
CH2
CH3
CH3
CH3
CH
CH3
⑤
否
H2C
CH2
CH2
探究课堂
【例】下列物质中属于同系物的是_________.
①CH2=CH-CH3 ②CH4 ③H2
④CH3(CH2)5CH(CH3)CH3 ⑤
CH2—CH2
CH2—CH2
②③
同系物判断的几个“一定”和“不一定”
① 同系物在分子组成上一定相差一个或若干个“CH2”原子团;
但在分子组成上相差一个或若干个“CH2”原子团的有机物不一定是同系物。
② 同系物具有同一通式,但具有同一通式的有机物不一定是同系物。
③ 同系物的化学性质一定相似,但化学性质相似的物质不一定是同系物。
④ 同系物的相对分子质量一定不相同。
探究课堂
结构简式
省略C H键,把同一碳原子上的H合并,省略横线上C C键
【注意】省略单键,但双键、三键不能省略
省略横线上
C—C键
CH3-CH3
CH3CH3
结构式
结构简式
结构简式
把同一C上的H合并
省略C—H键
任务五:有机物组成和结构的表示方法
探究课堂
【例】写出下列有机物的结构简式:
CH3CH2CH2CH3
CH3CH2CH3
CH3
CH3-CH-CH3或CH3CH(CH3 )CH3
探究课堂
表示物质组成的各元素原子最简整数比的式子。
分子式
最简式(实验式)
如 C4H10 的最简式为
C2H5
结构式
用短线来表示原子间的共用电子对
电子式
用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目
用小黑点等符号代替电子,表示原子最外层电子成键情况的式子
探究课堂
键线式
省略碳、氢元素符号,只写碳碳键;通常相邻碳碳键之间的夹角画成120°,每个端点和转折点都表示碳原子,除C、H以外原子都保留下来。
CH3CH2CH3 键线式可表示为__________________
键线式可表示为__________________
CH3CH=CHCH3 键线式可表示为__________________
探究课堂
分子模型
空间填充模型
球棍模型
最能反映真实结构
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
烷烃的结构与甲烷的相似
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
课堂小结
1、标准状况下,0.1 mol某烷烃完全燃烧生成11.2 L CO2。
(1)写出该烷烃的分子式:_________。
(2)写出该烷烃燃烧的化学方程式:______________________________。
(3)该烷烃的同分异构体有多种,写出分子中含有4个甲基(-CH3)的结构
简式:___________。
课堂达标
C5H12
C5H12+8O2 5CO2+6H2O
点燃
2.某有机化合物的结构简式为
下列说法中不正确的是( )
A.该有机化合物属于烷烃
B.1 mol该烃最多能与14 mol氯气发生取代反应
C.该烃的密度大于CH3—CH3,但小于水的密度
D.该烃的最简单同系物的二氯取代物有两种
D
课堂达标
3.丁烷有两种不同结构,分别为正丁烷和异丁烷,均可用作制冷剂,下列关于丁烷的说法正确的是( )
A.异丁烷的沸点高于正丁烷的沸点
B.正丁烷和异丁烷中碳原子均不可能共平面
C.可以通过酸性KMnO4溶液鉴别正丁烷和异丁烷
D.丁烷的一氯取代物共有4种结构(不包含立体异构)
D
课堂达标
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
