7.3.1乙醇课件(共47张ppt)化学人教版(2019)必修第二册第七章
文档属性
| 名称 | 7.3.1乙醇课件(共47张ppt)化学人教版(2019)必修第二册第七章 |  | |
| 格式 | pptx | ||
| 文件大小 | 32.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-06 21:22:13 | ||
图片预览








文档简介
(共47张PPT)
第七章 有机化合物
第三节 乙醇 乙酸
环节一:情境导入,感知乙醇的物理性质
乙醇的物理性质
无色、特殊香味液体
和水任意比互溶
易挥发
比水小
颜色、状态、气味
溶解性
密度
挥发性
俗称:酒精
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
【实验7-4】
在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃(如图7-19),在将干燥的小烧杯罩在火焰上。待烧杯璧上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水。
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
钠沉在乙醇的底部,
反应较缓慢,表面有气体放出 气体能燃烧,燃烧产物不能使澄清的石灰水变浑浊
实验现象:
钠与乙醇反应生成的气体为H2
钠密度大于乙醇
实验结论:
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
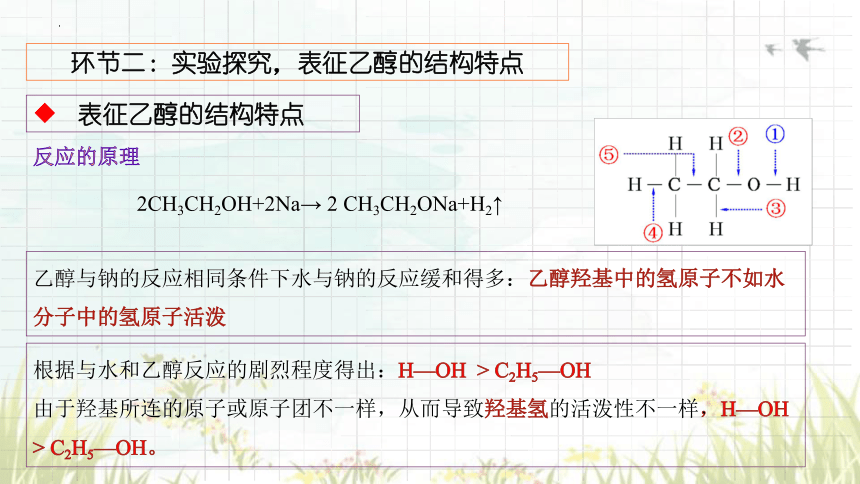
反应的原理
2CH3CH2OH+2Na→ 2 CH3CH2ONa+H2↑
乙醇与钠的反应相同条件下水与钠的反应缓和得多:乙醇羟基中的氢原子不如水分子中的氢原子活泼
根据与水和乙醇反应的剧烈程度得出:H—OH > C2H5—OH
由于羟基所连的原子或原子团不一样,从而导致羟基氢的活泼性不一样,H—OH > C2H5—OH。
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
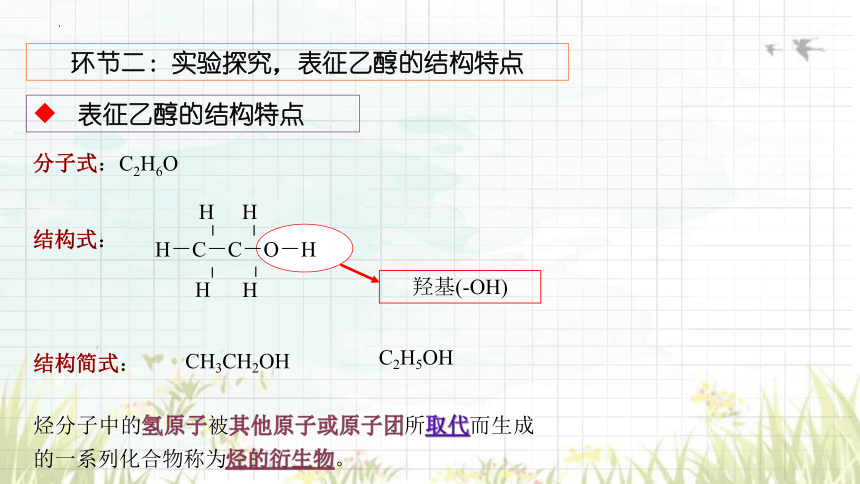
分子式:C2H6O
结构式:
结构简式:
CH3CH2OH
C2H5OH
羟基(-OH)
H-C-C-O-H
-
H
-
-
-
H
H
H
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
环节二:实验探究,表征乙醇的结构特点
概念辨析
官能团:像这种决定有机化合物特性的原子或原子团叫做官能团。羟基是醇类物质的官能团,碳碳双键和碳碳三键分别是烯烃和炔烃的官能团。
烃基:烃分子失去1个氢原子后所剩余的部分叫做烃基,可以用一R来表示。如一CH3叫甲基,一CH2CH3,叫乙基。
烃的衍生物:烃的衍生物分子一般可以看成是烃基和官能团相互结合组成的。例如,乙醇分子可以看成是由乙基和羟基组成的:CH3CH2-OH。
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
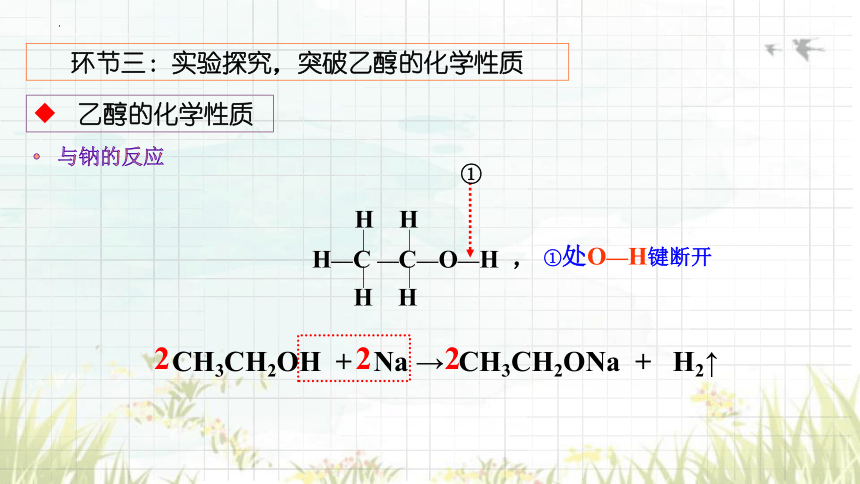
与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
H—C —C—O—H ,
H H
H H
①处O—H键断开
①
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——燃烧
现象:产生淡蓝色火焰,同时放出大量热。
C2H5OH + 3O2 2CO2 +3H2O
点燃
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——催化氧化
高温焊接银器或铜器时,表面会生成黑色的氧化物,师傅说:把铜或银器具趁热蘸一下酒精,铜或银会光亮如初!这是为什么呢?
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
【实验7-5】 向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。
现象:
在酒精灯上加热时铜丝由 红色变黑,插入乙醇后铜丝 又由黑变红色。试管中液体有刺激性气味。
氧化反应——催化氧化
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——催化氧化
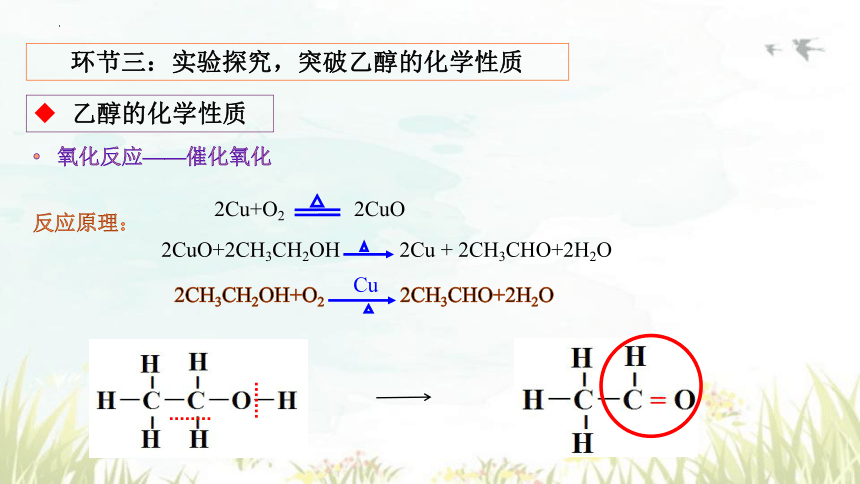
反应原理:
2Cu+O2 2CuO
2CuO+2CH3CH2OH 2Cu + 2CH3CHO+2H2O
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
醇发生催化氧化需满足的条件:
本碳有氢
氧化反应——催化氧化
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
【资料卡片】酗酒的危害
酒的主要成分是乙醇,少量饮酒对人体有益,但酗酒有害健康。科学研究表明酒量的大小与人体内某些酶有关。乙醇进入人体后,会在肝中通过酶的催化作用被氧化为乙醛和乙酸,最终被氧化为二氧化碳和水。过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用。
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——被强氧化剂氧化
据交警介绍,在机动车驾驶人的每100毫升血液中,酒精含量达到20毫克为饮酒驾车,大致相当于饮用一杯啤酒;每100毫升血液中酒精含量达到和超过80毫克可以认定为醉酒驾车,相当于饮用3两低度白酒或者两瓶啤酒。你知道酒精检测仪的工作原理吗?
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——被强氧化剂氧化
CH3CH2OH
乙醇
氧化
K2Cr2O7或KMnO4
CH3CHO
乙醛
氧化
K2Cr2O7或KMnO4
CH3COOH
乙酸
两个阶段:
K2Cr2O7
Cr2(SO4)3
乙醇
KMnO4(紫色)
MnSO4
(无色)
环节三:实验探究,突破乙醇的化学性质
乙醇的用途
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
(3) 医疗上常用体积分数为75%的乙醇溶液作消毒剂。
乙醇
分子组成和结构
用途
分子式
结构式
官能团
C2H6O
—OH
燃料
化工原料
医用消毒剂
物理性质
无色、有特殊香味的液体
密度小于水
易溶于水和有机溶剂
沸点较低,易挥发
化学性质
与强氧化剂反应
氧化反应
置换反应
使酸性高锰酸钾溶液褪色
与羟基相连的碳上必须有氢原子
淡蓝色火焰
乙醇与钠反应
环节四:归纳整理,巩固提升
归纳整理
环节二:归纳整理,巩固提升
巩固提升
1.比较乙烷和乙醇的结构,下列说法错误的是( )
A.分子中的化学键都包括极性键和非极性键
B.分子中都含6个氢原子且6个氢原子的化学环境完全相同
C.乙基与1个氢原子相连就是乙烷分子
D.乙基与1个羟基相连就是乙醇分子
B
环节二:归纳整理,巩固提升
巩固提升
2.下列关于乙醇结构与性质的说法正确的是( )
A.乙醇分子中含有—OH,所以乙醇可溶于水,也可电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇分子中羟基上的氢原子不如水中的
氢原子活泼
D
环节二:归纳整理,巩固提升
巩固提升
3.某醇在铜作催化剂的条件下和氧气反应生成的产物为 ,
则该醇为( )
A. B.
C. D.
A
环节二:归纳整理,巩固提升
巩固提升
4.某化学反应过程如图所示。由图得出的判断错误的是( )
A.生成物M的官能团为醛基
B.铜是此反应的催化剂
C. 也能发生此反应生成M的同系物
D.反应中有红、黑交替变化的现象
C
4.某化学反应过程如图所示。由图得出的判断错误的是( )
A.生成物M的官能团为醛基
B.铜是此反应的催化剂
C. 也能发生此反应生成M的同系物
D.反应中有红、黑交替变化的现象
环节二:归纳整理,巩固提升
巩固提升
5.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
A.和金属钠反应时①键断裂
B.在铜催化共热下与O2反应时断裂①键和③键
C.在铜催化共热下与O2反应时断裂①键和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
C
1. 乙酸的物理性质
颜色、 状态:
气 味:
沸 点:
熔 点:
溶 解 性:
无色液体
有强烈刺激性气味
118℃ (具有挥发性)
16.6℃
(无水乙酸又称为冰醋酸)
易溶于水、乙醇等溶剂
一、乙酸
(1)乙酸的分子式:
(2)结构式:
(3)结构简式 :
C2H4O2
2. 分子组成与结构
羧基可以表示为—COOH或者:
羧基是羧酸的官能团
(4)乙酸结构分析
甲基 和 羧基
受C=O的影响,氢氧键更易(羧基中的H活泼)
当氢氧键断裂时,容易解离出氢离子,体现乙酸具有酸性(弱酸,不完全电离)。
乙酸的球棍模型
比例模型
二、乙酸的化学性质(羧基决定性质)
1.弱酸性
与活泼金属反应:Mg + 2CH3COOH (CH3COO)2Mg + H2↑
与碱反应:NaOH+ CH3COOH CH3COONa + H2O
CH3COOH CH3COO-+H+
乙酸除水垢表现了酸性,乙酸可以和某些盐反应
【思考与讨论】
(1)食醋可以清除水壶中的少量水垢(主要成分碳酸钙),这是利用了乙酸的什么性质?请写出相关反应的化学方程式。
CaCO3 + 2CH3COOH (CH3COO)2Ca + CO2↑+ H2O(除水垢)
CaCO3 + 2CH3COOH 2CH3COO- + Ca2+ + CO2↑+ H2O
化学反应:
离子反应:
【思考与讨论】
(2)如何比较乙酸、碳酸、盐酸的酸性强弱?请查阅资料,与同学讨论,根据生活经验设计实验方案。
操作: 往小苏打中滴入乙酸
NaHCO3 + CH3COOH CH3COONa + CO2↑+ H2O
现象: 产生气泡,收集该气体可使燃烧的木条熄灭
酸性: CH3COOH > H2CO3
【思考与讨论】
(2)如何比较乙酸、碳酸、盐酸的酸性强弱?请查阅资料,与同学讨论,根据生活经验设计实验方案。
酸性: HCl>CH3COOH
HCl + CH3COONa CH3COOH + NaCl
操作: 往往醋酸钠溶液中滴入盐酸,用手用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔。
现象: 闻到刺激性气味
酸性: HCl> CH3COOH > H2CO3
2.酯化反应
(1)【实验7-6】在一支试管中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上(如图7-22),观察现象。
【实验现象】
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5+H2O
反应的化学方程式
饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
先加乙醇
再加浓硫酸
再加乙酸
饱和的Na2CO3溶液收集
实验的药品加入顺序是什么,是否可以换?
碎瓷片的作用是什么?
【实验药品】
防止暴沸
(2)浓硫酸和饱和Na2CO3溶液有什么作用?
①浓硫酸——
②饱和Na2CO3溶液——
催化剂、吸水剂
1.中和挥发出来的乙酸
2.溶解挥发出的乙醇
3.降低乙酸乙酯在水中的溶解度
为什么导管不插入饱和Na2CO3溶液中?
为了使挥发出来的物质入溶液中,并且不能倒吸,该如何改进?
防止发生倒吸
在导管下端连接干燥管
3.酯化反应反应原理
酯化反应——酸与醇反应生成酯和水
酯基
原子或原子团被取代掉,因此酯化反应又称取代反应
+
+
实质:酸脱羟基、醇脱氢(羟基上的)
18
同位素示踪法
18
酯化反应一般需要加热,并加入浓硫酸等催化剂。酯化反应
是可逆反应,乙酸乙酯会与水发生水解反应生成乙酸和乙醇。
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5+H2O
乙酸乙酯属于酯类官能团是酯基 ,写作:
三、常见化合物类别、官能团和代表物
通过学习乙烯、乙醇和乙酸性质的学习,我们认识到官能团对有机物的性质具有决定作用,含有相同官能团的物质具有相似的作用,因此我们根据有机物的官能团对物质进行分类。
有机化合物类别 官能团 代表物
烯烃
炔烃
甲烷
乙烯
乙炔
有机化合物类别 官能团
代表物
芳香烃
卤代烃
醇
醛
|
—C—X碳卤键(X代表卤素原子)
|
CH3CH2Br溴乙烷
O
‖
—C—H醛基
O
‖
CH3—C—H乙醛
苯
—OH羟基
CH3CH2OH乙醇
有机化合物类别 官能团 代表物
羧酸
酯基
羧基
乙酸
乙酸乙酯
酯基
1.关于乙酸的下列说法中不正确的是 ( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有刺激性气味的液体
D.乙酸分子里有四个氢原子,所以不是一元酸
D
2. 炒菜时,又加酒又加醋,可使菜变得香味可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成
D
3. 除去乙酸乙酯中含有的乙酸,最好的处理和操作是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液 D.用过量氢氧化钠溶液洗涤后分液
C
4.下列关于乙酸性质的叙述中,错误的是( )
A. 乙酸的酸性比碳酸强,所以它可以与碳酸盐反应,产生CO2气体
乙酸能与醇类物质发生酯化反应
乙酸分子中含有碳氧双键,所以它能使溴水褪色
D. 乙酸在温度低于16.6℃时,就凝结成冰状晶体
C
5.下列关于醋酸性质的叙述错误的是 ( )
A.醋酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.醋酸能跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,醋酸分子中羟基中的氢原子跟醇分子中的羟基结合成水
D
6.某有机物的结构为
它最不可能具有的性质是( )。
A.能与金属钠反应放出H2
B.既能与C2H5OH发生酯化反应也能与CH3COOH发生酯化反应
C.能发生加聚反应
D.溶于水所得溶液能使紫色石蕊试纸变红
C
一、乙酸的物理性质
二、乙酸的分子结构
分子式
结构简式
无色液体,有强烈刺激性气味,无水乙酸又称为冰醋酸(16.6摄氏度以下结冰).
三、乙酸的化学性质
1. 乙酸是一种弱酸
2. 乙酸能发生酯化反应
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5+H2O
CH3COOH CH3COO-+H+
第七章 有机化合物
第三节 乙醇 乙酸
环节一:情境导入,感知乙醇的物理性质
乙醇的物理性质
无色、特殊香味液体
和水任意比互溶
易挥发
比水小
颜色、状态、气味
溶解性
密度
挥发性
俗称:酒精
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
【实验7-4】
在盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸吸干表面煤油的钠,在试管口迅速塞上带尖嘴导管的橡胶塞,用小试管收集气体并检验其纯度,然后点燃(如图7-19),在将干燥的小烧杯罩在火焰上。待烧杯璧上出现液滴后,迅速倒转烧杯,向其中加入少量澄清石灰水。
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
钠沉在乙醇的底部,
反应较缓慢,表面有气体放出 气体能燃烧,燃烧产物不能使澄清的石灰水变浑浊
实验现象:
钠与乙醇反应生成的气体为H2
钠密度大于乙醇
实验结论:
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
反应的原理
2CH3CH2OH+2Na→ 2 CH3CH2ONa+H2↑
乙醇与钠的反应相同条件下水与钠的反应缓和得多:乙醇羟基中的氢原子不如水分子中的氢原子活泼
根据与水和乙醇反应的剧烈程度得出:H—OH > C2H5—OH
由于羟基所连的原子或原子团不一样,从而导致羟基氢的活泼性不一样,H—OH > C2H5—OH。
环节二:实验探究,表征乙醇的结构特点
表征乙醇的结构特点
分子式:C2H6O
结构式:
结构简式:
CH3CH2OH
C2H5OH
羟基(-OH)
H-C-C-O-H
-
H
-
-
-
H
H
H
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
环节二:实验探究,表征乙醇的结构特点
概念辨析
官能团:像这种决定有机化合物特性的原子或原子团叫做官能团。羟基是醇类物质的官能团,碳碳双键和碳碳三键分别是烯烃和炔烃的官能团。
烃基:烃分子失去1个氢原子后所剩余的部分叫做烃基,可以用一R来表示。如一CH3叫甲基,一CH2CH3,叫乙基。
烃的衍生物:烃的衍生物分子一般可以看成是烃基和官能团相互结合组成的。例如,乙醇分子可以看成是由乙基和羟基组成的:CH3CH2-OH。
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
H—C —C—O—H ,
H H
H H
①处O—H键断开
①
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——燃烧
现象:产生淡蓝色火焰,同时放出大量热。
C2H5OH + 3O2 2CO2 +3H2O
点燃
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——催化氧化
高温焊接银器或铜器时,表面会生成黑色的氧化物,师傅说:把铜或银器具趁热蘸一下酒精,铜或银会光亮如初!这是为什么呢?
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
【实验7-5】 向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。
现象:
在酒精灯上加热时铜丝由 红色变黑,插入乙醇后铜丝 又由黑变红色。试管中液体有刺激性气味。
氧化反应——催化氧化
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——催化氧化
反应原理:
2Cu+O2 2CuO
2CuO+2CH3CH2OH 2Cu + 2CH3CHO+2H2O
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
醇发生催化氧化需满足的条件:
本碳有氢
氧化反应——催化氧化
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
【资料卡片】酗酒的危害
酒的主要成分是乙醇,少量饮酒对人体有益,但酗酒有害健康。科学研究表明酒量的大小与人体内某些酶有关。乙醇进入人体后,会在肝中通过酶的催化作用被氧化为乙醛和乙酸,最终被氧化为二氧化碳和水。过量饮酒会加重肝负担,血液中较高浓度的乙醇和乙醛也会对人体产生毒害作用。
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——被强氧化剂氧化
据交警介绍,在机动车驾驶人的每100毫升血液中,酒精含量达到20毫克为饮酒驾车,大致相当于饮用一杯啤酒;每100毫升血液中酒精含量达到和超过80毫克可以认定为醉酒驾车,相当于饮用3两低度白酒或者两瓶啤酒。你知道酒精检测仪的工作原理吗?
环节三:实验探究,突破乙醇的化学性质
乙醇的化学性质
氧化反应——被强氧化剂氧化
CH3CH2OH
乙醇
氧化
K2Cr2O7或KMnO4
CH3CHO
乙醛
氧化
K2Cr2O7或KMnO4
CH3COOH
乙酸
两个阶段:
K2Cr2O7
Cr2(SO4)3
乙醇
KMnO4(紫色)
MnSO4
(无色)
环节三:实验探究,突破乙醇的化学性质
乙醇的用途
(1) 用作酒精灯、火锅、内燃机等的燃料。
(2) 用作化工原料、香料、化妆品、涂料等。
(3) 医疗上常用体积分数为75%的乙醇溶液作消毒剂。
乙醇
分子组成和结构
用途
分子式
结构式
官能团
C2H6O
—OH
燃料
化工原料
医用消毒剂
物理性质
无色、有特殊香味的液体
密度小于水
易溶于水和有机溶剂
沸点较低,易挥发
化学性质
与强氧化剂反应
氧化反应
置换反应
使酸性高锰酸钾溶液褪色
与羟基相连的碳上必须有氢原子
淡蓝色火焰
乙醇与钠反应
环节四:归纳整理,巩固提升
归纳整理
环节二:归纳整理,巩固提升
巩固提升
1.比较乙烷和乙醇的结构,下列说法错误的是( )
A.分子中的化学键都包括极性键和非极性键
B.分子中都含6个氢原子且6个氢原子的化学环境完全相同
C.乙基与1个氢原子相连就是乙烷分子
D.乙基与1个羟基相连就是乙醇分子
B
环节二:归纳整理,巩固提升
巩固提升
2.下列关于乙醇结构与性质的说法正确的是( )
A.乙醇分子中含有—OH,所以乙醇可溶于水,也可电离出OH-
B.乙醇能电离出H+,所以是电解质
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇分子中羟基上的氢原子不如水中的
氢原子活泼
D
环节二:归纳整理,巩固提升
巩固提升
3.某醇在铜作催化剂的条件下和氧气反应生成的产物为 ,
则该醇为( )
A. B.
C. D.
A
环节二:归纳整理,巩固提升
巩固提升
4.某化学反应过程如图所示。由图得出的判断错误的是( )
A.生成物M的官能团为醛基
B.铜是此反应的催化剂
C. 也能发生此反应生成M的同系物
D.反应中有红、黑交替变化的现象
C
4.某化学反应过程如图所示。由图得出的判断错误的是( )
A.生成物M的官能团为醛基
B.铜是此反应的催化剂
C. 也能发生此反应生成M的同系物
D.反应中有红、黑交替变化的现象
环节二:归纳整理,巩固提升
巩固提升
5.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明不正确的是( )
A.和金属钠反应时①键断裂
B.在铜催化共热下与O2反应时断裂①键和③键
C.在铜催化共热下与O2反应时断裂①键和⑤键
D.在空气中完全燃烧时断裂①②③④⑤键
C
1. 乙酸的物理性质
颜色、 状态:
气 味:
沸 点:
熔 点:
溶 解 性:
无色液体
有强烈刺激性气味
118℃ (具有挥发性)
16.6℃
(无水乙酸又称为冰醋酸)
易溶于水、乙醇等溶剂
一、乙酸
(1)乙酸的分子式:
(2)结构式:
(3)结构简式 :
C2H4O2
2. 分子组成与结构
羧基可以表示为—COOH或者:
羧基是羧酸的官能团
(4)乙酸结构分析
甲基 和 羧基
受C=O的影响,氢氧键更易(羧基中的H活泼)
当氢氧键断裂时,容易解离出氢离子,体现乙酸具有酸性(弱酸,不完全电离)。
乙酸的球棍模型
比例模型
二、乙酸的化学性质(羧基决定性质)
1.弱酸性
与活泼金属反应:Mg + 2CH3COOH (CH3COO)2Mg + H2↑
与碱反应:NaOH+ CH3COOH CH3COONa + H2O
CH3COOH CH3COO-+H+
乙酸除水垢表现了酸性,乙酸可以和某些盐反应
【思考与讨论】
(1)食醋可以清除水壶中的少量水垢(主要成分碳酸钙),这是利用了乙酸的什么性质?请写出相关反应的化学方程式。
CaCO3 + 2CH3COOH (CH3COO)2Ca + CO2↑+ H2O(除水垢)
CaCO3 + 2CH3COOH 2CH3COO- + Ca2+ + CO2↑+ H2O
化学反应:
离子反应:
【思考与讨论】
(2)如何比较乙酸、碳酸、盐酸的酸性强弱?请查阅资料,与同学讨论,根据生活经验设计实验方案。
操作: 往小苏打中滴入乙酸
NaHCO3 + CH3COOH CH3COONa + CO2↑+ H2O
现象: 产生气泡,收集该气体可使燃烧的木条熄灭
酸性: CH3COOH > H2CO3
【思考与讨论】
(2)如何比较乙酸、碳酸、盐酸的酸性强弱?请查阅资料,与同学讨论,根据生活经验设计实验方案。
酸性: HCl>CH3COOH
HCl + CH3COONa CH3COOH + NaCl
操作: 往往醋酸钠溶液中滴入盐酸,用手用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔。
现象: 闻到刺激性气味
酸性: HCl> CH3COOH > H2CO3
2.酯化反应
(1)【实验7-6】在一支试管中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上(如图7-22),观察现象。
【实验现象】
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5+H2O
反应的化学方程式
饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。
先加乙醇
再加浓硫酸
再加乙酸
饱和的Na2CO3溶液收集
实验的药品加入顺序是什么,是否可以换?
碎瓷片的作用是什么?
【实验药品】
防止暴沸
(2)浓硫酸和饱和Na2CO3溶液有什么作用?
①浓硫酸——
②饱和Na2CO3溶液——
催化剂、吸水剂
1.中和挥发出来的乙酸
2.溶解挥发出的乙醇
3.降低乙酸乙酯在水中的溶解度
为什么导管不插入饱和Na2CO3溶液中?
为了使挥发出来的物质入溶液中,并且不能倒吸,该如何改进?
防止发生倒吸
在导管下端连接干燥管
3.酯化反应反应原理
酯化反应——酸与醇反应生成酯和水
酯基
原子或原子团被取代掉,因此酯化反应又称取代反应
+
+
实质:酸脱羟基、醇脱氢(羟基上的)
18
同位素示踪法
18
酯化反应一般需要加热,并加入浓硫酸等催化剂。酯化反应
是可逆反应,乙酸乙酯会与水发生水解反应生成乙酸和乙醇。
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5+H2O
乙酸乙酯属于酯类官能团是酯基 ,写作:
三、常见化合物类别、官能团和代表物
通过学习乙烯、乙醇和乙酸性质的学习,我们认识到官能团对有机物的性质具有决定作用,含有相同官能团的物质具有相似的作用,因此我们根据有机物的官能团对物质进行分类。
有机化合物类别 官能团 代表物
烯烃
炔烃
甲烷
乙烯
乙炔
有机化合物类别 官能团
代表物
芳香烃
卤代烃
醇
醛
|
—C—X碳卤键(X代表卤素原子)
|
CH3CH2Br溴乙烷
O
‖
—C—H醛基
O
‖
CH3—C—H乙醛
苯
—OH羟基
CH3CH2OH乙醇
有机化合物类别 官能团 代表物
羧酸
酯基
羧基
乙酸
乙酸乙酯
酯基
1.关于乙酸的下列说法中不正确的是 ( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有刺激性气味的液体
D.乙酸分子里有四个氢原子,所以不是一元酸
D
2. 炒菜时,又加酒又加醋,可使菜变得香味可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成
D
3. 除去乙酸乙酯中含有的乙酸,最好的处理和操作是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液 D.用过量氢氧化钠溶液洗涤后分液
C
4.下列关于乙酸性质的叙述中,错误的是( )
A. 乙酸的酸性比碳酸强,所以它可以与碳酸盐反应,产生CO2气体
乙酸能与醇类物质发生酯化反应
乙酸分子中含有碳氧双键,所以它能使溴水褪色
D. 乙酸在温度低于16.6℃时,就凝结成冰状晶体
C
5.下列关于醋酸性质的叙述错误的是 ( )
A.醋酸是一种有强烈刺激性气味的无色液体
B.冰醋酸是无水乙酸,不是乙酸的水溶液
C.醋酸能跟碳酸钠溶液发生反应产生CO2
D.在发生酯化反应时,醋酸分子中羟基中的氢原子跟醇分子中的羟基结合成水
D
6.某有机物的结构为
它最不可能具有的性质是( )。
A.能与金属钠反应放出H2
B.既能与C2H5OH发生酯化反应也能与CH3COOH发生酯化反应
C.能发生加聚反应
D.溶于水所得溶液能使紫色石蕊试纸变红
C
一、乙酸的物理性质
二、乙酸的分子结构
分子式
结构简式
无色液体,有强烈刺激性气味,无水乙酸又称为冰醋酸(16.6摄氏度以下结冰).
三、乙酸的化学性质
1. 乙酸是一种弱酸
2. 乙酸能发生酯化反应
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5+H2O
CH3COOH CH3COO-+H+
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
