化学物质的分类方法试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 化学物质的分类方法试题 高考化学考前专项复习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 768.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 10:04:48 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
化学物质的分类方法
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列各组内的不同名称实际是指同一物质的是
A.液氯、氯水 B.烧碱、火碱 C.胆矾、绿矾 D.干冰、水晶
2.下列各组物质中,按碱、单质、化合物、混合物顺序排列的是
A.石灰水、氮气、空气、食盐
B.氨气、铁粉、干冰、医用酒精
C.火碱、液态氧、苛性钠、稀有气体
D.纯碱、白磷、氧化镁、漂白精
3.下列物质中有一种物质和其它三种组成不同的是
A.饱和食盐水 B.胆矾 C.黄铜(铜锌合金) D.浓硫酸
4.下列各项中的物质,能满足图中阴影部分关系的是
① ② ③ ④
A NaCl KCl K2SO4 NH4Cl
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl KCl NH4Cl K2SO4
D Na2SO4 K2SO4 KCl (NH4)2SO4
A.A B.B C.C D.D
5.构建元素化合价和物质类别的二维图是学习化学的一种重要方法。如图是碳元素的“价一类”二维图,下列说法错误的是
A.A点可能是
B.B点对应的物质充分燃烧可能得到D点对应的物质
C.某化合物的化学式为,它对应的点是F
D.C点对应的物质与水反应可能得到E点对应的物质
6.下列有关氧化物的分类错误的是
A B C D
SO2 CuO Mn2O7 NO
酸性氧化物 碱性氧化物 碱性氧化物 不成盐氧化物
A.A B.B C.C D.D
7.下列说法,不正确的是
A.失电子难的原子获得电子的能力不一定强
B.根据交叉分类法,既属于钠盐又属于硫酸盐
C.氧化还原反应中,有一种元素化合价升高,必定有另一种元素化合价降低
D.在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子
8.下列物质的分类合理的是( )
A.酸性氧化物:CO2、SiO2、 SO2、CO B.碱:烧碱、纯碱、苛性钾、氢氧化钡
C.混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体 D.碱性氧化物:Na2O、CaO、MgO、Mn2O7
9.根据下列已知,得到的类比或推理合理的是
选项 已知 方法 结论
A 酸一定能电离出 推理 能电离出的一定为酸
B 与可以发生化合反应 类比 与也可以发生化合反应
C 为酸性氧化物 类比 也为酸性氧化物
D 是正盐 推理 是一元酸
A.A B.B C.C D.D
10.下列各组物质,按化合物、单质、混合物顺序排列的是
A.生石灰、白磷、 B.干冰、臭氧、硫酸
C.烧碱、液态氧、碘酒 D.空气、臭氧、
二、判断题
11.四类物质①酸、②碱、③盐、④氧化物中一定含有氧元素的是②④。 ( )
12.酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱。
13.酸性氧化物不一定是非金属氧化物。
14.FeSO4·7H2O等结晶水合物均属于混合物。 ( )
15.电离时只要生成金属阳离子(或)和酸根阴离子的化合物就是盐
三、解答题
16.完成下列问题。
(1)“84”消毒液可通过和氢氧化钠(NaOH)反应制得,主要成分是NaCl和NaClO(次氯酸钠)。次氯酸钠是“84”消毒液的主要成分,通过与空气中的缓慢反应生成HClO(次氯酸),次氯酸具有强氧化性和漂白性。医用酒精(含75%的酒精)的主要成分是,可用于人体的消毒。
①上述短文中提到的物质属于混合物的是 (写名称);属于钠盐是 (写化学式)。
②属于单质是 (写化学式),氧化物的是 (写化学式)。
(2)草木灰中含有可溶性钾盐(主要成分是、、KCl)。某校化学兴趣小组按下列实验检验草木灰中的某些离子;取适量草木灰加水溶解,过滤,将滤液分成四份,完成以下实验报告(在横线上填写相关内容)
实验步骤 实验现象 实验结论
(1)取第一份溶液和过量稀盐酸混合,并将产生的气体通入澄清石灰水 有无色无味气泡产生,澄清石灰水变浑浊 证明可能含 (填化学式)
(2)取第二份溶液,依次滴加 和 溶液 有白色沉淀产生 证明含有
(3)取第三份溶液,加入过量 溶液,过滤,再向滤液中滴加 。 有白色沉淀产生 证明含有
(4)取第四份溶液进行焰色反应 透过 观察到火焰呈紫色 证明含有
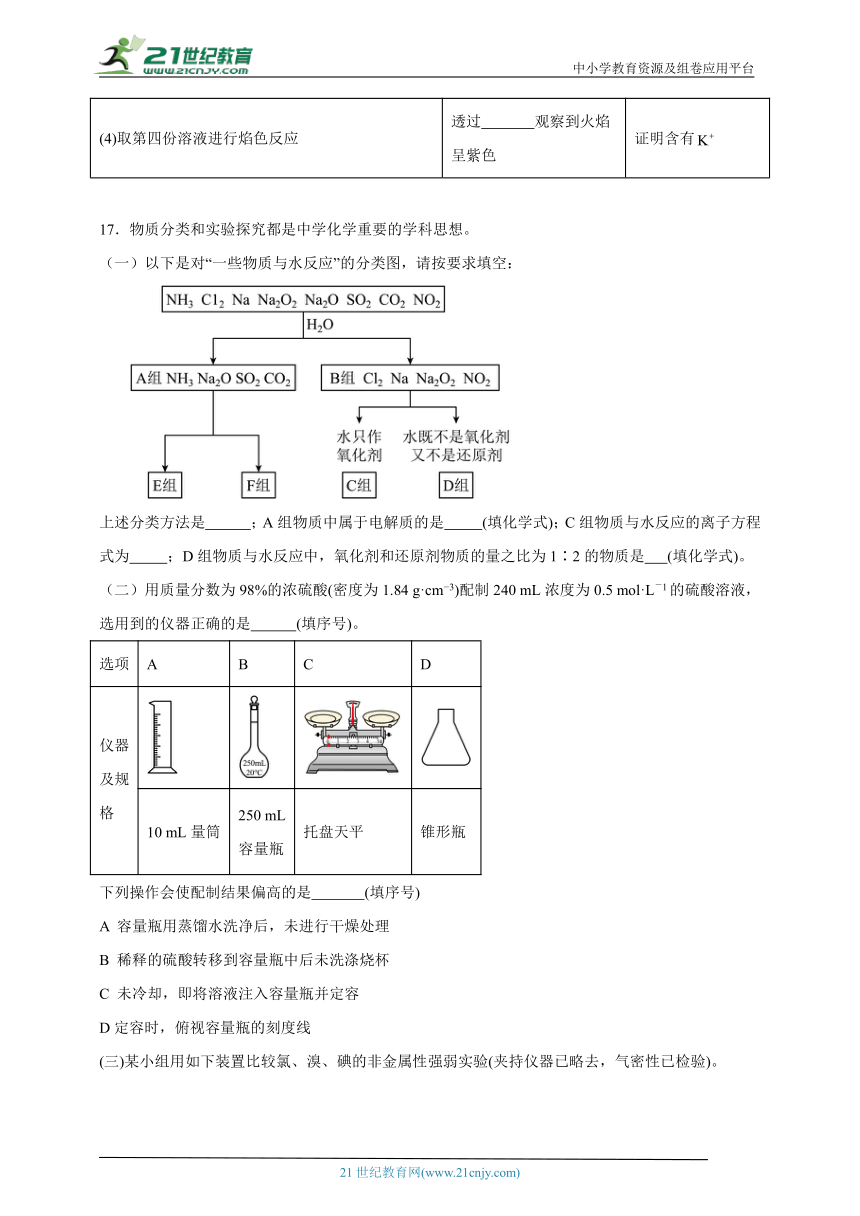
17.物质分类和实验探究都是中学化学重要的学科思想。
(一)以下是对“一些物质与水反应”的分类图,请按要求填空:
上述分类方法是 ;A组物质中属于电解质的是 (填化学式);C组物质与水反应的离子方程式为 ;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是 (填化学式)。
(二)用质量分数为98%的浓硫酸(密度为1.84 g·cm 3)配制240 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是 (填序号)。
选项 A B C D
仪器 及规 格
10 mL量筒 250 mL 容量瓶 托盘天平 锥形瓶
下列操作会使配制结果偏高的是 (填序号)
A 容量瓶用蒸馏水洗净后,未进行干燥处理
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯
C 未冷却,即将溶液注入容量瓶并定容
D定容时,俯视容量瓶的刻度线
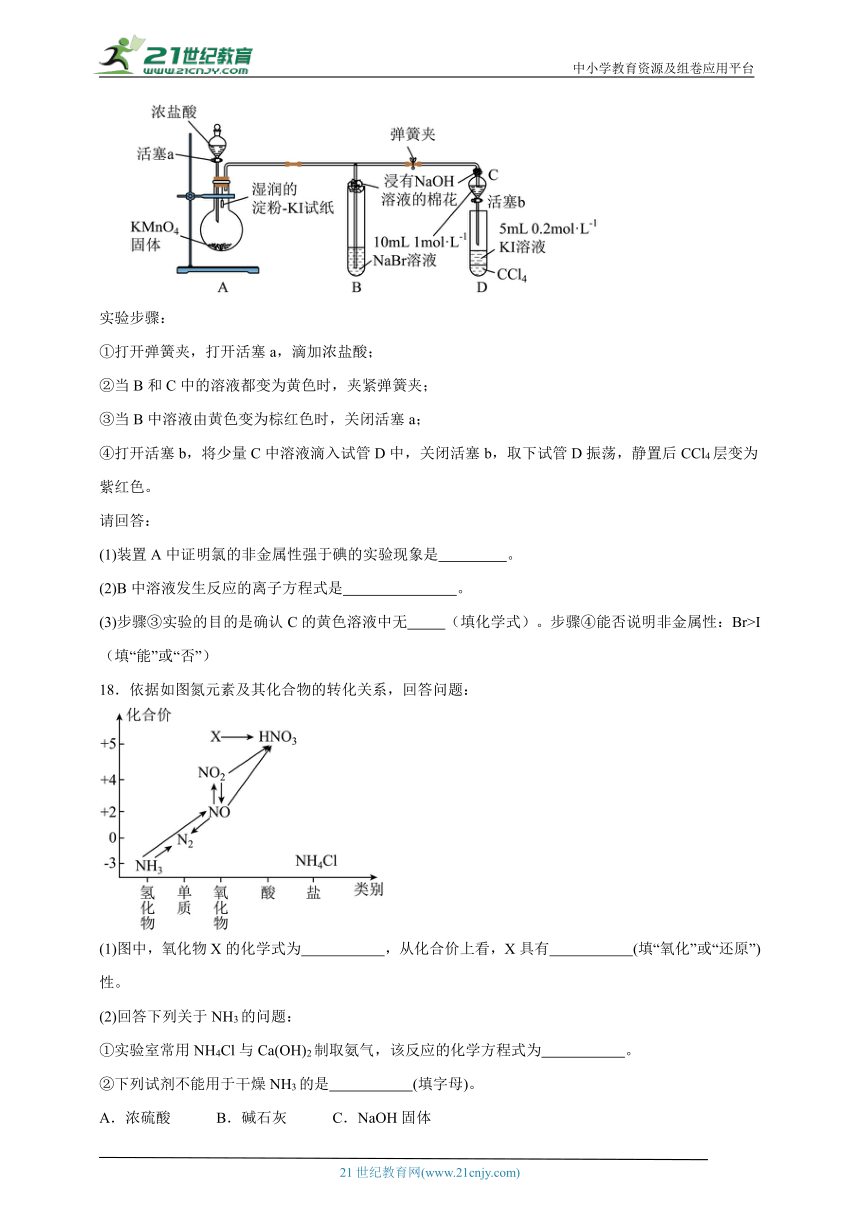
(三)某小组用如下装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。
实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。
请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是 。
(2)B中溶液发生反应的离子方程式是 。
(3)步骤③实验的目的是确认C的黄色溶液中无 (填化学式)。步骤④能否说明非金属性:Br>I (填“能”或“否”)
18.依据如图氮元素及其化合物的转化关系,回答问题:
(1)图中,氧化物X的化学式为 ,从化合价上看,X具有 (填“氧化”或“还原”)性。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为 。
②下列试剂不能用于干燥NH3的是 (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将装置补充完整,在图中虚框内画出连接图 。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式: 。
(3)若要将NH3转变成N2。从氧化还原角度看,下列试剂可行的是:___________
A.O2 B.Na C.NH4Cl D.NO2
参考答案:
1.B
【详解】A. 液氯是只含Cl2的纯净物,氯水是氯气溶于水得到的混合物,不是同一物质,故A错误;
B. 氢氧化钠俗称火碱、烧碱、苛性钠,是同一物质,故B正确;
C.胆矾的化学式为CuSO4·5H2O,绿矾的化学式为FeSO4·7H2O,二者表示的不是同一种物质,故C错误;
D. 干冰是固体二氧化碳,水晶是二氧化硅晶体,二者表示的不是同一种物质,故D错误。
故答案选B。
【点睛】本题考查常见物质的名称,了解常见物质的俗名是解题的关键,易错选项A,注意对易混淆的物质归纳总结。
2.C
【详解】A.石灰水为混合物;氮气为单质;空气为混合物;食盐属于混合物,故A不选;
B.氨气属于碱性气体;铁粉属于单质;干冰为二氧化碳固体,属于化合物;医用酒精为75%乙醇溶液,属于混合物,故B不选;
C.火碱为NaOH,是碱;液态氧为单质;苛性钠为NaOH,属于化合物;稀有气体为混合物,故C选;
D.纯碱为碳酸钠,属于盐;白磷属于单质;氧化镁属于化合物;漂白精是次氯酸钙和氯化钙的混合物,故D不选;
故选C。
3.B
【详解】A.饱和食盐水为溶液,属于混合物;
B.胆矾为五水合硫酸铜,属于纯净物;
C.黄铜(铜锌合金)属于混合物;
D.浓硫酸为溶液,属于混合物;
综上所述,答案为B。
4.B
【详解】Na2SO4属于钠盐和硫酸盐;K2SO4属于硫酸盐和钾盐;KCl属于钾盐和盐酸盐;NH4Cl属于盐酸盐和铵盐;
B正确。
5.D
【详解】A.A点为碳元素的有机物,C为-4价,可能是,A项正确;
B.B点对应物质为碳单质,充分燃烧生成,为D点对应物质,B项正确;
C.为盐,对应点是F,C项正确;
D.C点对应物质为,不能与水反应,D项错误;
故选D。
6.C
【详解】A.酸性氧化物为和碱反应生成盐和水的氧化物,SO2是酸性氧化物,选项A正确;
B.碱性氧化物是和酸反应生成盐和水的氧化物,CuO是碱性氧化物,选项B正确;
C.酸性氧化物为和碱反应生成盐和水的氧化物, Mn2O7是酸性氧化物,选项C错误;
D.NO既不能与酸反应生成盐和水,也不能与碱反应生成盐和水,是不成盐氧化物,选项D正确;
答案选C。
7.C
【详解】
A. 失电子难的原子获得电子的能力不一定强,如稀有气体原子失电子难,获得电子的能力也很弱,A项正确;
B. 由钠离子和硫酸根离子构成,若采用交叉分类法,既是钠盐又是硫酸盐,B项正确;
C. 在氧化还原反应中,存在同种元素的化合价同时发生升降,如在反应Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价既升高又降低,C项错误;
D. 根据阿伏加德罗定律可知,在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子,D项正确;
答案选C。
8.C
【详解】A、只能和碱反应生成盐和水的氧化物为酸性氧化物,而CO不能和酸或碱反应,故不是酸性氧化物,故A错误;
B、电离出的阴离子全部是氢氧根的化合物为碱,而纯碱为碳酸钠,是盐不是碱,故B错误;
C、由两种或两种以上物质构成的是混合物,盐酸是HCl的水溶液,是混合物;漂白粉是氯化钙和次氯酸钙的混合物;水煤气是CO和氢气的混合物;氢氧化铁胶体是分散系,是混合物,故C正确;
D、能和酸反应生成盐和水的氧化物是碱性氧化物,Na2O、CaO、MgO都是碱性氧化物,但 Mn2O7是酸性氧化物不是碱性氧化物,故D错误;
故选C。
【点睛】本题的易错点为A、D,要注意无论是酸性氧化物和碱性氧化物,与碱或酸反应生成盐和水的反应中均不能发生氧化还原反应,否则不属于这两种物质,如过氧化钠能够与亚硫酸反应生成硫酸钠和水,但过氧化钠不属于碱性氧化物。
9.D
【详解】A.酸一定能电离出,电离出的阳离子全部是的才是酸,A项错误;
B.与可以发生氧化还原反应生成,而与与反应生成和,不是化合反应,B项错误;
C.和碱反应只生成盐和水,为酸性氧化物,和碱反应除了生成盐和水外,还会生成,所以不是酸性氧化物,C项错误;
D.是正盐,说明与碱反应只能生成一种盐,可以推出为一元酸,D项正确;
故选D。
【点睛】
10.C
【详解】A.生石灰、白磷、依次属于化合物、单质、化合物,故A不符合题意;
B.干冰、臭氧、硫酸依次属于化合物、单质、化合物,故B不符合题意;
C.烧碱、液态氧、碘酒依次属于化合物、单质、混合物,故C符合题意;
D.空气、臭氧、依次属于混合物、单质、化合物,故D不符合题意;
故选C。
11.正确
【详解】碱的组成中有氢氧根,氧化物的组成中有氧元素,则②④的组成中一定含有氧元素,而酸有无氧酸,盐有无氧酸根构成的盐,故酸和盐组成中不一定含有氧元素,故正确;
12.正确
【详解】酸性氧化物不一定都与水反应生成相应的酸,如SiO2与水不反应,但二氧化硅是酸性氧化物,碱性氧化物不一定都能与水反应生成碱,如氧化铜、氧化铁等碱性氧化物与水不反应,故说法正确;
13.正确
【详解】酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物,故正确;
14.错误
【详解】FeSO4·7H2O等结晶水合物均属于纯净物中的化合物,错误。
15.正确
【详解】盐是由金属阳离子(或铵根离子)和酸根阴离子组成的化合物,故说法正确;
16.(1) 84消毒液、医用酒精 NaCl和NaClO Cl2 CO2
(2) CO 稀HCl BaCl2 Ba(NO3)2 稀硝酸酸化的硝酸银溶液 蓝色钴玻璃片
【详解】(1)①由题给短文可知,文中84消毒液、医用酒精属于混合物,氯化钠、次氯酸钠属于钠盐,故答案为:84消毒液、医用酒精;NaCl和NaClO;
②由题给短文可知,文中氯气是非金属单质,二氧化碳是与碱反应生成盐和水的酸性氧化物,故答案为:Cl2;CO2;
(2)(1)二氧化碳能与澄清石灰水反应生成碳酸钙沉淀使溶液变混浊,则取第一份溶液和过量稀盐酸混合,有无色无味气泡产生,将产生的气体通入澄清石灰水,澄清石灰水变浑浊说明草木灰中含有碳酸根离子,故答案为:CO;
(2)向溶液中加入碳酸根等离子干扰后,再加入氯化钡溶液有白色沉淀生成说明溶液中含有硫酸根离子,则取第二份溶液,依次滴加盐酸和氯化钡溶液,有白色沉淀产生说明草木灰中含有硫酸根离子,故答案为:稀HCl;BaCl2;
(3)向溶液中加入硝酸钡溶液排出硫酸根离子干扰后,向过滤得到的滤液中加入稀硝酸酸化的硝酸银溶液有白色沉淀产生,说明溶液中含有氯离子,则取第三份溶液,加入过量硝酸钡溶液过滤,再向滤液中滴加稀硝酸酸化的硝酸银溶液有白色沉淀产生,说明草木灰中含有氯离子,故答案为:稀硝酸酸化的硝酸银溶液;
(4)用铂丝蘸取溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃片观察到火焰呈紫色说明溶液中含有钾离子,则取第四份溶液进行焰色反应,透过蓝色钴玻璃片观察到火焰呈紫色说明草木灰中含有钾离子,故答案为:蓝色钴玻璃片。
17. 树状分类法 Na2O 2Na+2H2O=2Na++2OH-+H2↑ NO2 AB CD 湿润的淀粉 KI试纸变蓝 Cl2+2Br-=Br2+2Cl- Cl2 能
【分析】此题体现了对三块内容的考查,一是通过化学分类方法考查了离子反应、氧化还原等相关内容,二是考查了一定物质的量浓度溶液的配置实验,三是以化学实验为背景考查了氯气的制备与性质。
【详解】(一)题图所示的分类方法为树状分类法;A组物质中属于电解质的是金属氧化物Na2O;C组物质与水反应,水只作氧化剂,因此C组物质只有Na,因此C组物质与水反应的方程式为2Na+2H2O=2Na++2OH-+H2↑;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是NO2;
(二)用质量分数为98%的浓硫酸配制240 mL浓度为0.5 mol·L-1的硫酸溶液,是溶液的稀释,要用到量筒量取浓硫酸的体积,用容量瓶配置溶液,故应该选AB;
A容量瓶用蒸馏水洗净后,未进行干燥处理,对浓度无影响;
B稀释的硫酸转移到容量瓶中后未洗涤烧杯,会使浓度减小;
C未冷却,即将溶液注入容量瓶并定容,会使浓度偏大;
D定容时,俯视容量瓶的刻度线,会使浓度偏大;
故应选CD;
(三)A装置是氯气的制备装置,其中湿润的淀粉-KI试纸是用来比较氯与碘的非金属性强弱的,装置BC用来比较氯与溴的非金属性,D装置用来比较Br和I的非金属性。
(1)装置A中证明氯的非金属性强于碘的实验现象是湿润的淀粉 KI试纸变蓝;
(2)B中溶液发生反应的离子方程式是Cl2+2Br-=Br2+2Cl-;
(3)步骤③实验的目的是确认C的黄色溶液中无Cl2,步骤④能说明非金属性Br>I。
18.(1) N2O5 氧化
(2) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O A 4NH3+5O2 4NO+6H2O
(3)AD
【详解】(1)图中,氧化物X为+5价的氧化物,其化学式为N2O5,从化合价上看,X中氮处于最高价态,因此具有氧化性;故答案为:N2O5;氧化。
(2)①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
②氨气与浓硫酸反应,碱石灰、 固体都不与氨气反应,因此不能用于干燥NH3的是浓硫酸;故答案为:A。
③若要收集一瓶氨气,由于氨气的密度比空气小,根据图中情况,则说明氨气只能短进长出,其连接图为;故答案为:。
④氨气是重要的化工原料,其催化氧化是氨气催化氧化生成一氧化氮和水,其反应的化学方程式:4NH3+5O2 4NO+6H2O;故答案为:4NH3+5O2 4NO+6H2O。
(3)若要将NH3转变成N2,氨气化合价升高,作还原剂,则需要有氧化剂,或则氮的化合价高于0价的物质,可行的试剂是氧气、二氧化氮;故答案为:AD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
化学物质的分类方法
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列各组内的不同名称实际是指同一物质的是
A.液氯、氯水 B.烧碱、火碱 C.胆矾、绿矾 D.干冰、水晶
2.下列各组物质中,按碱、单质、化合物、混合物顺序排列的是
A.石灰水、氮气、空气、食盐
B.氨气、铁粉、干冰、医用酒精
C.火碱、液态氧、苛性钠、稀有气体
D.纯碱、白磷、氧化镁、漂白精
3.下列物质中有一种物质和其它三种组成不同的是
A.饱和食盐水 B.胆矾 C.黄铜(铜锌合金) D.浓硫酸
4.下列各项中的物质,能满足图中阴影部分关系的是
① ② ③ ④
A NaCl KCl K2SO4 NH4Cl
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl KCl NH4Cl K2SO4
D Na2SO4 K2SO4 KCl (NH4)2SO4
A.A B.B C.C D.D
5.构建元素化合价和物质类别的二维图是学习化学的一种重要方法。如图是碳元素的“价一类”二维图,下列说法错误的是
A.A点可能是
B.B点对应的物质充分燃烧可能得到D点对应的物质
C.某化合物的化学式为,它对应的点是F
D.C点对应的物质与水反应可能得到E点对应的物质
6.下列有关氧化物的分类错误的是
A B C D
SO2 CuO Mn2O7 NO
酸性氧化物 碱性氧化物 碱性氧化物 不成盐氧化物
A.A B.B C.C D.D
7.下列说法,不正确的是
A.失电子难的原子获得电子的能力不一定强
B.根据交叉分类法,既属于钠盐又属于硫酸盐
C.氧化还原反应中,有一种元素化合价升高,必定有另一种元素化合价降低
D.在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子
8.下列物质的分类合理的是( )
A.酸性氧化物:CO2、SiO2、 SO2、CO B.碱:烧碱、纯碱、苛性钾、氢氧化钡
C.混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体 D.碱性氧化物:Na2O、CaO、MgO、Mn2O7
9.根据下列已知,得到的类比或推理合理的是
选项 已知 方法 结论
A 酸一定能电离出 推理 能电离出的一定为酸
B 与可以发生化合反应 类比 与也可以发生化合反应
C 为酸性氧化物 类比 也为酸性氧化物
D 是正盐 推理 是一元酸
A.A B.B C.C D.D
10.下列各组物质,按化合物、单质、混合物顺序排列的是
A.生石灰、白磷、 B.干冰、臭氧、硫酸
C.烧碱、液态氧、碘酒 D.空气、臭氧、
二、判断题
11.四类物质①酸、②碱、③盐、④氧化物中一定含有氧元素的是②④。 ( )
12.酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱。
13.酸性氧化物不一定是非金属氧化物。
14.FeSO4·7H2O等结晶水合物均属于混合物。 ( )
15.电离时只要生成金属阳离子(或)和酸根阴离子的化合物就是盐
三、解答题
16.完成下列问题。
(1)“84”消毒液可通过和氢氧化钠(NaOH)反应制得,主要成分是NaCl和NaClO(次氯酸钠)。次氯酸钠是“84”消毒液的主要成分,通过与空气中的缓慢反应生成HClO(次氯酸),次氯酸具有强氧化性和漂白性。医用酒精(含75%的酒精)的主要成分是,可用于人体的消毒。
①上述短文中提到的物质属于混合物的是 (写名称);属于钠盐是 (写化学式)。
②属于单质是 (写化学式),氧化物的是 (写化学式)。
(2)草木灰中含有可溶性钾盐(主要成分是、、KCl)。某校化学兴趣小组按下列实验检验草木灰中的某些离子;取适量草木灰加水溶解,过滤,将滤液分成四份,完成以下实验报告(在横线上填写相关内容)
实验步骤 实验现象 实验结论
(1)取第一份溶液和过量稀盐酸混合,并将产生的气体通入澄清石灰水 有无色无味气泡产生,澄清石灰水变浑浊 证明可能含 (填化学式)
(2)取第二份溶液,依次滴加 和 溶液 有白色沉淀产生 证明含有
(3)取第三份溶液,加入过量 溶液,过滤,再向滤液中滴加 。 有白色沉淀产生 证明含有
(4)取第四份溶液进行焰色反应 透过 观察到火焰呈紫色 证明含有
17.物质分类和实验探究都是中学化学重要的学科思想。
(一)以下是对“一些物质与水反应”的分类图,请按要求填空:
上述分类方法是 ;A组物质中属于电解质的是 (填化学式);C组物质与水反应的离子方程式为 ;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是 (填化学式)。
(二)用质量分数为98%的浓硫酸(密度为1.84 g·cm 3)配制240 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是 (填序号)。
选项 A B C D
仪器 及规 格
10 mL量筒 250 mL 容量瓶 托盘天平 锥形瓶
下列操作会使配制结果偏高的是 (填序号)
A 容量瓶用蒸馏水洗净后,未进行干燥处理
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯
C 未冷却,即将溶液注入容量瓶并定容
D定容时,俯视容量瓶的刻度线
(三)某小组用如下装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。
实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。
请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是 。
(2)B中溶液发生反应的离子方程式是 。
(3)步骤③实验的目的是确认C的黄色溶液中无 (填化学式)。步骤④能否说明非金属性:Br>I (填“能”或“否”)
18.依据如图氮元素及其化合物的转化关系,回答问题:
(1)图中,氧化物X的化学式为 ,从化合价上看,X具有 (填“氧化”或“还原”)性。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为 。
②下列试剂不能用于干燥NH3的是 (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将装置补充完整,在图中虚框内画出连接图 。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式: 。
(3)若要将NH3转变成N2。从氧化还原角度看,下列试剂可行的是:___________
A.O2 B.Na C.NH4Cl D.NO2
参考答案:
1.B
【详解】A. 液氯是只含Cl2的纯净物,氯水是氯气溶于水得到的混合物,不是同一物质,故A错误;
B. 氢氧化钠俗称火碱、烧碱、苛性钠,是同一物质,故B正确;
C.胆矾的化学式为CuSO4·5H2O,绿矾的化学式为FeSO4·7H2O,二者表示的不是同一种物质,故C错误;
D. 干冰是固体二氧化碳,水晶是二氧化硅晶体,二者表示的不是同一种物质,故D错误。
故答案选B。
【点睛】本题考查常见物质的名称,了解常见物质的俗名是解题的关键,易错选项A,注意对易混淆的物质归纳总结。
2.C
【详解】A.石灰水为混合物;氮气为单质;空气为混合物;食盐属于混合物,故A不选;
B.氨气属于碱性气体;铁粉属于单质;干冰为二氧化碳固体,属于化合物;医用酒精为75%乙醇溶液,属于混合物,故B不选;
C.火碱为NaOH,是碱;液态氧为单质;苛性钠为NaOH,属于化合物;稀有气体为混合物,故C选;
D.纯碱为碳酸钠,属于盐;白磷属于单质;氧化镁属于化合物;漂白精是次氯酸钙和氯化钙的混合物,故D不选;
故选C。
3.B
【详解】A.饱和食盐水为溶液,属于混合物;
B.胆矾为五水合硫酸铜,属于纯净物;
C.黄铜(铜锌合金)属于混合物;
D.浓硫酸为溶液,属于混合物;
综上所述,答案为B。
4.B
【详解】Na2SO4属于钠盐和硫酸盐;K2SO4属于硫酸盐和钾盐;KCl属于钾盐和盐酸盐;NH4Cl属于盐酸盐和铵盐;
B正确。
5.D
【详解】A.A点为碳元素的有机物,C为-4价,可能是,A项正确;
B.B点对应物质为碳单质,充分燃烧生成,为D点对应物质,B项正确;
C.为盐,对应点是F,C项正确;
D.C点对应物质为,不能与水反应,D项错误;
故选D。
6.C
【详解】A.酸性氧化物为和碱反应生成盐和水的氧化物,SO2是酸性氧化物,选项A正确;
B.碱性氧化物是和酸反应生成盐和水的氧化物,CuO是碱性氧化物,选项B正确;
C.酸性氧化物为和碱反应生成盐和水的氧化物, Mn2O7是酸性氧化物,选项C错误;
D.NO既不能与酸反应生成盐和水,也不能与碱反应生成盐和水,是不成盐氧化物,选项D正确;
答案选C。
7.C
【详解】
A. 失电子难的原子获得电子的能力不一定强,如稀有气体原子失电子难,获得电子的能力也很弱,A项正确;
B. 由钠离子和硫酸根离子构成,若采用交叉分类法,既是钠盐又是硫酸盐,B项正确;
C. 在氧化还原反应中,存在同种元素的化合价同时发生升降,如在反应Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价既升高又降低,C项错误;
D. 根据阿伏加德罗定律可知,在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子,D项正确;
答案选C。
8.C
【详解】A、只能和碱反应生成盐和水的氧化物为酸性氧化物,而CO不能和酸或碱反应,故不是酸性氧化物,故A错误;
B、电离出的阴离子全部是氢氧根的化合物为碱,而纯碱为碳酸钠,是盐不是碱,故B错误;
C、由两种或两种以上物质构成的是混合物,盐酸是HCl的水溶液,是混合物;漂白粉是氯化钙和次氯酸钙的混合物;水煤气是CO和氢气的混合物;氢氧化铁胶体是分散系,是混合物,故C正确;
D、能和酸反应生成盐和水的氧化物是碱性氧化物,Na2O、CaO、MgO都是碱性氧化物,但 Mn2O7是酸性氧化物不是碱性氧化物,故D错误;
故选C。
【点睛】本题的易错点为A、D,要注意无论是酸性氧化物和碱性氧化物,与碱或酸反应生成盐和水的反应中均不能发生氧化还原反应,否则不属于这两种物质,如过氧化钠能够与亚硫酸反应生成硫酸钠和水,但过氧化钠不属于碱性氧化物。
9.D
【详解】A.酸一定能电离出,电离出的阳离子全部是的才是酸,A项错误;
B.与可以发生氧化还原反应生成,而与与反应生成和,不是化合反应,B项错误;
C.和碱反应只生成盐和水,为酸性氧化物,和碱反应除了生成盐和水外,还会生成,所以不是酸性氧化物,C项错误;
D.是正盐,说明与碱反应只能生成一种盐,可以推出为一元酸,D项正确;
故选D。
【点睛】
10.C
【详解】A.生石灰、白磷、依次属于化合物、单质、化合物,故A不符合题意;
B.干冰、臭氧、硫酸依次属于化合物、单质、化合物,故B不符合题意;
C.烧碱、液态氧、碘酒依次属于化合物、单质、混合物,故C符合题意;
D.空气、臭氧、依次属于混合物、单质、化合物,故D不符合题意;
故选C。
11.正确
【详解】碱的组成中有氢氧根,氧化物的组成中有氧元素,则②④的组成中一定含有氧元素,而酸有无氧酸,盐有无氧酸根构成的盐,故酸和盐组成中不一定含有氧元素,故正确;
12.正确
【详解】酸性氧化物不一定都与水反应生成相应的酸,如SiO2与水不反应,但二氧化硅是酸性氧化物,碱性氧化物不一定都能与水反应生成碱,如氧化铜、氧化铁等碱性氧化物与水不反应,故说法正确;
13.正确
【详解】酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物,故正确;
14.错误
【详解】FeSO4·7H2O等结晶水合物均属于纯净物中的化合物,错误。
15.正确
【详解】盐是由金属阳离子(或铵根离子)和酸根阴离子组成的化合物,故说法正确;
16.(1) 84消毒液、医用酒精 NaCl和NaClO Cl2 CO2
(2) CO 稀HCl BaCl2 Ba(NO3)2 稀硝酸酸化的硝酸银溶液 蓝色钴玻璃片
【详解】(1)①由题给短文可知,文中84消毒液、医用酒精属于混合物,氯化钠、次氯酸钠属于钠盐,故答案为:84消毒液、医用酒精;NaCl和NaClO;
②由题给短文可知,文中氯气是非金属单质,二氧化碳是与碱反应生成盐和水的酸性氧化物,故答案为:Cl2;CO2;
(2)(1)二氧化碳能与澄清石灰水反应生成碳酸钙沉淀使溶液变混浊,则取第一份溶液和过量稀盐酸混合,有无色无味气泡产生,将产生的气体通入澄清石灰水,澄清石灰水变浑浊说明草木灰中含有碳酸根离子,故答案为:CO;
(2)向溶液中加入碳酸根等离子干扰后,再加入氯化钡溶液有白色沉淀生成说明溶液中含有硫酸根离子,则取第二份溶液,依次滴加盐酸和氯化钡溶液,有白色沉淀产生说明草木灰中含有硫酸根离子,故答案为:稀HCl;BaCl2;
(3)向溶液中加入硝酸钡溶液排出硫酸根离子干扰后,向过滤得到的滤液中加入稀硝酸酸化的硝酸银溶液有白色沉淀产生,说明溶液中含有氯离子,则取第三份溶液,加入过量硝酸钡溶液过滤,再向滤液中滴加稀硝酸酸化的硝酸银溶液有白色沉淀产生,说明草木灰中含有氯离子,故答案为:稀硝酸酸化的硝酸银溶液;
(4)用铂丝蘸取溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃片观察到火焰呈紫色说明溶液中含有钾离子,则取第四份溶液进行焰色反应,透过蓝色钴玻璃片观察到火焰呈紫色说明草木灰中含有钾离子,故答案为:蓝色钴玻璃片。
17. 树状分类法 Na2O 2Na+2H2O=2Na++2OH-+H2↑ NO2 AB CD 湿润的淀粉 KI试纸变蓝 Cl2+2Br-=Br2+2Cl- Cl2 能
【分析】此题体现了对三块内容的考查,一是通过化学分类方法考查了离子反应、氧化还原等相关内容,二是考查了一定物质的量浓度溶液的配置实验,三是以化学实验为背景考查了氯气的制备与性质。
【详解】(一)题图所示的分类方法为树状分类法;A组物质中属于电解质的是金属氧化物Na2O;C组物质与水反应,水只作氧化剂,因此C组物质只有Na,因此C组物质与水反应的方程式为2Na+2H2O=2Na++2OH-+H2↑;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是NO2;
(二)用质量分数为98%的浓硫酸配制240 mL浓度为0.5 mol·L-1的硫酸溶液,是溶液的稀释,要用到量筒量取浓硫酸的体积,用容量瓶配置溶液,故应该选AB;
A容量瓶用蒸馏水洗净后,未进行干燥处理,对浓度无影响;
B稀释的硫酸转移到容量瓶中后未洗涤烧杯,会使浓度减小;
C未冷却,即将溶液注入容量瓶并定容,会使浓度偏大;
D定容时,俯视容量瓶的刻度线,会使浓度偏大;
故应选CD;
(三)A装置是氯气的制备装置,其中湿润的淀粉-KI试纸是用来比较氯与碘的非金属性强弱的,装置BC用来比较氯与溴的非金属性,D装置用来比较Br和I的非金属性。
(1)装置A中证明氯的非金属性强于碘的实验现象是湿润的淀粉 KI试纸变蓝;
(2)B中溶液发生反应的离子方程式是Cl2+2Br-=Br2+2Cl-;
(3)步骤③实验的目的是确认C的黄色溶液中无Cl2,步骤④能说明非金属性Br>I。
18.(1) N2O5 氧化
(2) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O A 4NH3+5O2 4NO+6H2O
(3)AD
【详解】(1)图中,氧化物X为+5价的氧化物,其化学式为N2O5,从化合价上看,X中氮处于最高价态,因此具有氧化性;故答案为:N2O5;氧化。
(2)①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
②氨气与浓硫酸反应,碱石灰、 固体都不与氨气反应,因此不能用于干燥NH3的是浓硫酸;故答案为:A。
③若要收集一瓶氨气,由于氨气的密度比空气小,根据图中情况,则说明氨气只能短进长出,其连接图为;故答案为:。
④氨气是重要的化工原料,其催化氧化是氨气催化氧化生成一氧化氮和水,其反应的化学方程式:4NH3+5O2 4NO+6H2O;故答案为:4NH3+5O2 4NO+6H2O。
(3)若要将NH3转变成N2,氨气化合价升高,作还原剂,则需要有氧化剂,或则氮的化合价高于0价的物质,可行的试剂是氧气、二氧化氮;故答案为:AD。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
