氮的化合物试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 氮的化合物试题 高考化学考前专项复习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 853.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
氮的化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.氨气的分子式是
A.N2 B.NH3 C.NO2 D.NH
2.A、B、C、D为中学化学常见的物质,A、B、C中均含有同一种元素,它们之间具有如图转化关系,下列说法错误的是
A.若A、D为非金属单质,则C的水溶液可能是一元强酸溶液
B.若A和D均为化合物且D为无色无味气体,则C的水溶液可能呈弱碱性
C.若A为非金属单质,D为金属单质,则C的水溶液可腐蚀铜
D.若A为气态氢化物,D为气态非金属单质,则C的水溶液的浓溶液可能使纸张变黑
3.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
A.NO2是该过程的中间产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分包括CO和NO
D.催化转化总反应为2NO+O2+4CO4CO2+N2
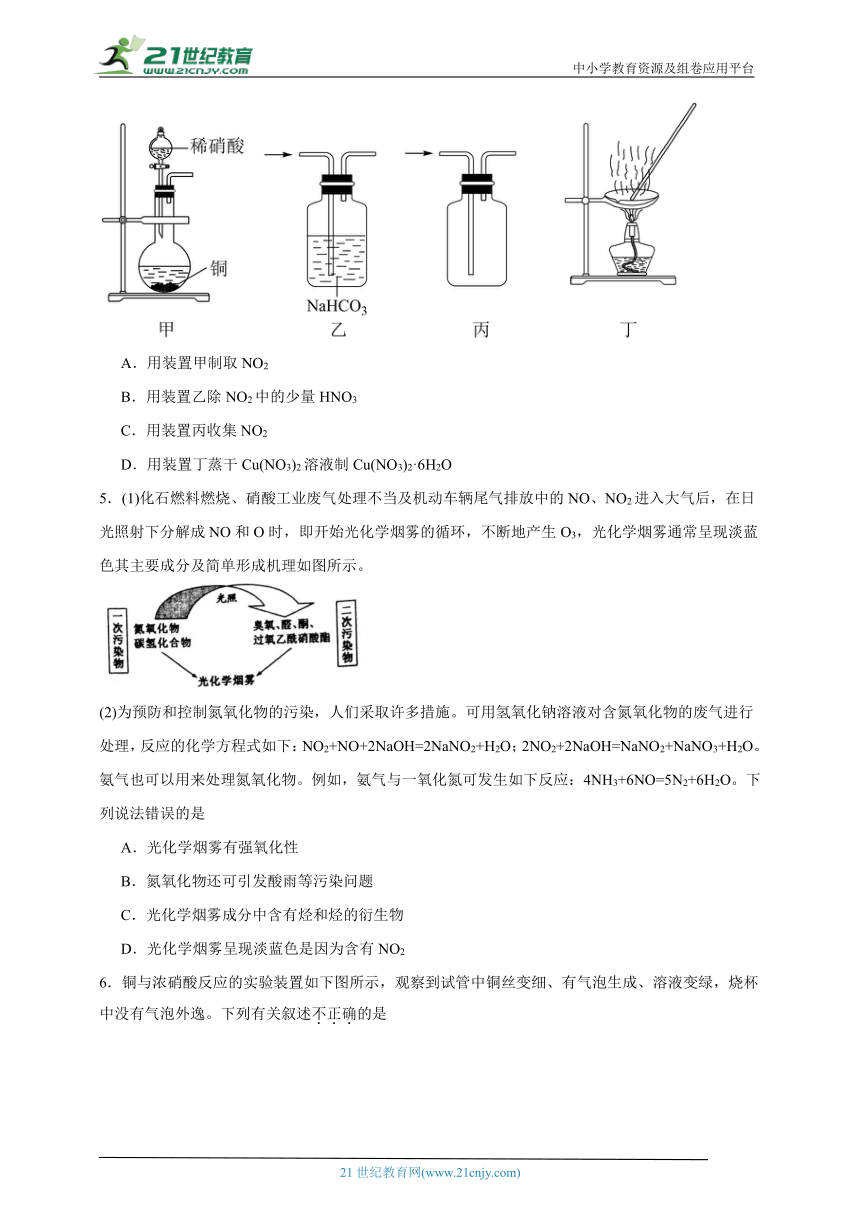
4.氨气是一种重要的化工原料,以氨为原料可以生产化肥和硝酸,在催化剂条件下,氨催化氧化生成NO,进而继续被氧化为NO2,再与水反应生成硝酸,氨气与硝酸反应可得氮肥硝酸铵。4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-905.8kJ·mol-1。工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。下列装置用于实验室制NO2并回收硝酸铜,能达到实验目的的是
A.用装置甲制取NO2
B.用装置乙除NO2中的少量HNO3
C.用装置丙收集NO2
D.用装置丁蒸干Cu(NO3)2溶液制Cu(NO3)2·6H2O
5.(1)化石燃料燃烧、硝酸工业废气处理不当及机动车辆尾气排放中的NO、NO2进入大气后,在日光照射下分解成NO和O时,即开始光化学烟雾的循环,不断地产生O3,光化学烟雾通常呈现淡蓝色其主要成分及简单形成机理如图所示。
(2)为预防和控制氮氧化物的污染,人们采取许多措施。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。下列说法错误的是
A.光化学烟雾有强氧化性
B.氮氧化物还可引发酸雨等污染问题
C.光化学烟雾成分中含有烃和烃的衍生物
D.光化学烟雾呈现淡蓝色是因为含有NO2
6.铜与浓硝酸反应的实验装置如下图所示,观察到试管中铜丝变细、有气泡生成、溶液变绿,烧杯中没有气泡外逸。下列有关叙述不正确的是
A.硝酸在该反应中既体现氧化性又体现酸性
B.实验时试管上方有红棕色气体产生
C.烧杯中的NaOH在反应中既作氧化剂又作还原剂
D.向绿色溶液中加入适量水,观察溶液变蓝,可证明绿色溶液中溶有
7.下列说法不正确的是
A.实验室用二氧化锰和浓盐酸混合加热制备氯气
B.钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来
C.常温常压下,二氧化氮与四氧化二氮共存于同一个体系中
D.因为钝化,工业上可用铝槽盛放热的浓硫酸或浓硝酸
8.标准状况下,在一不规则的玻璃容器内充满NO2气体后,将其倒置于水槽中,假设容器中的物质不扩散至容器外,则充分反应后容器中所得溶液的物质的量浓度近似为
A.1.0 mol·L-1 B.0.045 mol·L-1 C.0.020 mol·L-1 D.0.12 mol·L-1
9.X、Y、Z三种物质的转化关系如图所示。已知硅酸不稳定,易分解。则下列各组物质的转化不能一步实现的是
选项 X Y Z
A HNO3 NO NO2
B SiO2 Na2SiO3 H2SiO3
C Al2O3 AlCl3 Al(OH)3
D H2S S SO3
A.A B.B C.C D.D
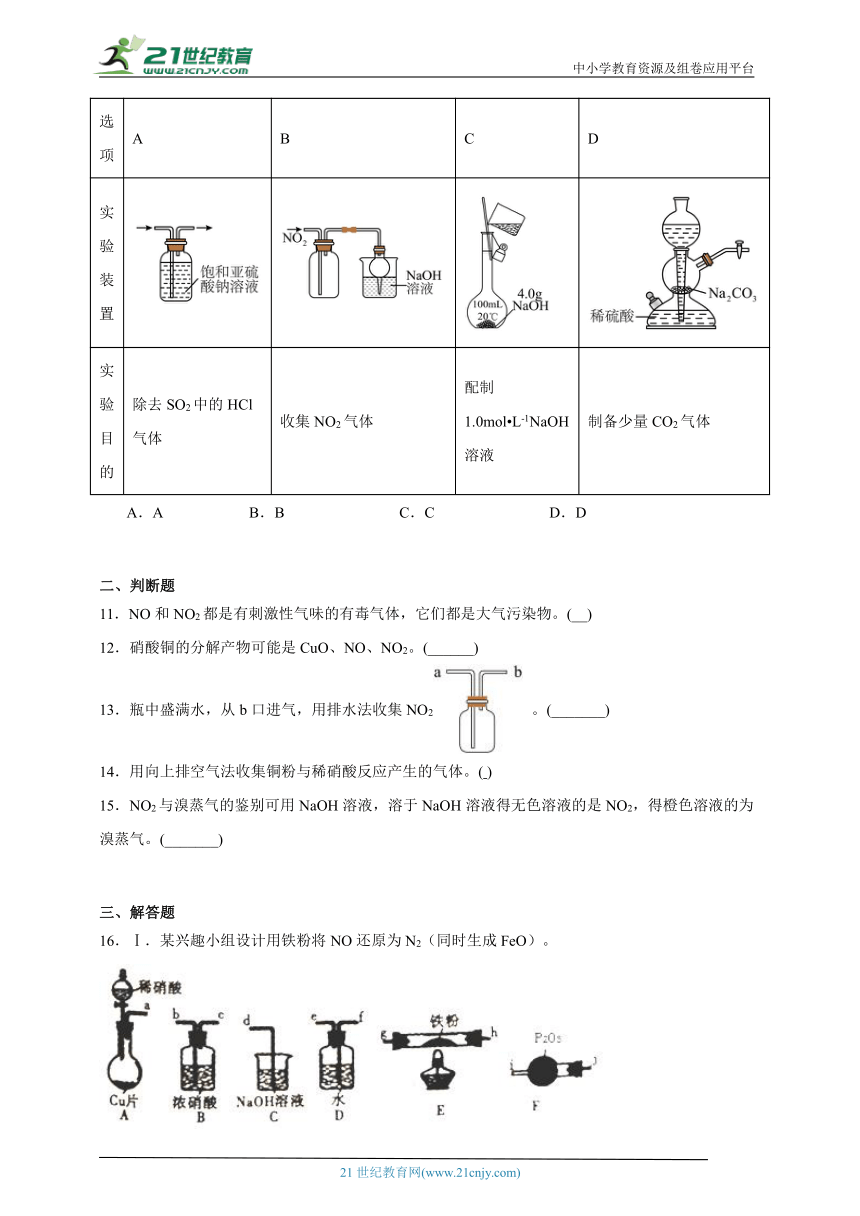
10.用下列仪器或装置进行相应实验,能达到实验目的的是
选项 A B C D
实验装置
实验目的 除去SO2中的HCl气体 收集NO2气体 配制1.0mol L-1NaOH溶液 制备少量CO2气体
A.A B.B C.C D.D
二、判断题
11.NO和NO2都是有刺激性气味的有毒气体,它们都是大气污染物。(__)
12.硝酸铜的分解产物可能是CuO、NO、NO2。(______)
13.瓶中盛满水,从b口进气,用排水法收集NO2 。(_______)
14.用向上排空气法收集铜粉与稀硝酸反应产生的气体。( )
15.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO2,得橙色溶液的为溴蒸气。(_______)
三、解答题
16.Ⅰ.某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO)。
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
(1)装置A中反应的离子方程式是 。
(2)装置的连接顺序为:a→()→()→()→()→()→()→()→()→d
Ⅱ.已知:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,易水解产生大量白雾;易分解:SO2Cl2=SO2↑+Cl2↑,催化合成硫酰氯的实验装置如下图(夹持装置已省略)
回答下列问题:
(3)仪器B的名称是 仪器B冷却水的进口为 (填“a”或“b”)活性炭的作用是 。
(4)装置D除干燥气体外,另一个作用是 。若缺少D,则硫酰氯会水解,该反应的化学方程式是 。
(5)C装置的作用是 。为了防止硫酰氯分解,某同学建议将收集器A放在 中冷却。
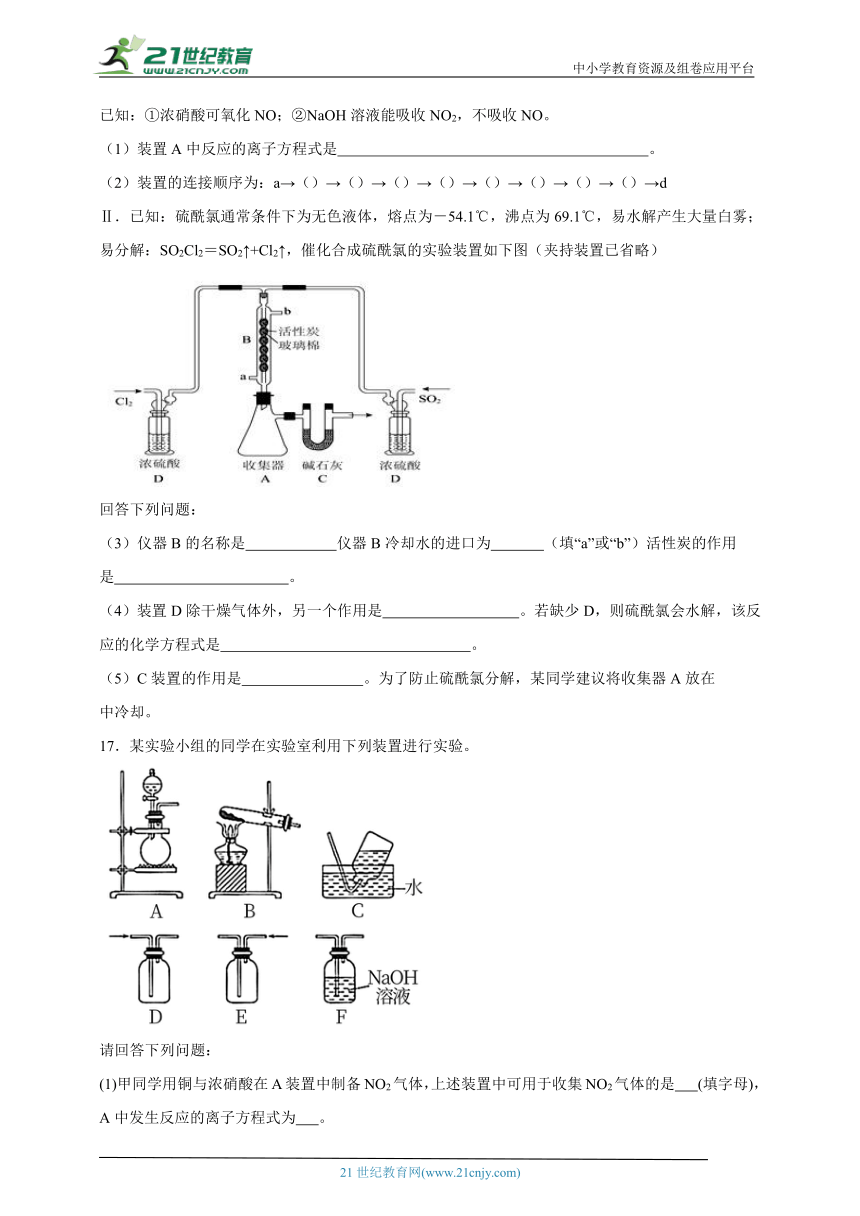
17.某实验小组的同学在实验室利用下列装置进行实验。
请回答下列问题:
(1)甲同学用铜与浓硝酸在A装置中制备NO2气体,上述装置中可用于收集NO2气体的是 (填字母),A中发生反应的离子方程式为 。
(2)乙同学用图中的装置A进行铜与浓硫酸反应制取SO2气体,装置A中还缺少的仪器名称是 ,该反应的化学方程式为 。
(3)丙同学用装置B制取氨气,发生反应的化学方程式是 ;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是 ,该反应的化学程式为 。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下11.2LNO时,被氧化物质的质量是 g。
18.下列各图是实验室制取和收集气体的常用装置:
(1)用A装置制取氨气的化学方程式是 。若用B装置制取氨气,则选用的药品是 。
(2)收集干燥氨气时,选用的干燥剂是 ,检验氨气是否收集满的方法是 。
(3)图a、b、c、d是某学生设计的收集气体的几种装置。其中不能用于收集NO2的是 ;若用d装置收集氨气,则气体流向为 (用序号说明)。
(4)若用C装置与d装置相连制取并收集X气体,则X可能是下列气体中的 ,在d装置之后还应连接导管插入到盛某种液体的烧杯中,其目的是 。
① CO2 ② NO ③ Cl2④ SO2⑤ NH3
参考答案:
1.B
【详解】A.N2是氮气的分子式,A不符合题意;
B.NH3是氨气的分子式,B符合题意;
C.NO2是二氧化氮的分子式,C不符合题意;
D.NH是铵根的化学式,D不符合题意;
答案选B。
2.C
【详解】A.若A、D为非金属单质,由转化关系可知,A可能为N2、B为NO、C为NO2、D为O2,NO2与水反应生成HNO3,是一元强酸,A正确;
B.若A和D均为化合物且D为无色无味气体,由转化关系可知,A可能为NaOH溶液、B为Na2CO3、C为NaHCO3、D为CO2,NaHCO3溶液呈碱性,B正确;
C.若A为非金属单质、D为金属单质,由转化关系可知,A可能为Cl2、B为FeCl3、C为FeCl2、D为Fe,FeCl2不能与铜反应,C错误;
D.若A为气态氢化物、D为非金属单质,由转化关系可知,A可能为H2S、B为SO2、C为SO3、D为O2,SO3与水反应得到的浓硫酸具有脱水性,能使纸脱水碳化而变黑,D正确;
故选C。
3.B
【详解】A、由题目提供的图可知:2NO+O2=2NO2,2NO2+4C04CO2+N2,NO2是该过程的中间产物,故A正确;
B、NO与O2在通常条件下就可化合生成红棕色的NO2,故B错误;
C、汽车尾气的主要污染成分包括CO和NO,故C正确;
D、根据①2NO+O2=2NO2 ②2NO2+4C0 4CO2+N2,①+②可得:2NO+O2+4CO4CO2+N2,故D正确;
【点睛】本题根据图考查了汽车尾气的主要污染物的处理,难度不大,只需读懂图就可完成,培养了学生分析问题的能力、应用知识解决问题的能力。
4.C
【详解】A.稀硝酸和铜反应生成的是一氧化氮,不能生成二氧化氮,A错误;
B.硝酸会和碳酸氢钠反应生成二氧化碳,引入二氧化碳杂质,B错误;
C.二氧化氮密度大于空气,且不和空气反应,可以用向上排空气的方法收集,C正确;
D.加热促进Cu(NO3)2溶液的水解,且生成的硝酸易挥发,应采用降温结晶法制备Cu(NO3)2·6H2O,D错误;
故选C。
5.D
【分析】汽车尾气产生的NO2在日光照射下分解成NO和氧原子,此时即开始“光化学烟雾”的循环,不断地产生O3.这个循环包括了下列3个化学方程式①NO2 NO+[O],②2NO+O2═2NO2,③O2+[O]═O3,净结果:3O2═2O3;为预防和控制氮氧化物的污染,可用氢氧化钠溶液对含氮氧化物的废气进行处理,也可以用氨气来处理。
【详解】A. 由分析,过程中有臭氧、过氧乙酰硝酸酯等氧化性物质产生,光化学烟雾有强氧化性,故A正确;
B. 二氧化氮与水反应生成硝酸,氮氧化物还可引发酸雨等污染问题,故B正确;
C. 碳氢化合物即烃类,醛、酮、过氧乙酰硝酸酯都属于烃的衍生物,故C正确;
D. NO2是红棕色气体,光化学烟雾呈现淡蓝色是由于光的折射和反射,故D错误;
故选D。
6.C
【详解】A.由于浓硝酸与铜的反应方程式为,N的化合价降低同时有盐和水生成,故硝酸在该反应中既体现氧化性又体现酸性,A正确;
B.由于浓硝酸与铜的反应方程式为,有二氧化氮生成,故试管上方有红棕色气体产生,B正确;
C.二氧化氮与烧杯中的NaOH发生反应,在反应正氢氧化钠的化合价没有变化,既不是氧化剂也不是还原剂,C错误;
D.试管中溶液变绿的原因,可能是因为溶有二氧化氮的原因,向溶液中加入适量水,可以降低二氧化氮的浓度,溶液变蓝,可证明绿色溶液中溶有,D正确;
故选C。
7.D
【详解】A. 实验室用二氧化锰和浓盐酸混合加热制备氯气,A正确;
B. 钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来,B正确;
C. 常温常压下,二氧化氮与四氧化二氮共存于同一个体系中,存在平衡关系:2NO2N2O4,C正确;
D. 因为钝化,工业上可用铝槽盛放冷的浓硫酸或浓硝酸,加热时铝与浓硝酸或浓硫酸反应,D错误;
答案选D。
8.B
【详解】设标况下该容器的容积为3L,则二氧化氮的体积为3L,生成硝酸的物质的量为xmol,一氧化氮为ymol,发生反应的方程式为:,由解得x=mol,y=mol浓度的计算公式:c(HNO3)= 。
答案选B。
9.D
【详解】A.稀HNO3与还原性物质反应生成NO,NO可与O2反应生成NO2,NO2可与H2O反生成HNO3,A不符合题意;
B.SiO2与NaOH反应生成Na2SiO3,Na2SiO3与HCl反应生成H2SiO3,H2SiO3受热分解生成SiO2,B不符合题意;
C.Al2O3可与HCl反应生成AlCl3,AlCl3与碱反应生成Al(OH)3,Al(OH)3受热分解生成Al2O3,C不符合题意;
D.H2S受热分解生成S(H2S不充分燃烧也会生成S),S与O2反应一步只能到SO2,不能直接到SO3,SO3通入Na2S溶液中可转化为H2S,D符合题意;
故答案选D。
10.B
【详解】A.HCl和饱和亚硫酸钠溶液反应生成SO2,SO2也能和饱和亚硫酸钠溶液,不能用饱和亚硫酸钠溶液除去SO2中的HCl气体,故A错误;
B.NO2的密度比空气大,能用向上排空气法收集,NO2能够和NaOH溶液反应,可以用NaOH吸收尾气,故B正确;
C.不能在容量瓶中溶解NaOH固体,故C错误;
D.Na2CO3易溶于水,不能用Na2CO3和稀盐酸通过启普发射器制备CO2气体,故D错误;
故选B。
11.错误
【解析】略
12.错误
【详解】硝酸铜的分解产物如果是CuO、NO、NO2,则N元素化合价均降低,氧元素和铜元素化合价不变,没有元素化合价升高,不符合氧化还原反应的规律,错误。
13.错误
【详解】用排水法收集NO2,发生反应:3NO2+H2O=2HNO3+NO,最终得到的是NO,故错误;
14.错误
【详解】铜粉与稀硝酸反应生成NO,NO和O2反应生成NO2,故不能用排空气法收集,错误。
15.错误
【详解】该说法错误。可用水来鉴别NO2和溴蒸气。NO2溶于水后生成HNO3和NO,溶液略显黄色。溴蒸气溶于水得到溴水,溴水为橙色溶液。故答案为:错误。
16. 3Cu +8H++2NO3-=3Cu2++2NO↑+4H2O f → e → j→ i→ h → g(或g→h)→ b → c 球型冷凝管 a 催化剂 通过观察气泡控制气流速度(或比例) SO2Cl2+2H2O=H2SO4+2HCl 吸收SO2和Cl2,防止空气污染 冰水浴
【详解】I.根据实验原理利用NO被灼热的铁粉还原为N2,同时生成FeO,所以首先应制备纯净的干燥的NO,利用铜与稀硝酸反应生成NO,由于硝酸具有挥发性,所以制得的NO中会混有硝酸和水蒸气气体,则先通过装置D除去挥发出的HNO3等酸性气体,然后再通过F干燥,得到纯净的干燥的NO进入E中与铁粉反应,最后处理多余的NO,又因为NaOH溶液不与NO反应,而浓硝酸可氧化NO生成NO2,所以最终先通过B氧化NO,后再通过C吸收。
(1)装置A中铜与稀硝酸反应的离子方程式为3Cu +8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为3Cu +8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)根据以上分析,先制备NO→除硝酸气体→除水蒸气→氧化铁粉→氧化多余的NO→NaOH溶液吸收,所以上述装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d,故答案为f→e→j→i→h→g(或g→h)→b→c→d;
II.(3)根据装置图,仪器B为球型冷凝管,根据采用逆流的冷凝效果好,所以冷凝管中的冷却水进口为a,活性炭作催化剂;故答案为球型冷凝管;a;催化剂;
(4)D装置的浓硫酸用来干燥气体,防止硫酰氯水解,同时还可以通过观察气泡控制气体流速;若无D,硫酰氯水解为硫酸和盐酸。化学方程式为:SO2Cl2+2H2O═H2SO4+2HCl,故答案为通过观察气泡控制气体流速;SO2Cl2+2H2O═H2SO4+2HCl;
(5)SO2Cl2易分解放出SO2和Cl2,C装置中的碱石灰可以吸收SO2和Cl2,防止空气污染;为了防止硫酰氯分解,可将收集器A放在冰水中冷却,故答案为吸收SO2和Cl2,防止空气污染;冰水浴。
17. D Cu+4H++2=2NO2↑+2H2O+Cu2+ 酒精灯 Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑ Ca(OH)2+2NH4ClCaCl2+2H2O+2NH3↑ 产生白烟 NH3+HCl=NH4Cl 8.5
【详解】(1)NO2密度比空气大且不与空气反应,可用向上排空气法反应,即D;铜与浓硝酸在A装置中反应生成NO2、硝酸铜、水,发生反应的离子方程式为Cu+4H++2=2NO2↑+2H2O+Cu2+;
(2)Cu和浓硫酸需要在加热条件下才反应,因此装置A中还缺少的仪器是酒精灯;铜与浓硫酸在加热条件下反应生成硫酸铜、水和二氧化硫,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑;
(3)B为固固加热型装置,丙同学用装置B制取氨气,则发生反应的化学方程式是Ca(OH)2+2NH4ClCaCl2+2H2O+2NH3↑;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是产生白烟;原因是浓盐酸挥发出的HCl和氨气反应生成氯化铵固体小颗粒,该反应的化学程式为NH3+HCl=NH4Cl;
(4)丙同学在实验室中模拟氨的催化氧化反应,则发生4NH3+5O24NO+6H2O,该反应中,N元素化合价从-3升高到+2,氨气被氧化,有关系式NH3~NO,则当生成标准状况下11.2LNO(0.5mol)时,被氧化物质的质量是0.5mol×17g/mol=8.5g。
18. 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 浓氨水与生石灰(或NaOH固体) 碱石灰(或生石灰) 用润湿的红色石蕊试纸(无色酚酞试纸)置于试管口(或集气瓶口),若试纸变蓝(变红),则氨气已集满(或用玻璃棒蘸取浓盐酸靠近瓶口,若产生白烟,则氨气已集满) b c ②进①出 ③④ 吸收尾气,防止污染空气
【详解】(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,若用B装置制取氨气,利用了氨气易挥发的性质,一般可用浓氨水与生石灰(或NaOH固体),生石灰、氢氧化钠吸水,并放出大量的热,有利于氨气的生成;
(2)氨水成碱性,应用碱性干燥剂干燥氨气,一般可用碱石灰(或生石灰),检验氨气是否收集满的方法是用润湿的红色石蕊试纸(无色酚酞试纸)置于试管口(或集气瓶口),若试纸变蓝(变红),则氨气已集满(或用玻璃棒蘸取浓盐酸靠近瓶口,若产生白烟,则氨气已集满);
(3)二氧化氮密度比空气大,易与水反应,则装置b和c不能用于收集二氧化氮,氨气的密度比空气小,若用d装置收集氨气,则气体流向为②进①出;
(4)若用C装置与d装置相连制取并收集X气体,则在加热条件下制备,且用固体和液体或者液体与液体反应,可用于制备氯气,二氧化硫等,气体有毒,不能排放到空气中,应有尾气处理装置。
【点睛】考查气体的实验室制备和装置的应用,明确气体制备原理是解题关键,特别注意NH3不能用浓硫酸干燥,NO只能用排水法收集,而NO2只能用向上排空气法收集。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
氮的化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.氨气的分子式是
A.N2 B.NH3 C.NO2 D.NH
2.A、B、C、D为中学化学常见的物质,A、B、C中均含有同一种元素,它们之间具有如图转化关系,下列说法错误的是
A.若A、D为非金属单质,则C的水溶液可能是一元强酸溶液
B.若A和D均为化合物且D为无色无味气体,则C的水溶液可能呈弱碱性
C.若A为非金属单质,D为金属单质,则C的水溶液可腐蚀铜
D.若A为气态氢化物,D为气态非金属单质,则C的水溶液的浓溶液可能使纸张变黑
3.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
A.NO2是该过程的中间产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分包括CO和NO
D.催化转化总反应为2NO+O2+4CO4CO2+N2
4.氨气是一种重要的化工原料,以氨为原料可以生产化肥和硝酸,在催化剂条件下,氨催化氧化生成NO,进而继续被氧化为NO2,再与水反应生成硝酸,氨气与硝酸反应可得氮肥硝酸铵。4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-905.8kJ·mol-1。工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。下列装置用于实验室制NO2并回收硝酸铜,能达到实验目的的是
A.用装置甲制取NO2
B.用装置乙除NO2中的少量HNO3
C.用装置丙收集NO2
D.用装置丁蒸干Cu(NO3)2溶液制Cu(NO3)2·6H2O
5.(1)化石燃料燃烧、硝酸工业废气处理不当及机动车辆尾气排放中的NO、NO2进入大气后,在日光照射下分解成NO和O时,即开始光化学烟雾的循环,不断地产生O3,光化学烟雾通常呈现淡蓝色其主要成分及简单形成机理如图所示。
(2)为预防和控制氮氧化物的污染,人们采取许多措施。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。下列说法错误的是
A.光化学烟雾有强氧化性
B.氮氧化物还可引发酸雨等污染问题
C.光化学烟雾成分中含有烃和烃的衍生物
D.光化学烟雾呈现淡蓝色是因为含有NO2
6.铜与浓硝酸反应的实验装置如下图所示,观察到试管中铜丝变细、有气泡生成、溶液变绿,烧杯中没有气泡外逸。下列有关叙述不正确的是
A.硝酸在该反应中既体现氧化性又体现酸性
B.实验时试管上方有红棕色气体产生
C.烧杯中的NaOH在反应中既作氧化剂又作还原剂
D.向绿色溶液中加入适量水,观察溶液变蓝,可证明绿色溶液中溶有
7.下列说法不正确的是
A.实验室用二氧化锰和浓盐酸混合加热制备氯气
B.钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来
C.常温常压下,二氧化氮与四氧化二氮共存于同一个体系中
D.因为钝化,工业上可用铝槽盛放热的浓硫酸或浓硝酸
8.标准状况下,在一不规则的玻璃容器内充满NO2气体后,将其倒置于水槽中,假设容器中的物质不扩散至容器外,则充分反应后容器中所得溶液的物质的量浓度近似为
A.1.0 mol·L-1 B.0.045 mol·L-1 C.0.020 mol·L-1 D.0.12 mol·L-1
9.X、Y、Z三种物质的转化关系如图所示。已知硅酸不稳定,易分解。则下列各组物质的转化不能一步实现的是
选项 X Y Z
A HNO3 NO NO2
B SiO2 Na2SiO3 H2SiO3
C Al2O3 AlCl3 Al(OH)3
D H2S S SO3
A.A B.B C.C D.D
10.用下列仪器或装置进行相应实验,能达到实验目的的是
选项 A B C D
实验装置
实验目的 除去SO2中的HCl气体 收集NO2气体 配制1.0mol L-1NaOH溶液 制备少量CO2气体
A.A B.B C.C D.D
二、判断题
11.NO和NO2都是有刺激性气味的有毒气体,它们都是大气污染物。(__)
12.硝酸铜的分解产物可能是CuO、NO、NO2。(______)
13.瓶中盛满水,从b口进气,用排水法收集NO2 。(_______)
14.用向上排空气法收集铜粉与稀硝酸反应产生的气体。( )
15.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO2,得橙色溶液的为溴蒸气。(_______)
三、解答题
16.Ⅰ.某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO)。
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
(1)装置A中反应的离子方程式是 。
(2)装置的连接顺序为:a→()→()→()→()→()→()→()→()→d
Ⅱ.已知:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,易水解产生大量白雾;易分解:SO2Cl2=SO2↑+Cl2↑,催化合成硫酰氯的实验装置如下图(夹持装置已省略)
回答下列问题:
(3)仪器B的名称是 仪器B冷却水的进口为 (填“a”或“b”)活性炭的作用是 。
(4)装置D除干燥气体外,另一个作用是 。若缺少D,则硫酰氯会水解,该反应的化学方程式是 。
(5)C装置的作用是 。为了防止硫酰氯分解,某同学建议将收集器A放在 中冷却。
17.某实验小组的同学在实验室利用下列装置进行实验。
请回答下列问题:
(1)甲同学用铜与浓硝酸在A装置中制备NO2气体,上述装置中可用于收集NO2气体的是 (填字母),A中发生反应的离子方程式为 。
(2)乙同学用图中的装置A进行铜与浓硫酸反应制取SO2气体,装置A中还缺少的仪器名称是 ,该反应的化学方程式为 。
(3)丙同学用装置B制取氨气,发生反应的化学方程式是 ;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是 ,该反应的化学程式为 。
(4)丙同学在实验室中模拟氨的催化氧化反应,该反应中,当生成标准状况下11.2LNO时,被氧化物质的质量是 g。
18.下列各图是实验室制取和收集气体的常用装置:
(1)用A装置制取氨气的化学方程式是 。若用B装置制取氨气,则选用的药品是 。
(2)收集干燥氨气时,选用的干燥剂是 ,检验氨气是否收集满的方法是 。
(3)图a、b、c、d是某学生设计的收集气体的几种装置。其中不能用于收集NO2的是 ;若用d装置收集氨气,则气体流向为 (用序号说明)。
(4)若用C装置与d装置相连制取并收集X气体,则X可能是下列气体中的 ,在d装置之后还应连接导管插入到盛某种液体的烧杯中,其目的是 。
① CO2 ② NO ③ Cl2④ SO2⑤ NH3
参考答案:
1.B
【详解】A.N2是氮气的分子式,A不符合题意;
B.NH3是氨气的分子式,B符合题意;
C.NO2是二氧化氮的分子式,C不符合题意;
D.NH是铵根的化学式,D不符合题意;
答案选B。
2.C
【详解】A.若A、D为非金属单质,由转化关系可知,A可能为N2、B为NO、C为NO2、D为O2,NO2与水反应生成HNO3,是一元强酸,A正确;
B.若A和D均为化合物且D为无色无味气体,由转化关系可知,A可能为NaOH溶液、B为Na2CO3、C为NaHCO3、D为CO2,NaHCO3溶液呈碱性,B正确;
C.若A为非金属单质、D为金属单质,由转化关系可知,A可能为Cl2、B为FeCl3、C为FeCl2、D为Fe,FeCl2不能与铜反应,C错误;
D.若A为气态氢化物、D为非金属单质,由转化关系可知,A可能为H2S、B为SO2、C为SO3、D为O2,SO3与水反应得到的浓硫酸具有脱水性,能使纸脱水碳化而变黑,D正确;
故选C。
3.B
【详解】A、由题目提供的图可知:2NO+O2=2NO2,2NO2+4C04CO2+N2,NO2是该过程的中间产物,故A正确;
B、NO与O2在通常条件下就可化合生成红棕色的NO2,故B错误;
C、汽车尾气的主要污染成分包括CO和NO,故C正确;
D、根据①2NO+O2=2NO2 ②2NO2+4C0 4CO2+N2,①+②可得:2NO+O2+4CO4CO2+N2,故D正确;
【点睛】本题根据图考查了汽车尾气的主要污染物的处理,难度不大,只需读懂图就可完成,培养了学生分析问题的能力、应用知识解决问题的能力。
4.C
【详解】A.稀硝酸和铜反应生成的是一氧化氮,不能生成二氧化氮,A错误;
B.硝酸会和碳酸氢钠反应生成二氧化碳,引入二氧化碳杂质,B错误;
C.二氧化氮密度大于空气,且不和空气反应,可以用向上排空气的方法收集,C正确;
D.加热促进Cu(NO3)2溶液的水解,且生成的硝酸易挥发,应采用降温结晶法制备Cu(NO3)2·6H2O,D错误;
故选C。
5.D
【分析】汽车尾气产生的NO2在日光照射下分解成NO和氧原子,此时即开始“光化学烟雾”的循环,不断地产生O3.这个循环包括了下列3个化学方程式①NO2 NO+[O],②2NO+O2═2NO2,③O2+[O]═O3,净结果:3O2═2O3;为预防和控制氮氧化物的污染,可用氢氧化钠溶液对含氮氧化物的废气进行处理,也可以用氨气来处理。
【详解】A. 由分析,过程中有臭氧、过氧乙酰硝酸酯等氧化性物质产生,光化学烟雾有强氧化性,故A正确;
B. 二氧化氮与水反应生成硝酸,氮氧化物还可引发酸雨等污染问题,故B正确;
C. 碳氢化合物即烃类,醛、酮、过氧乙酰硝酸酯都属于烃的衍生物,故C正确;
D. NO2是红棕色气体,光化学烟雾呈现淡蓝色是由于光的折射和反射,故D错误;
故选D。
6.C
【详解】A.由于浓硝酸与铜的反应方程式为,N的化合价降低同时有盐和水生成,故硝酸在该反应中既体现氧化性又体现酸性,A正确;
B.由于浓硝酸与铜的反应方程式为,有二氧化氮生成,故试管上方有红棕色气体产生,B正确;
C.二氧化氮与烧杯中的NaOH发生反应,在反应正氢氧化钠的化合价没有变化,既不是氧化剂也不是还原剂,C错误;
D.试管中溶液变绿的原因,可能是因为溶有二氧化氮的原因,向溶液中加入适量水,可以降低二氧化氮的浓度,溶液变蓝,可证明绿色溶液中溶有,D正确;
故选C。
7.D
【详解】A. 实验室用二氧化锰和浓盐酸混合加热制备氯气,A正确;
B. 钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来,B正确;
C. 常温常压下,二氧化氮与四氧化二氮共存于同一个体系中,存在平衡关系:2NO2N2O4,C正确;
D. 因为钝化,工业上可用铝槽盛放冷的浓硫酸或浓硝酸,加热时铝与浓硝酸或浓硫酸反应,D错误;
答案选D。
8.B
【详解】设标况下该容器的容积为3L,则二氧化氮的体积为3L,生成硝酸的物质的量为xmol,一氧化氮为ymol,发生反应的方程式为:,由解得x=mol,y=mol浓度的计算公式:c(HNO3)= 。
答案选B。
9.D
【详解】A.稀HNO3与还原性物质反应生成NO,NO可与O2反应生成NO2,NO2可与H2O反生成HNO3,A不符合题意;
B.SiO2与NaOH反应生成Na2SiO3,Na2SiO3与HCl反应生成H2SiO3,H2SiO3受热分解生成SiO2,B不符合题意;
C.Al2O3可与HCl反应生成AlCl3,AlCl3与碱反应生成Al(OH)3,Al(OH)3受热分解生成Al2O3,C不符合题意;
D.H2S受热分解生成S(H2S不充分燃烧也会生成S),S与O2反应一步只能到SO2,不能直接到SO3,SO3通入Na2S溶液中可转化为H2S,D符合题意;
故答案选D。
10.B
【详解】A.HCl和饱和亚硫酸钠溶液反应生成SO2,SO2也能和饱和亚硫酸钠溶液,不能用饱和亚硫酸钠溶液除去SO2中的HCl气体,故A错误;
B.NO2的密度比空气大,能用向上排空气法收集,NO2能够和NaOH溶液反应,可以用NaOH吸收尾气,故B正确;
C.不能在容量瓶中溶解NaOH固体,故C错误;
D.Na2CO3易溶于水,不能用Na2CO3和稀盐酸通过启普发射器制备CO2气体,故D错误;
故选B。
11.错误
【解析】略
12.错误
【详解】硝酸铜的分解产物如果是CuO、NO、NO2,则N元素化合价均降低,氧元素和铜元素化合价不变,没有元素化合价升高,不符合氧化还原反应的规律,错误。
13.错误
【详解】用排水法收集NO2,发生反应:3NO2+H2O=2HNO3+NO,最终得到的是NO,故错误;
14.错误
【详解】铜粉与稀硝酸反应生成NO,NO和O2反应生成NO2,故不能用排空气法收集,错误。
15.错误
【详解】该说法错误。可用水来鉴别NO2和溴蒸气。NO2溶于水后生成HNO3和NO,溶液略显黄色。溴蒸气溶于水得到溴水,溴水为橙色溶液。故答案为:错误。
16. 3Cu +8H++2NO3-=3Cu2++2NO↑+4H2O f → e → j→ i→ h → g(或g→h)→ b → c 球型冷凝管 a 催化剂 通过观察气泡控制气流速度(或比例) SO2Cl2+2H2O=H2SO4+2HCl 吸收SO2和Cl2,防止空气污染 冰水浴
【详解】I.根据实验原理利用NO被灼热的铁粉还原为N2,同时生成FeO,所以首先应制备纯净的干燥的NO,利用铜与稀硝酸反应生成NO,由于硝酸具有挥发性,所以制得的NO中会混有硝酸和水蒸气气体,则先通过装置D除去挥发出的HNO3等酸性气体,然后再通过F干燥,得到纯净的干燥的NO进入E中与铁粉反应,最后处理多余的NO,又因为NaOH溶液不与NO反应,而浓硝酸可氧化NO生成NO2,所以最终先通过B氧化NO,后再通过C吸收。
(1)装置A中铜与稀硝酸反应的离子方程式为3Cu +8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为3Cu +8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)根据以上分析,先制备NO→除硝酸气体→除水蒸气→氧化铁粉→氧化多余的NO→NaOH溶液吸收,所以上述装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d,故答案为f→e→j→i→h→g(或g→h)→b→c→d;
II.(3)根据装置图,仪器B为球型冷凝管,根据采用逆流的冷凝效果好,所以冷凝管中的冷却水进口为a,活性炭作催化剂;故答案为球型冷凝管;a;催化剂;
(4)D装置的浓硫酸用来干燥气体,防止硫酰氯水解,同时还可以通过观察气泡控制气体流速;若无D,硫酰氯水解为硫酸和盐酸。化学方程式为:SO2Cl2+2H2O═H2SO4+2HCl,故答案为通过观察气泡控制气体流速;SO2Cl2+2H2O═H2SO4+2HCl;
(5)SO2Cl2易分解放出SO2和Cl2,C装置中的碱石灰可以吸收SO2和Cl2,防止空气污染;为了防止硫酰氯分解,可将收集器A放在冰水中冷却,故答案为吸收SO2和Cl2,防止空气污染;冰水浴。
17. D Cu+4H++2=2NO2↑+2H2O+Cu2+ 酒精灯 Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑ Ca(OH)2+2NH4ClCaCl2+2H2O+2NH3↑ 产生白烟 NH3+HCl=NH4Cl 8.5
【详解】(1)NO2密度比空气大且不与空气反应,可用向上排空气法反应,即D;铜与浓硝酸在A装置中反应生成NO2、硝酸铜、水,发生反应的离子方程式为Cu+4H++2=2NO2↑+2H2O+Cu2+;
(2)Cu和浓硫酸需要在加热条件下才反应,因此装置A中还缺少的仪器是酒精灯;铜与浓硫酸在加热条件下反应生成硫酸铜、水和二氧化硫,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑;
(3)B为固固加热型装置,丙同学用装置B制取氨气,则发生反应的化学方程式是Ca(OH)2+2NH4ClCaCl2+2H2O+2NH3↑;若将一端蘸有浓盐酸的玻璃棒接近导管口,观察到的现象是产生白烟;原因是浓盐酸挥发出的HCl和氨气反应生成氯化铵固体小颗粒,该反应的化学程式为NH3+HCl=NH4Cl;
(4)丙同学在实验室中模拟氨的催化氧化反应,则发生4NH3+5O24NO+6H2O,该反应中,N元素化合价从-3升高到+2,氨气被氧化,有关系式NH3~NO,则当生成标准状况下11.2LNO(0.5mol)时,被氧化物质的质量是0.5mol×17g/mol=8.5g。
18. 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 浓氨水与生石灰(或NaOH固体) 碱石灰(或生石灰) 用润湿的红色石蕊试纸(无色酚酞试纸)置于试管口(或集气瓶口),若试纸变蓝(变红),则氨气已集满(或用玻璃棒蘸取浓盐酸靠近瓶口,若产生白烟,则氨气已集满) b c ②进①出 ③④ 吸收尾气,防止污染空气
【详解】(1)实验室用氯化铵和氢氧化钙在加热条件下制备氨气,方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,若用B装置制取氨气,利用了氨气易挥发的性质,一般可用浓氨水与生石灰(或NaOH固体),生石灰、氢氧化钠吸水,并放出大量的热,有利于氨气的生成;
(2)氨水成碱性,应用碱性干燥剂干燥氨气,一般可用碱石灰(或生石灰),检验氨气是否收集满的方法是用润湿的红色石蕊试纸(无色酚酞试纸)置于试管口(或集气瓶口),若试纸变蓝(变红),则氨气已集满(或用玻璃棒蘸取浓盐酸靠近瓶口,若产生白烟,则氨气已集满);
(3)二氧化氮密度比空气大,易与水反应,则装置b和c不能用于收集二氧化氮,氨气的密度比空气小,若用d装置收集氨气,则气体流向为②进①出;
(4)若用C装置与d装置相连制取并收集X气体,则在加热条件下制备,且用固体和液体或者液体与液体反应,可用于制备氯气,二氧化硫等,气体有毒,不能排放到空气中,应有尾气处理装置。
【点睛】考查气体的实验室制备和装置的应用,明确气体制备原理是解题关键,特别注意NH3不能用浓硫酸干燥,NO只能用排水法收集,而NO2只能用向上排空气法收集。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
