含镁化合物试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 含镁化合物试题 高考化学考前专项复习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 796.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 11:23:17 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
含镁化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3。跟盐酸和NaOH溶液都能反应的物质有
A.二种 B.三种 C.四种 D.五种
2.化学与生活密切相关,下列说法错误的是
A.氧化镁可制做耐火材料
B.药皂中含苯酚具有杀菌、消毒作用
C.甲醛的水溶液可用于蔬菜防腐
D.醋酸用来除水垢
3.以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.以上流程中得到浸出液的操作是过滤
B.为了加快反应速率,浸出和沉镁的操作均可在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.浸出镁的反应为
4.向含MgCl2、AlCl3均为n mol的混合液中逐滴加入NaOH溶液至过量,有关离子沉淀或沉淀溶解与pH关系如下表:
离子 Mg2+ Al3+ 物质 Al(OH)3[来
开始沉淀时的pH 8.93 3.56 开始溶解时的pH 8.04
完全沉淀时的pH 10.92 4.89 完全溶解时的pH 12.04
列表示生成沉淀与加入NaOH的物质的量关系的图像中,关系正确的是
A.A B.B C.C D.D
5.向x的溶液中,加入Y试剂,产生的沉淀示意图如图所示的是(注意线段的斜率)
A.向NaOH和Ca(OH)2的混合液中通入CO2
B.向HCl和A1C13的混合液中滴加NaOH溶液
C.向NH4A1(SO4)2溶液中滴加NaOH溶液
D.向NH4C1和MgCl2的混合液中滴加NaOH溶液
6.下列有关物质的性质与用途具有对应关系的是
A.Mg(OH)2具有碱性,可用于制胃酸中和剂 B.H2O2是无色液体,可用作消毒剂
C.FeCl3具有氧化性,可用作净水剂 D.Mg与CO2反应生成MgO和CO
7.如图所示的5种物质中均含同种金属元素,且在一定条件下(不含通电)能发生图示转化的金属元素有几个
①Mg ②Al ③Ca ④Fe ⑤Cu
A.2 B.3 C.4 D.5
8.以下物质间的每步转化都能通过一步反应就能实现的是( )
A.MgCl2→Mg(OH)2→MgO B.Cl2→FeCl3→Fe
C.S→SO3→H2SO4 D.Si→SiO2→H2SiO3
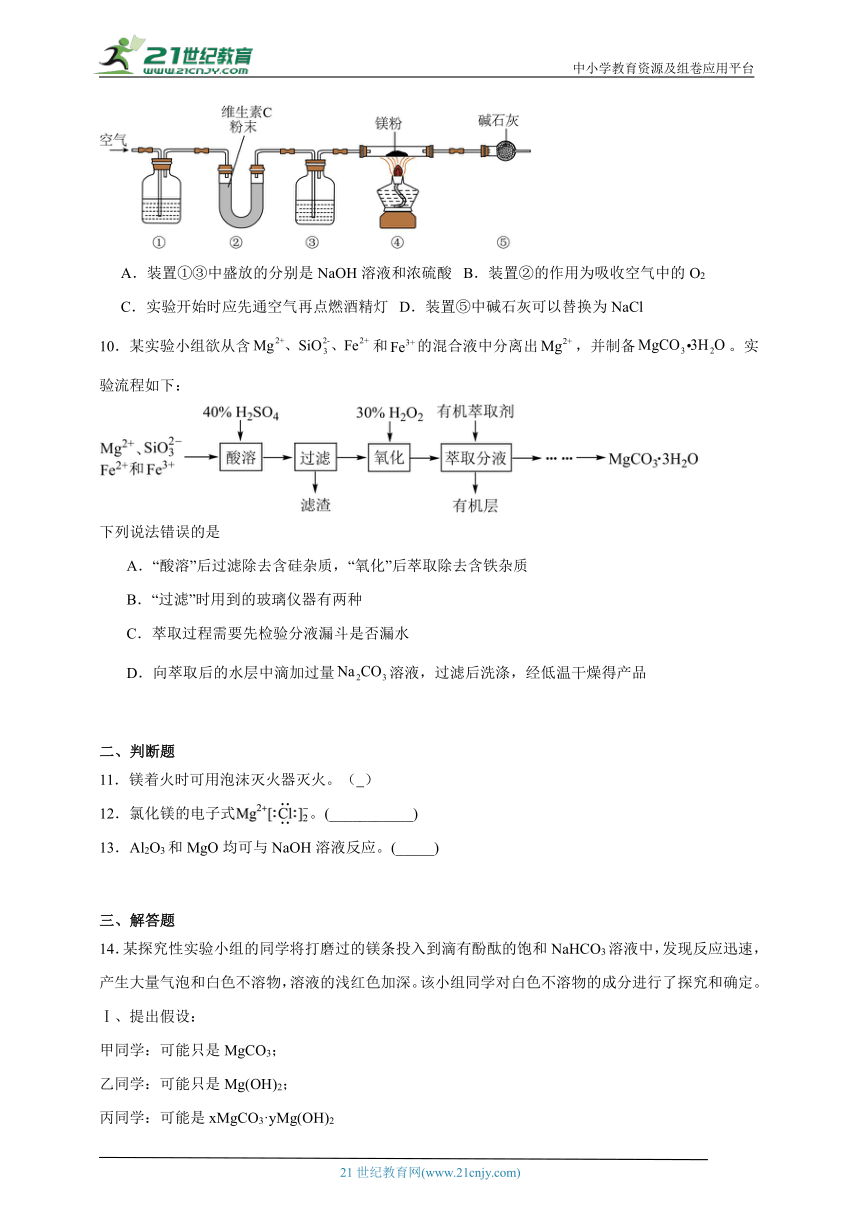
9.某兴趣小组在实验室通过镁粉和空气中的氮气制备氮化镁(可与水发生反应),其装置如下图所示。已知:维生素C具有较强的还原性。下列说法错误的是
A.装置①③中盛放的分别是NaOH溶液和浓硫酸 B.装置②的作用为吸收空气中的O2
C.实验开始时应先通空气再点燃酒精灯 D.装置⑤中碱石灰可以替换为NaCl
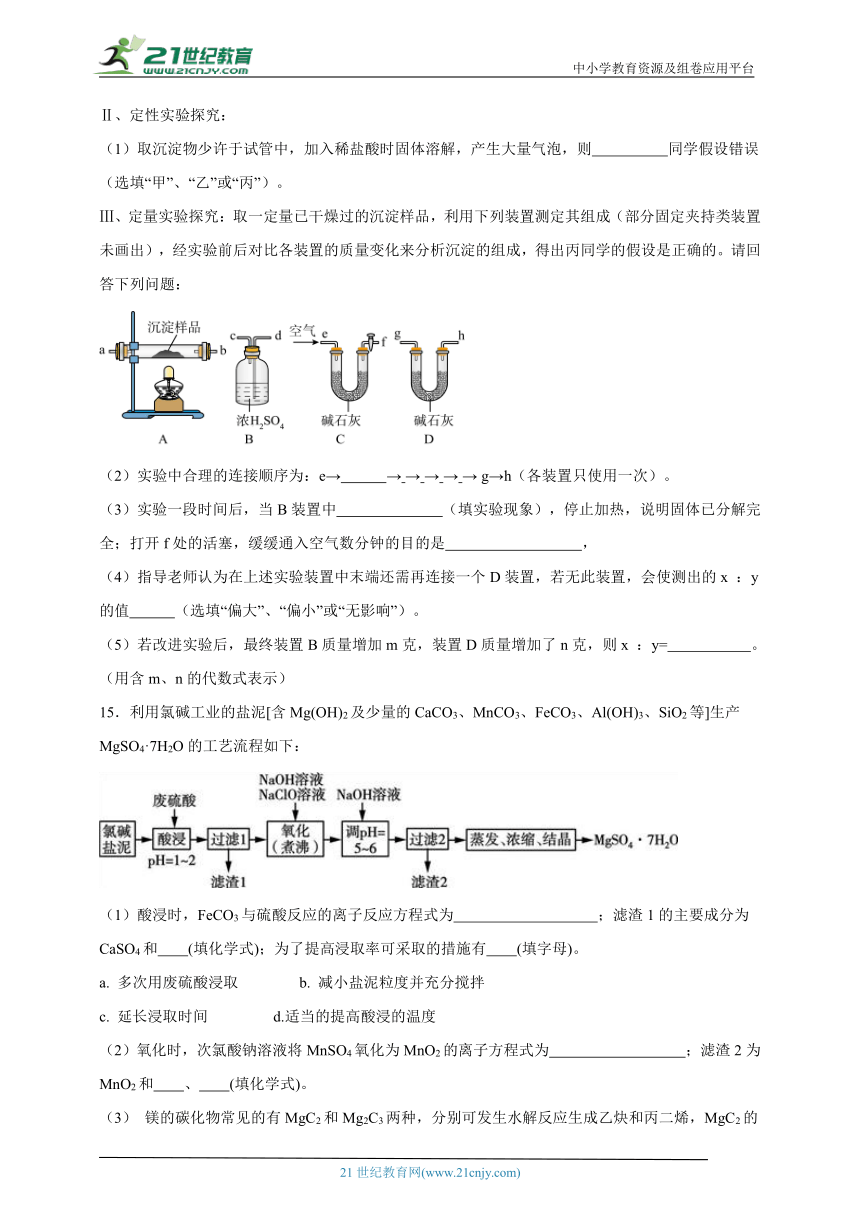
10.某实验小组欲从含和的混合液中分离出,并制备。实验流程如下:
下列说法错误的是
A.“酸溶”后过滤除去含硅杂质,“氧化”后萃取除去含铁杂质
B.“过滤”时用到的玻璃仪器有两种
C.萃取过程需要先检验分液漏斗是否漏水
D.向萃取后的水层中滴加过量溶液,过滤后洗涤,经低温干燥得产品
二、判断题
11.镁着火时可用泡沫灭火器灭火。( )
12.氯化镁的电子式。(___________)
13.Al2O3和MgO均可与NaOH溶液反应。(_____)
三、解答题
14.某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
甲同学:可能只是MgCO3;
乙同学:可能只是Mg(OH)2;
丙同学:可能是xMgCO3·yMg(OH)2
Ⅱ、定性实验探究:
(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则 同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:
(2)实验中合理的连接顺序为:e→ → → → → → g→h(各装置只使用一次)。
(3)实验一段时间后,当B装置中 (填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是 ,
(4)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值 (选填“偏大”、“偏小”或“无影响”)。
(5)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y= 。(用含m、n的代数式表示)
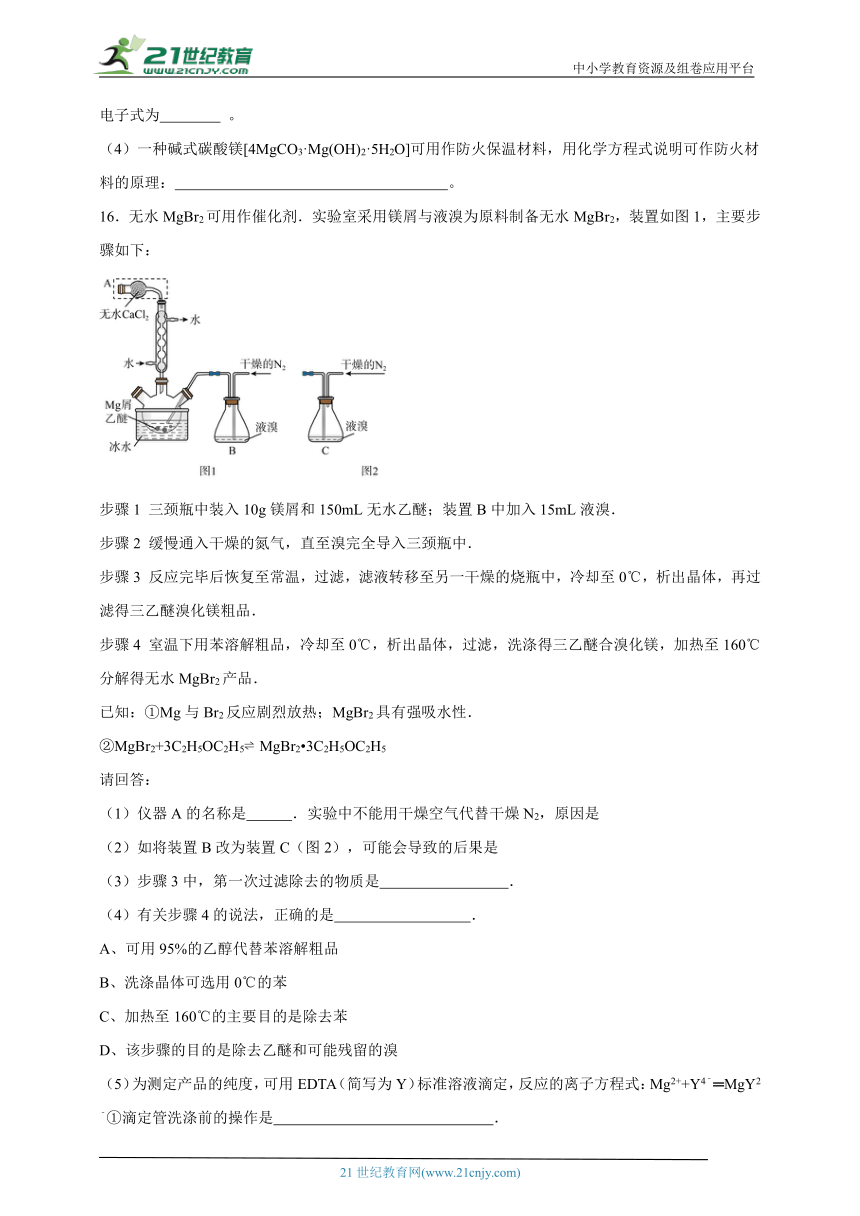
15.利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为 ;滤渣1的主要成分为CaSO4和 (填化学式);为了提高浸取率可采取的措施有 (填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为 ;滤渣2为MnO2和 、 (填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理: 。
16.无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5 MgBr2 3C2H5OC2H5
请回答:
(1)仪器A的名称是 .实验中不能用干燥空气代替干燥N2,原因是
(2)如将装置B改为装置C(图2),可能会导致的后果是
(3)步骤3中,第一次过滤除去的物质是 .
(4)有关步骤4的说法,正确的是 .
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是 .
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol L﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是 (以质量分数表示).
参考答案:
1.D
【详解】碳酸氢镁能和氢氧化钠反应生成氢氧化镁和碳酸钠,氢氧化铝和氢氧化钠反应生成偏铝酸钠,铝和氢氧化钠反应生成偏铝酸钠和氢气,碳酸铵和氢氧化钠反应生成一水合氨和碳酸钠,氧化铝和氢氧化钠反应生成偏铝酸钠和水,五种物质都和盐酸反应,故选D。
2.C
【分析】A. 氧化镁可制做耐火材料;B. 低浓度的苯酚可以起到杀菌、消毒作用;C. 甲醛对人体有害,不能用于蔬菜防腐;D.水垢可以和醋酸反应;
【详解】A. 氧化镁熔点高,具有极高的稳定性,可制做耐火材料,故A项正确; B. 低浓度的苯酚是一种杀菌剂,在药皂中加入苯酚可以起到杀菌、消毒作用,故B项正确;C.甲醛对人体有害,不能用于蔬菜防腐,故C项错误;D.水垢的主要成分是碳酸钙和氢氧化镁,两者均能溶于酸,故醋酸可以用来除水垢,D项正确。综上,本题选C。
3.B
【分析】菱镁矿煅烧后得到轻烧粉,其中MgCO3转化为MgO,加入氯化铵溶液浸取,浸出的废渣有SiO2、Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有Mg2+,加入氨水得到Mg(OH)2沉淀,煅烧得到高纯镁砂。
【详解】A.加入氯化铵溶液浸取,浸出的废渣有SiO2、Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有Mg2+,通过过滤将其分离,故A不选;
B.一水合氨受热易分解,沉镁时在较高温度下进行会造成一水合氨大量分解,挥发出氨气,降低利用率,故B选;
C.浸出过程产生的氨气可以回收制备氨水,沉镁时氯化镁与氨水反应生成的氯化铵又可以利用到浸出过程中,故C不选;
D.高温煅烧后Mg元素主要以MgO的形式存在,MgO可以与铵根水解产生的氢离子反应,促进铵根的水解,所以得到氯化镁、氨气和水,化学方程式为,故D不选;
故选:B。
4.C
【详解】当Al3+完全沉淀时,溶液的pH=8.04,而镁离子开始沉淀的pH=8.93,则Al3+完全沉淀时Mg2+还没有开始沉淀;即:当Mg2+开始沉淀时,已经有部分氢氧化铝开始溶解;镁离子完全沉淀的pH=10.92,氢氧化铝完全溶解的pH=12.04,则当Mg2+完全沉淀时,氢氧化铝还没有完全被溶解,所以正确的图像应该是C,C正确;
故选C。
5.A
【详解】A.向NaOH和Ca(OH)2的混合液中通入CO2,先发生Ca(OH)2+CO2=CaCO3↓+H2O,生成沉淀,再发生CO2+NaOH=NaHCO3,沉淀的量不变,最后发生反应:CaCO3↓+H2O+CO2=Ca(HCO3)2,沉淀溶解,根据方程式中物质消耗关系可知:生成沉淀和沉淀溶解消耗的CO2相等,图象与反应符合,A正确;
B.向HCl和AlCl3的混合溶液中滴加NaOH,先发生HCl+NaOH=NaCl+H2O,然后发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;开始无沉淀生成,图象与发生的化学反应不符,B错误;
C.向NH4Al(SO4)2溶液中加入NaOH溶液,首先发生反应:Al3++3OH-=Al(OH)3↓,然后发生反应:NH4++OH-=NH3·H2O,最后发生反应:Al(OH)3+OH-=AlO2-+2H2O,形成沉淀与沉淀溶解消耗NaOH的物质的量的比是3:1,发生的反应与图象不符合,C错误;
D.向NH4Cl和MgCl2的混合液中滴加NaOH,先发生Mg2++2OH-=Mg(OH)2↓,然后发生NH4++OH-=NH3·H2O,由于Mg(OH)2是难溶性的弱碱,NaOH过量时沉淀白色不会溶解,图象与发生的化学反应不符,D错误;
故合理选项是A。
6.A
【详解】A.Mg(OH)2具有弱碱性,难溶于水,能与HCl反应生成氯化镁和水,并且无毒,所以Mg(OH)2可用于制胃酸中和剂,故A正确;
B.H2O2具有氧化性,可用作消毒剂,与H2O2是无色液体无关,故B错误;
C.FeCl3易水解生成氢氧化铁胶体、吸附作用强,能吸附水中的悬浮物形成沉淀,达到净水目的,与FeCl3具有氧化性无关,故C错误;
D.Mg在CO2中燃烧生成MgO和C,故D错误;
故选A。
7.A
【分析】根据图知,金属单质能转化为硝酸盐,硝酸盐能生成氢氧化物,说明生成的氢氧化物是难溶性物质,氢氧化物不稳定受热易分解生成氧化物,氧化物能溶于稀盐酸生成盐酸盐,盐酸盐能发生置换反应生成金属单质,据此分析。
【详解】①Mg和稀硝酸或可溶性硝酸盐反应生成硝酸镁,将硝酸镁与氢氧化钠反应生成氢氧化镁,将氢氧化镁加热分解可以得到氧化镁,将氧化镁加入盐酸反应制得氯化镁,氯化镁不能通过置换反应制得镁,故①不能发生图示转化,①不符合题意;
②铝与硝酸盐或稀硝酸反应生成硝酸铝,硝酸铝与氢氧化钠反应生成氢氧化铝,将氢氧化铝加热分解可以得到氧化铝,氧化铝和盐酸反应可以生成氯化铝,氯化铝不能通过置换反应得到金属铝,故②不能发生图示转化,②不符合题意;
③钙与稀硝酸反应生成硝酸钙,硝酸钙与碱不反应,不能生成氢氧化钙,故③不能发生图示转化,③不符合题意;
④Fe与硝酸盐或稀硝酸反应生成硝酸铁,硝酸铁与氢氧化钠反应生成氢氧化铁,将氢氧化铁加热分解可以得到氧化铁,氧化铝和盐酸反应可以生成氯化铁,氯化铁能通过置换反应得到金属铁,故④能发生图示转化,④符合题意;
⑤Cu与硝酸盐或稀硝酸反应生成硝酸铜,硝酸铜与氢氧化钠反应生成氢氧化铜,将氢氧化铜加热分解可以得到氧化铜,氧化铜和盐酸反应可以生成氯化铜,氯化铜能通过置换反应得到金属铜,故⑤能发生图示转化,⑤符合题意;符合题意的是④Fe ⑤Cu;
答案选A。
8.A
【详解】A. MgCl2与NaOH溶液发生复分解反应产生Mg(OH)2沉淀,将Mg(OH)2加热,发生分解反应,产生MgO,每步转化都能通过一步反应就能实现,A符合题意;
B. Cl2与Fe在加热时反应产生FeCl3,FeCl3在溶液中与还原剂Zn等反应,先被还原产生Fe2+,然后Fe2+再与Zn反应产生Fe单质,所以不是每步转化都能通过一步反应就能实现,B不符合题意;
C.S与O2点燃反应产生SO2, SO2与O2在一定条件下反应产生SO3,所以不是每步转化都能通过一步反应就能实现,C不符合题意;
D. Si与O2反应产生SiO2,SiO2不溶于水,不能一步反应产生H2SiO3,SiO2与NaOH溶液反应产生Na2SiO3,Na2SiO3与盐酸反应产生硅酸,可见不是每步转化都能通过一步反应就能实现,D不符合题意;
故合理选项是A。
9.D
【详解】A.镁可以空气中的氧气、二氧化碳发生反应,产物氮化镁可以与水发生反应,故应先除去空气中的二氧化碳、氧气再干燥气体,装置①中盛放NaOH溶液,装置③中装有浓硫酸,故A正确;
B.维生素C具有还原性,则先除去氧气,故B正确;
C.实验前先通空气,排尽装置中的氧气、二氧化碳等气体,再点燃酒精灯,使镁与氮气反应,故C正确;
D.装置⑤的作用是防止外界的水蒸气进入装置④中与产物反应,影响产物的纯度,不能用NaCl替换,故D错误;
故选:D。
10.B
【分析】用稀硫酸溶解硅酸跟离子转化为硅酸沉淀,过滤得到滤渣的主要成分是硅酸,滤液中加入双氧水氧化亚铁离子转化为铁离子,利用有机溶剂萃取铁离子,得到水层中含有镁离子,最后转化为碳酸镁,据此解答。
【详解】A.根据以上分析可知“酸溶”后过滤除去含硅杂质即硅酸,“氧化”后萃取除去含铁杂质,即铁离子,A正确;
B.“过滤”时用到的玻璃仪器有三种,即烧杯、漏斗和玻璃棒,B错误;
C.萃取时需要先检验分液漏斗是否漏水,C正确;
D.向萃取后的水层中滴加过量溶液生成碳酸镁,过滤后洗涤,经低温干燥得产品,D正确;
答案选B。
11.错误
【详解】泡沫灭火器使用时生成二氧化碳,镁能与二氧化碳反应,因此镁着火时不能用泡沫灭火器灭火,故错误。
12.错误
【详解】氯化镁是离子化合物,电子式为,故错误。
13.错误
【详解】Al2O3属于两性氧化物,能与氢氧化钠溶液反应,MgO属于碱性氧化物,与NaOH溶液不反应,故错误。
答案为:错误。
14. 乙同学 fabdc 无气泡冒出 排出装置中的CO2和水蒸气 偏大 9n/22m
【分析】氢氧化镁加热分解为氧化镁和水、碳酸镁加热分解为氧化镁和二氧化碳,加热得到的气体通过浓硫酸,若浓硫酸质量增大,说明有水生成,则固体中含有氢氧化镁;剩余气体再通过碱石灰,若碱石灰质量增大,则说明气体中含有二氧化碳,原固体沉淀中含有碳酸镁。
【详解】(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,放出的气体是二氧化碳,沉淀中一定含有碳酸根,则乙同学假设错误;
(2)利用C装置中的碱石灰吸收空气中的二氧化碳,用除去二氧化碳的空气把装置内的水蒸气、二氧化碳全部排出;加热A装置,用B中的浓硫酸吸收反应生成的水蒸气,用D装置吸收反应生成的二氧化碳,实验中合理的连接顺序为:e→f→a→b→d→c→ g→h或e→f→b→a→d→c→ g→h;
(3)实验一段时间后,当B装置中无气泡冒出时,说明固体已分解完全,停止加热;根据以上分析可知打开f处的活塞,缓缓通入空气数分钟,用空气把装置内的CO2和水蒸气完全排出;
(4)若无D装置,空气中的水蒸气和CO2也被D中碱石灰吸收,导致生成的CO2质量增加,因此会使测出的x :y的值偏大;
(5)若改进实验后,最终装置B质量增加mg,即产生水是,装置D质量增加了ng,CO2的物质的量是,则根据原子守恒可知x :y=。
15. FeCO3+2H+Fe 2++CO2↑+H2O SiO2 abcd Mn2++2OH-+ClO-MnO2↓+Cl-+H2O(或Mn2++H2O+ClO-MnO2↓+Cl-+2H+ Fe(OH)3 Al(OH)3 Mg2+[∶C C∶]2- 4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O
【详解】(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为FeCO3+2H+=Fe 2++CO2↑+H2O;盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]中只有二氧化硅不溶于硫酸,同时碳酸钙与硫酸反应会生成硫酸钙沉淀,因此滤渣1的主要成分为CaSO4和SiO2; a. 多次用废硫酸浸取,可以使盐泥中的物质充分溶解;b. 减小盐泥粒度并充分搅拌,c. 延长浸取时间,d.适当的提高酸浸的温度,都可以提高浸取率,故选abcd,故答案为FeCO3+2H+=Fe 2++CO2↑+H2O;SiO2;abcd;
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为Mn2++2OH-+ClO- =MnO2↓+Cl-+H2O,调节pH=5~6,可以沉淀铁离子、铝离子,形成氢氧化铁和氢氧化铝沉淀,故滤渣2为MnO2和Fe(OH)3、Al(OH)3,故答案为Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O;Fe(OH)3、Al(OH)3;
(3) MgC2发生水解反应生成乙炔,则MgC2与碳化钙的结构相似,电子式为Mg2+,故答案为Mg2+;
(4)碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]受热分解生成氧化镁和二氧化碳,以及水,氧化镁熔点较高,可以覆盖在可燃物表面,起到隔绝氧气的作用,同时二氧化碳和水也可以帮助灭火,反应的方程式为4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O,故答案为4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O。
16. 干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 镁屑 BD 检漏 92%
【详解】(1)仪器A为干燥管,本实验要用镁屑和液溴反应生成溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气,防止镁屑与氧气反应生成的氧化镁阻碍Mg和Br2的反应,故答案为干燥管;防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应;
(2)将装置B改为C装置,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热存在安全隐患,装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,反应容易控制,可防止反应过快,故答案为会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患;
(3)步骤3过滤出去的是不溶于水的镁屑,故答案为镁屑;
(4)A.95%的乙醇中含有水,溴化镁有强烈的吸水性,选项A错误;
B.加入苯的目的是除去乙醚和溴,洗涤晶体用0°C的苯,可以减少产品的溶解,选项B正确;
C.加热至160°C的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,选项C错误;
D.该步骤是为了除去乙醚和溴,选项D正确;
答案选BD;
(5)①滴定管洗涤前的操作是检漏;
②依据方程式Mg2++Y4-═MgY2-分析,溴化镁的物质的量=0.0500mol/L×0.0250L=0.00125mol,则溴化镁的质量为0.00125mol×184g/mol=0.23g,溴化镁的产品的纯度=×100%=92%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
含镁化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3。跟盐酸和NaOH溶液都能反应的物质有
A.二种 B.三种 C.四种 D.五种
2.化学与生活密切相关,下列说法错误的是
A.氧化镁可制做耐火材料
B.药皂中含苯酚具有杀菌、消毒作用
C.甲醛的水溶液可用于蔬菜防腐
D.醋酸用来除水垢
3.以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.以上流程中得到浸出液的操作是过滤
B.为了加快反应速率,浸出和沉镁的操作均可在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.浸出镁的反应为
4.向含MgCl2、AlCl3均为n mol的混合液中逐滴加入NaOH溶液至过量,有关离子沉淀或沉淀溶解与pH关系如下表:
离子 Mg2+ Al3+ 物质 Al(OH)3[来
开始沉淀时的pH 8.93 3.56 开始溶解时的pH 8.04
完全沉淀时的pH 10.92 4.89 完全溶解时的pH 12.04
列表示生成沉淀与加入NaOH的物质的量关系的图像中,关系正确的是
A.A B.B C.C D.D
5.向x的溶液中,加入Y试剂,产生的沉淀示意图如图所示的是(注意线段的斜率)
A.向NaOH和Ca(OH)2的混合液中通入CO2
B.向HCl和A1C13的混合液中滴加NaOH溶液
C.向NH4A1(SO4)2溶液中滴加NaOH溶液
D.向NH4C1和MgCl2的混合液中滴加NaOH溶液
6.下列有关物质的性质与用途具有对应关系的是
A.Mg(OH)2具有碱性,可用于制胃酸中和剂 B.H2O2是无色液体,可用作消毒剂
C.FeCl3具有氧化性,可用作净水剂 D.Mg与CO2反应生成MgO和CO
7.如图所示的5种物质中均含同种金属元素,且在一定条件下(不含通电)能发生图示转化的金属元素有几个
①Mg ②Al ③Ca ④Fe ⑤Cu
A.2 B.3 C.4 D.5
8.以下物质间的每步转化都能通过一步反应就能实现的是( )
A.MgCl2→Mg(OH)2→MgO B.Cl2→FeCl3→Fe
C.S→SO3→H2SO4 D.Si→SiO2→H2SiO3
9.某兴趣小组在实验室通过镁粉和空气中的氮气制备氮化镁(可与水发生反应),其装置如下图所示。已知:维生素C具有较强的还原性。下列说法错误的是
A.装置①③中盛放的分别是NaOH溶液和浓硫酸 B.装置②的作用为吸收空气中的O2
C.实验开始时应先通空气再点燃酒精灯 D.装置⑤中碱石灰可以替换为NaCl
10.某实验小组欲从含和的混合液中分离出,并制备。实验流程如下:
下列说法错误的是
A.“酸溶”后过滤除去含硅杂质,“氧化”后萃取除去含铁杂质
B.“过滤”时用到的玻璃仪器有两种
C.萃取过程需要先检验分液漏斗是否漏水
D.向萃取后的水层中滴加过量溶液,过滤后洗涤,经低温干燥得产品
二、判断题
11.镁着火时可用泡沫灭火器灭火。( )
12.氯化镁的电子式。(___________)
13.Al2O3和MgO均可与NaOH溶液反应。(_____)
三、解答题
14.某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
甲同学:可能只是MgCO3;
乙同学:可能只是Mg(OH)2;
丙同学:可能是xMgCO3·yMg(OH)2
Ⅱ、定性实验探究:
(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则 同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:
(2)实验中合理的连接顺序为:e→ → → → → → g→h(各装置只使用一次)。
(3)实验一段时间后,当B装置中 (填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是 ,
(4)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值 (选填“偏大”、“偏小”或“无影响”)。
(5)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y= 。(用含m、n的代数式表示)
15.利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为 ;滤渣1的主要成分为CaSO4和 (填化学式);为了提高浸取率可采取的措施有 (填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为 ;滤渣2为MnO2和 、 (填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理: 。
16.无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5 MgBr2 3C2H5OC2H5
请回答:
(1)仪器A的名称是 .实验中不能用干燥空气代替干燥N2,原因是
(2)如将装置B改为装置C(图2),可能会导致的后果是
(3)步骤3中,第一次过滤除去的物质是 .
(4)有关步骤4的说法,正确的是 .
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是 .
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol L﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是 (以质量分数表示).
参考答案:
1.D
【详解】碳酸氢镁能和氢氧化钠反应生成氢氧化镁和碳酸钠,氢氧化铝和氢氧化钠反应生成偏铝酸钠,铝和氢氧化钠反应生成偏铝酸钠和氢气,碳酸铵和氢氧化钠反应生成一水合氨和碳酸钠,氧化铝和氢氧化钠反应生成偏铝酸钠和水,五种物质都和盐酸反应,故选D。
2.C
【分析】A. 氧化镁可制做耐火材料;B. 低浓度的苯酚可以起到杀菌、消毒作用;C. 甲醛对人体有害,不能用于蔬菜防腐;D.水垢可以和醋酸反应;
【详解】A. 氧化镁熔点高,具有极高的稳定性,可制做耐火材料,故A项正确; B. 低浓度的苯酚是一种杀菌剂,在药皂中加入苯酚可以起到杀菌、消毒作用,故B项正确;C.甲醛对人体有害,不能用于蔬菜防腐,故C项错误;D.水垢的主要成分是碳酸钙和氢氧化镁,两者均能溶于酸,故醋酸可以用来除水垢,D项正确。综上,本题选C。
3.B
【分析】菱镁矿煅烧后得到轻烧粉,其中MgCO3转化为MgO,加入氯化铵溶液浸取,浸出的废渣有SiO2、Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有Mg2+,加入氨水得到Mg(OH)2沉淀,煅烧得到高纯镁砂。
【详解】A.加入氯化铵溶液浸取,浸出的废渣有SiO2、Fe(OH)3、Al(OH)3,同时产生氨气,则此时浸出液中主要含有Mg2+,通过过滤将其分离,故A不选;
B.一水合氨受热易分解,沉镁时在较高温度下进行会造成一水合氨大量分解,挥发出氨气,降低利用率,故B选;
C.浸出过程产生的氨气可以回收制备氨水,沉镁时氯化镁与氨水反应生成的氯化铵又可以利用到浸出过程中,故C不选;
D.高温煅烧后Mg元素主要以MgO的形式存在,MgO可以与铵根水解产生的氢离子反应,促进铵根的水解,所以得到氯化镁、氨气和水,化学方程式为,故D不选;
故选:B。
4.C
【详解】当Al3+完全沉淀时,溶液的pH=8.04,而镁离子开始沉淀的pH=8.93,则Al3+完全沉淀时Mg2+还没有开始沉淀;即:当Mg2+开始沉淀时,已经有部分氢氧化铝开始溶解;镁离子完全沉淀的pH=10.92,氢氧化铝完全溶解的pH=12.04,则当Mg2+完全沉淀时,氢氧化铝还没有完全被溶解,所以正确的图像应该是C,C正确;
故选C。
5.A
【详解】A.向NaOH和Ca(OH)2的混合液中通入CO2,先发生Ca(OH)2+CO2=CaCO3↓+H2O,生成沉淀,再发生CO2+NaOH=NaHCO3,沉淀的量不变,最后发生反应:CaCO3↓+H2O+CO2=Ca(HCO3)2,沉淀溶解,根据方程式中物质消耗关系可知:生成沉淀和沉淀溶解消耗的CO2相等,图象与反应符合,A正确;
B.向HCl和AlCl3的混合溶液中滴加NaOH,先发生HCl+NaOH=NaCl+H2O,然后发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O;开始无沉淀生成,图象与发生的化学反应不符,B错误;
C.向NH4Al(SO4)2溶液中加入NaOH溶液,首先发生反应:Al3++3OH-=Al(OH)3↓,然后发生反应:NH4++OH-=NH3·H2O,最后发生反应:Al(OH)3+OH-=AlO2-+2H2O,形成沉淀与沉淀溶解消耗NaOH的物质的量的比是3:1,发生的反应与图象不符合,C错误;
D.向NH4Cl和MgCl2的混合液中滴加NaOH,先发生Mg2++2OH-=Mg(OH)2↓,然后发生NH4++OH-=NH3·H2O,由于Mg(OH)2是难溶性的弱碱,NaOH过量时沉淀白色不会溶解,图象与发生的化学反应不符,D错误;
故合理选项是A。
6.A
【详解】A.Mg(OH)2具有弱碱性,难溶于水,能与HCl反应生成氯化镁和水,并且无毒,所以Mg(OH)2可用于制胃酸中和剂,故A正确;
B.H2O2具有氧化性,可用作消毒剂,与H2O2是无色液体无关,故B错误;
C.FeCl3易水解生成氢氧化铁胶体、吸附作用强,能吸附水中的悬浮物形成沉淀,达到净水目的,与FeCl3具有氧化性无关,故C错误;
D.Mg在CO2中燃烧生成MgO和C,故D错误;
故选A。
7.A
【分析】根据图知,金属单质能转化为硝酸盐,硝酸盐能生成氢氧化物,说明生成的氢氧化物是难溶性物质,氢氧化物不稳定受热易分解生成氧化物,氧化物能溶于稀盐酸生成盐酸盐,盐酸盐能发生置换反应生成金属单质,据此分析。
【详解】①Mg和稀硝酸或可溶性硝酸盐反应生成硝酸镁,将硝酸镁与氢氧化钠反应生成氢氧化镁,将氢氧化镁加热分解可以得到氧化镁,将氧化镁加入盐酸反应制得氯化镁,氯化镁不能通过置换反应制得镁,故①不能发生图示转化,①不符合题意;
②铝与硝酸盐或稀硝酸反应生成硝酸铝,硝酸铝与氢氧化钠反应生成氢氧化铝,将氢氧化铝加热分解可以得到氧化铝,氧化铝和盐酸反应可以生成氯化铝,氯化铝不能通过置换反应得到金属铝,故②不能发生图示转化,②不符合题意;
③钙与稀硝酸反应生成硝酸钙,硝酸钙与碱不反应,不能生成氢氧化钙,故③不能发生图示转化,③不符合题意;
④Fe与硝酸盐或稀硝酸反应生成硝酸铁,硝酸铁与氢氧化钠反应生成氢氧化铁,将氢氧化铁加热分解可以得到氧化铁,氧化铝和盐酸反应可以生成氯化铁,氯化铁能通过置换反应得到金属铁,故④能发生图示转化,④符合题意;
⑤Cu与硝酸盐或稀硝酸反应生成硝酸铜,硝酸铜与氢氧化钠反应生成氢氧化铜,将氢氧化铜加热分解可以得到氧化铜,氧化铜和盐酸反应可以生成氯化铜,氯化铜能通过置换反应得到金属铜,故⑤能发生图示转化,⑤符合题意;符合题意的是④Fe ⑤Cu;
答案选A。
8.A
【详解】A. MgCl2与NaOH溶液发生复分解反应产生Mg(OH)2沉淀,将Mg(OH)2加热,发生分解反应,产生MgO,每步转化都能通过一步反应就能实现,A符合题意;
B. Cl2与Fe在加热时反应产生FeCl3,FeCl3在溶液中与还原剂Zn等反应,先被还原产生Fe2+,然后Fe2+再与Zn反应产生Fe单质,所以不是每步转化都能通过一步反应就能实现,B不符合题意;
C.S与O2点燃反应产生SO2, SO2与O2在一定条件下反应产生SO3,所以不是每步转化都能通过一步反应就能实现,C不符合题意;
D. Si与O2反应产生SiO2,SiO2不溶于水,不能一步反应产生H2SiO3,SiO2与NaOH溶液反应产生Na2SiO3,Na2SiO3与盐酸反应产生硅酸,可见不是每步转化都能通过一步反应就能实现,D不符合题意;
故合理选项是A。
9.D
【详解】A.镁可以空气中的氧气、二氧化碳发生反应,产物氮化镁可以与水发生反应,故应先除去空气中的二氧化碳、氧气再干燥气体,装置①中盛放NaOH溶液,装置③中装有浓硫酸,故A正确;
B.维生素C具有还原性,则先除去氧气,故B正确;
C.实验前先通空气,排尽装置中的氧气、二氧化碳等气体,再点燃酒精灯,使镁与氮气反应,故C正确;
D.装置⑤的作用是防止外界的水蒸气进入装置④中与产物反应,影响产物的纯度,不能用NaCl替换,故D错误;
故选:D。
10.B
【分析】用稀硫酸溶解硅酸跟离子转化为硅酸沉淀,过滤得到滤渣的主要成分是硅酸,滤液中加入双氧水氧化亚铁离子转化为铁离子,利用有机溶剂萃取铁离子,得到水层中含有镁离子,最后转化为碳酸镁,据此解答。
【详解】A.根据以上分析可知“酸溶”后过滤除去含硅杂质即硅酸,“氧化”后萃取除去含铁杂质,即铁离子,A正确;
B.“过滤”时用到的玻璃仪器有三种,即烧杯、漏斗和玻璃棒,B错误;
C.萃取时需要先检验分液漏斗是否漏水,C正确;
D.向萃取后的水层中滴加过量溶液生成碳酸镁,过滤后洗涤,经低温干燥得产品,D正确;
答案选B。
11.错误
【详解】泡沫灭火器使用时生成二氧化碳,镁能与二氧化碳反应,因此镁着火时不能用泡沫灭火器灭火,故错误。
12.错误
【详解】氯化镁是离子化合物,电子式为,故错误。
13.错误
【详解】Al2O3属于两性氧化物,能与氢氧化钠溶液反应,MgO属于碱性氧化物,与NaOH溶液不反应,故错误。
答案为:错误。
14. 乙同学 fabdc 无气泡冒出 排出装置中的CO2和水蒸气 偏大 9n/22m
【分析】氢氧化镁加热分解为氧化镁和水、碳酸镁加热分解为氧化镁和二氧化碳,加热得到的气体通过浓硫酸,若浓硫酸质量增大,说明有水生成,则固体中含有氢氧化镁;剩余气体再通过碱石灰,若碱石灰质量增大,则说明气体中含有二氧化碳,原固体沉淀中含有碳酸镁。
【详解】(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,放出的气体是二氧化碳,沉淀中一定含有碳酸根,则乙同学假设错误;
(2)利用C装置中的碱石灰吸收空气中的二氧化碳,用除去二氧化碳的空气把装置内的水蒸气、二氧化碳全部排出;加热A装置,用B中的浓硫酸吸收反应生成的水蒸气,用D装置吸收反应生成的二氧化碳,实验中合理的连接顺序为:e→f→a→b→d→c→ g→h或e→f→b→a→d→c→ g→h;
(3)实验一段时间后,当B装置中无气泡冒出时,说明固体已分解完全,停止加热;根据以上分析可知打开f处的活塞,缓缓通入空气数分钟,用空气把装置内的CO2和水蒸气完全排出;
(4)若无D装置,空气中的水蒸气和CO2也被D中碱石灰吸收,导致生成的CO2质量增加,因此会使测出的x :y的值偏大;
(5)若改进实验后,最终装置B质量增加mg,即产生水是,装置D质量增加了ng,CO2的物质的量是,则根据原子守恒可知x :y=。
15. FeCO3+2H+Fe 2++CO2↑+H2O SiO2 abcd Mn2++2OH-+ClO-MnO2↓+Cl-+H2O(或Mn2++H2O+ClO-MnO2↓+Cl-+2H+ Fe(OH)3 Al(OH)3 Mg2+[∶C C∶]2- 4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O
【详解】(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为FeCO3+2H+=Fe 2++CO2↑+H2O;盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]中只有二氧化硅不溶于硫酸,同时碳酸钙与硫酸反应会生成硫酸钙沉淀,因此滤渣1的主要成分为CaSO4和SiO2; a. 多次用废硫酸浸取,可以使盐泥中的物质充分溶解;b. 减小盐泥粒度并充分搅拌,c. 延长浸取时间,d.适当的提高酸浸的温度,都可以提高浸取率,故选abcd,故答案为FeCO3+2H+=Fe 2++CO2↑+H2O;SiO2;abcd;
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为Mn2++2OH-+ClO- =MnO2↓+Cl-+H2O,调节pH=5~6,可以沉淀铁离子、铝离子,形成氢氧化铁和氢氧化铝沉淀,故滤渣2为MnO2和Fe(OH)3、Al(OH)3,故答案为Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O;Fe(OH)3、Al(OH)3;
(3) MgC2发生水解反应生成乙炔,则MgC2与碳化钙的结构相似,电子式为Mg2+,故答案为Mg2+;
(4)碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]受热分解生成氧化镁和二氧化碳,以及水,氧化镁熔点较高,可以覆盖在可燃物表面,起到隔绝氧气的作用,同时二氧化碳和水也可以帮助灭火,反应的方程式为4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O,故答案为4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O。
16. 干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 镁屑 BD 检漏 92%
【详解】(1)仪器A为干燥管,本实验要用镁屑和液溴反应生成溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气,防止镁屑与氧气反应生成的氧化镁阻碍Mg和Br2的反应,故答案为干燥管;防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应;
(2)将装置B改为C装置,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热存在安全隐患,装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,反应容易控制,可防止反应过快,故答案为会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患;
(3)步骤3过滤出去的是不溶于水的镁屑,故答案为镁屑;
(4)A.95%的乙醇中含有水,溴化镁有强烈的吸水性,选项A错误;
B.加入苯的目的是除去乙醚和溴,洗涤晶体用0°C的苯,可以减少产品的溶解,选项B正确;
C.加热至160°C的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,选项C错误;
D.该步骤是为了除去乙醚和溴,选项D正确;
答案选BD;
(5)①滴定管洗涤前的操作是检漏;
②依据方程式Mg2++Y4-═MgY2-分析,溴化镁的物质的量=0.0500mol/L×0.0250L=0.00125mol,则溴化镁的质量为0.00125mol×184g/mol=0.23g,溴化镁的产品的纯度=×100%=92%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
