磷元素及其化合物试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 磷元素及其化合物试题 高考化学考前专项复习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 771.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 11:26:57 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
磷元素及其化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.大多数离子液体含有体积很大的阴、阳离子(如图所示)。其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。下列说法正确的是
A.Z的氯化物的分子式一定为ZCl3 B.气态氢化物的熔沸点:Z>Y>X
C.电负性:Y>X>Z D.此阴离子中Y、Z均满足8电子稳定结构
2.用如图装置进行实验。下列现象能证明空气中O2的含量的是:
A.红磷燃烧,产生白烟 B.瓶中液面先下降,后上升
C.瓶中液面最终上升至1处 D.水槽中液面下降
3.H3PO3易溶于水,它的结构式可表示为:,在盛有H3PO3溶液的试管中加入AgNO3溶液,则析出黑色金属银沉淀,并在试管口有红棕色气体生成。下列说法错误的是
A.H3PO3是具有还原性的二元强酸
B.它与NaOH反应只生成Na2HPO3和NaH2PO3两种盐
C.用化学方程式表示H3PO3和AgNO3溶液的反应:2H3PO3+AgNO3=Ag↓+NO↑+2H3PO4
D.表示 Na2HPO3水溶液呈碱性的离子方程式:
4.某班同学就施用化肥的“利与弊”为题进行辩论,正方观点是施用化肥有利,正方的下列观点中不科学的是
A.施用化肥可使农作物增产
B.化肥的肥效快
C.施用化肥不会造成环境污染
D.复合肥能给农作物提供几种营养元素
5.下列反应的化学或离子方程式错误的是
A.制的离子方程式:
B.白磷与溶液反应:
C.与足量的溶液反应的离子方程式:
D.雌黄制备雄黄的方程式:
6.下列试剂在实验室中的保存方法合理的是
A.磷的同素异形体均用冷水贮存 B.将浓硝酸与氢碘酸存放在同一药品橱内
C.用带胶塞的试剂瓶保存苯酚 D.保存溶液时加入适量稀硫酸
7.为正盐,其中P为价O为价,能将溶液中的还原为,可用于化学镀银。反应的离子方程式为。下列说法正确的是
A.上述反应中,氧化产物是
B.该反应氧化剂与还原剂的物质的量之比为1∶4
C.溶于水破坏离子键、极性共价键和非极性共价键
D.是三元酸,与反应可生成三种盐
8.磷纳米材料在光电领域应用广泛。一种利用液态铋催化白磷制备针状黑磷纳米棒的工艺如图所示,下列说法错误的是
A.该工艺涉及磷的三种同素异形体 B.变化I、Ⅱ、Ⅲ均属于化学变化
C.黑磷可与氧气反应生成五氧化二磷 D.该工艺须在隔绝空气的条件下进行
9.是一种易自燃的气体,能被溶液吸收生成。实验室利用白磷与过量的NaOH溶液制备(反应过程中同时有生成)。下列说法不正确的是
A.熔沸点:
B.制取时,
C.装置中加入白磷前应先通入氮气
D.溶液吸收表现了的氧化性
10.在下列变化中,体系的熵减小的是
A.硝酸铵溶于水 B.乙烯聚合为聚乙烯
C.冰融化成水 D.红磷转化成白磷
二、解答题
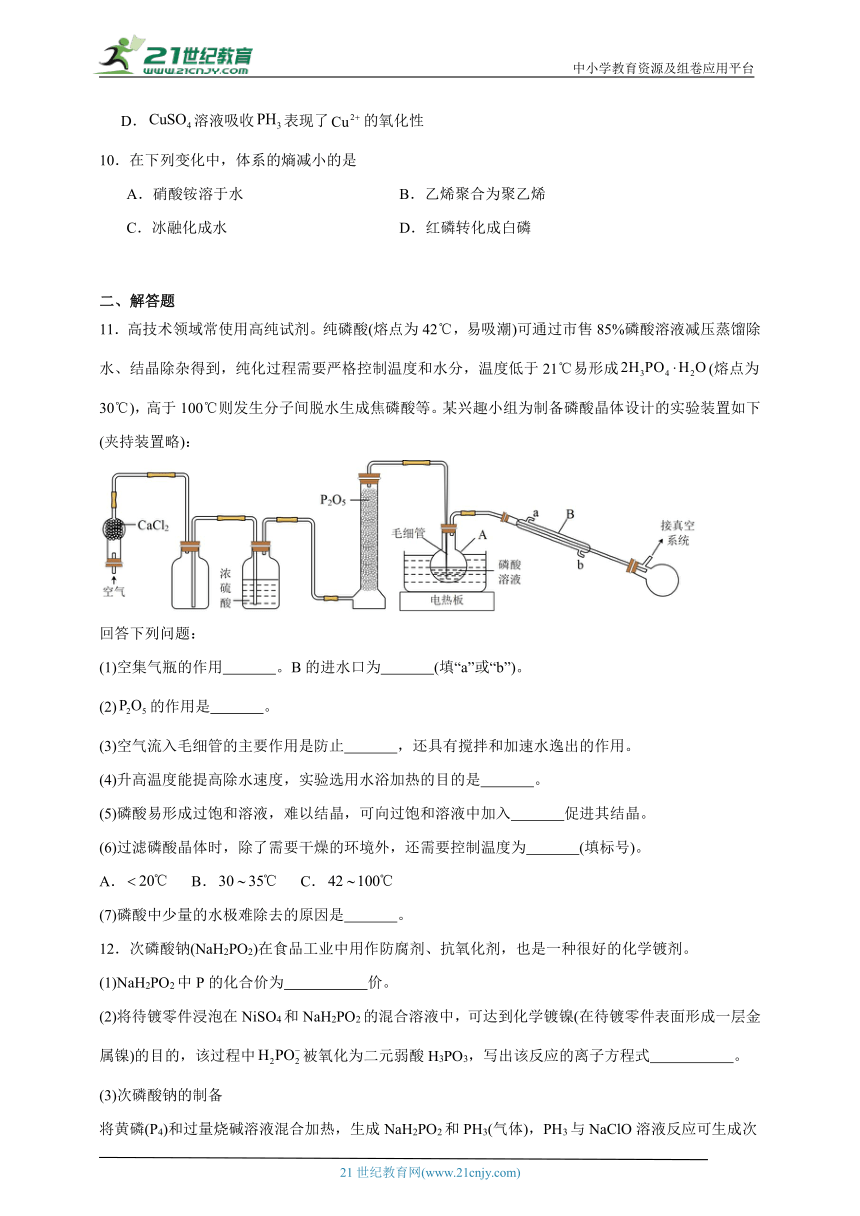
11.高技术领域常使用高纯试剂。纯磷酸(熔点为42℃,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21℃易形成(熔点为30℃),高于100℃则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)空集气瓶的作用 。B的进水口为 (填“a”或“b”)。
(2)的作用是 。
(3)空气流入毛细管的主要作用是防止 ,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是 。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入 促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为 (填标号)。
A. B. C.
(7)磷酸中少量的水极难除去的原因是 。
12.次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为 价。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中被氧化为二元弱酸H3PO3,写出该反应的离子方程式 。
(3)次磷酸钠的制备
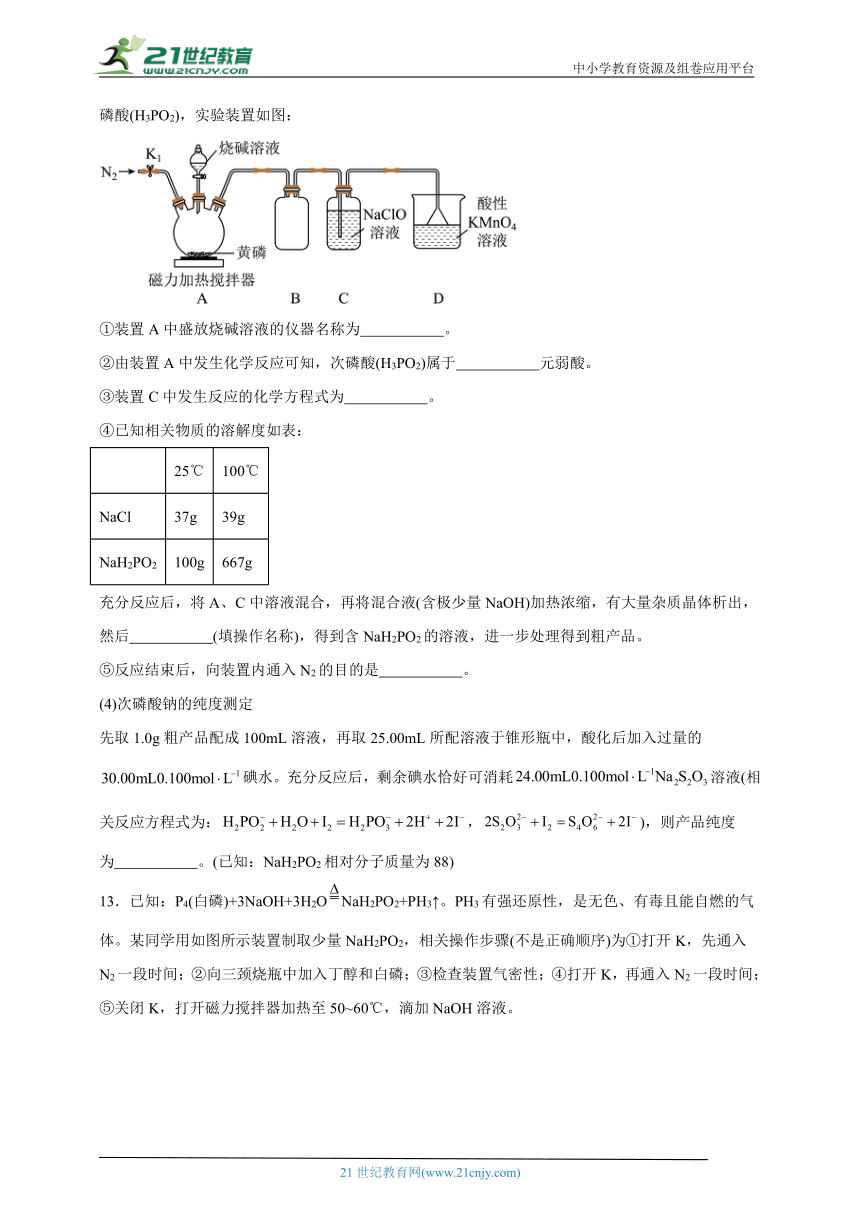
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:
①装置A中盛放烧碱溶液的仪器名称为 。
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于 元弱酸。
③装置C中发生反应的化学方程式为 。
④已知相关物质的溶解度如表:
25℃ 100℃
NaCl 37g 39g
NaH2PO2 100g 667g
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后 (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
⑤反应结束后,向装置内通入N2的目的是 。
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的碘水。充分反应后,剩余碘水恰好可消耗溶液(相关反应方程式为:,),则产品纯度为 。(已知:NaH2PO2相对分子质量为88)
13.已知:P4(白磷)+3NaOH+3H2ONaH2PO2+PH3↑。PH3有强还原性,是无色、有毒且能自燃的气体。某同学用如图所示装置制取少量NaH2PO2,相关操作步骤(不是正确顺序)为①打开K,先通入N2一段时间;②向三颈烧瓶中加入丁醇和白磷;③检查装置气密性;④打开K,再通入N2一段时间;⑤关闭K,打开磁力搅拌器加热至50~60℃,滴加NaOH溶液。
请回答下列问题:
(1)装置B的作用是 。
(2)写出该装置中的一处明显错误: 。
(3)该实验操作步骤的正确顺序是 (填标号)。
(4)先通入N2一段时间的目的是 。
(5)向三颈烧瓶中加入丁醇和白磷,其中加入丁醇的主要目的是 。
(6)PH3在装置C中可被氧化成磷酸,该反应的化学方程式为 ,装置D的作用为 。
(7)取产品mg溶于稀硫酸配成250mL溶液,取25.00mL于锥形瓶中,然后用0.02mol/LKMnO4标准溶液滴定,滴定终点的现象是 ;达到滴定终点时消耗VmLKMnO4标准溶液,则产品的纯度为 %(用含m、V的代数式表示)。
参考答案:
1.C
【分析】X、Z同主族,从图中可以看出,X能形成3个共价键,其原子的最外层有5个电子,Z原子形成的6个共价键中,有一个是配位键,则Z原子的最外层也有5个电子,从而得出X为N元素、Z为P元素,则Y为F元素。从而得出X、Y、Z为N、F、P元素。
【详解】A.Z为P元素,其氯化物的分子式为PCl3或PCl5,A不正确;
B.X、Y、Z为N、F、P元素,HF、NH3分子间都能形成氢键,非金属性F>N>P,则HF形成的氢键键能大于NH3,所以气态氢化物的熔沸点:HF>NH3>PH3,B不正确;
C.X、Y、Z为N、F、P元素,非金属性F>N>P,则电负性:F>N>P,C正确;
D.此阴离子中F原子满足8电子稳定结构,但P原子形成6对共用电子,原子的最外层电子数为12,D不正确;
故选C。
2.C
【详解】A.红磷燃烧,产生白烟,不能证明空气中O2含量,故选项错误。
B.瓶中液面先下降,是因为红磷燃烧放出大量的热;后上升,是红磷与空气中的氧气发生了化学反应,不能证明空气中O2含量,故选项错误。
C.瓶中液面最终上升至1处,说明氧气约占空气体积的,能证明空气中O2含量,故选项正确。
D.水槽中液面下降,是因为红磷燃烧放出大量的热,使装置内气体体积膨胀。故选项错误。
故选C。
3.A
【详解】A.由H3PO3的结构式可以看出,其分子中含有2个-OH,且中心原子达到8电子稳定结构,则其为二元酸,磷对应的含氧酸都为弱酸,能将AgNO3还原,则其具有还原性,所以H3PO3是具有还原性的二元弱酸,A错误;
B.H3PO3分子中含有2个-OH,为二元弱酸,则它与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,B正确;
C.H3PO3和AgNO3溶液反应,生成黑色金属银沉淀,在试管口有红棕色气体(NO2)生成,则瓶内生成NO,H3PO3表现出还原性,被氧化为H3PO4,化学方程式为:2H3PO3+AgNO3=Ag↓+NO↑+2H3PO4,C正确;
D.Na2HPO3为强碱弱酸盐,在水溶液中发生水解使溶液呈碱性,离子方程式:,D正确;
故选A。
4.C
【详解】A.施用化肥的目的就是使农作物增产,A正确;
B.化肥含营养素少,但量多见效快,农家肥含营养素种类多,但量少,见效慢,B正确;
C.由于化肥中含有氮、磷等元素容易使水体富营养化,会造成赤潮或水华现象,所以应该合理的使用化肥,C错误;
D.化学式中含有营养元素N、P、K中的任何两种或三种的叫复合肥,所以复合肥能给农作物提供几种营养元素,D正确;
故选C。
5.C
【详解】A.溶于水生成、NO,离子方程式为:,故A正确;
B.白磷与溶液反应生成、,离子方程式为,故B正确;
C.为一元酸,与足量的溶液反应的离子方程式:,故C错误;
D.雌黄(As2S3)和SnCl2、HCl制备雄黄(As4S4)的方程式为:,故D正确;
故选C。
6.D
【详解】A.红磷无需保存在冷水中,A项错误;
B.浓硝酸和氢碘酸均会挥发,且二者能发生氧化还原反应,B项错误;
C.苯酚为有机物,会腐蚀橡胶,C项错误;
D.保存溶液时加入适量稀硫酸可以抑制铝离子水解,D项正确;
故答案为:D。
7.A
【详解】A.该反应中中P失电子被氧化生成H3PO4,氧化产物为H3PO4,A正确;
B.该反应中还原剂为,氧化剂为Ag+,氧化剂和还原剂的物质的量之比为4:1,B错误;
C.NaH2PO2溶于水生成Na+和,破坏离子键,C错误;
D.H3PO2为一元酸,与NaOH反应生成一种盐,D错误;
故答案选A。
8.B
【分析】由题给流程可知,变化I为红磷固体隔绝空气加热得到液态白磷,变化Ⅱ为液态白磷受热转化为气态白磷,变化Ⅲ为液态铋做催化剂条件下气态白磷受热转化为黑磷纳米棒。
【详解】
A.红磷、白磷和黑磷都是磷元素形成的不同种单质,互为同素异形体,则该工艺涉及了磷元素的三种同素异形体,A正确;
B.液态白磷受热转化为气态白磷时,没有新物质生成,属于物理变化,不属于化学变化,B错误;
C.黑磷能在氧气燃烧生成五氧化二磷固体,C正确;
D.白磷在空气中易自燃,所以该工艺须在隔绝空气的条件下进行,D正确;
故选B。
9.B
【详解】A.可形成分子间氢键,因此熔沸点:,A项正确;
B.白磷与过量的NaOH溶液制备,同时有生成,P的化合价既有升高,又有降低,白磷中P元素从0价降低到中的-3价,白磷中P元素从O价升高到中的+1价,根据得失电子守恒可得,制取时,,B项错误;
C.易自燃,加入白磷前应先通入氮气,排尽装置中的空气,C项正确;
D.溶液吸收,生成,铜元素的化合价降低,表现了的氧化性,D项正确;
故选B。
10.B
【详解】A.硝酸铵溶于水,混乱度增大,导致熵增大,A错误;
B.乙烯聚合为聚乙烯,混乱度减小,熵减小,B正确;
C.冰融化成水,固体变为液体,混乱度增大,熵增大,C错误;
D.红磷转化为白磷,熵增大,D错误;
故答案选B。
11.(1) 安全瓶 b
(2)干燥气体
(3)防止暴沸
(4)使溶液受热均匀
(5)磷酸晶体
(6)B
(7)磷酸分子中含羟基,可与水分子间形成氢键
【分析】空气通过氯化钙除水,经过安全瓶后通过浓硫酸干燥除水,然后通过五氧化二磷,干燥的空气流入毛细管对烧瓶中的溶液进行搅拌,同时还具有加速水逸出和防止溶液沿毛细管上升的作用,将85%磷酸溶液进行减压蒸馏除水、结晶除杂得到纯磷酸。
【详解】(1)空集气瓶的作用是安全瓶;由仪器构造可知,仪器A为圆底烧瓶,仪器B为直形冷凝管,泠凝水应从b口进、a口出,形成逆流冷却,使冷却效果更好。
(2)纯磷酸制备过程中要严格控制温度和水分,因此五氧化二磷的作用为干燥气体。
(3)空气流入毛细管可以对烧瓶中的溶液防止暴沸,同时还具有加速水逸出和防止溶液沿毛细管上升的作用。
(4)升高温度能提高除水速度,而纯磷酸制备过程中要严格控制温度,水浴加热可以避免直接加热造成的温度过快升高与温度的不可控性,使溶液受热均匀。
(5)过饱和溶液暂时处于亚稳态,当加入一些固体的晶体或晃动时可使此状态失去平衡,过多的溶质就会结晶,因此可向磷酸的过饱和溶液中加入磷酸晶体促进其结晶。
(6)纯磷酸纯化过程中,温度低于易形成(熔点为),高于则发生分子间脱水生成焦磷酸,纯磷酸的熔点为42℃,因此过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为30 42℃,这个区间内答案选B。
(7)磷酸的结构式为:,分子中含羟基,可与水分子间形成氢键,因此磷酸中少量的水极难除去。
12.(1)+1
(2)
(3) 分液漏斗 一 趁热过滤 将生成的PH3全部排入C中充分吸收,增大次磷酸钠产率
(4)63.36%
【分析】目标产物的制备:
由实验装置图可知,实验前,应用氮气排除装置中的空气,防止黄磷被氧化,装置A中黄磷与氢氧化钠溶液反应生成次磷酸钠和磷化氢,装置B为空载仪器,做安全瓶,起防倒吸的作用,装置C中磷化氢与次氯酸钠溶液共热反应制备目标产物,装置D中盛有的酸性高锰酸钾溶液用于吸收磷化氢,防止污染空气。
【详解】(1)由化合价代数和为0可知,次磷酸钠中磷元素的化合价为+1价,故答案为:+1价;
(2)由题意可知,溶液中镍离子与次磷酸根离子反应生成亚磷酸、氢离子和镍,反应的离子方程式为Ni2++ H2PO+H2O =H3PO3+Ni+H+,故答案为:Ni2++ H2PO+H2O =H3PO3+Ni+H+;
(3)①由实验装置图可知,装置A中盛放烧碱溶液的仪器为分液漏斗;
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于一元弱酸;
③由实验装置图可知,装置C中发生的反应为磷化氢与次氯酸钠溶液共热反应制备次磷酸,反应的化学方程式为;
④由表格中的数据可知,次磷酸钠的溶解度随温度变化较大,则充分反应后,将A、B中溶液混合,将混合液采用蒸发浓缩,有大量晶体析出时,趁热过滤,滤液再冷却结晶,过滤、洗涤、干燥得到次磷酸钠,故答案为:趁热过滤;
⑤反应结束后,向装置内通入N2的目的是:将生成的PH3全部排入C中充分吸收,增大次磷酸钠产率。
(4)由题给方程式可得:次磷酸钠的物质的量为0.100mol/L×0.03L—0.100mol/L×0.024L×=0.0018mol,则1.00g粗产品的纯度为×100%=63.36%。
13.(1)防倒吸
(2)装置C中应长导管进,短导管出
(3)③②①⑤④
(4)排尽装置内的空气,防止PH3自燃引起爆炸
(5)作分散剂,使反应物充分混合,加快反应速率
(6) PH3+4NaClO=H3PO4+4NaCl 检验PH3是否被吸收干净
(7) 滴入最后半滴KMnO4标准溶液后,溶液由无色变为红色,且半分钟内不褪色
【详解】(1)装置B为安全瓶,作用是防倒吸;
(2)该装置中的一处明显错误是装置C中应长导管进,短导管出;
(3)由题意可知,该实验操作步骤的正确顺序是③检查装置气密性,实验中有气体生成,防止装置漏气;②向三颈烧瓶中加入丁醇和白磷;①打开K,先通入一段时间,排尽装置中的空气,防止自燃引起爆炸;⑤关闭K,打开磁力搅拌器加热至50~60℃,滴加NaOH溶液,NaOH和白磷反应制取少量;④打开K,再通入一段时间,排尽滞留在装置中的;
(4)PH3有强还原性,是无色、有毒且能自燃的气体,先通入N2一段时间的目的是排尽装置内的空气,防止PH3自燃引起爆炸;
(5)向三颈烧瓶中加入丁醇和白磷,其中加入丁醇的主要目的是作分散剂,使反应物充分混合,加快反应速率;
(6)PH3在装置C中可被氧化成磷酸,该反应的化学方程式为PH3+4NaClO=H3PO4+4NaCl,装置D的作用为检验PH3是否被吸收干净;
(7)溶液为紫红色,滴定终点的现象是滴入最后半滴标准溶液后,溶液变为红色,且半分钟内不褪色。和反应生成和,根据得失电子守恒可得关系式:,则mol,产品的纯度为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
磷元素及其化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.大多数离子液体含有体积很大的阴、阳离子(如图所示)。其中X、Y、Z为原子序数依次增大的短周期非金属元素,X、Z同主族。下列说法正确的是
A.Z的氯化物的分子式一定为ZCl3 B.气态氢化物的熔沸点:Z>Y>X
C.电负性:Y>X>Z D.此阴离子中Y、Z均满足8电子稳定结构
2.用如图装置进行实验。下列现象能证明空气中O2的含量的是:
A.红磷燃烧,产生白烟 B.瓶中液面先下降,后上升
C.瓶中液面最终上升至1处 D.水槽中液面下降
3.H3PO3易溶于水,它的结构式可表示为:,在盛有H3PO3溶液的试管中加入AgNO3溶液,则析出黑色金属银沉淀,并在试管口有红棕色气体生成。下列说法错误的是
A.H3PO3是具有还原性的二元强酸
B.它与NaOH反应只生成Na2HPO3和NaH2PO3两种盐
C.用化学方程式表示H3PO3和AgNO3溶液的反应:2H3PO3+AgNO3=Ag↓+NO↑+2H3PO4
D.表示 Na2HPO3水溶液呈碱性的离子方程式:
4.某班同学就施用化肥的“利与弊”为题进行辩论,正方观点是施用化肥有利,正方的下列观点中不科学的是
A.施用化肥可使农作物增产
B.化肥的肥效快
C.施用化肥不会造成环境污染
D.复合肥能给农作物提供几种营养元素
5.下列反应的化学或离子方程式错误的是
A.制的离子方程式:
B.白磷与溶液反应:
C.与足量的溶液反应的离子方程式:
D.雌黄制备雄黄的方程式:
6.下列试剂在实验室中的保存方法合理的是
A.磷的同素异形体均用冷水贮存 B.将浓硝酸与氢碘酸存放在同一药品橱内
C.用带胶塞的试剂瓶保存苯酚 D.保存溶液时加入适量稀硫酸
7.为正盐,其中P为价O为价,能将溶液中的还原为,可用于化学镀银。反应的离子方程式为。下列说法正确的是
A.上述反应中,氧化产物是
B.该反应氧化剂与还原剂的物质的量之比为1∶4
C.溶于水破坏离子键、极性共价键和非极性共价键
D.是三元酸,与反应可生成三种盐
8.磷纳米材料在光电领域应用广泛。一种利用液态铋催化白磷制备针状黑磷纳米棒的工艺如图所示,下列说法错误的是
A.该工艺涉及磷的三种同素异形体 B.变化I、Ⅱ、Ⅲ均属于化学变化
C.黑磷可与氧气反应生成五氧化二磷 D.该工艺须在隔绝空气的条件下进行
9.是一种易自燃的气体,能被溶液吸收生成。实验室利用白磷与过量的NaOH溶液制备(反应过程中同时有生成)。下列说法不正确的是
A.熔沸点:
B.制取时,
C.装置中加入白磷前应先通入氮气
D.溶液吸收表现了的氧化性
10.在下列变化中,体系的熵减小的是
A.硝酸铵溶于水 B.乙烯聚合为聚乙烯
C.冰融化成水 D.红磷转化成白磷
二、解答题
11.高技术领域常使用高纯试剂。纯磷酸(熔点为42℃,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21℃易形成(熔点为30℃),高于100℃则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)空集气瓶的作用 。B的进水口为 (填“a”或“b”)。
(2)的作用是 。
(3)空气流入毛细管的主要作用是防止 ,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是 。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入 促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为 (填标号)。
A. B. C.
(7)磷酸中少量的水极难除去的原因是 。
12.次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为 价。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金属镍)的目的,该过程中被氧化为二元弱酸H3PO3,写出该反应的离子方程式 。
(3)次磷酸钠的制备
将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:
①装置A中盛放烧碱溶液的仪器名称为 。
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于 元弱酸。
③装置C中发生反应的化学方程式为 。
④已知相关物质的溶解度如表:
25℃ 100℃
NaCl 37g 39g
NaH2PO2 100g 667g
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后 (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
⑤反应结束后,向装置内通入N2的目的是 。
(4)次磷酸钠的纯度测定
先取1.0g粗产品配成100mL溶液,再取25.00mL所配溶液于锥形瓶中,酸化后加入过量的碘水。充分反应后,剩余碘水恰好可消耗溶液(相关反应方程式为:,),则产品纯度为 。(已知:NaH2PO2相对分子质量为88)
13.已知:P4(白磷)+3NaOH+3H2ONaH2PO2+PH3↑。PH3有强还原性,是无色、有毒且能自燃的气体。某同学用如图所示装置制取少量NaH2PO2,相关操作步骤(不是正确顺序)为①打开K,先通入N2一段时间;②向三颈烧瓶中加入丁醇和白磷;③检查装置气密性;④打开K,再通入N2一段时间;⑤关闭K,打开磁力搅拌器加热至50~60℃,滴加NaOH溶液。
请回答下列问题:
(1)装置B的作用是 。
(2)写出该装置中的一处明显错误: 。
(3)该实验操作步骤的正确顺序是 (填标号)。
(4)先通入N2一段时间的目的是 。
(5)向三颈烧瓶中加入丁醇和白磷,其中加入丁醇的主要目的是 。
(6)PH3在装置C中可被氧化成磷酸,该反应的化学方程式为 ,装置D的作用为 。
(7)取产品mg溶于稀硫酸配成250mL溶液,取25.00mL于锥形瓶中,然后用0.02mol/LKMnO4标准溶液滴定,滴定终点的现象是 ;达到滴定终点时消耗VmLKMnO4标准溶液,则产品的纯度为 %(用含m、V的代数式表示)。
参考答案:
1.C
【分析】X、Z同主族,从图中可以看出,X能形成3个共价键,其原子的最外层有5个电子,Z原子形成的6个共价键中,有一个是配位键,则Z原子的最外层也有5个电子,从而得出X为N元素、Z为P元素,则Y为F元素。从而得出X、Y、Z为N、F、P元素。
【详解】A.Z为P元素,其氯化物的分子式为PCl3或PCl5,A不正确;
B.X、Y、Z为N、F、P元素,HF、NH3分子间都能形成氢键,非金属性F>N>P,则HF形成的氢键键能大于NH3,所以气态氢化物的熔沸点:HF>NH3>PH3,B不正确;
C.X、Y、Z为N、F、P元素,非金属性F>N>P,则电负性:F>N>P,C正确;
D.此阴离子中F原子满足8电子稳定结构,但P原子形成6对共用电子,原子的最外层电子数为12,D不正确;
故选C。
2.C
【详解】A.红磷燃烧,产生白烟,不能证明空气中O2含量,故选项错误。
B.瓶中液面先下降,是因为红磷燃烧放出大量的热;后上升,是红磷与空气中的氧气发生了化学反应,不能证明空气中O2含量,故选项错误。
C.瓶中液面最终上升至1处,说明氧气约占空气体积的,能证明空气中O2含量,故选项正确。
D.水槽中液面下降,是因为红磷燃烧放出大量的热,使装置内气体体积膨胀。故选项错误。
故选C。
3.A
【详解】A.由H3PO3的结构式可以看出,其分子中含有2个-OH,且中心原子达到8电子稳定结构,则其为二元酸,磷对应的含氧酸都为弱酸,能将AgNO3还原,则其具有还原性,所以H3PO3是具有还原性的二元弱酸,A错误;
B.H3PO3分子中含有2个-OH,为二元弱酸,则它与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,B正确;
C.H3PO3和AgNO3溶液反应,生成黑色金属银沉淀,在试管口有红棕色气体(NO2)生成,则瓶内生成NO,H3PO3表现出还原性,被氧化为H3PO4,化学方程式为:2H3PO3+AgNO3=Ag↓+NO↑+2H3PO4,C正确;
D.Na2HPO3为强碱弱酸盐,在水溶液中发生水解使溶液呈碱性,离子方程式:,D正确;
故选A。
4.C
【详解】A.施用化肥的目的就是使农作物增产,A正确;
B.化肥含营养素少,但量多见效快,农家肥含营养素种类多,但量少,见效慢,B正确;
C.由于化肥中含有氮、磷等元素容易使水体富营养化,会造成赤潮或水华现象,所以应该合理的使用化肥,C错误;
D.化学式中含有营养元素N、P、K中的任何两种或三种的叫复合肥,所以复合肥能给农作物提供几种营养元素,D正确;
故选C。
5.C
【详解】A.溶于水生成、NO,离子方程式为:,故A正确;
B.白磷与溶液反应生成、,离子方程式为,故B正确;
C.为一元酸,与足量的溶液反应的离子方程式:,故C错误;
D.雌黄(As2S3)和SnCl2、HCl制备雄黄(As4S4)的方程式为:,故D正确;
故选C。
6.D
【详解】A.红磷无需保存在冷水中,A项错误;
B.浓硝酸和氢碘酸均会挥发,且二者能发生氧化还原反应,B项错误;
C.苯酚为有机物,会腐蚀橡胶,C项错误;
D.保存溶液时加入适量稀硫酸可以抑制铝离子水解,D项正确;
故答案为:D。
7.A
【详解】A.该反应中中P失电子被氧化生成H3PO4,氧化产物为H3PO4,A正确;
B.该反应中还原剂为,氧化剂为Ag+,氧化剂和还原剂的物质的量之比为4:1,B错误;
C.NaH2PO2溶于水生成Na+和,破坏离子键,C错误;
D.H3PO2为一元酸,与NaOH反应生成一种盐,D错误;
故答案选A。
8.B
【分析】由题给流程可知,变化I为红磷固体隔绝空气加热得到液态白磷,变化Ⅱ为液态白磷受热转化为气态白磷,变化Ⅲ为液态铋做催化剂条件下气态白磷受热转化为黑磷纳米棒。
【详解】
A.红磷、白磷和黑磷都是磷元素形成的不同种单质,互为同素异形体,则该工艺涉及了磷元素的三种同素异形体,A正确;
B.液态白磷受热转化为气态白磷时,没有新物质生成,属于物理变化,不属于化学变化,B错误;
C.黑磷能在氧气燃烧生成五氧化二磷固体,C正确;
D.白磷在空气中易自燃,所以该工艺须在隔绝空气的条件下进行,D正确;
故选B。
9.B
【详解】A.可形成分子间氢键,因此熔沸点:,A项正确;
B.白磷与过量的NaOH溶液制备,同时有生成,P的化合价既有升高,又有降低,白磷中P元素从0价降低到中的-3价,白磷中P元素从O价升高到中的+1价,根据得失电子守恒可得,制取时,,B项错误;
C.易自燃,加入白磷前应先通入氮气,排尽装置中的空气,C项正确;
D.溶液吸收,生成,铜元素的化合价降低,表现了的氧化性,D项正确;
故选B。
10.B
【详解】A.硝酸铵溶于水,混乱度增大,导致熵增大,A错误;
B.乙烯聚合为聚乙烯,混乱度减小,熵减小,B正确;
C.冰融化成水,固体变为液体,混乱度增大,熵增大,C错误;
D.红磷转化为白磷,熵增大,D错误;
故答案选B。
11.(1) 安全瓶 b
(2)干燥气体
(3)防止暴沸
(4)使溶液受热均匀
(5)磷酸晶体
(6)B
(7)磷酸分子中含羟基,可与水分子间形成氢键
【分析】空气通过氯化钙除水,经过安全瓶后通过浓硫酸干燥除水,然后通过五氧化二磷,干燥的空气流入毛细管对烧瓶中的溶液进行搅拌,同时还具有加速水逸出和防止溶液沿毛细管上升的作用,将85%磷酸溶液进行减压蒸馏除水、结晶除杂得到纯磷酸。
【详解】(1)空集气瓶的作用是安全瓶;由仪器构造可知,仪器A为圆底烧瓶,仪器B为直形冷凝管,泠凝水应从b口进、a口出,形成逆流冷却,使冷却效果更好。
(2)纯磷酸制备过程中要严格控制温度和水分,因此五氧化二磷的作用为干燥气体。
(3)空气流入毛细管可以对烧瓶中的溶液防止暴沸,同时还具有加速水逸出和防止溶液沿毛细管上升的作用。
(4)升高温度能提高除水速度,而纯磷酸制备过程中要严格控制温度,水浴加热可以避免直接加热造成的温度过快升高与温度的不可控性,使溶液受热均匀。
(5)过饱和溶液暂时处于亚稳态,当加入一些固体的晶体或晃动时可使此状态失去平衡,过多的溶质就会结晶,因此可向磷酸的过饱和溶液中加入磷酸晶体促进其结晶。
(6)纯磷酸纯化过程中,温度低于易形成(熔点为),高于则发生分子间脱水生成焦磷酸,纯磷酸的熔点为42℃,因此过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为30 42℃,这个区间内答案选B。
(7)磷酸的结构式为:,分子中含羟基,可与水分子间形成氢键,因此磷酸中少量的水极难除去。
12.(1)+1
(2)
(3) 分液漏斗 一 趁热过滤 将生成的PH3全部排入C中充分吸收,增大次磷酸钠产率
(4)63.36%
【分析】目标产物的制备:
由实验装置图可知,实验前,应用氮气排除装置中的空气,防止黄磷被氧化,装置A中黄磷与氢氧化钠溶液反应生成次磷酸钠和磷化氢,装置B为空载仪器,做安全瓶,起防倒吸的作用,装置C中磷化氢与次氯酸钠溶液共热反应制备目标产物,装置D中盛有的酸性高锰酸钾溶液用于吸收磷化氢,防止污染空气。
【详解】(1)由化合价代数和为0可知,次磷酸钠中磷元素的化合价为+1价,故答案为:+1价;
(2)由题意可知,溶液中镍离子与次磷酸根离子反应生成亚磷酸、氢离子和镍,反应的离子方程式为Ni2++ H2PO+H2O =H3PO3+Ni+H+,故答案为:Ni2++ H2PO+H2O =H3PO3+Ni+H+;
(3)①由实验装置图可知,装置A中盛放烧碱溶液的仪器为分液漏斗;
②由装置A中发生化学反应可知,次磷酸(H3PO2)属于一元弱酸;
③由实验装置图可知,装置C中发生的反应为磷化氢与次氯酸钠溶液共热反应制备次磷酸,反应的化学方程式为;
④由表格中的数据可知,次磷酸钠的溶解度随温度变化较大,则充分反应后,将A、B中溶液混合,将混合液采用蒸发浓缩,有大量晶体析出时,趁热过滤,滤液再冷却结晶,过滤、洗涤、干燥得到次磷酸钠,故答案为:趁热过滤;
⑤反应结束后,向装置内通入N2的目的是:将生成的PH3全部排入C中充分吸收,增大次磷酸钠产率。
(4)由题给方程式可得:次磷酸钠的物质的量为0.100mol/L×0.03L—0.100mol/L×0.024L×=0.0018mol,则1.00g粗产品的纯度为×100%=63.36%。
13.(1)防倒吸
(2)装置C中应长导管进,短导管出
(3)③②①⑤④
(4)排尽装置内的空气,防止PH3自燃引起爆炸
(5)作分散剂,使反应物充分混合,加快反应速率
(6) PH3+4NaClO=H3PO4+4NaCl 检验PH3是否被吸收干净
(7) 滴入最后半滴KMnO4标准溶液后,溶液由无色变为红色,且半分钟内不褪色
【详解】(1)装置B为安全瓶,作用是防倒吸;
(2)该装置中的一处明显错误是装置C中应长导管进,短导管出;
(3)由题意可知,该实验操作步骤的正确顺序是③检查装置气密性,实验中有气体生成,防止装置漏气;②向三颈烧瓶中加入丁醇和白磷;①打开K,先通入一段时间,排尽装置中的空气,防止自燃引起爆炸;⑤关闭K,打开磁力搅拌器加热至50~60℃,滴加NaOH溶液,NaOH和白磷反应制取少量;④打开K,再通入一段时间,排尽滞留在装置中的;
(4)PH3有强还原性,是无色、有毒且能自燃的气体,先通入N2一段时间的目的是排尽装置内的空气,防止PH3自燃引起爆炸;
(5)向三颈烧瓶中加入丁醇和白磷,其中加入丁醇的主要目的是作分散剂,使反应物充分混合,加快反应速率;
(6)PH3在装置C中可被氧化成磷酸,该反应的化学方程式为PH3+4NaClO=H3PO4+4NaCl,装置D的作用为检验PH3是否被吸收干净;
(7)溶液为紫红色,滴定终点的现象是滴入最后半滴标准溶液后,溶液变为红色,且半分钟内不褪色。和反应生成和,根据得失电子守恒可得关系式:,则mol,产品的纯度为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
