硫试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 硫试题 高考化学考前专项复习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 433.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 11:27:37 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
硫
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质对应的化学式不正确的是
A.二硫化亚铁:FeS2 B.生石膏:CaSO4 2H2O
C.氰酸铵:NH4CN D.摩尔盐:(NH4)2Fe(SO4)2 6H2O
2.化学与生活密切相关。下列叙述正确的是( )
A.硫磺皂中的硫单质具有杀菌的功效
B.食品袋中放置的CaO可防止食品氧化变质
C.草木灰与硝酸铵混合施用效果更好
D.用碳酸钡、碳酸镁和氢氧化铝等作抗酸药
3.在给定条件下,下列选项中物质间的转化均能一步实现的是
A.SSO2H2SO4 B.Al3+AlO2-Al(OH)3
C.NaCl(aq)NaNa2O2 D.FeFeSO4(aq) Fe(OH)2
4.中华传统文化蕴含着很多科学知识,下列说法错误的是
A.“丹砂(HgS)烧之成水银,积变又还成丹砂”描述未涉及化学变化
B.“水声冰下咽,沙路雪中平”未涉及化学变化
C.“霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D.“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”其中提及的黄铜是混合物
5.下列说法正确的是
①硫的非金属性较强,所以只以化合态存在于自然界中
②分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水及过滤操作
③硫与金属或非金属反应时均作氧化剂
④硫在过量空气中燃烧产物是
⑤不能由单质直接化合而制得
⑥因为具有还原性,以不能用浓硫酸干燥
A.只有②③ B.只有② C.只有②④⑥ D.只有②⑤
6.下列物质不能由铜单质与其它物质发生化合反应得到的是
A.CuO B.CuS C.Cu2S D.CuCl2
7.能从下列四组混合物中把硫粉分离出来的同种方法是
①沙粒和硫粉 ②碳酸钙粉末和硫粉 ③铁屑和硫粉 ④碳粉和硫粉
A.用水溶解并过滤 B.加热使硫燃烧
C.用稀盐酸溶解并过滤 D.用NaOH溶液溶解并过滤
8.下列有关物质的用途说法正确的是
A.MgO具有很高的熔点,可作为耐高温材料,还可制作焰火
B.火山附近的温泉常因含有游离态硫而具有杀菌消毒作用
C.高纯度的硅可用于制造光导纤维
D.工业上用焦炭直接作还原剂还原铁矿石
9.给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.
B.
C.
D.
10.下列反应中,调节反应物用量或浓度,不会改变反应产物的是
A.铁在硫蒸气中燃烧 B.与NaOH溶液反应
C.二氧化硫通入澄清石灰水 D.硫酸中加入锌粉
二、判断题
11.单质硫在纯氧中燃烧,其氧化产物为SO3。(__)
12.要洗涤试管壁上附着的硫单质,不能用水洗,可以用酒精洗涤。(__)
13.硫在空气中燃烧生成SO2,在过量的纯氧中燃烧成SO3。(________)
14.不能由单质直接化合而制得CuS、CuCl2、Fe2S3、FeCl2
15.硫与金属或非金属反应时均作氧化剂
三、解答题
16.查阅资料知,铜的硫化物有和两种。某学生为探究铜与硫的反应产物和产物的性质做了如下实验:
I.将灼热的细铜丝放在硫蒸气里燃烧,产生黑色固体A;
II.冷却后,将硫与固体A分离;
III.取少量固体A于试管中,加入稀硫酸无明显现象,再加入适量浓溶液,黑色固体全部溶解,出现浅黄色沉淀,溶液变为蓝色,并产生在空气中变红的无色气体;
IV.取少量黑色于试管中,加入稀硫酸无明显现象,再加入适量浓溶液,也无明显现象。
回答下列问题:
(1)实验IV的目的是 。
(2)实验II中将硫粉与固体A分离的试剂是 (填化学式),分离方法是 。
(3)实验I可以在试管中进行,首先将硫加热成蒸气且充满试管,然后将灼热的细铜丝插入试管。将硫蒸气充满试管的主要目的是 ;该实验中发生反应的化学方程式为 。
(4)实验III中发生的反应是 (填“氧化还原反应”或“非氧化还原反应”);该反应的离子方程式为 。
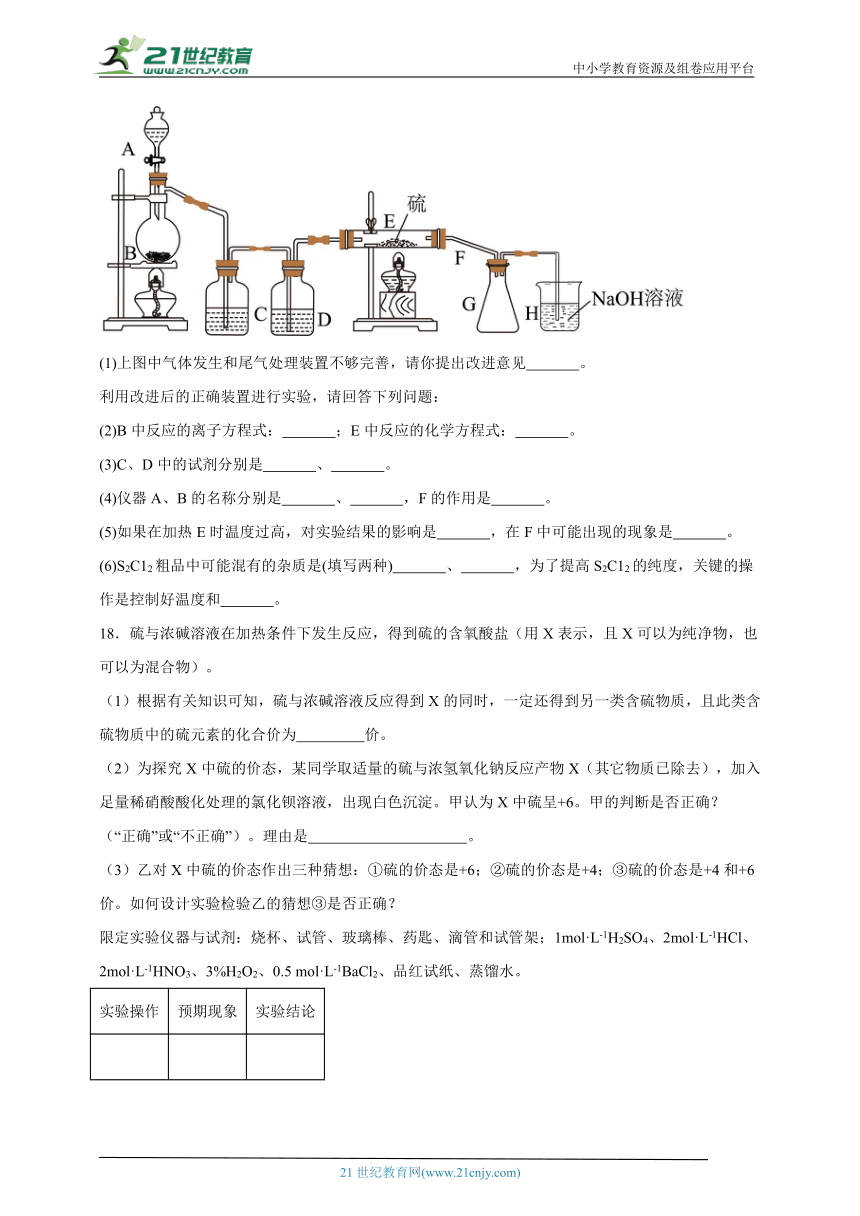
17.二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~ 140℃与硫反应,即可得S2C12粗品。
②有关物质的部分性质如下表:
物质 熔点/℃ 沸点/℃ 化学性质
S 112.8 444.6 略
S2C12 -77 137 遇水生成HCl、SO2、S;300℃以上完全分解;S2C12 + C12 2SCl2
设计实验装置图如下:
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: ;E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2C12粗品中可能混有的杂质是(填写两种) 、 ,为了提高S2C12的纯度,关键的操作是控制好温度和 。
18.硫与浓碱溶液在加热条件下发生反应,得到硫的含氧酸盐(用X表示,且X可以为纯净物,也可以为混合物)。
(1)根据有关知识可知,硫与浓碱溶液反应得到X的同时,一定还得到另一类含硫物质,且此类含硫物质中的硫元素的化合价为 价。
(2)为探究X中硫的价态,某同学取适量的硫与浓氢氧化钠反应产物X(其它物质已除去),加入足量稀硝酸酸化处理的氯化钡溶液,出现白色沉淀。甲认为X中硫呈+6。甲的判断是否正确? (“正确”或“不正确”)。理由是 。
(3)乙对X中硫的价态作出三种猜想:①硫的价态是+6;②硫的价态是+4;③硫的价态是+4和+6价。如何设计实验检验乙的猜想③是否正确?
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L-1H2SO4、2mol·L-1HCl、2mol·L-1HNO3、3%H2O2、0.5 mol·L-1BaCl2、品红试纸、蒸馏水。
实验操作 预期现象 实验结论
参考答案:
1.C
【详解】A.二硫化亚铁中Fe元素化合价为+2价,S元素化合价为-1价,化学式为:FeS2,A正确;
B.生石膏是带2个结晶水的硫酸钙,化学式为:CaSO4 2H2O,B正确;
C.氰酸铵是铵盐,化学式是:NH4CNO,C错误;
D.摩尔盐是绿矾与硫酸铵以等物质的量混合制得的盐,化学式是:(NH4)2Fe(SO4)2 6H2O,D正确;
故答案是C。
2.A
【详解】A.硫单质能杀菌,所以硫磺香皂中的硫单质有杀菌的效果,故A正确;
B.氧化钙不具有还原性,不能防止食品氧化变质,它能吸水,只作干燥剂,防止食品受潮,故B错误;
C.草木灰的主要成分为碳酸钾,碳酸钾水解溶液显碱性,与铵态氮肥混合会反应产生氨气,降低了施肥效果,二者不能混合使用,故C错误;
D.碳酸钡与盐酸反应生成易溶于水的氯化钡,钡离子为重金属离子,有毒,所以不能用碳酸钡作抗酸药,故D错误;
答案为A。
3.D
【详解】A. SO2与H2O反应生成H2SO3而不生成H2SO4 ,错误; B. 氢氧化铝不溶于弱碱氨水,Al3+与过量氨水反应生成氢氧化铝沉淀而不生成AlO2-,错误;C. 电解NaCl(aq)生成氢氧化钠、氢气和氯气,不生成金属钠,错误;D. Fe与稀硫酸反应生成硫酸亚铁和氢气,硫酸亚铁溶液与氢氧化钠溶液反应生成氢氧化亚铁沉淀和硫酸钠,均能一步实现,正确。
4.A
【详解】A.由题意可知,硫化汞受热分解生成汞和硫,汞和硫反应生成硫化汞时都有新物质生成,一定涉及化学变化,故A错误;
B.诗中表达的意思是流水在冰层下发出低咽的声响,原来崎岖不平的沙路铺上厚厚的积雪显得很平坦,该过程没有新物质生成,未涉及化学变化,故B正确;
C.由题意可知,“霾尘积聚难见路人”说明雾霾属于具有丁达尔效应的气溶胶,故C正确;
D.由题意可知,黄铜是铜铅形成的合金,属于混合物,故D正确;
故选A。
5.B
【详解】①在火山喷口附近存在硫单质,故①错误;
②硝酸钾溶液水,而硫、碳不溶于水,应先加水溶解,过滤后,由于不溶物中硫易溶于二氧化硫,碳不能溶于二硫化碳,再将难溶物置于二硫化碳中溶解、过滤,最后留在滤纸上的是碳,故②正确;
③硫可与氧气反应生成二氧化硫,为还原剂,硫单质和氢气反应生成硫化氢表现氧化性,故③错误;
④S的还原性较弱,S单质在过量的空气中燃烧生成SO2,不能直接生成SO3,故④错误;
⑤S的还原性较弱,与金属单质反应生成低价金属硫化物,铜与硫单质反应生成Cu2S,铁与硫单质反应生成硫化亚铁FeS,Cl的氧化性较强,铁与氯气反应生成氯化铁FeCl3,故⑤错误;
⑥SO2与浓硫酸不反应,则可用浓硫酸干燥,故⑥错误;
只有②正确,故选:B。
6.B
【详解】A.可由Cu与O 在加热下反应生成CuO,故A不选;
B.因S的氧化性弱,只能将Cu氧化为+1价,不能由单质得到CuS,故B选;
C.因S的氧化性弱,能将Cu氧化为+1价,点燃或加热下反应为2Cu+S=Cu2S,故B不选;
D.可由Cu与Cl 在点燃或加热下反应生成CuCl2,故D不选;
故选B。
7.D
【详解】A.①沙粒和硫粉②碳酸钙粉末和硫粉③铁屑和硫粉④碳粉和硫粉中物质均不溶于水,故A不选;
B.②碳酸钙粉末要分解③铁屑和硫粉反应生成FeS④碳粉和硫粉也会反应生成二硫化碳,故加热不能分离,故B不选;
C.②碳酸钙粉末和盐酸反应生成可溶性盐③铁屑和盐酸反应生成可溶性盐,过滤后可分离,但是①④不能分离,故C不选;
D.硫与NaOH溶液可就生成硫化钠、亚硫钠和水,过滤分离,故D选;
故选D。
8.B
【详解】A.MgO具有很高的熔点,可作为耐高温材料,但用于制作焰火的不是氧化镁而是镁,镁燃烧时发出耀眼的强光,A错误;
B.火山附近的温泉含有游离态硫,能杀菌消毒,治疗皮肤病,B正确;
C.高纯度的二氧化硅可用于制造光导纤维,C错误;
D.工业上用焦炭、铁矿石、空气和石灰石作原料进行高炉炼铁,但还原剂是CO,CO还原铁矿石得到铁,D错误;
答案选B。
9.B
【详解】A、硫燃烧只能生成SO2,A错误;B、氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,偏铝酸钠溶液中通入CO2生成氢氧化铝沉淀,B正确;C、镁离子水解,直接蒸发氯化镁溶液得不到氯化镁固体,C错误;D、铁与水蒸气反应生成氢气和四氧化三铁,D错误,答案选B。
10.A
【详解】A.无论铁是否过量,均发生反应Fe+SFeS,A符合题意;
B.若H2S少量,H2S+2NaOH=Na2S+2H2O,若H2S足量,H2S+NaOH=NaHS+H2O, B不符合题意;
C.若SO2少量,发生反应SO2+Ca(OH)2=CaSO3↓+H2O,若SO2足量,发生反应2SO2+Ca(OH)2= Ca(HSO3)2,C不符合题意;
D.若为稀H2SO4,发生反应Zn+H2SO4=ZnSO4+H2↑,若为浓H2SO4,发生反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O,D不符合题意;
故答案为:A。
11.错误
【解析】略
12.错误
【解析】略
13.错误
【详解】硫和氧气燃烧生成二氧化硫,不会生成三氧化硫;错误。
14.错误
【详解】S的原子半径较大,获得电子的能力较弱,因此S与Cu、Fe反应时只能生成低价态的Cu和Fe的硫化物,即与Cu生成Cu2S而不是CuS;与Fe生成FeS而不是Fe2S3;氯气氧化性较强,与Cu、Fe反应时只能生成高价态的CuCl2和FeCl3;则CuCl2可以通过化合反应制得,故错误
15.错误
【详解】硫单质为零价,是中间价态,与金属反应时显氧化性;硫与非金属性比它强的非金属(如氧、氯、氟等)反应时硫显还原性,错误
16. 证明实验III中的固体A不是CuS CS2 过滤 将空气排出,防止铜被空气氧化 氧化还原反应
【详解】(1)实验IV使用CuS,按照实验III的步骤进行实验,现象与实验III不同,可以通过这一点来证明实验III中的固体A不是CuS;
(2)硫粉易溶于CS2,而题干中的铜化合物不溶于CS2,故可以用CS2来溶解硫粉,通过过滤进行分离;
(3)铜在加热的条件下,易被空气氧化为氧化铜,将硫蒸气充满试管,可以将空气排出,防止铜被空气氧化;铜丝和硫蒸气反应生成Cu2S,该反应的化学方程式为;
(4)实验III中,向黑色固体Cu2S中,加入稀硫酸无名现象,再加入NaNO3浓溶液,黑色固体溶解,出现浅黄色沉淀,溶液变为蓝色,有在空气中会变红的无色气体生成,说明有硫单质、Cu2+、NO这些物质产生,可以得知该化学反应中有元素化合价的升降,故该反应是氧化还原反应,该反应的离子方程式为。
17.(1)将A换成恒压滴液漏斗,在G和H之间增加干燥装置
(2) MnO2 + 4 H+ +2 C1- Mn2+ + C12 ↑+ 2H2O 2 S + Cl2S2Cl2
(3) 饱和食盐水 浓硫酸
(4) 分液漏斗 蒸馏烧瓶 导气、冷凝
(5) 产率降低 有固体产生
(6) SCl2 C12或S 控制浓盐酸的滴速不要过快
【分析】由实验装置图可知,装置B中二氧化锰与浓盐酸共热反应制备氯气,浓盐酸具有挥发性,制得的氯气中混有氯化氢和水蒸气,装置C中盛有的饱和食盐水用于除去氯化氢气体,装置D中盛有的浓硫酸用于干燥氯气,装置E中氯气与硫共热反应制备二氯化二硫,导气管F用于起导气、冷凝的作用,装置G用于收集二氯化二硫,装置H中盛有的氢氧化钠溶液用于吸收未反应的氯气,防止污染空气,该装置设计不够完善,一是装置A不便于浓盐酸顺利流下,应换成恒压滴液漏斗,二是装置H中水蒸气进入G中会导致二氯化二硫与水反应,应在G和H之间增加干燥装置。
【详解】(1)由分析可知,该装置设计不够完善,一是若B中气压过大,装置A不便于浓盐酸顺利流下,应换成恒压滴液漏斗,二是装置H中水蒸气进入G中会导致二氯化二硫与水反应,应在G和H之间增加干燥装置,故答案为:将A换成恒压滴液漏斗,在G和H之间增加干燥装置;
(2)由分析可知,装置B中发生的反应为浓盐酸和二氧化锰共热反应生成氯化锰、氯气和水,反应离子方程式为MnO2+4H++2Cl—Mn2++Cl2↑+2H2O;装置E中发生的反应为氯气与硫共热反应生成二氯化二硫,反应的化学方程式2S+Cl2S2Cl2,故答案为:MnO2+4H++2Cl—Mn2++Cl2↑+2H2O;2S+Cl2S2Cl2;
(3)由分析可知,装置C中盛有的饱和食盐水用于除去氯化氢气体,装置D中盛有的浓硫酸用于干燥氯气,故答案为:饱和食盐水;浓硫酸;
(4)由实验装置图可知,仪器A为分液漏斗、仪器B为蒸馏烧瓶;由分析可知,导气管F用于起导气、冷凝的作用,故答案为:分液漏斗;蒸馏烧瓶;导气、冷凝;
(5)由信息可知,若温度过高,二氯化二硫会受热分解、会与氯气反应生成二氯化硫,导致产率偏低;二氯化二硫分解生成的硫蒸气在导气管F中冷凝会转化为硫固体,故答案为:产率降低;有固体产生;
(6)由信息可知,实验时可能因温度、水蒸气和氯气用量等因素在二氯化二硫中混有氯气、硫、二氯化硫、二氧化硫等杂质;若滴加盐酸过快,过量的氯气会将二氯化二硫氧化为应二氯化硫,导致产品不纯,所以为了提高二氯化二硫的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快,故答案为:SCl2;C12或S;控制浓盐酸的滴速不要过快。
18. -2 不正确 硝酸具有氧化性,可将SO32—氧化为SO42— 取固体适量,加入足量的稀盐酸,将湿润的品红试纸置于管口;在往溶液中滴入氯化钡溶液 品红试纸褪色,溶液中有白色沉淀 X中硫同时呈现+4、+6价
【详解】分析:(1)硫与强碱反应属于氧化还原反应,硫元素化合价有升高就一定有硫元素的化合价降低。
(2)亚硫酸根离子能够被硝酸氧化为硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀。
(3)亚硫酸根离子与氢离子作用产生二氧化硫,二氧化硫气体能使品红褪色,可说明含亚硫酸根离子,然后加氯化钡生成白色沉淀,说明含硫酸根离子,反之,不存在,以此来解答。
详解:(1)硫元素有-2、0、+4、+6几种价态,X为硫的含氧酸盐,则X中硫元素为正价,故单质硫与碱反应时生成物中一定有-2价的化合物;正确答案:-2。
(2)硝酸具有氧化性,如果反应生成了亚硫酸盐,亚硫酸根离子能够被硝酸氧化为硫酸根离子,加入氯化钡溶液后也能出现白色沉淀,反应不一定生成了硫酸盐;正确答案:不正确; 硝酸具有氧化性,可将SO32—氧化为SO42—。
(3)取固体适量,加入足量的稀盐酸,将湿润的品红试纸置于管口;若品红试纸褪色,说明产生了二氧化硫气体,溶液中含有亚硫酸根离子;再往反应后的溶液中滴入氯化钡溶液,出现白色沉淀,反应生成了硫酸钡,说明溶液中含有硫酸根离子;即X中硫同时呈现+4、+6价;正确答案: 取固体适量,加入足量的稀盐酸,将湿润的品红试纸置于管口;在往溶液中滴入氯化钡溶液; 品红试纸褪色,溶液中有白色沉淀;X中硫同时呈现+4、+6价。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
硫
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质对应的化学式不正确的是
A.二硫化亚铁:FeS2 B.生石膏:CaSO4 2H2O
C.氰酸铵:NH4CN D.摩尔盐:(NH4)2Fe(SO4)2 6H2O
2.化学与生活密切相关。下列叙述正确的是( )
A.硫磺皂中的硫单质具有杀菌的功效
B.食品袋中放置的CaO可防止食品氧化变质
C.草木灰与硝酸铵混合施用效果更好
D.用碳酸钡、碳酸镁和氢氧化铝等作抗酸药
3.在给定条件下,下列选项中物质间的转化均能一步实现的是
A.SSO2H2SO4 B.Al3+AlO2-Al(OH)3
C.NaCl(aq)NaNa2O2 D.FeFeSO4(aq) Fe(OH)2
4.中华传统文化蕴含着很多科学知识,下列说法错误的是
A.“丹砂(HgS)烧之成水银,积变又还成丹砂”描述未涉及化学变化
B.“水声冰下咽,沙路雪中平”未涉及化学变化
C.“霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D.“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”其中提及的黄铜是混合物
5.下列说法正确的是
①硫的非金属性较强,所以只以化合态存在于自然界中
②分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水及过滤操作
③硫与金属或非金属反应时均作氧化剂
④硫在过量空气中燃烧产物是
⑤不能由单质直接化合而制得
⑥因为具有还原性,以不能用浓硫酸干燥
A.只有②③ B.只有② C.只有②④⑥ D.只有②⑤
6.下列物质不能由铜单质与其它物质发生化合反应得到的是
A.CuO B.CuS C.Cu2S D.CuCl2
7.能从下列四组混合物中把硫粉分离出来的同种方法是
①沙粒和硫粉 ②碳酸钙粉末和硫粉 ③铁屑和硫粉 ④碳粉和硫粉
A.用水溶解并过滤 B.加热使硫燃烧
C.用稀盐酸溶解并过滤 D.用NaOH溶液溶解并过滤
8.下列有关物质的用途说法正确的是
A.MgO具有很高的熔点,可作为耐高温材料,还可制作焰火
B.火山附近的温泉常因含有游离态硫而具有杀菌消毒作用
C.高纯度的硅可用于制造光导纤维
D.工业上用焦炭直接作还原剂还原铁矿石
9.给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.
B.
C.
D.
10.下列反应中,调节反应物用量或浓度,不会改变反应产物的是
A.铁在硫蒸气中燃烧 B.与NaOH溶液反应
C.二氧化硫通入澄清石灰水 D.硫酸中加入锌粉
二、判断题
11.单质硫在纯氧中燃烧,其氧化产物为SO3。(__)
12.要洗涤试管壁上附着的硫单质,不能用水洗,可以用酒精洗涤。(__)
13.硫在空气中燃烧生成SO2,在过量的纯氧中燃烧成SO3。(________)
14.不能由单质直接化合而制得CuS、CuCl2、Fe2S3、FeCl2
15.硫与金属或非金属反应时均作氧化剂
三、解答题
16.查阅资料知,铜的硫化物有和两种。某学生为探究铜与硫的反应产物和产物的性质做了如下实验:
I.将灼热的细铜丝放在硫蒸气里燃烧,产生黑色固体A;
II.冷却后,将硫与固体A分离;
III.取少量固体A于试管中,加入稀硫酸无明显现象,再加入适量浓溶液,黑色固体全部溶解,出现浅黄色沉淀,溶液变为蓝色,并产生在空气中变红的无色气体;
IV.取少量黑色于试管中,加入稀硫酸无明显现象,再加入适量浓溶液,也无明显现象。
回答下列问题:
(1)实验IV的目的是 。
(2)实验II中将硫粉与固体A分离的试剂是 (填化学式),分离方法是 。
(3)实验I可以在试管中进行,首先将硫加热成蒸气且充满试管,然后将灼热的细铜丝插入试管。将硫蒸气充满试管的主要目的是 ;该实验中发生反应的化学方程式为 。
(4)实验III中发生的反应是 (填“氧化还原反应”或“非氧化还原反应”);该反应的离子方程式为 。
17.二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~ 140℃与硫反应,即可得S2C12粗品。
②有关物质的部分性质如下表:
物质 熔点/℃ 沸点/℃ 化学性质
S 112.8 444.6 略
S2C12 -77 137 遇水生成HCl、SO2、S;300℃以上完全分解;S2C12 + C12 2SCl2
设计实验装置图如下:
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: ;E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2C12粗品中可能混有的杂质是(填写两种) 、 ,为了提高S2C12的纯度,关键的操作是控制好温度和 。
18.硫与浓碱溶液在加热条件下发生反应,得到硫的含氧酸盐(用X表示,且X可以为纯净物,也可以为混合物)。
(1)根据有关知识可知,硫与浓碱溶液反应得到X的同时,一定还得到另一类含硫物质,且此类含硫物质中的硫元素的化合价为 价。
(2)为探究X中硫的价态,某同学取适量的硫与浓氢氧化钠反应产物X(其它物质已除去),加入足量稀硝酸酸化处理的氯化钡溶液,出现白色沉淀。甲认为X中硫呈+6。甲的判断是否正确? (“正确”或“不正确”)。理由是 。
(3)乙对X中硫的价态作出三种猜想:①硫的价态是+6;②硫的价态是+4;③硫的价态是+4和+6价。如何设计实验检验乙的猜想③是否正确?
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L-1H2SO4、2mol·L-1HCl、2mol·L-1HNO3、3%H2O2、0.5 mol·L-1BaCl2、品红试纸、蒸馏水。
实验操作 预期现象 实验结论
参考答案:
1.C
【详解】A.二硫化亚铁中Fe元素化合价为+2价,S元素化合价为-1价,化学式为:FeS2,A正确;
B.生石膏是带2个结晶水的硫酸钙,化学式为:CaSO4 2H2O,B正确;
C.氰酸铵是铵盐,化学式是:NH4CNO,C错误;
D.摩尔盐是绿矾与硫酸铵以等物质的量混合制得的盐,化学式是:(NH4)2Fe(SO4)2 6H2O,D正确;
故答案是C。
2.A
【详解】A.硫单质能杀菌,所以硫磺香皂中的硫单质有杀菌的效果,故A正确;
B.氧化钙不具有还原性,不能防止食品氧化变质,它能吸水,只作干燥剂,防止食品受潮,故B错误;
C.草木灰的主要成分为碳酸钾,碳酸钾水解溶液显碱性,与铵态氮肥混合会反应产生氨气,降低了施肥效果,二者不能混合使用,故C错误;
D.碳酸钡与盐酸反应生成易溶于水的氯化钡,钡离子为重金属离子,有毒,所以不能用碳酸钡作抗酸药,故D错误;
答案为A。
3.D
【详解】A. SO2与H2O反应生成H2SO3而不生成H2SO4 ,错误; B. 氢氧化铝不溶于弱碱氨水,Al3+与过量氨水反应生成氢氧化铝沉淀而不生成AlO2-,错误;C. 电解NaCl(aq)生成氢氧化钠、氢气和氯气,不生成金属钠,错误;D. Fe与稀硫酸反应生成硫酸亚铁和氢气,硫酸亚铁溶液与氢氧化钠溶液反应生成氢氧化亚铁沉淀和硫酸钠,均能一步实现,正确。
4.A
【详解】A.由题意可知,硫化汞受热分解生成汞和硫,汞和硫反应生成硫化汞时都有新物质生成,一定涉及化学变化,故A错误;
B.诗中表达的意思是流水在冰层下发出低咽的声响,原来崎岖不平的沙路铺上厚厚的积雪显得很平坦,该过程没有新物质生成,未涉及化学变化,故B正确;
C.由题意可知,“霾尘积聚难见路人”说明雾霾属于具有丁达尔效应的气溶胶,故C正确;
D.由题意可知,黄铜是铜铅形成的合金,属于混合物,故D正确;
故选A。
5.B
【详解】①在火山喷口附近存在硫单质,故①错误;
②硝酸钾溶液水,而硫、碳不溶于水,应先加水溶解,过滤后,由于不溶物中硫易溶于二氧化硫,碳不能溶于二硫化碳,再将难溶物置于二硫化碳中溶解、过滤,最后留在滤纸上的是碳,故②正确;
③硫可与氧气反应生成二氧化硫,为还原剂,硫单质和氢气反应生成硫化氢表现氧化性,故③错误;
④S的还原性较弱,S单质在过量的空气中燃烧生成SO2,不能直接生成SO3,故④错误;
⑤S的还原性较弱,与金属单质反应生成低价金属硫化物,铜与硫单质反应生成Cu2S,铁与硫单质反应生成硫化亚铁FeS,Cl的氧化性较强,铁与氯气反应生成氯化铁FeCl3,故⑤错误;
⑥SO2与浓硫酸不反应,则可用浓硫酸干燥,故⑥错误;
只有②正确,故选:B。
6.B
【详解】A.可由Cu与O 在加热下反应生成CuO,故A不选;
B.因S的氧化性弱,只能将Cu氧化为+1价,不能由单质得到CuS,故B选;
C.因S的氧化性弱,能将Cu氧化为+1价,点燃或加热下反应为2Cu+S=Cu2S,故B不选;
D.可由Cu与Cl 在点燃或加热下反应生成CuCl2,故D不选;
故选B。
7.D
【详解】A.①沙粒和硫粉②碳酸钙粉末和硫粉③铁屑和硫粉④碳粉和硫粉中物质均不溶于水,故A不选;
B.②碳酸钙粉末要分解③铁屑和硫粉反应生成FeS④碳粉和硫粉也会反应生成二硫化碳,故加热不能分离,故B不选;
C.②碳酸钙粉末和盐酸反应生成可溶性盐③铁屑和盐酸反应生成可溶性盐,过滤后可分离,但是①④不能分离,故C不选;
D.硫与NaOH溶液可就生成硫化钠、亚硫钠和水,过滤分离,故D选;
故选D。
8.B
【详解】A.MgO具有很高的熔点,可作为耐高温材料,但用于制作焰火的不是氧化镁而是镁,镁燃烧时发出耀眼的强光,A错误;
B.火山附近的温泉含有游离态硫,能杀菌消毒,治疗皮肤病,B正确;
C.高纯度的二氧化硅可用于制造光导纤维,C错误;
D.工业上用焦炭、铁矿石、空气和石灰石作原料进行高炉炼铁,但还原剂是CO,CO还原铁矿石得到铁,D错误;
答案选B。
9.B
【详解】A、硫燃烧只能生成SO2,A错误;B、氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,偏铝酸钠溶液中通入CO2生成氢氧化铝沉淀,B正确;C、镁离子水解,直接蒸发氯化镁溶液得不到氯化镁固体,C错误;D、铁与水蒸气反应生成氢气和四氧化三铁,D错误,答案选B。
10.A
【详解】A.无论铁是否过量,均发生反应Fe+SFeS,A符合题意;
B.若H2S少量,H2S+2NaOH=Na2S+2H2O,若H2S足量,H2S+NaOH=NaHS+H2O, B不符合题意;
C.若SO2少量,发生反应SO2+Ca(OH)2=CaSO3↓+H2O,若SO2足量,发生反应2SO2+Ca(OH)2= Ca(HSO3)2,C不符合题意;
D.若为稀H2SO4,发生反应Zn+H2SO4=ZnSO4+H2↑,若为浓H2SO4,发生反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O,D不符合题意;
故答案为:A。
11.错误
【解析】略
12.错误
【解析】略
13.错误
【详解】硫和氧气燃烧生成二氧化硫,不会生成三氧化硫;错误。
14.错误
【详解】S的原子半径较大,获得电子的能力较弱,因此S与Cu、Fe反应时只能生成低价态的Cu和Fe的硫化物,即与Cu生成Cu2S而不是CuS;与Fe生成FeS而不是Fe2S3;氯气氧化性较强,与Cu、Fe反应时只能生成高价态的CuCl2和FeCl3;则CuCl2可以通过化合反应制得,故错误
15.错误
【详解】硫单质为零价,是中间价态,与金属反应时显氧化性;硫与非金属性比它强的非金属(如氧、氯、氟等)反应时硫显还原性,错误
16. 证明实验III中的固体A不是CuS CS2 过滤 将空气排出,防止铜被空气氧化 氧化还原反应
【详解】(1)实验IV使用CuS,按照实验III的步骤进行实验,现象与实验III不同,可以通过这一点来证明实验III中的固体A不是CuS;
(2)硫粉易溶于CS2,而题干中的铜化合物不溶于CS2,故可以用CS2来溶解硫粉,通过过滤进行分离;
(3)铜在加热的条件下,易被空气氧化为氧化铜,将硫蒸气充满试管,可以将空气排出,防止铜被空气氧化;铜丝和硫蒸气反应生成Cu2S,该反应的化学方程式为;
(4)实验III中,向黑色固体Cu2S中,加入稀硫酸无名现象,再加入NaNO3浓溶液,黑色固体溶解,出现浅黄色沉淀,溶液变为蓝色,有在空气中会变红的无色气体生成,说明有硫单质、Cu2+、NO这些物质产生,可以得知该化学反应中有元素化合价的升降,故该反应是氧化还原反应,该反应的离子方程式为。
17.(1)将A换成恒压滴液漏斗,在G和H之间增加干燥装置
(2) MnO2 + 4 H+ +2 C1- Mn2+ + C12 ↑+ 2H2O 2 S + Cl2S2Cl2
(3) 饱和食盐水 浓硫酸
(4) 分液漏斗 蒸馏烧瓶 导气、冷凝
(5) 产率降低 有固体产生
(6) SCl2 C12或S 控制浓盐酸的滴速不要过快
【分析】由实验装置图可知,装置B中二氧化锰与浓盐酸共热反应制备氯气,浓盐酸具有挥发性,制得的氯气中混有氯化氢和水蒸气,装置C中盛有的饱和食盐水用于除去氯化氢气体,装置D中盛有的浓硫酸用于干燥氯气,装置E中氯气与硫共热反应制备二氯化二硫,导气管F用于起导气、冷凝的作用,装置G用于收集二氯化二硫,装置H中盛有的氢氧化钠溶液用于吸收未反应的氯气,防止污染空气,该装置设计不够完善,一是装置A不便于浓盐酸顺利流下,应换成恒压滴液漏斗,二是装置H中水蒸气进入G中会导致二氯化二硫与水反应,应在G和H之间增加干燥装置。
【详解】(1)由分析可知,该装置设计不够完善,一是若B中气压过大,装置A不便于浓盐酸顺利流下,应换成恒压滴液漏斗,二是装置H中水蒸气进入G中会导致二氯化二硫与水反应,应在G和H之间增加干燥装置,故答案为:将A换成恒压滴液漏斗,在G和H之间增加干燥装置;
(2)由分析可知,装置B中发生的反应为浓盐酸和二氧化锰共热反应生成氯化锰、氯气和水,反应离子方程式为MnO2+4H++2Cl—Mn2++Cl2↑+2H2O;装置E中发生的反应为氯气与硫共热反应生成二氯化二硫,反应的化学方程式2S+Cl2S2Cl2,故答案为:MnO2+4H++2Cl—Mn2++Cl2↑+2H2O;2S+Cl2S2Cl2;
(3)由分析可知,装置C中盛有的饱和食盐水用于除去氯化氢气体,装置D中盛有的浓硫酸用于干燥氯气,故答案为:饱和食盐水;浓硫酸;
(4)由实验装置图可知,仪器A为分液漏斗、仪器B为蒸馏烧瓶;由分析可知,导气管F用于起导气、冷凝的作用,故答案为:分液漏斗;蒸馏烧瓶;导气、冷凝;
(5)由信息可知,若温度过高,二氯化二硫会受热分解、会与氯气反应生成二氯化硫,导致产率偏低;二氯化二硫分解生成的硫蒸气在导气管F中冷凝会转化为硫固体,故答案为:产率降低;有固体产生;
(6)由信息可知,实验时可能因温度、水蒸气和氯气用量等因素在二氯化二硫中混有氯气、硫、二氯化硫、二氧化硫等杂质;若滴加盐酸过快,过量的氯气会将二氯化二硫氧化为应二氯化硫,导致产品不纯,所以为了提高二氯化二硫的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快,故答案为:SCl2;C12或S;控制浓盐酸的滴速不要过快。
18. -2 不正确 硝酸具有氧化性,可将SO32—氧化为SO42— 取固体适量,加入足量的稀盐酸,将湿润的品红试纸置于管口;在往溶液中滴入氯化钡溶液 品红试纸褪色,溶液中有白色沉淀 X中硫同时呈现+4、+6价
【详解】分析:(1)硫与强碱反应属于氧化还原反应,硫元素化合价有升高就一定有硫元素的化合价降低。
(2)亚硫酸根离子能够被硝酸氧化为硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀。
(3)亚硫酸根离子与氢离子作用产生二氧化硫,二氧化硫气体能使品红褪色,可说明含亚硫酸根离子,然后加氯化钡生成白色沉淀,说明含硫酸根离子,反之,不存在,以此来解答。
详解:(1)硫元素有-2、0、+4、+6几种价态,X为硫的含氧酸盐,则X中硫元素为正价,故单质硫与碱反应时生成物中一定有-2价的化合物;正确答案:-2。
(2)硝酸具有氧化性,如果反应生成了亚硫酸盐,亚硫酸根离子能够被硝酸氧化为硫酸根离子,加入氯化钡溶液后也能出现白色沉淀,反应不一定生成了硫酸盐;正确答案:不正确; 硝酸具有氧化性,可将SO32—氧化为SO42—。
(3)取固体适量,加入足量的稀盐酸,将湿润的品红试纸置于管口;若品红试纸褪色,说明产生了二氧化硫气体,溶液中含有亚硫酸根离子;再往反应后的溶液中滴入氯化钡溶液,出现白色沉淀,反应生成了硫酸钡,说明溶液中含有硫酸根离子;即X中硫同时呈现+4、+6价;正确答案: 取固体适量,加入足量的稀盐酸,将湿润的品红试纸置于管口;在往溶液中滴入氯化钡溶液; 品红试纸褪色,溶液中有白色沉淀;X中硫同时呈现+4、+6价。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
