硫化氢与硫化物试题 高考化学考前专项复习
文档属性
| 名称 | 硫化氢与硫化物试题 高考化学考前专项复习 |

|
|
| 格式 | docx | ||
| 文件大小 | 934.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
硫化氢与硫化物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在常温常压下, 24mL H2S和O2的混合气点火燃烧, 生成6mL SO2时,剩余气体中不含氧气,则原混合气中H2S的体积为
A.6mL B.12mL C.15mL D.18mL
2.下列实验预测现象与实际相符的是
选项 实验 预测现象
A 向砂纸打磨后的铝片上滴加浓硝酸 铝片逐渐溶解,产生红棕色气体
B 向品红溶液中通入足量Cl2,然后加热 溶液红色褪去,加热后恢复红色
C 向Fe2(SO4)3溶液中加入足量铁粉,充分反应后滴入KSCN溶液 溶液黄色逐渐褪去,滴入KSCN溶液后溶液变红
D 向粗锌粒(含硫化物)中滴入稀硫酸,产生的气体通入少量KMnO4稀溶液中 KMnO4稀溶液紫色逐渐变浅
A.A B.B C.C D.D
3.自然界中的分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是
A.H2S是一种无色臭鸡蛋气味的有毒气体
B.H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S分子很稳定,受热难分解
4.用如图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是
A.向硫化钠溶液中通入氯气 B.向硝酸银溶液中通入少量氯化氢
C.向饱和溶液中通入 D.向氢氧化钠溶液中通入少量氯气
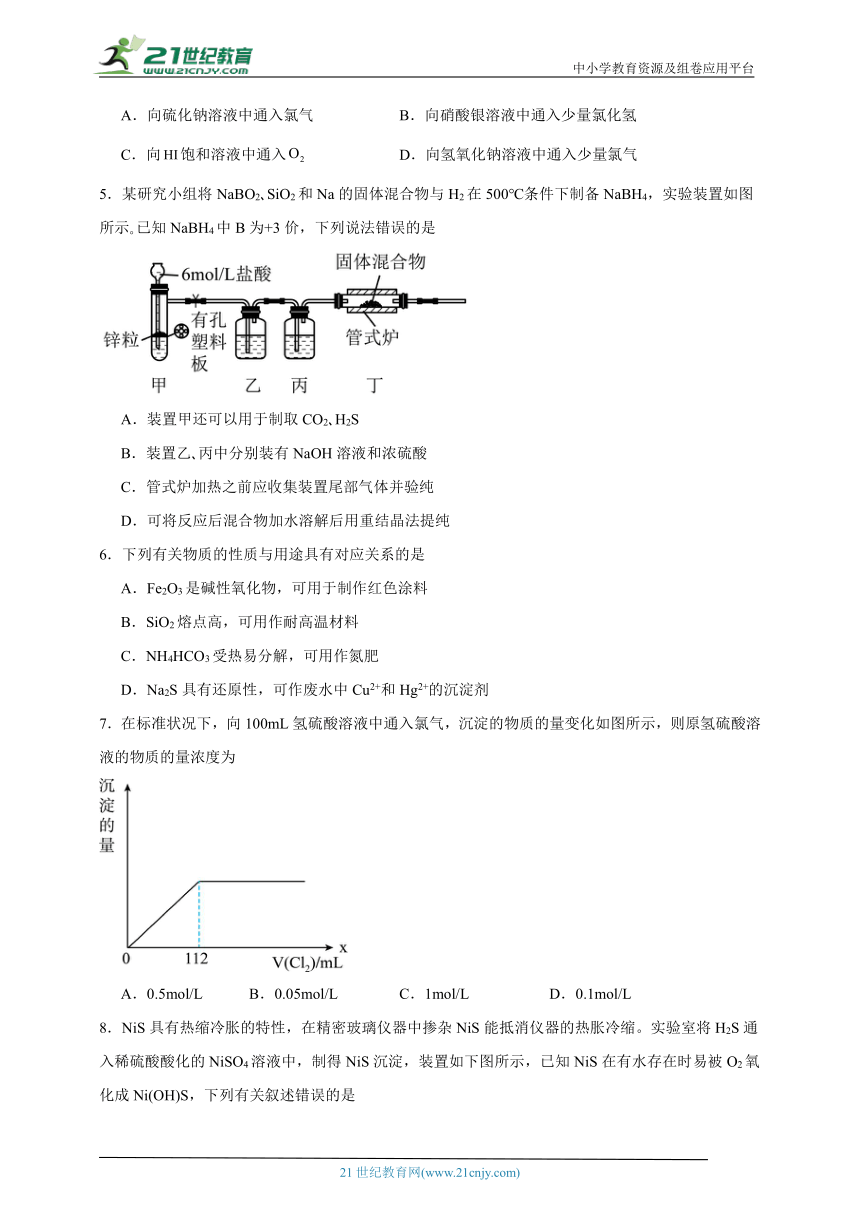
5.某研究小组将NaBO2 SiO2和Na的固体混合物与H2在500℃条件下制备NaBH4,实验装置如图所示 已知NaBH4中B为+3价,下列说法错误的是
A.装置甲还可以用于制取CO2 H2S
B.装置乙 丙中分别装有NaOH溶液和浓硫酸
C.管式炉加热之前应收集装置尾部气体并验纯
D.可将反应后混合物加水溶解后用重结晶法提纯
6.下列有关物质的性质与用途具有对应关系的是
A.Fe2O3是碱性氧化物,可用于制作红色涂料
B.SiO2熔点高,可用作耐高温材料
C.NH4HCO3受热易分解,可用作氮肥
D.Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂
7.在标准状况下,向100mL氢硫酸溶液中通入氯气,沉淀的物质的量变化如图所示,则原氢硫酸溶液的物质的量浓度为
A.0.5mol/L B.0.05mol/L C.1mol/L D.0.1mol/L
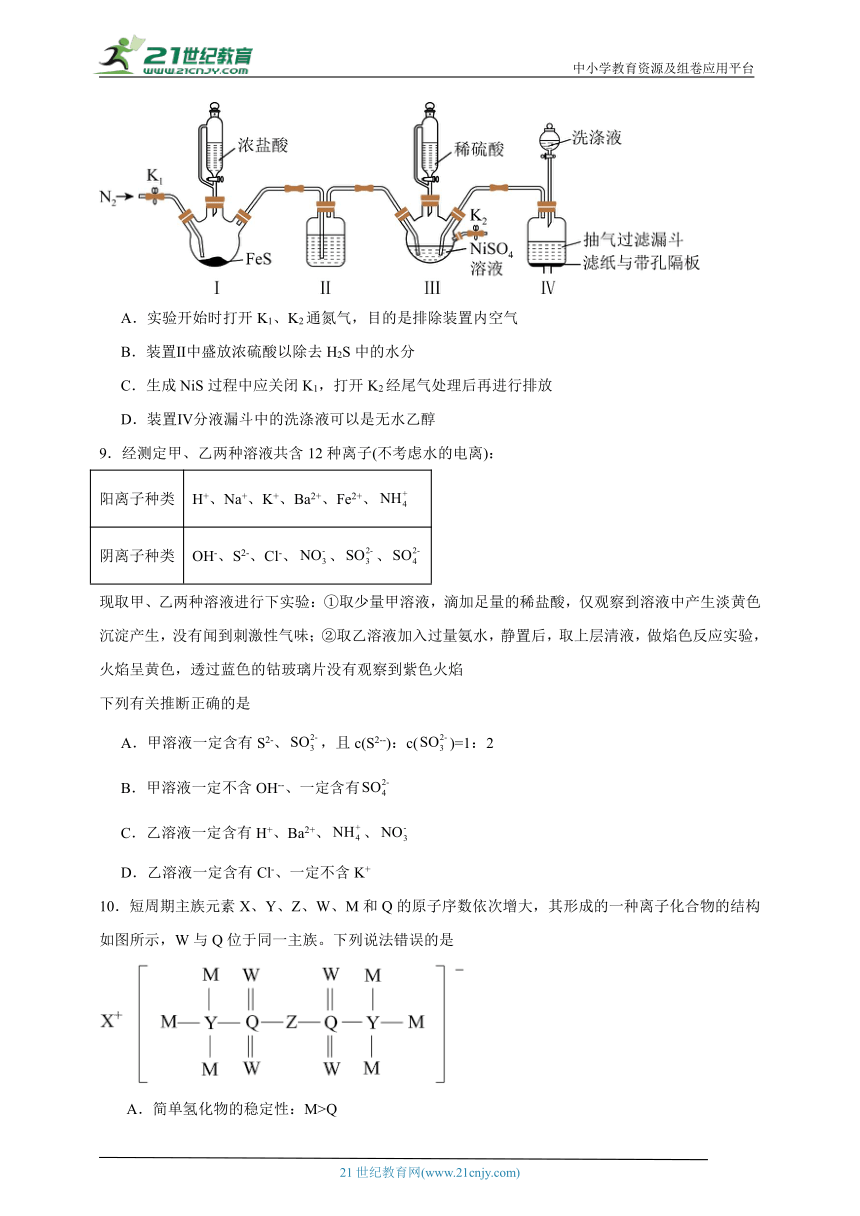
8.NiS具有热缩冷胀的特性,在精密玻璃仪器中掺杂NiS能抵消仪器的热胀冷缩。实验室将H2S通入稀硫酸酸化的NiSO4溶液中,制得NiS沉淀,装置如下图所示,已知NiS在有水存在时易被O2氧化成Ni(OH)S,下列有关叙述错误的是
A.实验开始时打开K1、K2通氮气,目的是排除装置内空气
B.装置Ⅱ中盛放浓硫酸以除去H2S中的水分
C.生成NiS过程中应关闭K1,打开K2经尾气处理后再进行排放
D.装置Ⅳ分液漏斗中的洗涤液可以是无水乙醇
9.经测定甲、乙两种溶液共含12种离子(不考虑水的电离):
阳离子种类 H+、Na+、K+、Ba2+、Fe2+、
阴离子种类 OH-、S2-、Cl-、、、
现取甲、乙两种溶液进行下实验:①取少量甲溶液,滴加足量的稀盐酸,仅观察到溶液中产生淡黄色沉淀产生,没有闻到刺激性气味;②取乙溶液加入过量氨水,静置后,取上层清液,做焰色反应实验,火焰呈黄色,透过蓝色的钴玻璃片没有观察到紫色火焰
下列有关推断正确的是
A.甲溶液一定含有S2-、,且c(S2--):c()=1:2
B.甲溶液一定不含OH--、一定含有
C.乙溶液一定含有H+、Ba2+、、
D.乙溶液一定含有Cl-、一定不含K+
10.短周期主族元素X、Y、Z、W、M和Q的原子序数依次增大,其形成的一种离子化合物的结构如图所示,W与Q位于同一主族。下列说法错误的是
A.简单氢化物的稳定性:M>Q
B.向Q氢化物的水溶液中通入W气体产生黄色沉淀
C.X和Z形成的化合物溶于水得到两种碱
D.该阴离子中所有原子均满足最外层8电子稳定结构
二、解答题
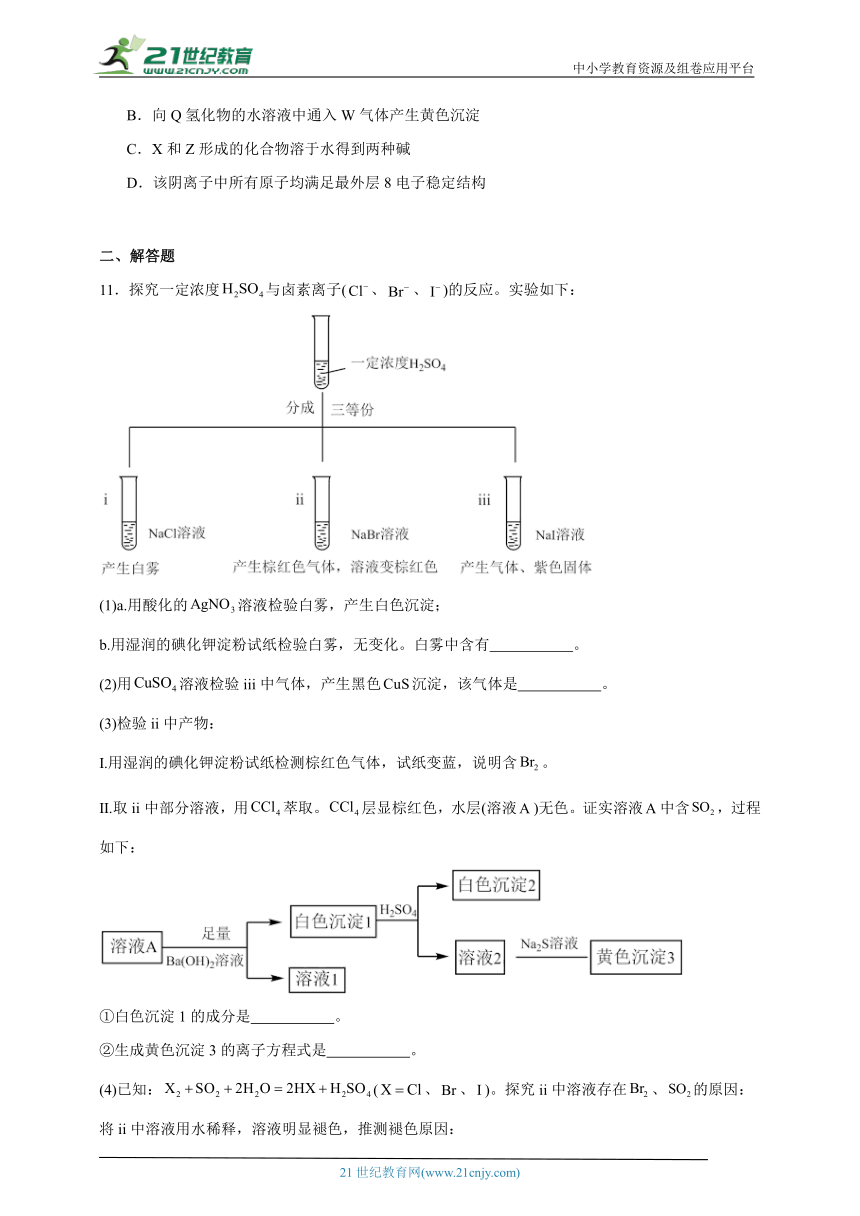
11.探究一定浓度与卤素离子(、、)的反应。实验如下:
(1)a.用酸化的溶液检验白雾,产生白色沉淀;
b.用湿润的碘化钾淀粉试纸检验白雾,无变化。白雾中含有 。
(2)用溶液检验iii中气体,产生黑色沉淀,该气体是 。
(3)检验ii中产物:
Ⅰ.用湿润的碘化钾淀粉试纸检测棕红色气体,试纸变蓝,说明含。
Ⅱ.取ii中部分溶液,用萃取。层显棕红色,水层(溶液)无色。证实溶液中含,过程如下:
①白色沉淀1的成分是 。
②生成黄色沉淀3的离子方程式是 。
(4)已知:(、、)。探究ii中溶液存在、的原因:将ii中溶液用水稀释,溶液明显褪色,推测褪色原因:
a. 与发生了反应。
b.加水稀释导致溶液颜色变浅。
c.与在溶液中发生了反应。
①资料: ,判断 (填“是”或“不是”)主要原因。
②实验证实不是主要原因,所用试剂和现象是 。
可选试剂:溶液、、溶液
③原因成立。稀释前溶液未明显褪色,稀释后明显褪色,试解释原因: 。
(5)实验表明,一定浓度能氧化、,不能氧化,从原子结构角度说明 。
12.Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
请回答:
(1)组成A的三种元素是 ,A的化学式是 。
(2)固体A与足量稀盐酸反应的化学方程式是 。
(3)气体E与甲醛在一定条件下可生成乌洛托品(学名:亚甲基四胺),该反应的化学方程式是 (乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示 。
(2) 若通入水中的Cl2O已过量,设计实验方案检验 。
13.某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质 颜色 水中溶解性
Fe2S3 黑色 难溶于水
FeS 黑褐色 难溶于水
进行如下实验:
实验步骤 操作 现象 备注
1 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 自始至终都未见红褐色沉淀
2 继续滴加3滴0.1 mol/L 硫化钠溶液 同上
3 继续滴加0.1 mol/L 硫化钠溶液至过量 产生黑色沉淀,振荡后静置,未发现明显变化
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 操作 现象
4 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 产生黑色沉淀,未见其它明显现象
5 继续滴加3滴0.1 mol/L 氯化铁溶液 同上
6 继续滴加0.1 mol/L 氯化铁溶液至过量 同上
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论: 。
参考答案:
1.B
【详解】有二氧化硫生成,说明发生了反应2H2S+3O2═2SO2+2H2O,根据反应可知生成6mL二氧化硫消耗硫化氢和氧气的总体积为:6mL×=15mL,其含有硫化氢的体积为:15mL×=6mL;剩余气体体积为:24mL-15mL=9mL,剩余发生反应2H2S+O2═2S↓+2H2O,则反应生成S单质的硫化氢的体积为:9mL×=6mL,所以原混合气体中硫化氢的总体积为:6mL+6mL=12mL,故选B。
点睛:明确发生反应实质为解答关键,注意硫化氢与氧气的反应中,氧气不足时生成S,氧气过量时生成二氧化硫;常温常压下,将24ml的氧气和硫化氢的混合气体点火燃烧,充分冷却反应后到原来状态,测得有6mL二氧化硫生成,根据反应2H2S+3O2═2SO2+2H2O可知,生成6mL二氧化硫消耗硫化氢和氧气的总体积为:6mL× =15mL;剩余的气体发生反应2H2S+O2═2S↓+2H2O,结合反应方程式计算出混合气体中硫化氢的总体积。
2.D
【详解】A.向砂纸打磨后的铝片上滴加浓硝酸,浓硝酸使铝表面重新生成Al2O3,阻止反应的进一步发生,看不到明显的现象,A错误;
B.向品红溶液中通入足量Cl2,溶液褪色,然后加热,溶液仍呈无色,B错误;
C.向Fe2(SO4)3溶液中加入足量铁粉,充分反应后Fe3+全部被还原为Fe2+,滴入KSCN溶液,溶液仍呈无色,C错误;
D.向粗锌粒(含硫化物)中滴入稀硫酸,产生的气体为H2S,通入少量KMnO4稀溶液中,将MnO4-还原为Mn2+,从而使溶液的紫色变浅,D正确;
故选D。
3.A
【详解】A.通常情况下,硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,密度比空气大,能溶于水,A正确;
B.H2S分子中H原子最外层只有2个电子,B错误;
C.FeS沉淀溶于酸,将H2S通入FeSO4溶液,没有沉淀生成,C错误;
D.硫化氢分子不稳定,受热能分解生成S和氢气,D错误;
故选A。
4.C
【详解】A.硫化钠溶液中通入氯气,发生Na2S+Cl2=2NaCl+S↓,Na2S、NaCl均为可溶的盐,离子浓度变化不明显,反应前后,导电能力几乎不变,故A不符合题意;
B.硝酸银溶液中通入少量的氯化氢,发生AgNO3+HCl=AgCl↓+HNO3,AgNO3、HNO3均为可溶的强电解质,反应前后,导电能力几乎不变,故B不符合题意;
C.向HI中溶液氧气,发生4HI+O2=2H2O+2I2,溶液中离子浓度减小,导电能力明显减弱,故C符合题意;
D.向氢氧化钠溶液中通入氯气,发生2NaOH+Cl2=NaCl+NaClO+H2O,NaOH、NaCl、NaClO均为可溶的强电解质,反应前后离子浓度变化不明显,即反应前后导电能力变化不明显,故D不符合题意;
答案为C。
5.D
【分析】盐酸与锌反应生成氢气,由于盐酸具有挥发性,制取的氢气中含有氯化氢和水蒸气,故通过装置乙中的氢氧化钠溶液除去氯化氢杂质,在通过装置丙中的浓硫酸干燥除去水蒸气,干燥的氢气通入管式炉中一段时间后,对管式炉尾部流出的气体先验纯,再对管式炉进行加热,让氢气与NaBO2 SiO2和Na固体混合物在500℃条件下反应制备NaBH4,反应方程式为:NaBO2+2SiO2+4Na+2H2NaBH4+2Na2SiO3,据此分析解答。
【详解】A.装置甲为块状固体与液体不加热反应制气体的装置,可以看做启普发生器的简易装置,实验室用大理石或石灰石与稀盐酸反应制取二氧化碳,用硫化亚铁固体与稀盐酸或稀硫酸反应制取硫化氢,都属于块状固体与液体不加热反应制气体,装置甲可以用于制取CO2 H2S,故A正确;
B.根据分析装置乙 丙分别用于除去氢气中混有的氯化氢和水蒸气,NaOH溶液可与氯化氢反应,浓硫酸具有吸水性,故B正确;
C.氢气通入管式炉中与NaBO2 SiO2和Na固体混合物在500℃条件下反应制备NaBH4,高温下,管式炉中若含有空气,氢气与氧气反应会引发爆炸,则管式炉加热之前应收集装置尾部气体并验纯,故C正确;
D.根据分析,管式炉中发生的反应化学方程式为:NaBO2+2SiO2+4Na+2H2NaBH4+2Na2SiO3,NaBH4中B为+3价,则H为-1价,将反应后混合物加水溶解后,NaBH4可与水发生反应:NaBH4+2H2O=NaBO2+4H2↑,无法做到NaBH4提纯,故D错误;
答案选D。
6.B
【详解】A. Fe2O3是碱性氧化物与可用于制作红色涂料没有关系,A错误;B. SiO2熔点高,可用作耐高温材料,B正确;C. NH4HCO3受热易分解与可用作氮肥没有关系,C错误;D. Na2S可作废水中Cu2+和Hg2+的沉淀剂,发生的是复分解反应,与具有还原性没有关系,D错误,答案选B。
7.B
【分析】向氢硫酸溶液中通入氯气,发生的反应为H2S+Cl2=S↓+2HCl,结合图象分析计算。
【详解】在标准状况下,向100mL氢硫酸溶液中通入氯气,发生的反应为:H2S+Cl2=S↓+2HCl,图中反应生成S沉淀最大量时,消耗的氯气的物质的量为=510-3 mol,则H2S的物质的量为510-3 mol,则硫酸溶液的物质的量浓度为=0.05mol/L,B项正确;
答案选B。
8.B
【分析】实验前先通入N2,排除装置中空气的干扰。装置I中FeS与浓盐酸制取H2S,浓盐酸易挥发,制取的H2S中混有HCl,需要用装置II中的试剂除去,该试剂可以为饱和NaHS溶液;装置III用于制备NiS,装置IV连接抽气泵可将装置III中的浑浊液吸入装置IV中,为了避免NiS被氧化,装置IV中的洗涤液应用煮沸过的蒸馏水。
【详解】A.实验开始时打开K1、K2通入N2,目的是排除装置内空气,防止H2S被空气氧化,故A正确;
B.装置Ⅱ的作用是除去H2S中的HCl杂质,该试剂是饱和NaHS溶液,而不是浓硫酸,故B错误;
C.生成NiS过程中应关闭K1,而反应产生的尾气中含有未反应的H2S,H2S是有毒气体,会造成大气污染,应该是经尾气处理后再进行排放,故C正确;
D.为了减少在洗涤过程中NiS的损失及氧化变质,可以利用沸点比较低的易挥发的乙醇作洗涤剂,减少洗涤时间,故D正确;
故选B。
9.D
【详解】①取少量甲溶液,滴加足量的稀盐酸溶液,仅看到溶液中有淡黄色沉淀产生,没有闻到刺激性气味的气体,生成的沉淀为S,说明溶液中含有S2-、,二者恰好发生反应:2S2-++6H+=3S↓+3H2O,因存在S2-、,则溶液中一定没有Ba2+,二者应存在于碱性溶液中,则溶液中一定没有H+、Fe2+、;
②取乙溶液,进行焰色反应,火焰为黄色,透过蓝色钴玻璃观察不到紫色火焰,说明溶液中含有Na+,没有K+,根据①分析知:乙溶液中存在Na+、Ba2+、H+、Fe2+、,则一定不存在,应在甲溶液中,H+、Fe2+与会发生氧化还原反应,所以在甲溶液中,根据溶液电中性,乙溶液中应还有阴离子Cl-,由以上分析可知,甲中含有K+、S2-、、、OH-、;乙溶液中存在Na+、Ba2+、、H+,Fe2+、Cl-;
A.甲溶液中一定含有S2-、,仅看到溶液中有淡黄色沉淀产生,没有闻到刺激性气味的气体,说明二者恰好发生反应,生成的沉淀为S,根据2S2-++6H+=3S↓+3H2O,c(S2--):c()=2:1,故A错误;
B.甲中含有K+、S2-、、、OH-、,在甲中含OH-,故B错误;
C.乙溶液中存在Na+、Ba2+、、H+,Fe2+、Cl-,在甲溶液中,故C错误;
D.乙溶液中存在Na+、Ba2+、、H+,Fe2+、Cl-,乙溶液中一定含有Cl-,一定不含K+,故D正确;
故选D。
10.D
【分析】短周期主族元素X、Y、Z、W、M和Q的原子序数依次增大,由离子化合物中X为+1价阳离子,阴离子中Y、W、M、Q形成的共价键分别为4、2、1、6,结合W与Q位于同一主族可知,X为Li元素、Y为C元素、Z为N元素、W为O元素、M为F元素、Q为S元素。
【详解】A.元素的非金属性越强,简单氢化物的稳定性越强,氟元素的非金属性强于硫元素,则氟化氢的稳定性强于硫化氢,故A正确;
B.氢硫酸溶液能与氧气反应生成黄色沉淀硫和水,故B正确;
C.氮化锂与水反应生成氢氧化锂和氨水,生成物氢氧化锂和氨水都是碱,故C正确;
D.阴离子中硫原子的最外层电子数为12,不满足最外层8电子稳定结构,故D错误;
故选D。
11.(1)HCl
(2)H2S
(3) 硫酸钡和亚硫酸钡 SO2+2S2-+4H+=3S↓+2H2O
(4) 不是 ,层显示棕红色 降低硫酸浓度,减小其氧化性
(5)氯原子半径小,氯元素非金属性质强,其阴离子还原性弱
【分析】卤素离子有还原性,一定浓度的硫酸有氧化性,但是不同的卤离子的还原性的强弱不同,通过本实验验证了不同的卤素离子的还原性强弱,并对不同的产物进行了验证,以此解题。
【详解】(1)用溶液检验白雾,产生白色沉淀,则白雾中可能含有Cl2,HCl,用湿润的KI淀粉试纸检验无变化,则白雾中没有Cl2,因为Cl2+2I-=I2+2Cl-,淀粉遇碘单质变蓝;
(2)因为用CuSO4检验会产生CuS沉淀,则白雾中含有-2价的S,因为产生紫色固体(I2),即硫酸和碘化钠发生氧化还原反应,碘元素化合价由-1价升高到0价,则硫元素化合价由+6价降到-2价,所以气体可能是H2S;
(3)①溶液A应该有硫酸根离子,可能有二氧化硫,故向其中加入氢氧化钡后产生的白色沉淀1中应该是硫酸钡和亚硫酸钡,再加入硫酸后,形成的溶液2中应该含有二氧化硫或者亚硫酸,这样加入硫化钠后才能生成黄色沉淀3,同时也证明了溶液A中含有二氧化硫;
②黄色沉淀3是硫单质,这是-2价硫和+4价硫归中反应后生成的,其离子方程式是SO2+2S2-+4H+=3S↓+2H2O;
(4)①反应 常数比较小,则反应不易发生,故a不是主要原因;
②溴和水的反应是可逆反应,若b是主要原因,则溶液中存在溴单质,这时加入萃取,层显示棕红色;
③稀释前硫酸浓度较大,通过本实验可以知道,这个浓度的硫酸可以氧化溴离子变成溴单质,故答案为:降低硫酸浓度,减小其氧化性;
(5)非金属性越强,其阴离子的还原性越弱,故答案为:氯原子半径小,氯元素非金属性质强,其阴离子还原性弱。
12. Ca、H和N Ca2HN Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl 4NH3+6HCHO→(或C6H12N4)+6H2O 2H2S+Cl2O=2S↓+2HCl+H2O 用玻璃棒蘸取清液,点到KI 淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量
【分析】Ⅰ.由溶液C焰色反应为砖红色可知,溶液C中含有钙元素,由气体E能使湿润的红色石蕊试纸变蓝可知,气体E为氨气,则C中含有氯化铵,C为氯化钙和氯化铵的混合溶液,则固体A中含有钙元素和氮元素,由固体A与足量盐酸反应结合质量守恒定律可知,气体B为氢气,固体A中还含有氢元素,则固体A中含有Ca、N和H三种元素。
Ⅱ.由题意可知,H2S和Cl2O发生氧化还原反应生成硫、氯化氢和水,反应中H2S中硫元素化合价升高被氧化,Cl2O中氯元素化合价降低被还原。
【详解】Ⅰ.(1)由分析可知,组成A的三种元素是Ca、N和H,由钙原子个数守恒可知,固体A中钙的物质的量为=0.04mol,质量为0.04mol×40g/mol=1.6g,固体A与足量盐酸反应时,固体A中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,由得失电子数目守恒和原子个数守恒可知,固体A中氢的物质的量为×2×=0.02mol,质量为0.02mol×1g/mol=0.02g,则固体A中氮的物质的量为=0.02mol,A中Ca、N和H的物质的量比为0.04mol: 0.02mol: 0.02mol=2:1:1,化学式为Ca2HN,故答案为:Ca、H和N ;Ca2HN;
(2)Ca2HN与足量盐酸反应时,Ca2HN中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,反应生成氯化钙、氯化铵和氢气,反应的化学方程式为Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl,故答案为:Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl;
(3)氨气与甲醛反应生成和水,反应的化学方程式为4NH3+6HCHO→(或C6H12N4)+6H2O,故答案为4NH3+6HCHO→(或C6H12N4)+6H2O;
Ⅱ.(1)由三颈瓶中出现淡黄色沉淀,溶液呈强酸性可知,H2S和Cl2O发生氧化还原反应生成硫、氯化氢和水,反应的化学方程式为2H2S+Cl2O=2S↓+2HCl+H2O,故答案为:2H2S+Cl2O=2S↓+2HCl+H2O;
(2) Cl2O具有强氧化性,若通入水中的Cl2O已过量,过量的Cl2O能与碘化钾溶液反应生成单质碘,单质碘能使淀粉溶液变蓝色,则检验Cl2O已过量的实验方案为用玻璃棒蘸取清液,点到KI 淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量,故答案为:用玻璃棒蘸取清液,点到KI 淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量。
13.(1)2Fe3++3S2-=Fe2S3↓
(2) 氧化还原 Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应
(3)Fe2S3+4Fe3+=3S↓+6Fe2+
(4)Fe3+量不足,不能氧化Fe2S3;而且体系中S2-不能还原Fe2S3,所以不能生成S
(5)合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS。
(6)Fe3+与 S2-发生复分解反应
【分析】根据题意,某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应,有三种可能:a.Fe3+与 S2-发生复分解反应;b.Fe3+与 S2-发生氧化还原反应;c.Fe3+与 S2-发生互促水解反应。
【详解】(1)依据预测a ,该反应的离子方程式为2Fe3++3S2-=Fe2S3↓;故答案为:2Fe3++3S2-=Fe2S3↓;
(2)铁离子具有氧化性,硫离子具有还原性,可能发生氧化还原反应;Fe3+中Fe元素处于高价,可以降低,体现氧化性; S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应;故答案为:氧化还原反应 ;Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应;
(3)黑色沉淀为硫化铁,发生氧化还原反应,生成硫单质沉淀,转变为黄色沉淀,离子方程式为Fe2S3+4Fe3+=3S↓+6Fe2+;故答案为:Fe2S3+4Fe3+=3S↓+6Fe2+;
(4)步骤4与步骤1的区别是氯化铁溶液和硫化钠溶液的用量不同,Fe3+量不足,不能氧化Fe2S3;而且体系中S2-不能还原Fe2S3,所以不能生成S;故答案为:Fe3+量不足,不能氧化Fe2S3;而且体系中S2-不能还原Fe2S3,所以不能生成S;
(5)依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS,因此黑色沉淀中可能有FeS的想法是合理的;故答案为:合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS。;
(6)根据上述分析,Fe3+与 S2-发生复分解反应。故答案为:Fe3+与 S2-发生复分解反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
硫化氢与硫化物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在常温常压下, 24mL H2S和O2的混合气点火燃烧, 生成6mL SO2时,剩余气体中不含氧气,则原混合气中H2S的体积为
A.6mL B.12mL C.15mL D.18mL
2.下列实验预测现象与实际相符的是
选项 实验 预测现象
A 向砂纸打磨后的铝片上滴加浓硝酸 铝片逐渐溶解,产生红棕色气体
B 向品红溶液中通入足量Cl2,然后加热 溶液红色褪去,加热后恢复红色
C 向Fe2(SO4)3溶液中加入足量铁粉,充分反应后滴入KSCN溶液 溶液黄色逐渐褪去,滴入KSCN溶液后溶液变红
D 向粗锌粒(含硫化物)中滴入稀硫酸,产生的气体通入少量KMnO4稀溶液中 KMnO4稀溶液紫色逐渐变浅
A.A B.B C.C D.D
3.自然界中的分解者可将含硫有机物分解为H2S,硫磺细菌和硫化细菌可将H2S进一步变为硫单质或硫酸盐,下列关于硫化氢说法正确的是
A.H2S是一种无色臭鸡蛋气味的有毒气体
B.H2S分子中所有原子的最外层都达到8电子结构
C.将H2S通入FeSO4溶液,产生沉淀
D.H2S分子很稳定,受热难分解
4.用如图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是
A.向硫化钠溶液中通入氯气 B.向硝酸银溶液中通入少量氯化氢
C.向饱和溶液中通入 D.向氢氧化钠溶液中通入少量氯气
5.某研究小组将NaBO2 SiO2和Na的固体混合物与H2在500℃条件下制备NaBH4,实验装置如图所示 已知NaBH4中B为+3价,下列说法错误的是
A.装置甲还可以用于制取CO2 H2S
B.装置乙 丙中分别装有NaOH溶液和浓硫酸
C.管式炉加热之前应收集装置尾部气体并验纯
D.可将反应后混合物加水溶解后用重结晶法提纯
6.下列有关物质的性质与用途具有对应关系的是
A.Fe2O3是碱性氧化物,可用于制作红色涂料
B.SiO2熔点高,可用作耐高温材料
C.NH4HCO3受热易分解,可用作氮肥
D.Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂
7.在标准状况下,向100mL氢硫酸溶液中通入氯气,沉淀的物质的量变化如图所示,则原氢硫酸溶液的物质的量浓度为
A.0.5mol/L B.0.05mol/L C.1mol/L D.0.1mol/L
8.NiS具有热缩冷胀的特性,在精密玻璃仪器中掺杂NiS能抵消仪器的热胀冷缩。实验室将H2S通入稀硫酸酸化的NiSO4溶液中,制得NiS沉淀,装置如下图所示,已知NiS在有水存在时易被O2氧化成Ni(OH)S,下列有关叙述错误的是
A.实验开始时打开K1、K2通氮气,目的是排除装置内空气
B.装置Ⅱ中盛放浓硫酸以除去H2S中的水分
C.生成NiS过程中应关闭K1,打开K2经尾气处理后再进行排放
D.装置Ⅳ分液漏斗中的洗涤液可以是无水乙醇
9.经测定甲、乙两种溶液共含12种离子(不考虑水的电离):
阳离子种类 H+、Na+、K+、Ba2+、Fe2+、
阴离子种类 OH-、S2-、Cl-、、、
现取甲、乙两种溶液进行下实验:①取少量甲溶液,滴加足量的稀盐酸,仅观察到溶液中产生淡黄色沉淀产生,没有闻到刺激性气味;②取乙溶液加入过量氨水,静置后,取上层清液,做焰色反应实验,火焰呈黄色,透过蓝色的钴玻璃片没有观察到紫色火焰
下列有关推断正确的是
A.甲溶液一定含有S2-、,且c(S2--):c()=1:2
B.甲溶液一定不含OH--、一定含有
C.乙溶液一定含有H+、Ba2+、、
D.乙溶液一定含有Cl-、一定不含K+
10.短周期主族元素X、Y、Z、W、M和Q的原子序数依次增大,其形成的一种离子化合物的结构如图所示,W与Q位于同一主族。下列说法错误的是
A.简单氢化物的稳定性:M>Q
B.向Q氢化物的水溶液中通入W气体产生黄色沉淀
C.X和Z形成的化合物溶于水得到两种碱
D.该阴离子中所有原子均满足最外层8电子稳定结构
二、解答题
11.探究一定浓度与卤素离子(、、)的反应。实验如下:
(1)a.用酸化的溶液检验白雾,产生白色沉淀;
b.用湿润的碘化钾淀粉试纸检验白雾,无变化。白雾中含有 。
(2)用溶液检验iii中气体,产生黑色沉淀,该气体是 。
(3)检验ii中产物:
Ⅰ.用湿润的碘化钾淀粉试纸检测棕红色气体,试纸变蓝,说明含。
Ⅱ.取ii中部分溶液,用萃取。层显棕红色,水层(溶液)无色。证实溶液中含,过程如下:
①白色沉淀1的成分是 。
②生成黄色沉淀3的离子方程式是 。
(4)已知:(、、)。探究ii中溶液存在、的原因:将ii中溶液用水稀释,溶液明显褪色,推测褪色原因:
a. 与发生了反应。
b.加水稀释导致溶液颜色变浅。
c.与在溶液中发生了反应。
①资料: ,判断 (填“是”或“不是”)主要原因。
②实验证实不是主要原因,所用试剂和现象是 。
可选试剂:溶液、、溶液
③原因成立。稀释前溶液未明显褪色,稀释后明显褪色,试解释原因: 。
(5)实验表明,一定浓度能氧化、,不能氧化,从原子结构角度说明 。
12.Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
请回答:
(1)组成A的三种元素是 ,A的化学式是 。
(2)固体A与足量稀盐酸反应的化学方程式是 。
(3)气体E与甲醛在一定条件下可生成乌洛托品(学名:亚甲基四胺),该反应的化学方程式是 (乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示 。
(2) 若通入水中的Cl2O已过量,设计实验方案检验 。
13.某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质 颜色 水中溶解性
Fe2S3 黑色 难溶于水
FeS 黑褐色 难溶于水
进行如下实验:
实验步骤 操作 现象 备注
1 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 自始至终都未见红褐色沉淀
2 继续滴加3滴0.1 mol/L 硫化钠溶液 同上
3 继续滴加0.1 mol/L 硫化钠溶液至过量 产生黑色沉淀,振荡后静置,未发现明显变化
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 操作 现象
4 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 产生黑色沉淀,未见其它明显现象
5 继续滴加3滴0.1 mol/L 氯化铁溶液 同上
6 继续滴加0.1 mol/L 氯化铁溶液至过量 同上
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论: 。
参考答案:
1.B
【详解】有二氧化硫生成,说明发生了反应2H2S+3O2═2SO2+2H2O,根据反应可知生成6mL二氧化硫消耗硫化氢和氧气的总体积为:6mL×=15mL,其含有硫化氢的体积为:15mL×=6mL;剩余气体体积为:24mL-15mL=9mL,剩余发生反应2H2S+O2═2S↓+2H2O,则反应生成S单质的硫化氢的体积为:9mL×=6mL,所以原混合气体中硫化氢的总体积为:6mL+6mL=12mL,故选B。
点睛:明确发生反应实质为解答关键,注意硫化氢与氧气的反应中,氧气不足时生成S,氧气过量时生成二氧化硫;常温常压下,将24ml的氧气和硫化氢的混合气体点火燃烧,充分冷却反应后到原来状态,测得有6mL二氧化硫生成,根据反应2H2S+3O2═2SO2+2H2O可知,生成6mL二氧化硫消耗硫化氢和氧气的总体积为:6mL× =15mL;剩余的气体发生反应2H2S+O2═2S↓+2H2O,结合反应方程式计算出混合气体中硫化氢的总体积。
2.D
【详解】A.向砂纸打磨后的铝片上滴加浓硝酸,浓硝酸使铝表面重新生成Al2O3,阻止反应的进一步发生,看不到明显的现象,A错误;
B.向品红溶液中通入足量Cl2,溶液褪色,然后加热,溶液仍呈无色,B错误;
C.向Fe2(SO4)3溶液中加入足量铁粉,充分反应后Fe3+全部被还原为Fe2+,滴入KSCN溶液,溶液仍呈无色,C错误;
D.向粗锌粒(含硫化物)中滴入稀硫酸,产生的气体为H2S,通入少量KMnO4稀溶液中,将MnO4-还原为Mn2+,从而使溶液的紫色变浅,D正确;
故选D。
3.A
【详解】A.通常情况下,硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,密度比空气大,能溶于水,A正确;
B.H2S分子中H原子最外层只有2个电子,B错误;
C.FeS沉淀溶于酸,将H2S通入FeSO4溶液,没有沉淀生成,C错误;
D.硫化氢分子不稳定,受热能分解生成S和氢气,D错误;
故选A。
4.C
【详解】A.硫化钠溶液中通入氯气,发生Na2S+Cl2=2NaCl+S↓,Na2S、NaCl均为可溶的盐,离子浓度变化不明显,反应前后,导电能力几乎不变,故A不符合题意;
B.硝酸银溶液中通入少量的氯化氢,发生AgNO3+HCl=AgCl↓+HNO3,AgNO3、HNO3均为可溶的强电解质,反应前后,导电能力几乎不变,故B不符合题意;
C.向HI中溶液氧气,发生4HI+O2=2H2O+2I2,溶液中离子浓度减小,导电能力明显减弱,故C符合题意;
D.向氢氧化钠溶液中通入氯气,发生2NaOH+Cl2=NaCl+NaClO+H2O,NaOH、NaCl、NaClO均为可溶的强电解质,反应前后离子浓度变化不明显,即反应前后导电能力变化不明显,故D不符合题意;
答案为C。
5.D
【分析】盐酸与锌反应生成氢气,由于盐酸具有挥发性,制取的氢气中含有氯化氢和水蒸气,故通过装置乙中的氢氧化钠溶液除去氯化氢杂质,在通过装置丙中的浓硫酸干燥除去水蒸气,干燥的氢气通入管式炉中一段时间后,对管式炉尾部流出的气体先验纯,再对管式炉进行加热,让氢气与NaBO2 SiO2和Na固体混合物在500℃条件下反应制备NaBH4,反应方程式为:NaBO2+2SiO2+4Na+2H2NaBH4+2Na2SiO3,据此分析解答。
【详解】A.装置甲为块状固体与液体不加热反应制气体的装置,可以看做启普发生器的简易装置,实验室用大理石或石灰石与稀盐酸反应制取二氧化碳,用硫化亚铁固体与稀盐酸或稀硫酸反应制取硫化氢,都属于块状固体与液体不加热反应制气体,装置甲可以用于制取CO2 H2S,故A正确;
B.根据分析装置乙 丙分别用于除去氢气中混有的氯化氢和水蒸气,NaOH溶液可与氯化氢反应,浓硫酸具有吸水性,故B正确;
C.氢气通入管式炉中与NaBO2 SiO2和Na固体混合物在500℃条件下反应制备NaBH4,高温下,管式炉中若含有空气,氢气与氧气反应会引发爆炸,则管式炉加热之前应收集装置尾部气体并验纯,故C正确;
D.根据分析,管式炉中发生的反应化学方程式为:NaBO2+2SiO2+4Na+2H2NaBH4+2Na2SiO3,NaBH4中B为+3价,则H为-1价,将反应后混合物加水溶解后,NaBH4可与水发生反应:NaBH4+2H2O=NaBO2+4H2↑,无法做到NaBH4提纯,故D错误;
答案选D。
6.B
【详解】A. Fe2O3是碱性氧化物与可用于制作红色涂料没有关系,A错误;B. SiO2熔点高,可用作耐高温材料,B正确;C. NH4HCO3受热易分解与可用作氮肥没有关系,C错误;D. Na2S可作废水中Cu2+和Hg2+的沉淀剂,发生的是复分解反应,与具有还原性没有关系,D错误,答案选B。
7.B
【分析】向氢硫酸溶液中通入氯气,发生的反应为H2S+Cl2=S↓+2HCl,结合图象分析计算。
【详解】在标准状况下,向100mL氢硫酸溶液中通入氯气,发生的反应为:H2S+Cl2=S↓+2HCl,图中反应生成S沉淀最大量时,消耗的氯气的物质的量为=510-3 mol,则H2S的物质的量为510-3 mol,则硫酸溶液的物质的量浓度为=0.05mol/L,B项正确;
答案选B。
8.B
【分析】实验前先通入N2,排除装置中空气的干扰。装置I中FeS与浓盐酸制取H2S,浓盐酸易挥发,制取的H2S中混有HCl,需要用装置II中的试剂除去,该试剂可以为饱和NaHS溶液;装置III用于制备NiS,装置IV连接抽气泵可将装置III中的浑浊液吸入装置IV中,为了避免NiS被氧化,装置IV中的洗涤液应用煮沸过的蒸馏水。
【详解】A.实验开始时打开K1、K2通入N2,目的是排除装置内空气,防止H2S被空气氧化,故A正确;
B.装置Ⅱ的作用是除去H2S中的HCl杂质,该试剂是饱和NaHS溶液,而不是浓硫酸,故B错误;
C.生成NiS过程中应关闭K1,而反应产生的尾气中含有未反应的H2S,H2S是有毒气体,会造成大气污染,应该是经尾气处理后再进行排放,故C正确;
D.为了减少在洗涤过程中NiS的损失及氧化变质,可以利用沸点比较低的易挥发的乙醇作洗涤剂,减少洗涤时间,故D正确;
故选B。
9.D
【详解】①取少量甲溶液,滴加足量的稀盐酸溶液,仅看到溶液中有淡黄色沉淀产生,没有闻到刺激性气味的气体,生成的沉淀为S,说明溶液中含有S2-、,二者恰好发生反应:2S2-++6H+=3S↓+3H2O,因存在S2-、,则溶液中一定没有Ba2+,二者应存在于碱性溶液中,则溶液中一定没有H+、Fe2+、;
②取乙溶液,进行焰色反应,火焰为黄色,透过蓝色钴玻璃观察不到紫色火焰,说明溶液中含有Na+,没有K+,根据①分析知:乙溶液中存在Na+、Ba2+、H+、Fe2+、,则一定不存在,应在甲溶液中,H+、Fe2+与会发生氧化还原反应,所以在甲溶液中,根据溶液电中性,乙溶液中应还有阴离子Cl-,由以上分析可知,甲中含有K+、S2-、、、OH-、;乙溶液中存在Na+、Ba2+、、H+,Fe2+、Cl-;
A.甲溶液中一定含有S2-、,仅看到溶液中有淡黄色沉淀产生,没有闻到刺激性气味的气体,说明二者恰好发生反应,生成的沉淀为S,根据2S2-++6H+=3S↓+3H2O,c(S2--):c()=2:1,故A错误;
B.甲中含有K+、S2-、、、OH-、,在甲中含OH-,故B错误;
C.乙溶液中存在Na+、Ba2+、、H+,Fe2+、Cl-,在甲溶液中,故C错误;
D.乙溶液中存在Na+、Ba2+、、H+,Fe2+、Cl-,乙溶液中一定含有Cl-,一定不含K+,故D正确;
故选D。
10.D
【分析】短周期主族元素X、Y、Z、W、M和Q的原子序数依次增大,由离子化合物中X为+1价阳离子,阴离子中Y、W、M、Q形成的共价键分别为4、2、1、6,结合W与Q位于同一主族可知,X为Li元素、Y为C元素、Z为N元素、W为O元素、M为F元素、Q为S元素。
【详解】A.元素的非金属性越强,简单氢化物的稳定性越强,氟元素的非金属性强于硫元素,则氟化氢的稳定性强于硫化氢,故A正确;
B.氢硫酸溶液能与氧气反应生成黄色沉淀硫和水,故B正确;
C.氮化锂与水反应生成氢氧化锂和氨水,生成物氢氧化锂和氨水都是碱,故C正确;
D.阴离子中硫原子的最外层电子数为12,不满足最外层8电子稳定结构,故D错误;
故选D。
11.(1)HCl
(2)H2S
(3) 硫酸钡和亚硫酸钡 SO2+2S2-+4H+=3S↓+2H2O
(4) 不是 ,层显示棕红色 降低硫酸浓度,减小其氧化性
(5)氯原子半径小,氯元素非金属性质强,其阴离子还原性弱
【分析】卤素离子有还原性,一定浓度的硫酸有氧化性,但是不同的卤离子的还原性的强弱不同,通过本实验验证了不同的卤素离子的还原性强弱,并对不同的产物进行了验证,以此解题。
【详解】(1)用溶液检验白雾,产生白色沉淀,则白雾中可能含有Cl2,HCl,用湿润的KI淀粉试纸检验无变化,则白雾中没有Cl2,因为Cl2+2I-=I2+2Cl-,淀粉遇碘单质变蓝;
(2)因为用CuSO4检验会产生CuS沉淀,则白雾中含有-2价的S,因为产生紫色固体(I2),即硫酸和碘化钠发生氧化还原反应,碘元素化合价由-1价升高到0价,则硫元素化合价由+6价降到-2价,所以气体可能是H2S;
(3)①溶液A应该有硫酸根离子,可能有二氧化硫,故向其中加入氢氧化钡后产生的白色沉淀1中应该是硫酸钡和亚硫酸钡,再加入硫酸后,形成的溶液2中应该含有二氧化硫或者亚硫酸,这样加入硫化钠后才能生成黄色沉淀3,同时也证明了溶液A中含有二氧化硫;
②黄色沉淀3是硫单质,这是-2价硫和+4价硫归中反应后生成的,其离子方程式是SO2+2S2-+4H+=3S↓+2H2O;
(4)①反应 常数比较小,则反应不易发生,故a不是主要原因;
②溴和水的反应是可逆反应,若b是主要原因,则溶液中存在溴单质,这时加入萃取,层显示棕红色;
③稀释前硫酸浓度较大,通过本实验可以知道,这个浓度的硫酸可以氧化溴离子变成溴单质,故答案为:降低硫酸浓度,减小其氧化性;
(5)非金属性越强,其阴离子的还原性越弱,故答案为:氯原子半径小,氯元素非金属性质强,其阴离子还原性弱。
12. Ca、H和N Ca2HN Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl 4NH3+6HCHO→(或C6H12N4)+6H2O 2H2S+Cl2O=2S↓+2HCl+H2O 用玻璃棒蘸取清液,点到KI 淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量
【分析】Ⅰ.由溶液C焰色反应为砖红色可知,溶液C中含有钙元素,由气体E能使湿润的红色石蕊试纸变蓝可知,气体E为氨气,则C中含有氯化铵,C为氯化钙和氯化铵的混合溶液,则固体A中含有钙元素和氮元素,由固体A与足量盐酸反应结合质量守恒定律可知,气体B为氢气,固体A中还含有氢元素,则固体A中含有Ca、N和H三种元素。
Ⅱ.由题意可知,H2S和Cl2O发生氧化还原反应生成硫、氯化氢和水,反应中H2S中硫元素化合价升高被氧化,Cl2O中氯元素化合价降低被还原。
【详解】Ⅰ.(1)由分析可知,组成A的三种元素是Ca、N和H,由钙原子个数守恒可知,固体A中钙的物质的量为=0.04mol,质量为0.04mol×40g/mol=1.6g,固体A与足量盐酸反应时,固体A中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,由得失电子数目守恒和原子个数守恒可知,固体A中氢的物质的量为×2×=0.02mol,质量为0.02mol×1g/mol=0.02g,则固体A中氮的物质的量为=0.02mol,A中Ca、N和H的物质的量比为0.04mol: 0.02mol: 0.02mol=2:1:1,化学式为Ca2HN,故答案为:Ca、H和N ;Ca2HN;
(2)Ca2HN与足量盐酸反应时,Ca2HN中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,反应生成氯化钙、氯化铵和氢气,反应的化学方程式为Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl,故答案为:Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl;
(3)氨气与甲醛反应生成和水,反应的化学方程式为4NH3+6HCHO→(或C6H12N4)+6H2O,故答案为4NH3+6HCHO→(或C6H12N4)+6H2O;
Ⅱ.(1)由三颈瓶中出现淡黄色沉淀,溶液呈强酸性可知,H2S和Cl2O发生氧化还原反应生成硫、氯化氢和水,反应的化学方程式为2H2S+Cl2O=2S↓+2HCl+H2O,故答案为:2H2S+Cl2O=2S↓+2HCl+H2O;
(2) Cl2O具有强氧化性,若通入水中的Cl2O已过量,过量的Cl2O能与碘化钾溶液反应生成单质碘,单质碘能使淀粉溶液变蓝色,则检验Cl2O已过量的实验方案为用玻璃棒蘸取清液,点到KI 淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量,故答案为:用玻璃棒蘸取清液,点到KI 淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量。
13.(1)2Fe3++3S2-=Fe2S3↓
(2) 氧化还原 Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应
(3)Fe2S3+4Fe3+=3S↓+6Fe2+
(4)Fe3+量不足,不能氧化Fe2S3;而且体系中S2-不能还原Fe2S3,所以不能生成S
(5)合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS。
(6)Fe3+与 S2-发生复分解反应
【分析】根据题意,某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应,有三种可能:a.Fe3+与 S2-发生复分解反应;b.Fe3+与 S2-发生氧化还原反应;c.Fe3+与 S2-发生互促水解反应。
【详解】(1)依据预测a ,该反应的离子方程式为2Fe3++3S2-=Fe2S3↓;故答案为:2Fe3++3S2-=Fe2S3↓;
(2)铁离子具有氧化性,硫离子具有还原性,可能发生氧化还原反应;Fe3+中Fe元素处于高价,可以降低,体现氧化性; S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应;故答案为:氧化还原反应 ;Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应;
(3)黑色沉淀为硫化铁,发生氧化还原反应,生成硫单质沉淀,转变为黄色沉淀,离子方程式为Fe2S3+4Fe3+=3S↓+6Fe2+;故答案为:Fe2S3+4Fe3+=3S↓+6Fe2+;
(4)步骤4与步骤1的区别是氯化铁溶液和硫化钠溶液的用量不同,Fe3+量不足,不能氧化Fe2S3;而且体系中S2-不能还原Fe2S3,所以不能生成S;故答案为:Fe3+量不足,不能氧化Fe2S3;而且体系中S2-不能还原Fe2S3,所以不能生成S;
(5)依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS,因此黑色沉淀中可能有FeS的想法是合理的;故答案为:合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS。;
(6)根据上述分析,Fe3+与 S2-发生复分解反应。故答案为:Fe3+与 S2-发生复分解反应。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
