硝酸试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 硝酸试题 高考化学考前专项复习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 697.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
硝酸
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列实验操作及现象能推出相应结论的是
选项 实验操作和现象 实验结论
A 将某样品溶于稀硫酸,并滴加少量的溶液,溶液变红 此样品已部分或全部变质
B 向淀粉溶液中加入适量稀硫酸,加热,冷却后加入过量溶液至碱性,再加少量碘水,溶液不变蓝 淀粉完全水解
C 向溶液中加溶液,再加入几滴溶液,溶液变红 此反应存在限度
D 在圆底烧瓶中加入苯和溴水,震荡后静置,水层颜色变浅 苯和溴水发生了加成反应
A.A B.B C.C D.D
2.常温时,下列实验中的金属单质不会溶解的是
A.K与足量水溶液混合 B.Al与足量NaOH溶液混合
C.Fe与足量浓硫酸混合 D.Ag与足量浓硝酸混合
3.100mL3mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的
A.Na2CO3固体 B.蒸馏水
C.NaNO3溶液 D.1mol/L的硫酸溶液
4.下列化学反应表示正确的是
A.粗硅的制取:
B.氨水与稀硫酸反应的热化学方程式:
C.粉与足量稀硝酸反应的离子方程式:
D.碱性氢氧燃料电池的正极反应式:
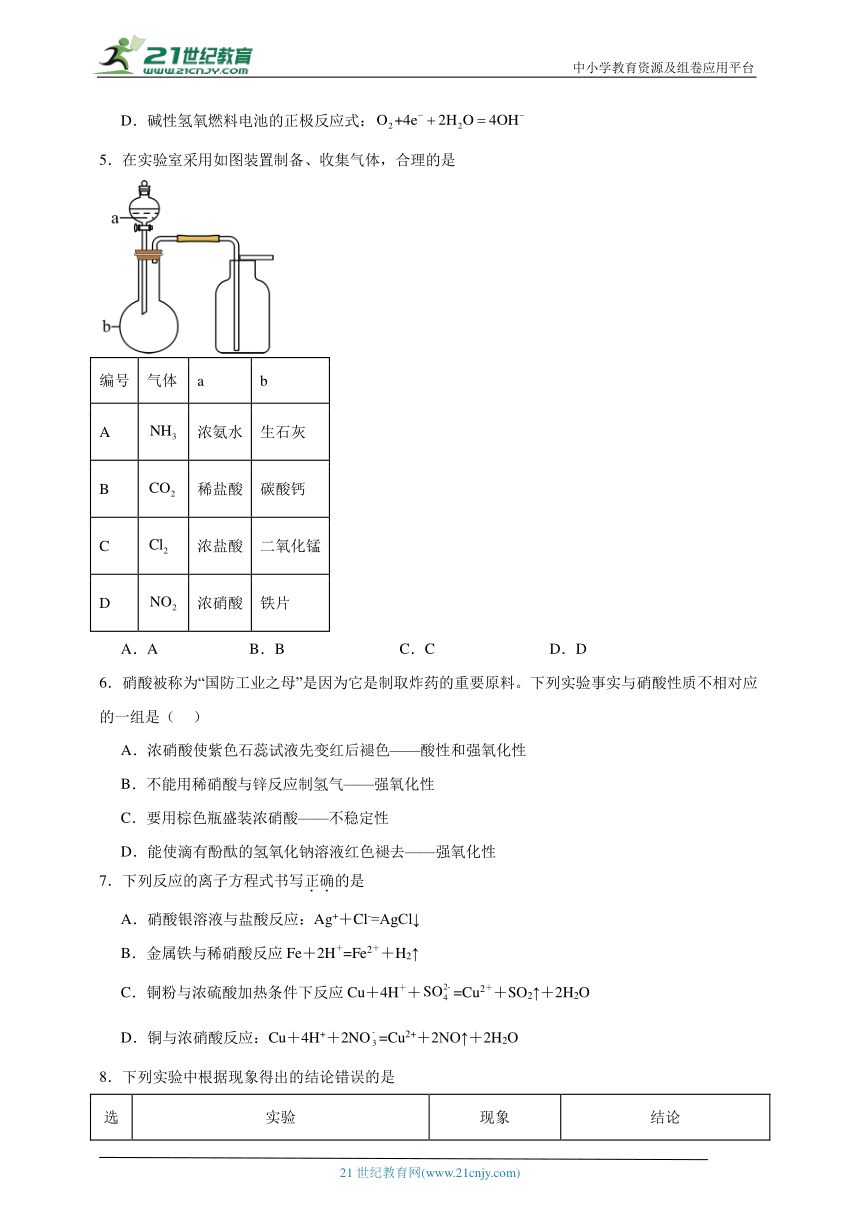
5.在实验室采用如图装置制备、收集气体,合理的是
编号 气体 a b
A 浓氨水 生石灰
B 稀盐酸 碳酸钙
C 浓盐酸 二氧化锰
D 浓硝酸 铁片
A.A B.B C.C D.D
6.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
7.下列反应的离子方程式书写正确的是
A.硝酸银溶液与盐酸反应:Ag++Cl-=AgCl↓
B.金属铁与稀硝酸反应Fe+2H+=Fe2++H2↑
C.铜粉与浓硫酸加热条件下反应Cu+4H++=Cu2++SO2↑+2H2O
D.铜与浓硝酸反应:Cu+4H++2NO=Cu2++2NO↑+2H2O
8.下列实验中根据现象得出的结论错误的是
选项 实验 现象 结论
A 将打磨后的镁条放盛入有稀盐酸的试管中 用手触摸试管外壁感觉变热 镁条与稀盐酸反应是放热反应
B 向某溶液中加铜和稀H2SO4 试管口有红棕色气体产生 原溶液可能含有
C 向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液 品红溶液褪色 该钠盐为Na2SO3或NaHSO3
D 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 先出现蓝色沉淀 Ksp[Mg(OH)2]>Ksp[ Cu(OH)2]
A.A B.B C.C D.D
9.下列反应中,相关示意图错误的是
A.图甲将铁粉加入一定量氯化铜溶液中[w(Cl)表示溶液中Cl的质量分数]
B.图乙将二氧化硫通入一定量新制氯水中
C.图丙将铜粉加入一定量浓硝酸中
D.图丁将氢氧化钠溶液滴入一定量氯化铝溶液中
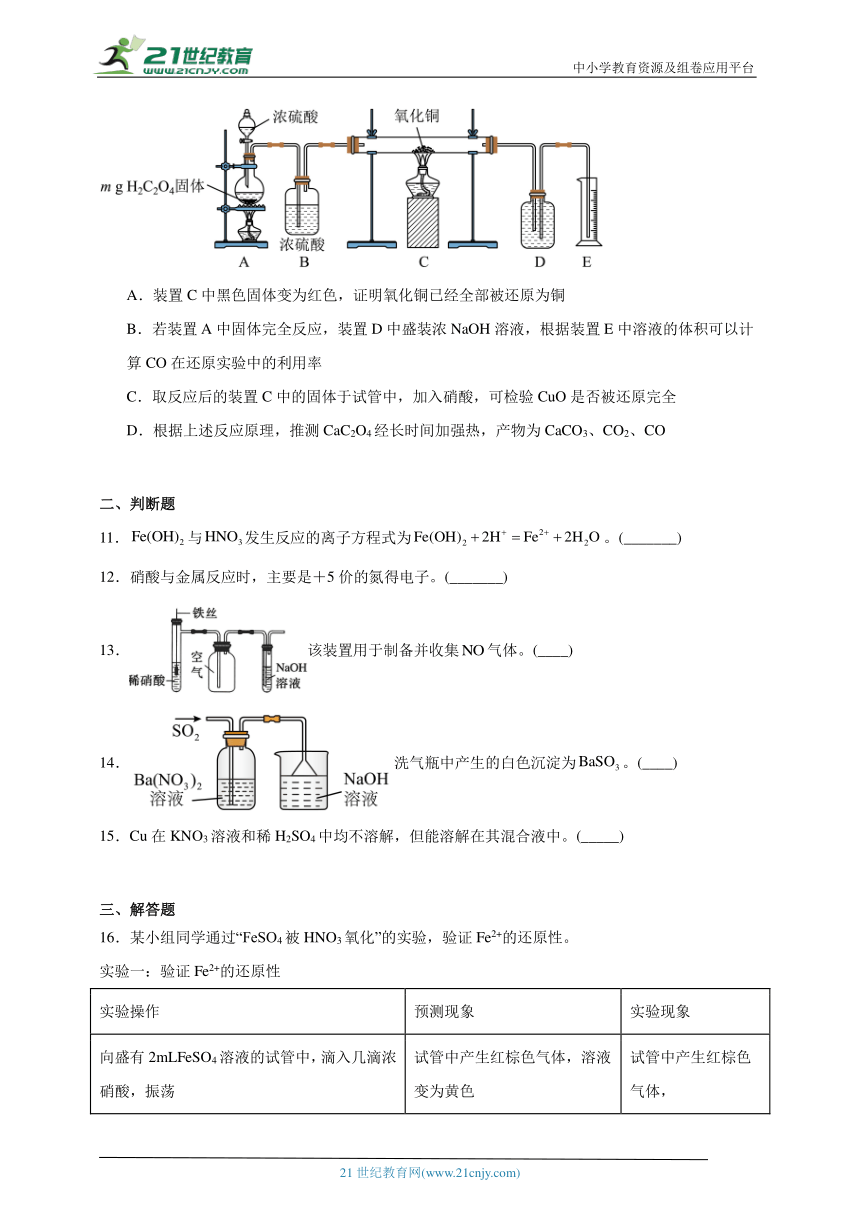
10.实验室用下图所示装置制备CO并用其还原CuO。制备CO的原理为H2C2O4 CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO Cu2O+ CO2,CO +Cu2O 2Cu+CO2。下列说法正确的是
A.装置C中黑色固体变为红色,证明氧化铜已经全部被还原为铜
B.若装置A中固体完全反应,装置D中盛装浓NaOH溶液,根据装置E中溶液的体积可以计算CO在还原实验中的利用率
C.取反应后的装置C中的固体于试管中,加入硝酸,可检验CuO是否被还原完全
D.根据上述反应原理,推测CaC2O4经长时间加强热,产物为CaCO3、CO2、CO
二、判断题
11.与发生反应的离子方程式为。(_______)
12.硝酸与金属反应时,主要是+5价的氮得电子。(_______)
13.该装置用于制备并收集气体。(____)
14.洗气瓶中产生的白色沉淀为。(____)
15.Cu在KNO3溶液和稀H2SO4中均不溶解,但能溶解在其混合液中。(_____)
三、解答题
16.某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 预测现象 实验现象
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 试管中产生红棕色气体,溶液变为黄色 试管中产生红棕色气体, 溶液变为深棕色
(1)红棕色气体是 (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明 。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是 ;
(4)铜与浓硝酸反应的化学方程式是 ;
(5)装置乙的作用是 ;
(6)实验结论是 。
17.硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
(1)后一个C装置的作用是 ,证明气体产物中有NO生成的实验现象是 。
(2)从第一个C装置中逸出的气体成分是 。
(3)溶液中还可能有一种还原产物,这种还原产物可能是 ,请设计实验验证你的猜想 ;并写出生成该还原产物的化学方程式
18.为研究1.0mol/LFe(NO3)3溶液与Cu的反应,甲与乙做了如下实验:将Cu片放入1.0mol/L的Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液变为蓝绿色,由此甲得出结论:Fe(NO3)3溶液中的Fe3+氧化了Cu。而乙认为,Fe(NO3)3溶液显酸性,此酸性条件下,NO3-也能氧化Cu。
(1)甲为证明自己的观点,设计如下实验:
步骤 操作 现象
Ⅰ 取蓝绿色溶液,向其中加入K3[Fe(CN)6]溶液 ……
①请用离子方程式解释,Fe(NO3)3溶液显酸性的原因 。
②证明甲观点正确的现象是 ,Fe3+与Cu反应的离子方程式为 。
(2)乙证明自己的观点,设计如下实验:
步骤 操作 现象
Ⅱ 用pH试纸测定1.0mol/L的Fe(NO3)3溶液的pH值 1.0mol/L的Fe(NO3)3溶液的pH=1
Ⅲ 将1.0mol/L的Fe(NO3)3溶液替换为某种溶液(或混合溶液),加入Cu ……
①下列溶液中,可以用于替换上述Fe(NO3)3溶液的是 (填序号)
a.0.1mol/LHNO3溶液
b.0.1mol/LFeCl3溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合后的溶液
②测定溶液pH值的操作是 。
③乙查阅资料:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生。证明乙观点正确的现象是 。
(3)研究发现,甲和乙的观点都正确。丙得出结论:将Cu片放入1.0mol/L的Fe(NO3)3溶液中,Fe3+和NO3-均氧化的Cu。你是否同意丙的结论,理由是 。
(4)为进一步研究1.0mol/LFe(NO3)3溶液与Cu的反应,甲与乙查阅资料:
水解反应 平衡常数(K)
Fe3++3H2OFe(OH)3+3H+ 7.9×10-4
Fe2++2H2OFe(OH)2+2H+ 3.2×10-10
Cu2++2H2OCu(OH)2+2H+ 3.2×10-7
甲与乙再次将Cu片放入1.0mol/L的Fe(NO3)3溶液中,并监测实验过程中溶液pH值的变化。他们发现Cu片逐渐溶解,溶液变为蓝绿色,且pH值略有上升。由此可以得出结论: 。
参考答案:
1.C
【详解】A.Fe(NO3)2中的硝酸根离子和稀硫酸中的H+会形成硝酸,硝酸具有氧化性,会把Fe2+氧化成Fe3+,此时再加KSCN,溶液一定会红,但不能说明变质,故A错误;
B.过量的NaOH会与碘发生反应,不能说明淀粉水解,故B错误;
C.KI与FeCl3会发生氧化还原反应,再加几滴KSCN溶液,溶液会变浅,说明Fe3+没有完全转化为Fe2+,也说明该反应存在限度,故C正确;
D.苯中没有碳碳双键,和溴水不会发生加成反应,故D错误;
故本题选C。
2.C
【详解】A.K与足量水溶液混合生成可溶性的KOH,反应方程式为:2K+2H2O=2KOH+H2↑,A不合题意;
B.Al与足量NaOH溶液混合生成可溶性的NaAlO2,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,B不合题意;
C.由于Fe在常温下在浓硫酸中发生钝化,故铁不溶于足量的浓硫酸中,C符合题意;
D.Ag与足量浓硝酸混合生成可溶性的AgNO3,反应方程式为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O,D不合题意;
故答案为:C。
3.B
【详解】A. Na2CO3固体与硫酸反应,减少氢气的产量,故A不符;
B. 蒸馏水降低硫酸的浓度,减缓反应进行的速率,又不影响生成氢气的总量,故B符合;
C. NaNO3溶液与硫酸作用,产生硝酸,与锌反应不产生氢气,故C不符;
D. 1mol/L的硫酸溶液,增加酸的用量,影响氢气的产量,故D不符;
故选B。
4.D
【详解】A.制取粗硅时,生成物应为和,,A项错误;
B.一水合氨是弱碱,不能拆,并且反应热不等于中和热,B项错误;
C.稀硝酸作氧化剂,所得还原产物为,,C项错误;
D.碱性氢氧燃料电池中,O2在正极得电子产物与电解质反应生成OH-,电极反应式:,D项正确;
故选D。
5.B
【详解】A.氨气的密度小于空气,需要用向下排空气法 ,A错误;
B.碳酸钙为纯净物,与稀盐酸反应速度过快,所以用分液漏斗控制反应速率,二氧化碳密度大于空气,用向上排空气法,B正确;
C.二氧化锰和浓盐酸制取氯气需要加热装置,又因为氯气有毒需要用多功能瓶收集气体并配有尾气处理装置,C错误;
D.铁与浓硝酸发生钝化,无法生成二氧化氮,D错误;
故答案为:B。
6.D
【详解】A. 浓硝酸使紫色石蕊试液先变红,表现出酸性;后褪色,表现出强氧化性,正确。
B. 不能用稀硝酸与锌反应制氢气,因为硝酸具有强氧化性,被锌还原生成氮氧化物等,而不生成氢气,正确。
C. 要用棕色瓶盛装浓硝酸,因为浓硝酸具有光的不稳定性,正确。
D. 能使滴有酚酞的氢氧化钠溶液红色褪去,可能是硝酸表现出强氧化性,将酚酞氧化而褪色;也可能是硝酸表现出酸性,中和了氢氧化钠的碱性,酚酞在中性溶液中呈无色,错误。
故选D。
7.A
【详解】A.硝酸银溶液与盐酸反应生成氯化银沉淀:Ag++Cl-=AgCl↓,A正确;
B.金属铁与稀硝酸发生氧化还原反应:Fe+NO+4H+=Fe3++NO↑+2H2O,B错误;
C.浓硫酸一般用化学式表示,则铜粉与浓硫酸加热条件下反应Cu+2H2SO4(浓)Cu2+++SO2↑+2H2O,C错误;
D.铜与浓硝酸反应生成二氧化氮:Cu+4H++2NO=Cu2++2NO2↑+2H2O,D错误;
答案选A。
8.C
【详解】A.将打磨后的镁条放盛入有稀盐酸的试管中发生反应,放入热量,用手感触试管外壁发热,A项正确;
B.铜在酸性条件下被硝酸根离子氧化为铜离子,硝酸根离子被还原为一氧化氮,一氧化氮遇到空气变为红棕色气体二氧化氮,因此原溶液可能含有,B项正确;
C.使品红溶液褪色的气体可能为二氧化硫,也可能为NaClO与浓盐酸反应生成的氯气,C项错误;
D.难溶电解质的结构相同,其溶度积越小,加入氨水时越容易生成沉淀,可以得出Ksp[Mg(OH)2]>Ksp[Cu(OH)2],D项正确;
故选C。
9.A
【详解】A.铁与氯化铜反应生成氯化亚铁和铜,氯化亚铁中氯的百分含量比氯化铜中氯的百分含量高,则Cl的质量分数先增大,铜离子反应完全后,Cl的质量分数不变,A错误;
B.当向氯水中通入二氧化硫时,氯水中的氯气有强氧化性,在水溶液中与二氧化硫反应生成硫酸和盐酸,溶液酸性增强,pH减小,最后达定值,B正确;
C.铜先和浓硝酸反应生成二氧化氮,随着反应进行,浓硝酸变为稀硝酸,铜和稀硝酸反应生成一氧化氮,当硝酸完全反应时,生成的气体为定值,C正确;
D.氯化铝与氢氧化钠反应生成氢氧化铝,沉淀质量增加,当氯化铝完全转化为氢氧化铝,继续滴加氢氧化钠溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠,沉淀质量减少,直至沉淀消失,且1mol铝离子转化为1mol氢氧化铝消耗3mol氢氧根离子,1mol氢氧化铝转化为1mol偏铝酸根离子消耗1mol氢氧根离子,D正确;
答案选A。
10.B
【详解】A.CuO被CO先还原为Cu2O,接着Cu2O再被还原为Cu,Cu2O固体颜色也为红色,A错误;
B.根据A中固体的质量可计算生成的CO的量,装置D的作用是吸收CO2,贮存CO,装置E中的液体的体积为CO的体积,进一步可计算CO在还原实验中的利用率,B正确;
C.检验是否全部被完全还原为铜,首先确认固体全部变红,故应该向固体中加入稀盐酸或者稀硫酸,发生反应Cu2O+2H+=Cu2+ +Cu+ H2O,溶液变蓝,证明未完全还原,而硝酸能够全部溶解单质铜和氧化亚铜,C错误;
D.CaC2O4长时间加强热,产物应为CaO、CO2、CO,D错误;
故选B。
11.错误
【详解】易被氧化,具有强氧化性,能把氧化成,离子方程式书写错误,则说法错误。
12.正确
【详解】硝酸是氧化性酸,具有强氧化性,硝酸与金属反应时,主要是+5价的氮得电子,故正确。
13.错误
【详解】NO遇氧气生成红棕色的NO2,所以NO不能用排空气法收集,只能用排水法收集,所以上述说法是错误的。
14.错误
【详解】二氧化硫通入硝酸钡溶液中,使溶液呈酸性,酸性条件下NO把SO2氧化为SO,Ba2+与SO反应生成BaSO4沉淀,故上述说法错误。
15.正确
【详解】在金属活动性顺序中,Cu属于H后金属,不能与KNO3溶液发生置换反应,也不能与稀H2SO4反应。当KNO3溶液和稀H2SO4形成混合溶液时,溶液中存在NO和H+,形成硝酸,氧化性强,能与铜反应生成硝酸铜和NO、水。故题给描述正确。
16. NO2 Fe2+具有还原性 排净装置内的空气,防止O2与产生的NO反应生成NO2 Cu+4HNO3(浓)═ Cu(NO3)2+2NO2↑+2H2O 使NO2转化NO 溶液的深棕色是由于Fe2+与NO或者NO2反应,不是由于Fe3+与NO或者NO2反应
【分析】实验一:(1)硝酸将Fe2+氧化为Fe3+的同时被还原生成NO,NO遇空气生成二氧化氮;
(2)取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明溶液中有Fe3+;
实验二:(1)通入N2的目的是排净装置内的空气;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水;
(3)装置乙的作用是利用水与二氧化氮反应,使NO2转化为NO;
(4)实验结论是溶液的深棕色是由于Fe2+与NO发生了反应,也可能是由于Fe2+与NO2发生了反应,不是由于Fe3+与NO或NO2发生反应。
【详解】实验一:(1)硝酸将Fe2+氧化为Fe3+的同时被还原生成NO,NO遇空气生成二氧化氮,故红棕色气体是二氧化氮;
(2)取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明Fe2+具有还原性,被氧化生成Fe3+,溶液中有Fe3+,与KSCN溶液反应使溶液变为红色;
实验二:(1)为防止产生的NO遇空气中的氧气反应生成二氧化氮,通入N2的目的是排净装置内的空气;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)装置乙的作用是利用水与二氧化氮反应,使NO2转化为NO;
(4)实验结论是溶液的深棕色是由于Fe2+与NO发生了反应,也可能是由于Fe2+与NO2发生了反应,不是由于Fe3+与NO或NO2发生反应。
17. 吸收未被冷却的二氧化氮 C装置中酚酞溶液不褪色,D装置中有红棕色气体出现 氮气和氢气 硝酸铵 取少量A中溶液于试管中,加入浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,则可证明有铵根离子存在,产物中含硝酸铵 4Mg+10HNO3=4Mg(NO3)2+3H2O+NH4NO3
【详解】(1)前一个C装置是吸收未被冷却的二氧化氮,防止其对后面一氧化氮的检验产生影响,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮,所以看到C中酚酞溶液不褪色,D装置中有红棕色气体出现,则证明体产物中有NO生成;
(2)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收,所以从后一个C装置中逸出的气体主要是氮气和氢气;
(3)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,即A溶液中可能还有一种还原产物为NH4NO3,可以在所得溶液中加入氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生;Mg粉溶于稀硝酸生成NH4NO3,发生反应的化学方程式为4Mg+10HNO3=4Mg(NO3)2+3H2O+NH4NO3。
点睛:性质实验方案设计的一般思路、程序为: 。
18. Fe3++3H2OFe(OH)3+3H+; 产生特征蓝色沉淀 2Fe3++Cu=Cu2++2Fe2+ c 用洁净的玻璃棒蘸取1.0mol/L的Fe(NO3)3溶液,点在pH试纸上,并与标准比色卡比对 (Cu溶解)溶液变为蓝色 不同意;甲同学检验出了Fe2+,可确定Fe3+一定氧化了Cu;乙同学虽然验证了此条件下NO3-能氧化Cu,但在硝酸铁溶液氧化Cu时,由于没有检验NO3-的还原产物,因此不能确定NO3-是否氧化了Cu Fe(NO3)3溶液中的Fe3+氧化了Cu
【详解】(1)①Fe3+的水解,使Fe(NO3)3溶液显酸性,发生水解反应的离子方程式为Fe3++3H2OFe(OH)3+3H+;
②取蓝绿色溶液,向其中加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,说明溶液里有Fe2+,即Cu还原Fe3+生成Fe2+,发生反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(2)①乙同学观点是在酸性条件下Cu与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol L-1NaNO3和0.2mol L-1盐酸等体积混合的溶液代替,而0.1mol/LHNO3溶液中NO3-浓度不够,0.1mol/LFeCl3溶液中无NO3-,故答案为c;
②用pH试纸测定溶液pH值的操作是用洁净的玻璃棒蘸取1.0mol/L的Fe(NO3)3溶液,点在pH试纸上,并与标准比色卡比对;
③依据乙的观念应该会观察到Cu溶解,溶液变为蓝色;
(3)甲同学检验出了Fe2+,可确定Fe3+一定氧化了Cu;乙同学虽然验证了此条件下NO3-能氧化Cu,但在硝酸铁溶液氧化Cu时,由于没有检验NO3-的还原产物,不能确定NO3-是否氧化了Cu,故不同意丙的结论;
(4)由图表可知Fe3+的水解能力明显强于Fe2+和Cu2+,Cu片放入1.0mol/L的Fe(NO3)3溶液中,Cu片逐渐溶解,溶液变为蓝绿色,且pH值略有上升,说明Fe3+ 氧化Cu,变为Cu2+和Fe2+,水解能力下降,导致实验过程中溶液pH略有上升,即 Fe(NO3)3溶液中的Fe3+氧化了Cu,而不是NO3-在酸性条件下氧化了Cu。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
硝酸
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列实验操作及现象能推出相应结论的是
选项 实验操作和现象 实验结论
A 将某样品溶于稀硫酸,并滴加少量的溶液,溶液变红 此样品已部分或全部变质
B 向淀粉溶液中加入适量稀硫酸,加热,冷却后加入过量溶液至碱性,再加少量碘水,溶液不变蓝 淀粉完全水解
C 向溶液中加溶液,再加入几滴溶液,溶液变红 此反应存在限度
D 在圆底烧瓶中加入苯和溴水,震荡后静置,水层颜色变浅 苯和溴水发生了加成反应
A.A B.B C.C D.D
2.常温时,下列实验中的金属单质不会溶解的是
A.K与足量水溶液混合 B.Al与足量NaOH溶液混合
C.Fe与足量浓硫酸混合 D.Ag与足量浓硝酸混合
3.100mL3mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的
A.Na2CO3固体 B.蒸馏水
C.NaNO3溶液 D.1mol/L的硫酸溶液
4.下列化学反应表示正确的是
A.粗硅的制取:
B.氨水与稀硫酸反应的热化学方程式:
C.粉与足量稀硝酸反应的离子方程式:
D.碱性氢氧燃料电池的正极反应式:
5.在实验室采用如图装置制备、收集气体,合理的是
编号 气体 a b
A 浓氨水 生石灰
B 稀盐酸 碳酸钙
C 浓盐酸 二氧化锰
D 浓硝酸 铁片
A.A B.B C.C D.D
6.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
7.下列反应的离子方程式书写正确的是
A.硝酸银溶液与盐酸反应:Ag++Cl-=AgCl↓
B.金属铁与稀硝酸反应Fe+2H+=Fe2++H2↑
C.铜粉与浓硫酸加热条件下反应Cu+4H++=Cu2++SO2↑+2H2O
D.铜与浓硝酸反应:Cu+4H++2NO=Cu2++2NO↑+2H2O
8.下列实验中根据现象得出的结论错误的是
选项 实验 现象 结论
A 将打磨后的镁条放盛入有稀盐酸的试管中 用手触摸试管外壁感觉变热 镁条与稀盐酸反应是放热反应
B 向某溶液中加铜和稀H2SO4 试管口有红棕色气体产生 原溶液可能含有
C 向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液 品红溶液褪色 该钠盐为Na2SO3或NaHSO3
D 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 先出现蓝色沉淀 Ksp[Mg(OH)2]>Ksp[ Cu(OH)2]
A.A B.B C.C D.D
9.下列反应中,相关示意图错误的是
A.图甲将铁粉加入一定量氯化铜溶液中[w(Cl)表示溶液中Cl的质量分数]
B.图乙将二氧化硫通入一定量新制氯水中
C.图丙将铜粉加入一定量浓硝酸中
D.图丁将氢氧化钠溶液滴入一定量氯化铝溶液中
10.实验室用下图所示装置制备CO并用其还原CuO。制备CO的原理为H2C2O4 CO2↑+CO↑十H2O;CO还原CuO的反应机理为CO+ 2CuO Cu2O+ CO2,CO +Cu2O 2Cu+CO2。下列说法正确的是
A.装置C中黑色固体变为红色,证明氧化铜已经全部被还原为铜
B.若装置A中固体完全反应,装置D中盛装浓NaOH溶液,根据装置E中溶液的体积可以计算CO在还原实验中的利用率
C.取反应后的装置C中的固体于试管中,加入硝酸,可检验CuO是否被还原完全
D.根据上述反应原理,推测CaC2O4经长时间加强热,产物为CaCO3、CO2、CO
二、判断题
11.与发生反应的离子方程式为。(_______)
12.硝酸与金属反应时,主要是+5价的氮得电子。(_______)
13.该装置用于制备并收集气体。(____)
14.洗气瓶中产生的白色沉淀为。(____)
15.Cu在KNO3溶液和稀H2SO4中均不溶解,但能溶解在其混合液中。(_____)
三、解答题
16.某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 预测现象 实验现象
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 试管中产生红棕色气体,溶液变为黄色 试管中产生红棕色气体, 溶液变为深棕色
(1)红棕色气体是 (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明 。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是 ;
(4)铜与浓硝酸反应的化学方程式是 ;
(5)装置乙的作用是 ;
(6)实验结论是 。
17.硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
(1)后一个C装置的作用是 ,证明气体产物中有NO生成的实验现象是 。
(2)从第一个C装置中逸出的气体成分是 。
(3)溶液中还可能有一种还原产物,这种还原产物可能是 ,请设计实验验证你的猜想 ;并写出生成该还原产物的化学方程式
18.为研究1.0mol/LFe(NO3)3溶液与Cu的反应,甲与乙做了如下实验:将Cu片放入1.0mol/L的Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液变为蓝绿色,由此甲得出结论:Fe(NO3)3溶液中的Fe3+氧化了Cu。而乙认为,Fe(NO3)3溶液显酸性,此酸性条件下,NO3-也能氧化Cu。
(1)甲为证明自己的观点,设计如下实验:
步骤 操作 现象
Ⅰ 取蓝绿色溶液,向其中加入K3[Fe(CN)6]溶液 ……
①请用离子方程式解释,Fe(NO3)3溶液显酸性的原因 。
②证明甲观点正确的现象是 ,Fe3+与Cu反应的离子方程式为 。
(2)乙证明自己的观点,设计如下实验:
步骤 操作 现象
Ⅱ 用pH试纸测定1.0mol/L的Fe(NO3)3溶液的pH值 1.0mol/L的Fe(NO3)3溶液的pH=1
Ⅲ 将1.0mol/L的Fe(NO3)3溶液替换为某种溶液(或混合溶液),加入Cu ……
①下列溶液中,可以用于替换上述Fe(NO3)3溶液的是 (填序号)
a.0.1mol/LHNO3溶液
b.0.1mol/LFeCl3溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合后的溶液
②测定溶液pH值的操作是 。
③乙查阅资料:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生。证明乙观点正确的现象是 。
(3)研究发现,甲和乙的观点都正确。丙得出结论:将Cu片放入1.0mol/L的Fe(NO3)3溶液中,Fe3+和NO3-均氧化的Cu。你是否同意丙的结论,理由是 。
(4)为进一步研究1.0mol/LFe(NO3)3溶液与Cu的反应,甲与乙查阅资料:
水解反应 平衡常数(K)
Fe3++3H2OFe(OH)3+3H+ 7.9×10-4
Fe2++2H2OFe(OH)2+2H+ 3.2×10-10
Cu2++2H2OCu(OH)2+2H+ 3.2×10-7
甲与乙再次将Cu片放入1.0mol/L的Fe(NO3)3溶液中,并监测实验过程中溶液pH值的变化。他们发现Cu片逐渐溶解,溶液变为蓝绿色,且pH值略有上升。由此可以得出结论: 。
参考答案:
1.C
【详解】A.Fe(NO3)2中的硝酸根离子和稀硫酸中的H+会形成硝酸,硝酸具有氧化性,会把Fe2+氧化成Fe3+,此时再加KSCN,溶液一定会红,但不能说明变质,故A错误;
B.过量的NaOH会与碘发生反应,不能说明淀粉水解,故B错误;
C.KI与FeCl3会发生氧化还原反应,再加几滴KSCN溶液,溶液会变浅,说明Fe3+没有完全转化为Fe2+,也说明该反应存在限度,故C正确;
D.苯中没有碳碳双键,和溴水不会发生加成反应,故D错误;
故本题选C。
2.C
【详解】A.K与足量水溶液混合生成可溶性的KOH,反应方程式为:2K+2H2O=2KOH+H2↑,A不合题意;
B.Al与足量NaOH溶液混合生成可溶性的NaAlO2,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,B不合题意;
C.由于Fe在常温下在浓硫酸中发生钝化,故铁不溶于足量的浓硫酸中,C符合题意;
D.Ag与足量浓硝酸混合生成可溶性的AgNO3,反应方程式为:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O,D不合题意;
故答案为:C。
3.B
【详解】A. Na2CO3固体与硫酸反应,减少氢气的产量,故A不符;
B. 蒸馏水降低硫酸的浓度,减缓反应进行的速率,又不影响生成氢气的总量,故B符合;
C. NaNO3溶液与硫酸作用,产生硝酸,与锌反应不产生氢气,故C不符;
D. 1mol/L的硫酸溶液,增加酸的用量,影响氢气的产量,故D不符;
故选B。
4.D
【详解】A.制取粗硅时,生成物应为和,,A项错误;
B.一水合氨是弱碱,不能拆,并且反应热不等于中和热,B项错误;
C.稀硝酸作氧化剂,所得还原产物为,,C项错误;
D.碱性氢氧燃料电池中,O2在正极得电子产物与电解质反应生成OH-,电极反应式:,D项正确;
故选D。
5.B
【详解】A.氨气的密度小于空气,需要用向下排空气法 ,A错误;
B.碳酸钙为纯净物,与稀盐酸反应速度过快,所以用分液漏斗控制反应速率,二氧化碳密度大于空气,用向上排空气法,B正确;
C.二氧化锰和浓盐酸制取氯气需要加热装置,又因为氯气有毒需要用多功能瓶收集气体并配有尾气处理装置,C错误;
D.铁与浓硝酸发生钝化,无法生成二氧化氮,D错误;
故答案为:B。
6.D
【详解】A. 浓硝酸使紫色石蕊试液先变红,表现出酸性;后褪色,表现出强氧化性,正确。
B. 不能用稀硝酸与锌反应制氢气,因为硝酸具有强氧化性,被锌还原生成氮氧化物等,而不生成氢气,正确。
C. 要用棕色瓶盛装浓硝酸,因为浓硝酸具有光的不稳定性,正确。
D. 能使滴有酚酞的氢氧化钠溶液红色褪去,可能是硝酸表现出强氧化性,将酚酞氧化而褪色;也可能是硝酸表现出酸性,中和了氢氧化钠的碱性,酚酞在中性溶液中呈无色,错误。
故选D。
7.A
【详解】A.硝酸银溶液与盐酸反应生成氯化银沉淀:Ag++Cl-=AgCl↓,A正确;
B.金属铁与稀硝酸发生氧化还原反应:Fe+NO+4H+=Fe3++NO↑+2H2O,B错误;
C.浓硫酸一般用化学式表示,则铜粉与浓硫酸加热条件下反应Cu+2H2SO4(浓)Cu2+++SO2↑+2H2O,C错误;
D.铜与浓硝酸反应生成二氧化氮:Cu+4H++2NO=Cu2++2NO2↑+2H2O,D错误;
答案选A。
8.C
【详解】A.将打磨后的镁条放盛入有稀盐酸的试管中发生反应,放入热量,用手感触试管外壁发热,A项正确;
B.铜在酸性条件下被硝酸根离子氧化为铜离子,硝酸根离子被还原为一氧化氮,一氧化氮遇到空气变为红棕色气体二氧化氮,因此原溶液可能含有,B项正确;
C.使品红溶液褪色的气体可能为二氧化硫,也可能为NaClO与浓盐酸反应生成的氯气,C项错误;
D.难溶电解质的结构相同,其溶度积越小,加入氨水时越容易生成沉淀,可以得出Ksp[Mg(OH)2]>Ksp[Cu(OH)2],D项正确;
故选C。
9.A
【详解】A.铁与氯化铜反应生成氯化亚铁和铜,氯化亚铁中氯的百分含量比氯化铜中氯的百分含量高,则Cl的质量分数先增大,铜离子反应完全后,Cl的质量分数不变,A错误;
B.当向氯水中通入二氧化硫时,氯水中的氯气有强氧化性,在水溶液中与二氧化硫反应生成硫酸和盐酸,溶液酸性增强,pH减小,最后达定值,B正确;
C.铜先和浓硝酸反应生成二氧化氮,随着反应进行,浓硝酸变为稀硝酸,铜和稀硝酸反应生成一氧化氮,当硝酸完全反应时,生成的气体为定值,C正确;
D.氯化铝与氢氧化钠反应生成氢氧化铝,沉淀质量增加,当氯化铝完全转化为氢氧化铝,继续滴加氢氧化钠溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠,沉淀质量减少,直至沉淀消失,且1mol铝离子转化为1mol氢氧化铝消耗3mol氢氧根离子,1mol氢氧化铝转化为1mol偏铝酸根离子消耗1mol氢氧根离子,D正确;
答案选A。
10.B
【详解】A.CuO被CO先还原为Cu2O,接着Cu2O再被还原为Cu,Cu2O固体颜色也为红色,A错误;
B.根据A中固体的质量可计算生成的CO的量,装置D的作用是吸收CO2,贮存CO,装置E中的液体的体积为CO的体积,进一步可计算CO在还原实验中的利用率,B正确;
C.检验是否全部被完全还原为铜,首先确认固体全部变红,故应该向固体中加入稀盐酸或者稀硫酸,发生反应Cu2O+2H+=Cu2+ +Cu+ H2O,溶液变蓝,证明未完全还原,而硝酸能够全部溶解单质铜和氧化亚铜,C错误;
D.CaC2O4长时间加强热,产物应为CaO、CO2、CO,D错误;
故选B。
11.错误
【详解】易被氧化,具有强氧化性,能把氧化成,离子方程式书写错误,则说法错误。
12.正确
【详解】硝酸是氧化性酸,具有强氧化性,硝酸与金属反应时,主要是+5价的氮得电子,故正确。
13.错误
【详解】NO遇氧气生成红棕色的NO2,所以NO不能用排空气法收集,只能用排水法收集,所以上述说法是错误的。
14.错误
【详解】二氧化硫通入硝酸钡溶液中,使溶液呈酸性,酸性条件下NO把SO2氧化为SO,Ba2+与SO反应生成BaSO4沉淀,故上述说法错误。
15.正确
【详解】在金属活动性顺序中,Cu属于H后金属,不能与KNO3溶液发生置换反应,也不能与稀H2SO4反应。当KNO3溶液和稀H2SO4形成混合溶液时,溶液中存在NO和H+,形成硝酸,氧化性强,能与铜反应生成硝酸铜和NO、水。故题给描述正确。
16. NO2 Fe2+具有还原性 排净装置内的空气,防止O2与产生的NO反应生成NO2 Cu+4HNO3(浓)═ Cu(NO3)2+2NO2↑+2H2O 使NO2转化NO 溶液的深棕色是由于Fe2+与NO或者NO2反应,不是由于Fe3+与NO或者NO2反应
【分析】实验一:(1)硝酸将Fe2+氧化为Fe3+的同时被还原生成NO,NO遇空气生成二氧化氮;
(2)取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明溶液中有Fe3+;
实验二:(1)通入N2的目的是排净装置内的空气;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水;
(3)装置乙的作用是利用水与二氧化氮反应,使NO2转化为NO;
(4)实验结论是溶液的深棕色是由于Fe2+与NO发生了反应,也可能是由于Fe2+与NO2发生了反应,不是由于Fe3+与NO或NO2发生反应。
【详解】实验一:(1)硝酸将Fe2+氧化为Fe3+的同时被还原生成NO,NO遇空气生成二氧化氮,故红棕色气体是二氧化氮;
(2)取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明Fe2+具有还原性,被氧化生成Fe3+,溶液中有Fe3+,与KSCN溶液反应使溶液变为红色;
实验二:(1)为防止产生的NO遇空气中的氧气反应生成二氧化氮,通入N2的目的是排净装置内的空气;
(2)铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(3)装置乙的作用是利用水与二氧化氮反应,使NO2转化为NO;
(4)实验结论是溶液的深棕色是由于Fe2+与NO发生了反应,也可能是由于Fe2+与NO2发生了反应,不是由于Fe3+与NO或NO2发生反应。
17. 吸收未被冷却的二氧化氮 C装置中酚酞溶液不褪色,D装置中有红棕色气体出现 氮气和氢气 硝酸铵 取少量A中溶液于试管中,加入浓氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口,如果试纸变蓝,则可证明有铵根离子存在,产物中含硝酸铵 4Mg+10HNO3=4Mg(NO3)2+3H2O+NH4NO3
【详解】(1)前一个C装置是吸收未被冷却的二氧化氮,防止其对后面一氧化氮的检验产生影响,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮,所以看到C中酚酞溶液不褪色,D装置中有红棕色气体出现,则证明体产物中有NO生成;
(2)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收,所以从后一个C装置中逸出的气体主要是氮气和氢气;
(3)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,即A溶液中可能还有一种还原产物为NH4NO3,可以在所得溶液中加入氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生;Mg粉溶于稀硝酸生成NH4NO3,发生反应的化学方程式为4Mg+10HNO3=4Mg(NO3)2+3H2O+NH4NO3。
点睛:性质实验方案设计的一般思路、程序为: 。
18. Fe3++3H2OFe(OH)3+3H+; 产生特征蓝色沉淀 2Fe3++Cu=Cu2++2Fe2+ c 用洁净的玻璃棒蘸取1.0mol/L的Fe(NO3)3溶液,点在pH试纸上,并与标准比色卡比对 (Cu溶解)溶液变为蓝色 不同意;甲同学检验出了Fe2+,可确定Fe3+一定氧化了Cu;乙同学虽然验证了此条件下NO3-能氧化Cu,但在硝酸铁溶液氧化Cu时,由于没有检验NO3-的还原产物,因此不能确定NO3-是否氧化了Cu Fe(NO3)3溶液中的Fe3+氧化了Cu
【详解】(1)①Fe3+的水解,使Fe(NO3)3溶液显酸性,发生水解反应的离子方程式为Fe3++3H2OFe(OH)3+3H+;
②取蓝绿色溶液,向其中加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,说明溶液里有Fe2+,即Cu还原Fe3+生成Fe2+,发生反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(2)①乙同学观点是在酸性条件下Cu与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol L-1NaNO3和0.2mol L-1盐酸等体积混合的溶液代替,而0.1mol/LHNO3溶液中NO3-浓度不够,0.1mol/LFeCl3溶液中无NO3-,故答案为c;
②用pH试纸测定溶液pH值的操作是用洁净的玻璃棒蘸取1.0mol/L的Fe(NO3)3溶液,点在pH试纸上,并与标准比色卡比对;
③依据乙的观念应该会观察到Cu溶解,溶液变为蓝色;
(3)甲同学检验出了Fe2+,可确定Fe3+一定氧化了Cu;乙同学虽然验证了此条件下NO3-能氧化Cu,但在硝酸铁溶液氧化Cu时,由于没有检验NO3-的还原产物,不能确定NO3-是否氧化了Cu,故不同意丙的结论;
(4)由图表可知Fe3+的水解能力明显强于Fe2+和Cu2+,Cu片放入1.0mol/L的Fe(NO3)3溶液中,Cu片逐渐溶解,溶液变为蓝绿色,且pH值略有上升,说明Fe3+ 氧化Cu,变为Cu2+和Fe2+,水解能力下降,导致实验过程中溶液pH略有上升,即 Fe(NO3)3溶液中的Fe3+氧化了Cu,而不是NO3-在酸性条件下氧化了Cu。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
