溴、碘及其化合物试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 溴、碘及其化合物试题 高考化学考前专项复习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 584.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
溴、碘及其化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于卤化银的叙述中不正确的是( )
A.AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中
B.AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案
C.AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨
D.AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨
2.下列有关实验说法中,正确的是
A.氯酸钾、高锰酸钾结块时,可放在研钵中先敲击成小块,再研碎
B.用滴定法进行定量测定时,基准物应该具有性质稳定、相对分子质量较小等特点
C.烫伤时,应用冷水冲洗,若皮肤未破,可涂饱和碳酸氢钠溶液于伤处
D.不慎溴腐蚀致伤时,先用酒精或甘油洗涤,再用水冲洗
3.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入苯、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色 B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色 D.Ⅳ中溶液分层
4.在密闭容器中发生反应H2(g)+I2(g)2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表表示的平均反应速率[mol/(L min)]为( )
A.0.50 B.0.01 C.0.04 D.0.10
5.下列物质不能与溴水发生反应的是
①苯②乙烯③FeBr2溶液④NaOH溶液⑤AgNO3溶液⑥镁粉⑦甲烷
A.①⑦ B.①③⑦ C.①⑥⑦ D.①
6.能正确表示下列反应的离子方程式的是
A.用K3[Fe(CN)6]溶液检验Fe2+:Fe2++K++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
B.向二元弱酸亚磷酸(H3PO3)溶液中滴加足量的烧碱溶液:H3PO3+3OH-=+3H2O
C.用惰性电极电解氯化镁溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
D.海水提溴工艺中用二氧化硫还原溴:SO2+Br2+2H2O=2H+++2HBr
7.1820年,德贝莱纳用MnO2催化KClO3分解制氧,发现制得的氧气有异常气味,使气体通过淀粉-KI溶液,则溶液变蓝。那么,氧气中可能混有的气体是
A.Cl2 B.Br2 C.HCl D.NO2
8.下列说法不正确的是
A.氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而常用于净水
B.次氯酸有漂白性是因为它不稳定,见光易分解
C.加碘盐不能长时间炖炒,且应避光、避热保存,原因是加点盐中的碘酸钾受热易分解
D.碘化银常用于人工降雨
9.下列有关食品安全正确的是:
A.用工业石膏或医疗废弃石膏制作豆腐
B.炒菜中加入适量的加碘盐,预防地方性甲状腺肿大
C.在猪肉中加入大量的牛肉膏(一种添加剂),让猪肉有牛肉的口感
D.将地沟油和潲水油回收利用来炒菜,以达到变废为宝、节约资源的目的
10.已知IO3-与I-可发生反应:IO3- +5I- +6H+==3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行试验,证明加碘食盐中存在IO3-。可供选用的物质有:①自来水②蓝色石蕊试纸③碘化钾淀粉试纸④淀粉⑤食盐⑥食醋⑦白酒,进行上述实验时必须用到的物质是( )
A.③⑥ B.①③
C.②④⑥ D.①②④⑤⑦
二、判断题
11.用干燥的淀粉碘化钾试纸检验Cl2是否收集满。( )
12.加碘盐能使淀粉变蓝。(_______)
13.氯气能使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性。(___________)
14.将碘单质加到普通食盐中可制成加碘食盐,经常食用可消除碘缺乏贫。
15.能使湿润的淀粉 KI试纸变成蓝色的物质一定是Cl2。( )
三、解答题
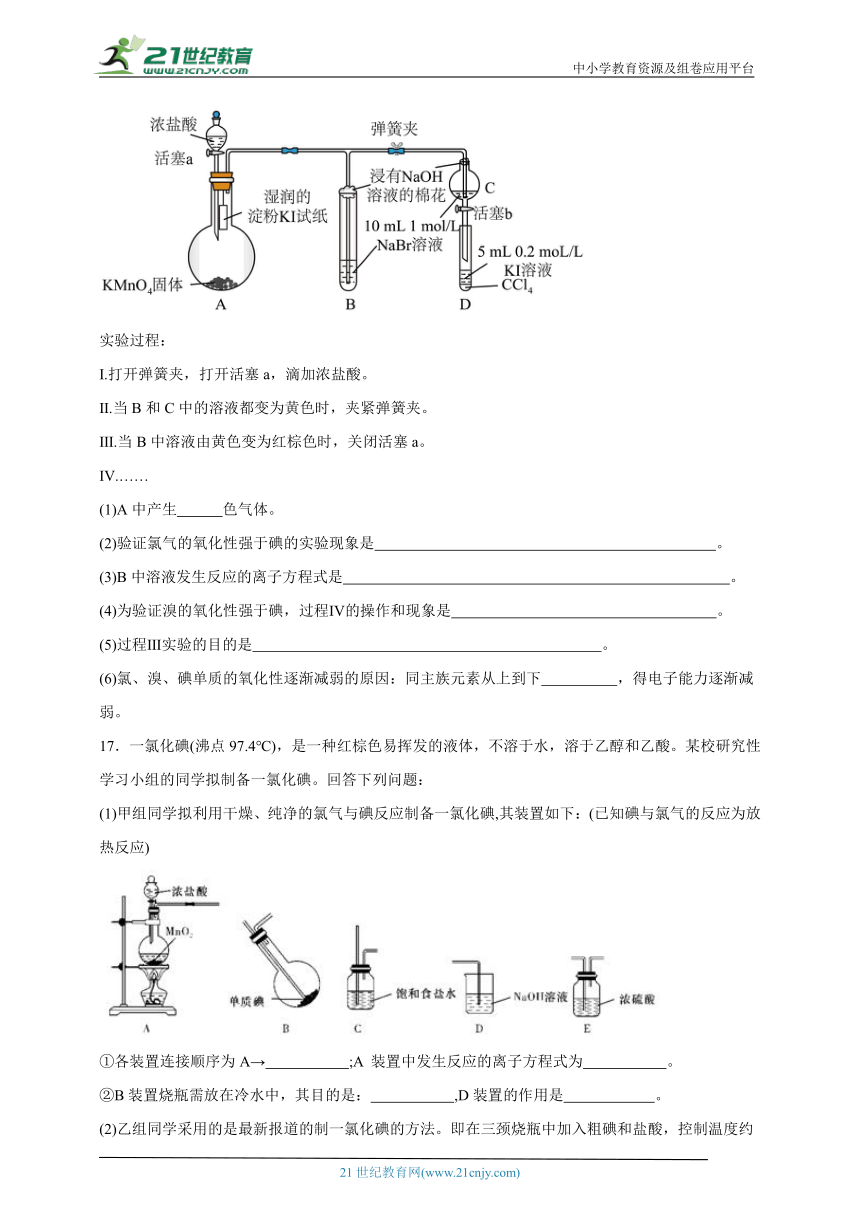
16.为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生 色气体。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
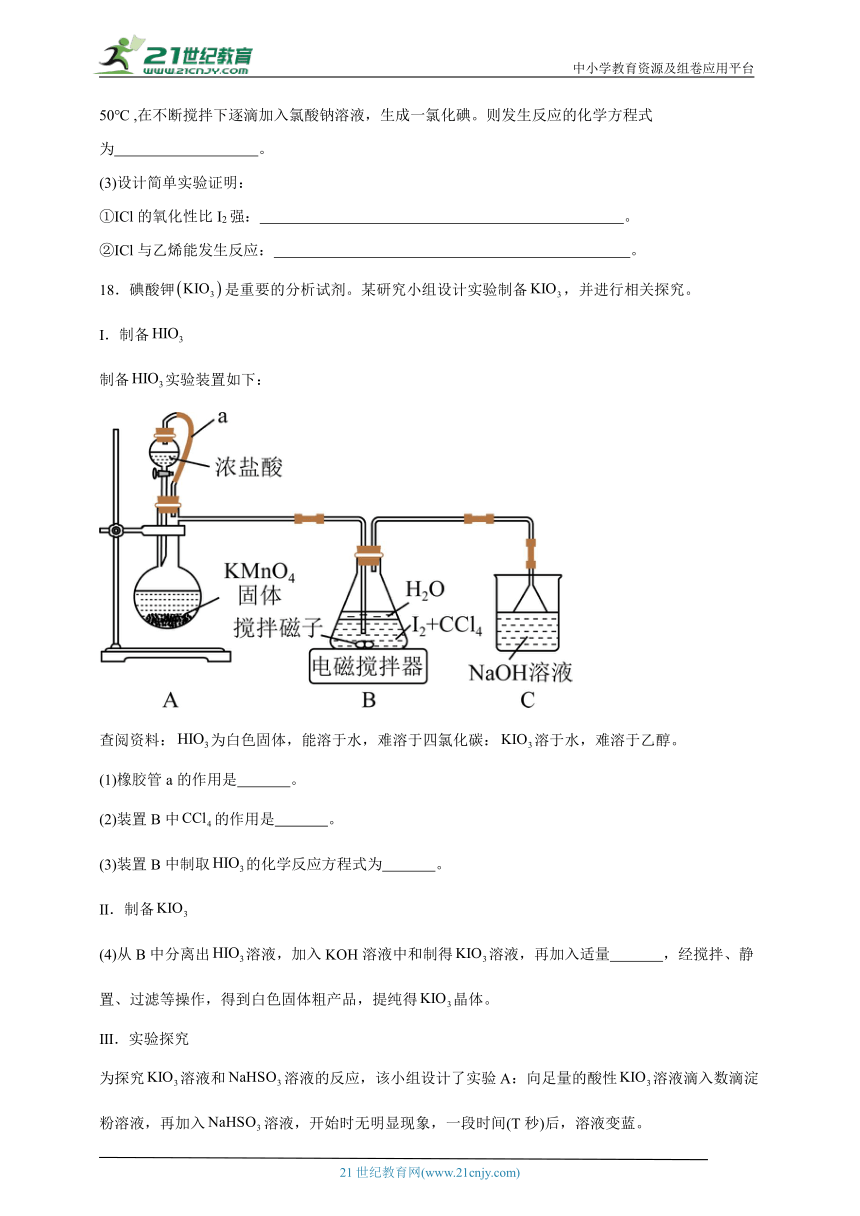
17.一氯化碘(沸点97.4℃),是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题:
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
①各装置连接顺序为A→ ;A 装置中发生反应的离子方程式为 。
②B装置烧瓶需放在冷水中,其目的是: ,D装置的作用是 。
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控制温度约50℃ ,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为 。
(3)设计简单实验证明:
①ICl的氧化性比I2强: 。
②ICl与乙烯能发生反应: 。
18.碘酸钾是重要的分析试剂。某研究小组设计实验制备,并进行相关探究。
Ⅰ.制备
制备实验装置如下:
查阅资料:为白色固体,能溶于水,难溶于四氯化碳:溶于水,难溶于乙醇。
(1)橡胶管a的作用是 。
(2)装置B中的作用是 。
(3)装置B中制取的化学反应方程式为 。
Ⅱ.制备
(4)从B中分离出溶液,加入KOH溶液中和制得溶液,再加入适量 ,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得晶体。
Ⅲ.实验探究
为探究溶液和溶液的反应,该小组设计了实验A:向足量的酸性溶液滴入数滴淀粉溶液,再加入溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(5)溶液变蓝,表明体现了 性。
(6)针对T秒前溶液未变蓝,小组做出如下猜想:
①猜想a:T秒前未生成,是由于反应的活化能 (填“大”或“小”),反应速率 (填“快”或“慢”)导致的。
②猜想b:T秒前生成了,但由于存在,迅速被消耗,反应为 (用离子方程式表示)。
(7)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入 ,蓝色迅速消失,后再次变蓝。
参考答案:
1.C
【详解】A、三者都是难溶于水的固体,具有感光性见光易分解,要避光保存在棕色瓶中,正确,不选A;
B、指纹中的氯化钠和硝酸银反应生成不溶于水和酸的氯化银沉淀,用于指纹鉴定有助于警察破案,正确,不选B;
C、溴化银是淡黄色光敏性物质,常用作感光材料制作胶卷,溴化银不易形成结晶核不能用于人工降雨,错误,选C;
D、碘化银是黄色固体,见光容易分解为单质碘和黑色的单质银,碘化银可在空气中形成结晶核,使水凝结,可用于人工降雨,正确,不选D。
故选C。
2.D
【详解】A.高锰酸钾为强氧化剂,不能敲击,否则容易发生爆炸,A错误;
B.基准物质必须具备纯度高、性质稳定、组成恒定、摩尔质量尽可能大等条件,B错误;
C.烫伤时,立刻用冷水冲洗再处理,若皮肤未破,涂饱和碳酸氢钠于伤处,若皮肤已破,涂1%的高锰酸钾溶液,C错误;
D.溴易溶于酒精或甘油,先用酒精或甘油洗涤,再用水冲洗,避免对皮肤的伤害,D正确;
故选D。
3.B
【详解】A、苯能萃取碘水中的碘,但密度小于水的密度,所以看到的现象是溶液分层,上层呈紫红色,下层呈无色,选项A错误;
B、四氯化碳能萃取碘水中的碘,但密度大于水的密度,所以看到的现象是溶液分层,下层呈紫红色,上层呈无色,选项B正确;
C、酒精和碘水能互溶,所以看到的现象是溶液不分层,选项C错误;
D、氯化钠溶液和碘水能互溶,所以溶液不分层,选项D错误;
答案选B。
4.D
【详解】在密闭容器中发生反应H2(g)+I2(g)2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表示的平均反应速率v(H2)= =0.10mol·L-1 min-1;答案为D。
5.A
【详解】①苯不与溴水反应,①项选;
②乙烯可以和溴水发生加成反应,②项不选;
③FeBr2溶液可以和Br2反应生成FeBr3,③项不选;
④溴水和NaOH溶液反应生成NaBr、NaBrO和H2O,④项不选;
⑤AgNO3溶液和溴水反应生成AgBr沉淀,⑤项不选;
⑥溴水中含有HBr、HBrO,可以和镁粉反应生成MgBr、Mg(BrO)2和H2,⑥项不选;
⑦甲烷为饱和烃,不与溴水反应,⑦项选;
答案选A。
6.A
【详解】A.用K3[Fe(CN)6]溶液检验Fe2+,离子方程式为Fe2++K++[Fe(CN)6]3-=KFe[Fe(CN)6]↓,故A正确;
B.向二元弱酸亚磷酸(H3PO3)溶液中滴加足量的烧碱溶液,离子方程式为H3PO3+2OH-=H+2H2O,故B错误;
C.用惰性电极电解氯化镁溶液,离子方程式为Mg2++2Cl-+2H2OCl2↑+H2↑+2Mg(OH)2↓,故C错误;
D.海水提溴工艺中用二氧化硫还原溴,离子方程式为SO2+Br2+2H2O=4H+++2Br-,故D错误;
故答案选A。
7.A
【详解】A.氯气具有刺激性气味,通过淀粉碘化钾溶液,碘离子被氧化为单质碘,遇到淀粉变蓝,故A正确;
B.反应物中没有溴元素,故不可能生成溴单质,故B错误;
C.氯化氢具有刺激性气味,但是反应物中没有氢元素,故不能生成氯化氢,故C错误;
D.二氧化氮为有刺激性气味的红棕色气体,但是反应物中没有氮元素,故不能生成二氧化氮,故D错误;
故选A。
8.B
【详解】A.胶体的表面积很大,具有吸附性,则氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,因而常用于净水,A正确;
B.次氯酸具有强氧化性,能使有色物质褪色,所以次氯酸有漂白性是因为它有强氧化性,B错误;
C.加碘盐不能长时间炖炒,且应避光、避热保存,原因是加碘盐中的碘酸钾受热易分解,C正确;
D.AgI在空气中易形成结晶核,使空气中水蒸气凝聚,用于人工降雨,D正确;
故选B。
9.B
【详解】A.工业石膏有过多杂质,会影响健康,医用石膏更是如此,故A错误;
B.碘元素是甲状腺激素的重要成分,补充适量的碘元素,可以预防甲状腺肿大等疾病,故B正确;
C.长期食用牛肉膏对人体有危害,甚至可能致癌,故C错误;
D.地沟油,泛指在生活中存在的各类劣质油,长期食用可能会引发癌症,对人体的危害极大,故D错误;
故选B。
10.A
【详解】根据反应IO3- +5I- +6H+==3I2+3H2O,要证明食盐中含有IO3- ,应加入含有I-、H+、淀粉的物质,③碘化钾淀粉试纸可提供I-和淀粉,⑥食醋可提供H+及水,所以必须用到的物质是③⑥,故选A。
11.错误
【详解】应用湿润的淀粉KI试纸检验Cl2是否收集满,故该说法错误。
12.错误
【详解】I2单质能使淀粉变蓝,加碘盐中含有的是KIO3,不能使淀粉变蓝,故该说法错误。
13.正确
【详解】氯气能与碘离子反应生成氯离子和碘单质,碘使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性,故正确。
14.错误
【详解】将KIO3加到普通食盐中可制成加碘食盐,经常食用可消除碘缺乏贫,故错误
15.错误
【详解】能使湿润的淀粉KI试纸变蓝的物质具有强氧化性,不一定为氯气,可为溴等,错误。
16. 黄绿 湿润的淀粉 KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 原子半径逐渐增大
【分析】装置A利用高锰酸钾和浓盐酸制备Cl2,Cl2和淀粉-KI试纸中的KI作用,置换出I2,使得试纸变蓝。在装置B和C中,Cl2和NaBr发生置换反应,生成Br2。将活塞b打开,Br2与KI发生置换反应,得到I2。I2被CCl4萃取,下层呈现紫红色。
【详解】(1)A中产生的黄绿色气体为Cl2;
(2)Cl2遇湿润的淀粉 KI试纸时,发生反应:Cl2+2KI=I2+2KCl,产生的I2遇淀粉变蓝,可以证明Cl2的氧化性强于I2;
(3)B中Cl2与NaBr发生置换反应,离子方程式为Cl2+2Br-=2Cl-+Br2;
(4)C中NaBr与Cl2反应生成NaCl和Br2,将C中溶液滴入D中,振荡,发生反应:Br2+2KI=I2+2KBr,静置后D中溶液分层,下层为碘的CCl4溶液,显紫红色,可以说明溴的氧化性强于碘;
(5)过程Ⅲ的B中溶液由黄色变为棕红色,说明仍有Br2生成,由于B与C中溶液相同,故C中通入Cl2不足,NaBr过量,故C的黄色溶液中无Cl2,排除对溴置换碘实验的干扰;
(6)氯、溴、碘单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱。
17. C→E→B→D MnO2+4H++2Cl- Mn2++Cl2↑+2H2O 防止ICl挥发 吸收未反应的氯气,防止污染空气 3I2+6HCl+NaClO36ICl+NaCl+3H2O 用湿润的KI-淀粉试纸检验一氯化碘蒸气,试纸变蓝 在ICl的乙醇溶液中通入乙烯,溶液褪色
【详解】分析:用干燥纯净的氯气与碘反应制备一氯化碘,A装置用二氧化锰和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥,将干燥的氯气通入B中与碘反应,制备ICl,而ICl挥发,所以B应放在冷水中,最后用氢氧化钠(D)处理未反应完的氯气,结合问题分析解答。
详解:(1)①用干燥纯净的氯气与碘反应制备一氯化碘,A装置用二氧化锰和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,因此需要先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥氯气,将干燥的氯气通入B中与碘反应,制备ICl。由于ICl易挥发,所以B应放在冷水中。又因为氯气有毒,需要尾气处理,所以最后用氢氧化钠(D)处理未反应完的氯气,因此装置顺序为:A→C→E→B→D。A中发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
②ICl挥发,所以B应放在冷水中,防止ICl挥发;氯气有毒,用氢氧化钠(D)处理未反应完的氯气,防止污染空气;
(2)粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,碘元素总共升2价,氯元素总共降6价,化合价升降应相等,则碘单质应配3,再由原子守恒可得3I2+6HCl+NaClO36ICl+NaCl+3H2O;
(3)①根据氧化性强的物质制氧化性弱的物质,可用湿润的KI淀粉试纸检验一氯化碘蒸气,试纸变蓝即证明ICl的氧化性比I2强;
②一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,与乙烯发生加成反应,则颜色褪去,即在ICl的乙醇溶液中通入乙烯,溶液褪色说明ICl与乙烯作用发生加成反应。
点睛:本题考查了物质的制备,涉及氧化还原反应、实验装置的选择、实验过程的控制,物质的分离提纯等知识点,为高考频点,注意掌握物质性质灵活运用,善于提取题目的信息。第(3)问是解答的难点和易错点,注意结合已学过的知识(即氧化还原反应规律的应用)和题目中隐含的信息进行知识的迁移灵活应用。
18.(1)平衡气压,使分液漏斗中浓盐酸能顺利滴下
(2)增大了反应物浓度,加快化学反应速率
(3)
(4)乙醇
(5)还原
(6) 大 慢
(7)少量
【详解】(1)由实验装置图可知,橡胶管a的作用是平衡气压,使分液漏斗中浓盐酸能顺利滴下,故答案为:平衡气压,使分液漏斗中浓盐酸能顺利滴下;
(2)已知I2和Cl2在水中溶解度很小,但易溶于CCl4中,故装置B中的作用是增大了反应物浓度,加快化学反应速率,故答案为:增大了反应物浓度,加快化学反应速率;
(3)装置B中制取即I2和Cl2、H2O反应生成HIO3和HCl,根据氧化还原反应配平可得该反应的化学反应方程式为,故答案为:;
(4)由题干已知信息可知,KIO3溶于水,难溶于乙醇,则从B中分离出HIO3溶液,加入KOH溶液中和制得KIO3溶液,再加入适量乙醇,以减小KIO3的溶解性便于析出,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得KIO3晶体,故答案为:乙醇;
(5)溶液变蓝,说明KIO3与NaHSO3反应得到了I2,故表明NaHSO3体现了还原性,故答案为:还原;
(6)①反应需要的活化能越大,反应越难进行,反应速率越慢,故猜想a:T秒前未生成I2,是由于反应的活化能大,反应速率慢导致的,故答案为:大;慢;
②猜想b:T秒前生成了I2,但由于存在NaHSO3,I2迅速被消耗,即I2与NaHSO3反应生成NaI和Na2SO4,故该反应为,故答案为:;
(7)由上述分析可知,证明猜想b成立的话是因为发生了反应:,故若向实验A的蓝色溶液中加入少量的NaHSO3,蓝色迅速消失,然后发生5I-++6H+=3I2+3H2O,后再次变蓝,故答案为:少量的NaHSO3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
溴、碘及其化合物
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于卤化银的叙述中不正确的是( )
A.AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中
B.AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案
C.AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨
D.AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨
2.下列有关实验说法中,正确的是
A.氯酸钾、高锰酸钾结块时,可放在研钵中先敲击成小块,再研碎
B.用滴定法进行定量测定时,基准物应该具有性质稳定、相对分子质量较小等特点
C.烫伤时,应用冷水冲洗,若皮肤未破,可涂饱和碳酸氢钠溶液于伤处
D.不慎溴腐蚀致伤时,先用酒精或甘油洗涤,再用水冲洗
3.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入苯、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色 B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色 D.Ⅳ中溶液分层
4.在密闭容器中发生反应H2(g)+I2(g)2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表表示的平均反应速率[mol/(L min)]为( )
A.0.50 B.0.01 C.0.04 D.0.10
5.下列物质不能与溴水发生反应的是
①苯②乙烯③FeBr2溶液④NaOH溶液⑤AgNO3溶液⑥镁粉⑦甲烷
A.①⑦ B.①③⑦ C.①⑥⑦ D.①
6.能正确表示下列反应的离子方程式的是
A.用K3[Fe(CN)6]溶液检验Fe2+:Fe2++K++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
B.向二元弱酸亚磷酸(H3PO3)溶液中滴加足量的烧碱溶液:H3PO3+3OH-=+3H2O
C.用惰性电极电解氯化镁溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
D.海水提溴工艺中用二氧化硫还原溴:SO2+Br2+2H2O=2H+++2HBr
7.1820年,德贝莱纳用MnO2催化KClO3分解制氧,发现制得的氧气有异常气味,使气体通过淀粉-KI溶液,则溶液变蓝。那么,氧气中可能混有的气体是
A.Cl2 B.Br2 C.HCl D.NO2
8.下列说法不正确的是
A.氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而常用于净水
B.次氯酸有漂白性是因为它不稳定,见光易分解
C.加碘盐不能长时间炖炒,且应避光、避热保存,原因是加点盐中的碘酸钾受热易分解
D.碘化银常用于人工降雨
9.下列有关食品安全正确的是:
A.用工业石膏或医疗废弃石膏制作豆腐
B.炒菜中加入适量的加碘盐,预防地方性甲状腺肿大
C.在猪肉中加入大量的牛肉膏(一种添加剂),让猪肉有牛肉的口感
D.将地沟油和潲水油回收利用来炒菜,以达到变废为宝、节约资源的目的
10.已知IO3-与I-可发生反应:IO3- +5I- +6H+==3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行试验,证明加碘食盐中存在IO3-。可供选用的物质有:①自来水②蓝色石蕊试纸③碘化钾淀粉试纸④淀粉⑤食盐⑥食醋⑦白酒,进行上述实验时必须用到的物质是( )
A.③⑥ B.①③
C.②④⑥ D.①②④⑤⑦
二、判断题
11.用干燥的淀粉碘化钾试纸检验Cl2是否收集满。( )
12.加碘盐能使淀粉变蓝。(_______)
13.氯气能使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性。(___________)
14.将碘单质加到普通食盐中可制成加碘食盐,经常食用可消除碘缺乏贫。
15.能使湿润的淀粉 KI试纸变成蓝色的物质一定是Cl2。( )
三、解答题
16.为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生 色气体。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
17.一氯化碘(沸点97.4℃),是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题:
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
①各装置连接顺序为A→ ;A 装置中发生反应的离子方程式为 。
②B装置烧瓶需放在冷水中,其目的是: ,D装置的作用是 。
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控制温度约50℃ ,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为 。
(3)设计简单实验证明:
①ICl的氧化性比I2强: 。
②ICl与乙烯能发生反应: 。
18.碘酸钾是重要的分析试剂。某研究小组设计实验制备,并进行相关探究。
Ⅰ.制备
制备实验装置如下:
查阅资料:为白色固体,能溶于水,难溶于四氯化碳:溶于水,难溶于乙醇。
(1)橡胶管a的作用是 。
(2)装置B中的作用是 。
(3)装置B中制取的化学反应方程式为 。
Ⅱ.制备
(4)从B中分离出溶液,加入KOH溶液中和制得溶液,再加入适量 ,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得晶体。
Ⅲ.实验探究
为探究溶液和溶液的反应,该小组设计了实验A:向足量的酸性溶液滴入数滴淀粉溶液,再加入溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(5)溶液变蓝,表明体现了 性。
(6)针对T秒前溶液未变蓝,小组做出如下猜想:
①猜想a:T秒前未生成,是由于反应的活化能 (填“大”或“小”),反应速率 (填“快”或“慢”)导致的。
②猜想b:T秒前生成了,但由于存在,迅速被消耗,反应为 (用离子方程式表示)。
(7)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入 ,蓝色迅速消失,后再次变蓝。
参考答案:
1.C
【详解】A、三者都是难溶于水的固体,具有感光性见光易分解,要避光保存在棕色瓶中,正确,不选A;
B、指纹中的氯化钠和硝酸银反应生成不溶于水和酸的氯化银沉淀,用于指纹鉴定有助于警察破案,正确,不选B;
C、溴化银是淡黄色光敏性物质,常用作感光材料制作胶卷,溴化银不易形成结晶核不能用于人工降雨,错误,选C;
D、碘化银是黄色固体,见光容易分解为单质碘和黑色的单质银,碘化银可在空气中形成结晶核,使水凝结,可用于人工降雨,正确,不选D。
故选C。
2.D
【详解】A.高锰酸钾为强氧化剂,不能敲击,否则容易发生爆炸,A错误;
B.基准物质必须具备纯度高、性质稳定、组成恒定、摩尔质量尽可能大等条件,B错误;
C.烫伤时,立刻用冷水冲洗再处理,若皮肤未破,涂饱和碳酸氢钠于伤处,若皮肤已破,涂1%的高锰酸钾溶液,C错误;
D.溴易溶于酒精或甘油,先用酒精或甘油洗涤,再用水冲洗,避免对皮肤的伤害,D正确;
故选D。
3.B
【详解】A、苯能萃取碘水中的碘,但密度小于水的密度,所以看到的现象是溶液分层,上层呈紫红色,下层呈无色,选项A错误;
B、四氯化碳能萃取碘水中的碘,但密度大于水的密度,所以看到的现象是溶液分层,下层呈紫红色,上层呈无色,选项B正确;
C、酒精和碘水能互溶,所以看到的现象是溶液不分层,选项C错误;
D、氯化钠溶液和碘水能互溶,所以溶液不分层,选项D错误;
答案选B。
4.D
【详解】在密闭容器中发生反应H2(g)+I2(g)2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表示的平均反应速率v(H2)= =0.10mol·L-1 min-1;答案为D。
5.A
【详解】①苯不与溴水反应,①项选;
②乙烯可以和溴水发生加成反应,②项不选;
③FeBr2溶液可以和Br2反应生成FeBr3,③项不选;
④溴水和NaOH溶液反应生成NaBr、NaBrO和H2O,④项不选;
⑤AgNO3溶液和溴水反应生成AgBr沉淀,⑤项不选;
⑥溴水中含有HBr、HBrO,可以和镁粉反应生成MgBr、Mg(BrO)2和H2,⑥项不选;
⑦甲烷为饱和烃,不与溴水反应,⑦项选;
答案选A。
6.A
【详解】A.用K3[Fe(CN)6]溶液检验Fe2+,离子方程式为Fe2++K++[Fe(CN)6]3-=KFe[Fe(CN)6]↓,故A正确;
B.向二元弱酸亚磷酸(H3PO3)溶液中滴加足量的烧碱溶液,离子方程式为H3PO3+2OH-=H+2H2O,故B错误;
C.用惰性电极电解氯化镁溶液,离子方程式为Mg2++2Cl-+2H2OCl2↑+H2↑+2Mg(OH)2↓,故C错误;
D.海水提溴工艺中用二氧化硫还原溴,离子方程式为SO2+Br2+2H2O=4H+++2Br-,故D错误;
故答案选A。
7.A
【详解】A.氯气具有刺激性气味,通过淀粉碘化钾溶液,碘离子被氧化为单质碘,遇到淀粉变蓝,故A正确;
B.反应物中没有溴元素,故不可能生成溴单质,故B错误;
C.氯化氢具有刺激性气味,但是反应物中没有氢元素,故不能生成氯化氢,故C错误;
D.二氧化氮为有刺激性气味的红棕色气体,但是反应物中没有氮元素,故不能生成二氧化氮,故D错误;
故选A。
8.B
【详解】A.胶体的表面积很大,具有吸附性,则氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,因而常用于净水,A正确;
B.次氯酸具有强氧化性,能使有色物质褪色,所以次氯酸有漂白性是因为它有强氧化性,B错误;
C.加碘盐不能长时间炖炒,且应避光、避热保存,原因是加碘盐中的碘酸钾受热易分解,C正确;
D.AgI在空气中易形成结晶核,使空气中水蒸气凝聚,用于人工降雨,D正确;
故选B。
9.B
【详解】A.工业石膏有过多杂质,会影响健康,医用石膏更是如此,故A错误;
B.碘元素是甲状腺激素的重要成分,补充适量的碘元素,可以预防甲状腺肿大等疾病,故B正确;
C.长期食用牛肉膏对人体有危害,甚至可能致癌,故C错误;
D.地沟油,泛指在生活中存在的各类劣质油,长期食用可能会引发癌症,对人体的危害极大,故D错误;
故选B。
10.A
【详解】根据反应IO3- +5I- +6H+==3I2+3H2O,要证明食盐中含有IO3- ,应加入含有I-、H+、淀粉的物质,③碘化钾淀粉试纸可提供I-和淀粉,⑥食醋可提供H+及水,所以必须用到的物质是③⑥,故选A。
11.错误
【详解】应用湿润的淀粉KI试纸检验Cl2是否收集满,故该说法错误。
12.错误
【详解】I2单质能使淀粉变蓝,加碘盐中含有的是KIO3,不能使淀粉变蓝,故该说法错误。
13.正确
【详解】氯气能与碘离子反应生成氯离子和碘单质,碘使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性,故正确。
14.错误
【详解】将KIO3加到普通食盐中可制成加碘食盐,经常食用可消除碘缺乏贫,故错误
15.错误
【详解】能使湿润的淀粉KI试纸变蓝的物质具有强氧化性,不一定为氯气,可为溴等,错误。
16. 黄绿 湿润的淀粉 KI试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 原子半径逐渐增大
【分析】装置A利用高锰酸钾和浓盐酸制备Cl2,Cl2和淀粉-KI试纸中的KI作用,置换出I2,使得试纸变蓝。在装置B和C中,Cl2和NaBr发生置换反应,生成Br2。将活塞b打开,Br2与KI发生置换反应,得到I2。I2被CCl4萃取,下层呈现紫红色。
【详解】(1)A中产生的黄绿色气体为Cl2;
(2)Cl2遇湿润的淀粉 KI试纸时,发生反应:Cl2+2KI=I2+2KCl,产生的I2遇淀粉变蓝,可以证明Cl2的氧化性强于I2;
(3)B中Cl2与NaBr发生置换反应,离子方程式为Cl2+2Br-=2Cl-+Br2;
(4)C中NaBr与Cl2反应生成NaCl和Br2,将C中溶液滴入D中,振荡,发生反应:Br2+2KI=I2+2KBr,静置后D中溶液分层,下层为碘的CCl4溶液,显紫红色,可以说明溴的氧化性强于碘;
(5)过程Ⅲ的B中溶液由黄色变为棕红色,说明仍有Br2生成,由于B与C中溶液相同,故C中通入Cl2不足,NaBr过量,故C的黄色溶液中无Cl2,排除对溴置换碘实验的干扰;
(6)氯、溴、碘单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱。
17. C→E→B→D MnO2+4H++2Cl- Mn2++Cl2↑+2H2O 防止ICl挥发 吸收未反应的氯气,防止污染空气 3I2+6HCl+NaClO36ICl+NaCl+3H2O 用湿润的KI-淀粉试纸检验一氯化碘蒸气,试纸变蓝 在ICl的乙醇溶液中通入乙烯,溶液褪色
【详解】分析:用干燥纯净的氯气与碘反应制备一氯化碘,A装置用二氧化锰和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥,将干燥的氯气通入B中与碘反应,制备ICl,而ICl挥发,所以B应放在冷水中,最后用氢氧化钠(D)处理未反应完的氯气,结合问题分析解答。
详解:(1)①用干燥纯净的氯气与碘反应制备一氯化碘,A装置用二氧化锰和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,因此需要先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥氯气,将干燥的氯气通入B中与碘反应,制备ICl。由于ICl易挥发,所以B应放在冷水中。又因为氯气有毒,需要尾气处理,所以最后用氢氧化钠(D)处理未反应完的氯气,因此装置顺序为:A→C→E→B→D。A中发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
②ICl挥发,所以B应放在冷水中,防止ICl挥发;氯气有毒,用氢氧化钠(D)处理未反应完的氯气,防止污染空气;
(2)粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,碘元素总共升2价,氯元素总共降6价,化合价升降应相等,则碘单质应配3,再由原子守恒可得3I2+6HCl+NaClO36ICl+NaCl+3H2O;
(3)①根据氧化性强的物质制氧化性弱的物质,可用湿润的KI淀粉试纸检验一氯化碘蒸气,试纸变蓝即证明ICl的氧化性比I2强;
②一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,与乙烯发生加成反应,则颜色褪去,即在ICl的乙醇溶液中通入乙烯,溶液褪色说明ICl与乙烯作用发生加成反应。
点睛:本题考查了物质的制备,涉及氧化还原反应、实验装置的选择、实验过程的控制,物质的分离提纯等知识点,为高考频点,注意掌握物质性质灵活运用,善于提取题目的信息。第(3)问是解答的难点和易错点,注意结合已学过的知识(即氧化还原反应规律的应用)和题目中隐含的信息进行知识的迁移灵活应用。
18.(1)平衡气压,使分液漏斗中浓盐酸能顺利滴下
(2)增大了反应物浓度,加快化学反应速率
(3)
(4)乙醇
(5)还原
(6) 大 慢
(7)少量
【详解】(1)由实验装置图可知,橡胶管a的作用是平衡气压,使分液漏斗中浓盐酸能顺利滴下,故答案为:平衡气压,使分液漏斗中浓盐酸能顺利滴下;
(2)已知I2和Cl2在水中溶解度很小,但易溶于CCl4中,故装置B中的作用是增大了反应物浓度,加快化学反应速率,故答案为:增大了反应物浓度,加快化学反应速率;
(3)装置B中制取即I2和Cl2、H2O反应生成HIO3和HCl,根据氧化还原反应配平可得该反应的化学反应方程式为,故答案为:;
(4)由题干已知信息可知,KIO3溶于水,难溶于乙醇,则从B中分离出HIO3溶液,加入KOH溶液中和制得KIO3溶液,再加入适量乙醇,以减小KIO3的溶解性便于析出,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得KIO3晶体,故答案为:乙醇;
(5)溶液变蓝,说明KIO3与NaHSO3反应得到了I2,故表明NaHSO3体现了还原性,故答案为:还原;
(6)①反应需要的活化能越大,反应越难进行,反应速率越慢,故猜想a:T秒前未生成I2,是由于反应的活化能大,反应速率慢导致的,故答案为:大;慢;
②猜想b:T秒前生成了I2,但由于存在NaHSO3,I2迅速被消耗,即I2与NaHSO3反应生成NaI和Na2SO4,故该反应为,故答案为:;
(7)由上述分析可知,证明猜想b成立的话是因为发生了反应:,故若向实验A的蓝色溶液中加入少量的NaHSO3,蓝色迅速消失,然后发生5I-++6H+=3I2+3H2O,后再次变蓝,故答案为:少量的NaHSO3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
