亚硫酸及其盐试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 亚硫酸及其盐试题 高考化学考前专项复习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 661.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
亚硫酸及其盐
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列除杂方法正确的是(括号内为杂质)
A.SO2(SO3),通过放置在冰水浴中的U形管
B.Na2SO3溶液(Na2SO4),滴加BaCl2溶液后过滤
C.SO2(CO2),通过NaOH溶液
D.CO2(SO2),通过饱和Na2CO3溶液
2.下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 主要成分 杂质 除杂试剂 分离操作
A 铜粉 铁粉 FeCl3溶液 过滤
B SO2 HCl 饱和NaHCO3 洗气
C Na2SO4 Na2SO3 双氧水 结晶
D NaBr NaI 氯水 分液
A.A B.B C.C D.D
3.依据下列实验操作及现象,可以得出SO体现还原性这一结论的是
序号 操作 现象
A 向Na2SO3溶液中加入盐酸 产生气泡
B 向Na2SO3溶液中加入酸性高锰酸钾溶液 溶液褪色
C 向Na2SO3溶液中加入BaCl2溶液 产生白色沉淀
D 向Na2SO3溶液中加入酸性Na2S溶液 产生黄色沉淀
A.A B.B C.C D.D
4.下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化
⑤浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
A.①③④ B.①② C.① D.①②⑤
5.下列反应中,会有沉淀生成的是
A.通入溶液
B.将金属投入溶液中
C.向久置的溶液中加入溶液,再加入稀盐酸
D.过量通入澄清石灰水
6.下列是对“某溶液”进行离子检测的方法和结论,其中说法正确的是
A.加入稀HCl产生能使澄清石灰水变浑浊的无色气体,则溶液中一定含有
B.先加入氯水,再加入KSCN溶液显红色,则溶液中一定含有Fe3+
C.依次加入BaCl2溶液、HNO3溶液,有白色沉淀产生,则溶液中一定含有
D.加入HNO3酸化的AgNO3液,有白色沉淀产生,则溶液中一定含有Cl-
7.下列方案设计、现象和结论有正确的是
目的 方案设计 现象和结论
A 鉴定与溴蒸气 两气体分别通入淀粉KI溶液中 变蓝色的是通入溴蒸气
B 检验固体混合物是否存在铵盐 将固体溶于水,加入足量浓NaOH溶液,加热,用红色湿润石蕊试纸检验产生的气体 若试纸不变蓝,说明固体中不存在铵盐
C 检验的氧化性 在溶液中加入溶液 若溶液出现淡黄色沉淀,则说明具有氧化性
D 检验火柴头中的氯元素 取用火柴头浸泡过的溶液,加溶液、稀硝酸和溶液 若出现白色沉淀,说明有氯元素
A.A B.B C.C D.D
8.根据下列实验操作和现象所得到的实验结论正确的是
选项 实验操作和现象 实验结论
A 将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色 该废铁屑中不含三价铁
B 向Na2SO3溶液中先加入少量BaCl2溶液,生成白色沉淀,过滤、洗涤,然后再向沉淀上加入稀盐酸,沉淀不溶解 Na2SO3溶液已经变质
C 将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中,产生白色沉淀 非金属性:Cl>C>Si
D 将乙烯通入酸性KMnO4溶液中,溶液的紫红色褪去 乙烯具有漂白性
A.A B.B C.C D.D
9.下列反应方程式书写不正确的是
A.铝与NaOH溶液产生气泡:
B.用浓氨水检验氯气泄漏:
C.溶液与少量NaOH溶液反应:
D.向酸性溶液中加入足量溶液:
10.在酸性高锰酸钾溶液中,可能大量共存的离子是
A. B. C. D.
二、判断题
11.用溶液吸收少量。(_______)
12.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO。(__)
13.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染。(___________)
14.向新制氯水中加入碳酸钙粉末或亚硫酸钙粉末,能增大氯水的漂白效果。(________)
15.向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,则部分Na2SO3被氧化。(__)
三、解答题
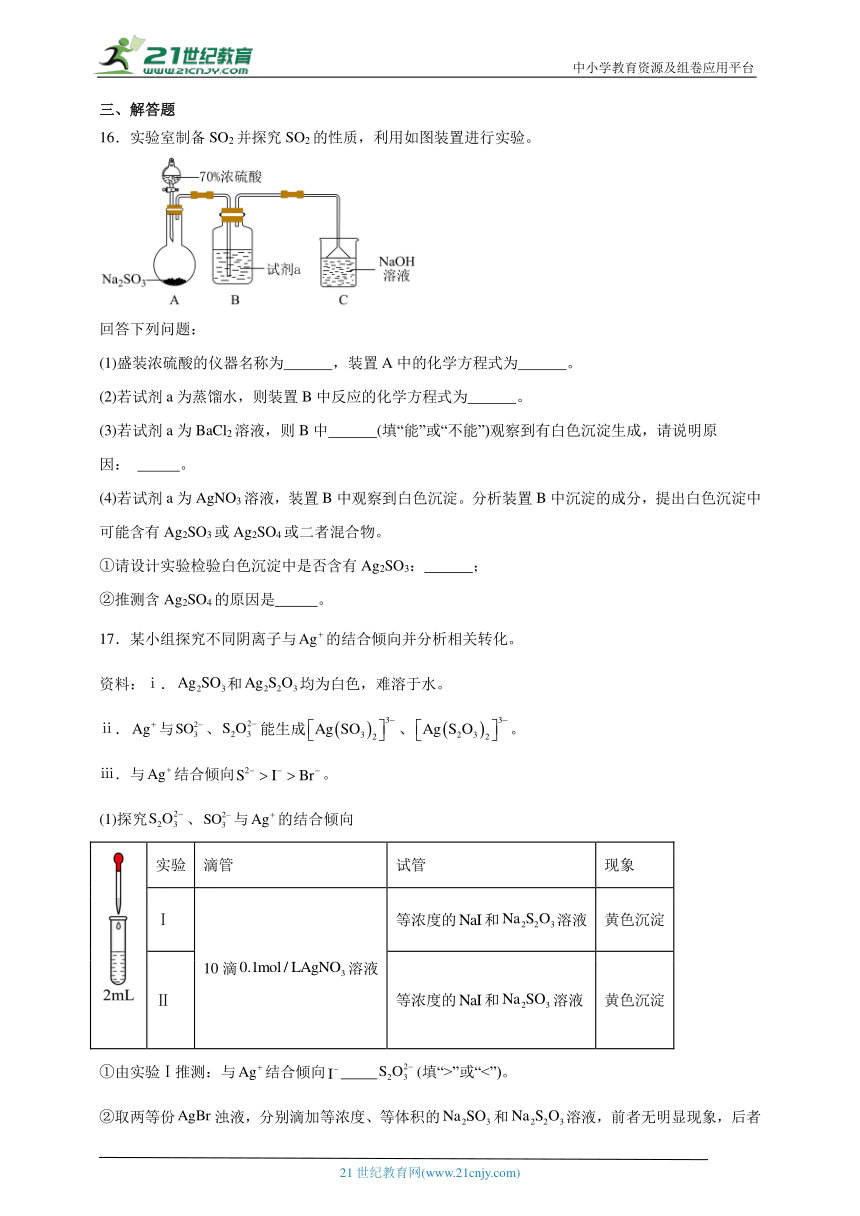
16.实验室制备SO2并探究SO2的性质,利用如图装置进行实验。
回答下列问题:
(1)盛装浓硫酸的仪器名称为 ,装置A中的化学方程式为 。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为 。
(3)若试剂a为BaCl2溶液,则B中 (填“能”或“不能”)观察到有白色沉淀生成,请说明原因: 。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3: ;
②推测含Ag2SO4的原因是 。
17.某小组探究不同阴离子与的结合倾向并分析相关转化。
资料:ⅰ.和均为白色,难溶于水。
ⅱ.与、能生成、。
ⅲ.与结合倾向。
(1)探究、与的结合倾向
实验 滴管 试管 现象
Ⅰ 10滴溶液 等浓度的和溶液 黄色沉淀
Ⅱ 等浓度的和溶液 黄色沉淀
①由实验Ⅰ推测:与结合倾向 (填“>”或“<”)。
②取两等份浊液,分别滴加等浓度、等体积的和溶液,前者无明显现象,后者浊液变澄清,澄清溶液中价银的主要存在形式 (填化学式)。推测:与结合倾向。查阅资料证实了上述推测。
(2)的转化
实验 滴管 试管 现象
Ⅲ 溶液 溶液 白色沉淀,振荡后消失
Ⅳ 溶液 溶液 白色沉淀,逐渐变为灰色,最终为黑色沉淀
①写出实验Ⅲ中白色沉淀消失的离子方程式 。
②查阅资料:实验Ⅳ中黑色沉淀是,中S元素的化合价分别为和。写出实验Ⅳ中白色沉淀变为黑色的化学方程式: 。
③溶液可用作定影液。向溶液溶解之后的废定影液中,加入 (填试剂和操作),可重新得到。
(3)的转化
分析试管1出现银镜的原因 。
(4)资料显示:与结构相似,可看作外围的一个O被S替换的结果。但与的配位倾向:,试从结构角度解释原因 。
18.设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性溶液会发生氧化还原反应,被还原为。
ⅱ.与反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和溶液,加入少量冰醋酸,再滴加5滴的溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴的溶液, (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性溶液反应的离子方程式
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性溶液的反应。若还原反应为:,则氧化反应为: 。
(5)某同学结合所学知识设计处理工业废气中和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的,生成,写出该反应的离子方程式
②再向生成的溶液中加入一定量 ,以此溶液来吸收NO气体。
参考答案:
1.A
【详解】A.SO3的熔沸点较高,冰水浴中会变为固态,所以将混合气体通过放置在冰水浴中的U形管可以得到纯净的SO2,A正确;
B.硫酸钠、亚硫酸钠都可以和氯化钡反应生成沉淀,达不到分离提纯的目的,B错误;
C.SO2和CO2都能和NaOH溶液反应,达不到分离提纯的目的,C错误;
D.CO2和SO2都能和饱和Na2CO3溶液反应,二氧化碳不与饱和碳酸氢钠溶液反应,应该用饱和NaHCO3溶液除去二氧化硫,D错误;
综上所述答案为A。
2.C
【详解】A.铜和铁均能和FeCl3溶液反应而溶解,不能除杂,A错误;
B.二氧化硫和饱和NaHCO3溶液反应生成亚硫酸钠、水和二氧化碳,氯化氢也能与饱和碳酸氢钠溶液反应,不能除杂,B错误;
C.Na2SO3有还原性,双氧水能将Na2SO3氧化物Na2SO4,然后通过结晶得到Na2SO4,能除杂,C正确;
D.氯水既能氧化NaI,又能氧化NaBr,不能除杂,D错误;
答案选C。
3.B
【详解】A.向Na2SO3溶液中加入盐酸发生反应Na2SO3+2HCl=2NaCl+SO2↑+H2O,生成SO2气体,体现的是亚硫酸的弱酸性,A不符合题意;
B.向Na2SO3溶液中加入酸性高锰酸钾溶液,溶液褪色,说明SO将高锰酸根还原,体现了SO的还原性,B符合题意;
C.向Na2SO3溶液中加入BaCl2溶液,生成亚硫酸钡沉淀,发生的是复分解反应,C不符合题意;
D.向Na2SO3溶液中加入酸性Na2S溶液,生成硫单质,SO将S2-氧化,体现了SO的氧化性,D不符合题意;
综上所述答案为B。
4.C
【详解】
①浓硝酸具有不稳定性,见光易分解,通常保存在棕色试剂瓶中,故①正确;
②硝酸具有强的氧化性能够氧化亚硫酸根离子,对硫酸根离子的检验造成干扰,不能用硝酸酸化,故②错误;
③硝酸具有强氧化性与任何金属反应都不产生氢气,产生的是氮氧化合物,故③错误;
④铁与硝酸反应首先生成硝酸铁,溶液呈浅绿色是由过量的铁与铁离子反应生成亚铁离子所致,故④错误;
⑤浓硫酸滴到纸张上变黑,体现浓硫酸的脱水性,故⑤错误;
正确的选项只有①,选项C符合题意;
故选C。
5.C
【详解】A.二氧化碳和氯化钙不能反应,A错误;
B.钠和水反应生成氢氧化钠和氢气,氢氧化钠和硝酸钡不反应,没有沉淀生成,B错误;
C.久置的亚硫酸钠会被氧化为硫酸钠,硫酸钠可以和氯化钡反应生成硫酸钡白色沉淀,C正确;
D.过量的二氧化硫和澄清石灰水反应生成亚硫酸氢钙,没有沉淀生成,D错误;
故选C。
6.D
【详解】A.加入稀HCl产生能使澄清石灰水变浑浊的无色气体,该气体可能是CO2,也可能是SO2,则溶液中可能含有,也可能含有或、,不一定含有,A错误;
B.向溶液中先加入氯水,再加入KSCN溶液显红色,说明加入氯水后的溶液中含有Fe3+,该Fe3+可能是原溶液中含有的,也可能是Fe2+被氯水氧化产生的,因此不能确定原溶液中是否含有Fe3+,B错误;
C.由于HNO3具有强氧化性,可能会将氧化为,所以向某溶液中依次加入BaCl2溶液、HNO3溶液,有白色沉淀产生,则溶液中可能含有,加入BaCl2溶液时产生BaSO3白色沉淀,再加入稀HNO3,HNO3将BaSO3氧化为BaSO4白色沉淀,因此原溶液中不一定含有,C错误;
D.由于AgCl是白色既不溶于水、也不溶于稀硝酸的物质,所以向某溶液中加入HNO3酸化的AgNO3液,有白色沉淀产生,则溶液中一定含有Cl-,D正确;
故合理选项是D。
7.D
【详解】A.与溴蒸气均能把碘离子氧化为碘单质,故分别通入淀粉KI溶液中,均能变蓝,A错误;
B.铵根与亚硝酸根离子能在水溶液中发生归中反应产生氮气。则:将固体混合物溶于水,加入足量浓NaOH溶液,加热,用红色湿润石蕊试纸检验产生的气体,若试纸不变蓝,不能说明固体中不存在铵盐,B错误;
C.在溶液中加入溶液不发生反应,在酸性条件下,氢离子、亚硫酸根离子和硫离子发生反应生成硫和水,溶液出现淡黄色沉淀, C错误;
D.氯酸钾、硝酸银和亚硝酸钠反应生成氯化银白色沉淀,则:取用火柴头浸泡过的溶液,加溶液、稀硝酸和溶液,若出现白色沉淀,说明有氯元素, D正确;
答案选D。
8.B
【详解】A.将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色,说明溶液中未见Fe3+,可能是Fe2O3与HCl反应产生FeCl3,反应产生的FeCl3与Fe反应产生FeCl2,因此不能说该废铁屑中不含三价铁,A错误;
B.向Na2SO3溶液中先加入少量Ba(NO3)2溶液,二者发生复分解反应产生BaSO3白色沉淀,过滤、洗涤,然后再向沉淀上加入稀盐酸,BaSO3与盐酸反应产生BaCl2、H2O、CO2,因此看到沉淀溶解,若变质为Na2SO4,Na2SO4与Ba(NO3)2反应产生BaSO4,BaSO4是白色不溶于水和盐酸的物质,因此向产生的沉淀中加入盐酸,沉淀不能溶解,说明Na2SO3溶液已经变质,B正确;
C.产生的气体中可能混入了挥发出来的氯化氢,另外盐酸也不是氯的最高价氧化物对应的水化物,故不能通过该现象证明酸性的强弱,C错误;
D.乙烯通入酸性KMnO4溶液中,溶液的紫红色褪去,是因为乙烯被KMnO4溶液氧化,不是因为乙烯有漂白性,D错误;
故选B。
9.D
【详解】A.铝与NaOH溶液产生气泡其反应方程式为:,故其离子方程式为:,A正确;
B.用浓氨水检验氯气泄漏,若泄漏则可观察到产生白烟,其反应原理为:,B正确;
C.溶液与少量NaOH溶液反应生成CaCO3、NaHCO3和H2O,故其离子方程式为:,C正确;
D.已知H2SO3是二元弱酸,故NaHSO3=Na++,则向酸性溶液中加入足量溶液的离子方程式为:,D错误;
故答案为:D。
10.C
【详解】A. 具有还原性,可以被酸性高锰酸钾溶液氧化,故A不选;
B. 具有还原性,可以被酸性高锰酸钾溶液氧化,故B不选;
C. 不能被酸性高锰酸钾溶液氧化,故C 选;
D. 与酸反应生成碳酸氢根或二氧化碳和水,故D不选;
故选C。
11.正确
【详解】氯气与发生氧化还原反应:,生成的氢离子与过量的反应生成,故离子方程式为,故正确。
12.错误
【详解】酸性条件下硝酸根离子具有强氧化性,能氧化亚硫酸根离子为硫酸根离子,故向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,不能说明该溶液中一定有SO,判断为错误。
13.错误
【详解】石灰石高温煅烧产生的氧化钙可以和有毒气体二氧化硫之间反应,生成亚硫酸钙不稳定,易被氧气氧化为稳定的硫酸钙,实现煤的脱硫,故错误。
【点睛】
14.错误
【详解】氯气和水反应是可逆反应:Cl2+H2OHCl+HClO,向新制氯水中加入碳酸钙粉末,碳酸钙和HCl反应,不能和次氯酸反应,可以使平衡正向移动,增大次氯酸的浓度,进而增大氯水的漂白效果;向氯水中加入亚硫酸钙粉末,亚硫酸钙中的硫为+4价,具有较强的还原性,能和次氯酸发生氧化还原反应,不能增大氯水的漂白效果,故错误。
15.正确
【详解】Na2SO3具有还原性,会被溶解在溶液中的O2氧化为Na2SO4,向其中加入足量BaCl2溶液时,Na2SO4与BaCl2反应产生既不溶于水也不溶于酸的BaSO4沉淀;而未氧化变质的Na2SO3与BaCl2反应产生BaSO3不溶于水的沉淀,当向白色沉淀中加入足量稀盐酸,BaSO3与盐酸反应产生可溶性BaCl2及H2O、SO2,故向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,说明溶液中部分Na2SO3被氧化,该说法是正确的。
16.(1) 分液漏斗 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)SO2+H2OH2SO3
(3) 不能 SO2与BaCl2不反应
(4) 取装置B中所得白色沉淀少许,滴加浓硫酸,将生成的气体通入品红溶液中,若品红溶液颜色变浅(或褪色),说明含有Ag2SO3,若品红溶液无明显变化,则说明不含 Ag2SO3可能在酸性环境中被NO氧化
【分析】
装置A中亚硫酸钠与浓硫酸反应生成二氧化硫,装置B用于探究二氧化硫的性质,装置C吸收多余的二氧化硫,防止污染环境。
【详解】(1)实验室用浓硫酸和固体亚硫酸钠制备,盛装浓硫酸的仪器名称为分液漏斗,制备的化学方程式为。
(2)和的反应为可逆反应:。
(3)与不反应,故B中不能观察到有白色沉淀生成。
(4)①取装置B中所得白色沉淀少许,滴加浓硫酸,将生成的气体通入品红溶液中,若品红溶液颜色变浅(或褪色),说明含有,若品红溶液无明显变化,则说明不含;
②具有还原性,在酸性环境中被氧化。
17.(1) >
(2) 硫化钠溶液至不再产生黑色固体,过滤
(3)在碱性加热条件下生成了银单质和硫酸根
(4)两者都是四面体结构,硫酸根中是氧原子和银离子形成配位,可看作外围的一个O被S替换的结果,氧的电负性更强不易于硫原子,银离子形成配位,配位键不稳定,S与银离子形成的配位键更稳定,所以与的配位倾向:
【详解】(1)①由实验Ⅰ推测:均为白色,难溶于水,黄色沉淀,硝酸银加入混合液溶液产生黄色沉淀可知与结合倾向> ;
②取两等份浊液,分别滴加等浓度、等体积的和溶液,前者无明显现象,后者浊液变澄清,说明亚硫酸根和银离子结合能力弱于溴离子,澄清溶液中说明形成了配合物和银离子结合能力强于溴离子,价银的主要存在形式;
(2)①实验Ⅲ中白色沉淀消失的离子方程式;
②实验Ⅳ中白色沉淀变为黑色的化学方程式:;
③溶液可用作定影液。向溶液溶解之后的废定影液中,加入硫化钠溶液至不再产生黑色固体,过滤,可重新得到;
(3)分析试管1出现银镜的原因在碱性加热条件下生成了银单质和硫酸根;
(4)与结构相似,可看作外围的一个O被S替换的结果。但与的配位倾向:,原因是两者都是四面体结构,硫酸根中是氧原子和银离子形成配位,可看作外围的一个O被S替换的结果,氧的电负性更强不易于硫原子,银离子形成配位,配位键不稳定,S与银离子形成的配位键更稳定,所以与的配位倾向:。
18.(1)出现黄色沉淀
(2)排除对检验的干扰
(3)
(4)
(5) NaOH
【分析】某小组通过实验探究NO的某些性质,用排水法收集一瓶NO,将其倒扣在盛有碱性溶液的水槽中,振荡,观察到集气瓶中液面上升,的氧化产物为硫酸根离子, 被还原为,检验反应产物时,要排除硫酸根离子等的干扰,以此解答。
【详解】(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴的溶液,根据信息:与反应生成黄色沉淀、结合分析可知,实验现象为:出现黄色沉淀。
(2)银离子能与硫酸根离子产生沉淀,再利用信息:Ag+与反应生成黄色沉淀,则实验Ⅱ的目的是:排除对检验的干扰。
(3)据分析,NO与碱性溶液反应生成、和H2O,反应中,氮元素从+2价升高到+1价、硫元素从+4价升高到+6价,则按得失电子数守恒、电荷守恒、元素质量守恒得离子方程式。
(4)氧化反应为:的氧化产物为硫酸根离子,硫元素化合价升高,结合守恒可知相应的离子方程式为。
(5)某同学结合所学知识设计处理工业废气中和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的,生成,则同时生成亚硫酸钠,该反应的离子方程式:。
②根据资料ⅰ可知:应再向生成的溶液中加入一定量NaOH,以此溶液来吸收NO气体。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
亚硫酸及其盐
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列除杂方法正确的是(括号内为杂质)
A.SO2(SO3),通过放置在冰水浴中的U形管
B.Na2SO3溶液(Na2SO4),滴加BaCl2溶液后过滤
C.SO2(CO2),通过NaOH溶液
D.CO2(SO2),通过饱和Na2CO3溶液
2.下列试剂中混有的杂质,其除杂试剂和分离操作都正确的是
编号 主要成分 杂质 除杂试剂 分离操作
A 铜粉 铁粉 FeCl3溶液 过滤
B SO2 HCl 饱和NaHCO3 洗气
C Na2SO4 Na2SO3 双氧水 结晶
D NaBr NaI 氯水 分液
A.A B.B C.C D.D
3.依据下列实验操作及现象,可以得出SO体现还原性这一结论的是
序号 操作 现象
A 向Na2SO3溶液中加入盐酸 产生气泡
B 向Na2SO3溶液中加入酸性高锰酸钾溶液 溶液褪色
C 向Na2SO3溶液中加入BaCl2溶液 产生白色沉淀
D 向Na2SO3溶液中加入酸性Na2S溶液 产生黄色沉淀
A.A B.B C.C D.D
4.下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化
⑤浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
A.①③④ B.①② C.① D.①②⑤
5.下列反应中,会有沉淀生成的是
A.通入溶液
B.将金属投入溶液中
C.向久置的溶液中加入溶液,再加入稀盐酸
D.过量通入澄清石灰水
6.下列是对“某溶液”进行离子检测的方法和结论,其中说法正确的是
A.加入稀HCl产生能使澄清石灰水变浑浊的无色气体,则溶液中一定含有
B.先加入氯水,再加入KSCN溶液显红色,则溶液中一定含有Fe3+
C.依次加入BaCl2溶液、HNO3溶液,有白色沉淀产生,则溶液中一定含有
D.加入HNO3酸化的AgNO3液,有白色沉淀产生,则溶液中一定含有Cl-
7.下列方案设计、现象和结论有正确的是
目的 方案设计 现象和结论
A 鉴定与溴蒸气 两气体分别通入淀粉KI溶液中 变蓝色的是通入溴蒸气
B 检验固体混合物是否存在铵盐 将固体溶于水,加入足量浓NaOH溶液,加热,用红色湿润石蕊试纸检验产生的气体 若试纸不变蓝,说明固体中不存在铵盐
C 检验的氧化性 在溶液中加入溶液 若溶液出现淡黄色沉淀,则说明具有氧化性
D 检验火柴头中的氯元素 取用火柴头浸泡过的溶液,加溶液、稀硝酸和溶液 若出现白色沉淀,说明有氯元素
A.A B.B C.C D.D
8.根据下列实验操作和现象所得到的实验结论正确的是
选项 实验操作和现象 实验结论
A 将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色 该废铁屑中不含三价铁
B 向Na2SO3溶液中先加入少量BaCl2溶液,生成白色沉淀,过滤、洗涤,然后再向沉淀上加入稀盐酸,沉淀不溶解 Na2SO3溶液已经变质
C 将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中,产生白色沉淀 非金属性:Cl>C>Si
D 将乙烯通入酸性KMnO4溶液中,溶液的紫红色褪去 乙烯具有漂白性
A.A B.B C.C D.D
9.下列反应方程式书写不正确的是
A.铝与NaOH溶液产生气泡:
B.用浓氨水检验氯气泄漏:
C.溶液与少量NaOH溶液反应:
D.向酸性溶液中加入足量溶液:
10.在酸性高锰酸钾溶液中,可能大量共存的离子是
A. B. C. D.
二、判断题
11.用溶液吸收少量。(_______)
12.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO。(__)
13.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染。(___________)
14.向新制氯水中加入碳酸钙粉末或亚硫酸钙粉末,能增大氯水的漂白效果。(________)
15.向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,则部分Na2SO3被氧化。(__)
三、解答题
16.实验室制备SO2并探究SO2的性质,利用如图装置进行实验。
回答下列问题:
(1)盛装浓硫酸的仪器名称为 ,装置A中的化学方程式为 。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为 。
(3)若试剂a为BaCl2溶液,则B中 (填“能”或“不能”)观察到有白色沉淀生成,请说明原因: 。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3: ;
②推测含Ag2SO4的原因是 。
17.某小组探究不同阴离子与的结合倾向并分析相关转化。
资料:ⅰ.和均为白色,难溶于水。
ⅱ.与、能生成、。
ⅲ.与结合倾向。
(1)探究、与的结合倾向
实验 滴管 试管 现象
Ⅰ 10滴溶液 等浓度的和溶液 黄色沉淀
Ⅱ 等浓度的和溶液 黄色沉淀
①由实验Ⅰ推测:与结合倾向 (填“>”或“<”)。
②取两等份浊液,分别滴加等浓度、等体积的和溶液,前者无明显现象,后者浊液变澄清,澄清溶液中价银的主要存在形式 (填化学式)。推测:与结合倾向。查阅资料证实了上述推测。
(2)的转化
实验 滴管 试管 现象
Ⅲ 溶液 溶液 白色沉淀,振荡后消失
Ⅳ 溶液 溶液 白色沉淀,逐渐变为灰色,最终为黑色沉淀
①写出实验Ⅲ中白色沉淀消失的离子方程式 。
②查阅资料:实验Ⅳ中黑色沉淀是,中S元素的化合价分别为和。写出实验Ⅳ中白色沉淀变为黑色的化学方程式: 。
③溶液可用作定影液。向溶液溶解之后的废定影液中,加入 (填试剂和操作),可重新得到。
(3)的转化
分析试管1出现银镜的原因 。
(4)资料显示:与结构相似,可看作外围的一个O被S替换的结果。但与的配位倾向:,试从结构角度解释原因 。
18.设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性溶液会发生氧化还原反应,被还原为。
ⅱ.与反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和溶液,加入少量冰醋酸,再滴加5滴的溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴的溶液, (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性溶液反应的离子方程式
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性溶液的反应。若还原反应为:,则氧化反应为: 。
(5)某同学结合所学知识设计处理工业废气中和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的,生成,写出该反应的离子方程式
②再向生成的溶液中加入一定量 ,以此溶液来吸收NO气体。
参考答案:
1.A
【详解】A.SO3的熔沸点较高,冰水浴中会变为固态,所以将混合气体通过放置在冰水浴中的U形管可以得到纯净的SO2,A正确;
B.硫酸钠、亚硫酸钠都可以和氯化钡反应生成沉淀,达不到分离提纯的目的,B错误;
C.SO2和CO2都能和NaOH溶液反应,达不到分离提纯的目的,C错误;
D.CO2和SO2都能和饱和Na2CO3溶液反应,二氧化碳不与饱和碳酸氢钠溶液反应,应该用饱和NaHCO3溶液除去二氧化硫,D错误;
综上所述答案为A。
2.C
【详解】A.铜和铁均能和FeCl3溶液反应而溶解,不能除杂,A错误;
B.二氧化硫和饱和NaHCO3溶液反应生成亚硫酸钠、水和二氧化碳,氯化氢也能与饱和碳酸氢钠溶液反应,不能除杂,B错误;
C.Na2SO3有还原性,双氧水能将Na2SO3氧化物Na2SO4,然后通过结晶得到Na2SO4,能除杂,C正确;
D.氯水既能氧化NaI,又能氧化NaBr,不能除杂,D错误;
答案选C。
3.B
【详解】A.向Na2SO3溶液中加入盐酸发生反应Na2SO3+2HCl=2NaCl+SO2↑+H2O,生成SO2气体,体现的是亚硫酸的弱酸性,A不符合题意;
B.向Na2SO3溶液中加入酸性高锰酸钾溶液,溶液褪色,说明SO将高锰酸根还原,体现了SO的还原性,B符合题意;
C.向Na2SO3溶液中加入BaCl2溶液,生成亚硫酸钡沉淀,发生的是复分解反应,C不符合题意;
D.向Na2SO3溶液中加入酸性Na2S溶液,生成硫单质,SO将S2-氧化,体现了SO的氧化性,D不符合题意;
综上所述答案为B。
4.C
【详解】
①浓硝酸具有不稳定性,见光易分解,通常保存在棕色试剂瓶中,故①正确;
②硝酸具有强的氧化性能够氧化亚硫酸根离子,对硫酸根离子的检验造成干扰,不能用硝酸酸化,故②错误;
③硝酸具有强氧化性与任何金属反应都不产生氢气,产生的是氮氧化合物,故③错误;
④铁与硝酸反应首先生成硝酸铁,溶液呈浅绿色是由过量的铁与铁离子反应生成亚铁离子所致,故④错误;
⑤浓硫酸滴到纸张上变黑,体现浓硫酸的脱水性,故⑤错误;
正确的选项只有①,选项C符合题意;
故选C。
5.C
【详解】A.二氧化碳和氯化钙不能反应,A错误;
B.钠和水反应生成氢氧化钠和氢气,氢氧化钠和硝酸钡不反应,没有沉淀生成,B错误;
C.久置的亚硫酸钠会被氧化为硫酸钠,硫酸钠可以和氯化钡反应生成硫酸钡白色沉淀,C正确;
D.过量的二氧化硫和澄清石灰水反应生成亚硫酸氢钙,没有沉淀生成,D错误;
故选C。
6.D
【详解】A.加入稀HCl产生能使澄清石灰水变浑浊的无色气体,该气体可能是CO2,也可能是SO2,则溶液中可能含有,也可能含有或、,不一定含有,A错误;
B.向溶液中先加入氯水,再加入KSCN溶液显红色,说明加入氯水后的溶液中含有Fe3+,该Fe3+可能是原溶液中含有的,也可能是Fe2+被氯水氧化产生的,因此不能确定原溶液中是否含有Fe3+,B错误;
C.由于HNO3具有强氧化性,可能会将氧化为,所以向某溶液中依次加入BaCl2溶液、HNO3溶液,有白色沉淀产生,则溶液中可能含有,加入BaCl2溶液时产生BaSO3白色沉淀,再加入稀HNO3,HNO3将BaSO3氧化为BaSO4白色沉淀,因此原溶液中不一定含有,C错误;
D.由于AgCl是白色既不溶于水、也不溶于稀硝酸的物质,所以向某溶液中加入HNO3酸化的AgNO3液,有白色沉淀产生,则溶液中一定含有Cl-,D正确;
故合理选项是D。
7.D
【详解】A.与溴蒸气均能把碘离子氧化为碘单质,故分别通入淀粉KI溶液中,均能变蓝,A错误;
B.铵根与亚硝酸根离子能在水溶液中发生归中反应产生氮气。则:将固体混合物溶于水,加入足量浓NaOH溶液,加热,用红色湿润石蕊试纸检验产生的气体,若试纸不变蓝,不能说明固体中不存在铵盐,B错误;
C.在溶液中加入溶液不发生反应,在酸性条件下,氢离子、亚硫酸根离子和硫离子发生反应生成硫和水,溶液出现淡黄色沉淀, C错误;
D.氯酸钾、硝酸银和亚硝酸钠反应生成氯化银白色沉淀,则:取用火柴头浸泡过的溶液,加溶液、稀硝酸和溶液,若出现白色沉淀,说明有氯元素, D正确;
答案选D。
8.B
【详解】A.将废铁屑溶于过量盐酸,滴入KSCN溶液,未见溶液变为红色,说明溶液中未见Fe3+,可能是Fe2O3与HCl反应产生FeCl3,反应产生的FeCl3与Fe反应产生FeCl2,因此不能说该废铁屑中不含三价铁,A错误;
B.向Na2SO3溶液中先加入少量Ba(NO3)2溶液,二者发生复分解反应产生BaSO3白色沉淀,过滤、洗涤,然后再向沉淀上加入稀盐酸,BaSO3与盐酸反应产生BaCl2、H2O、CO2,因此看到沉淀溶解,若变质为Na2SO4,Na2SO4与Ba(NO3)2反应产生BaSO4,BaSO4是白色不溶于水和盐酸的物质,因此向产生的沉淀中加入盐酸,沉淀不能溶解,说明Na2SO3溶液已经变质,B正确;
C.产生的气体中可能混入了挥发出来的氯化氢,另外盐酸也不是氯的最高价氧化物对应的水化物,故不能通过该现象证明酸性的强弱,C错误;
D.乙烯通入酸性KMnO4溶液中,溶液的紫红色褪去,是因为乙烯被KMnO4溶液氧化,不是因为乙烯有漂白性,D错误;
故选B。
9.D
【详解】A.铝与NaOH溶液产生气泡其反应方程式为:,故其离子方程式为:,A正确;
B.用浓氨水检验氯气泄漏,若泄漏则可观察到产生白烟,其反应原理为:,B正确;
C.溶液与少量NaOH溶液反应生成CaCO3、NaHCO3和H2O,故其离子方程式为:,C正确;
D.已知H2SO3是二元弱酸,故NaHSO3=Na++,则向酸性溶液中加入足量溶液的离子方程式为:,D错误;
故答案为:D。
10.C
【详解】A. 具有还原性,可以被酸性高锰酸钾溶液氧化,故A不选;
B. 具有还原性,可以被酸性高锰酸钾溶液氧化,故B不选;
C. 不能被酸性高锰酸钾溶液氧化,故C 选;
D. 与酸反应生成碳酸氢根或二氧化碳和水,故D不选;
故选C。
11.正确
【详解】氯气与发生氧化还原反应:,生成的氢离子与过量的反应生成,故离子方程式为,故正确。
12.错误
【详解】酸性条件下硝酸根离子具有强氧化性,能氧化亚硫酸根离子为硫酸根离子,故向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,不能说明该溶液中一定有SO,判断为错误。
13.错误
【详解】石灰石高温煅烧产生的氧化钙可以和有毒气体二氧化硫之间反应,生成亚硫酸钙不稳定,易被氧气氧化为稳定的硫酸钙,实现煤的脱硫,故错误。
【点睛】
14.错误
【详解】氯气和水反应是可逆反应:Cl2+H2OHCl+HClO,向新制氯水中加入碳酸钙粉末,碳酸钙和HCl反应,不能和次氯酸反应,可以使平衡正向移动,增大次氯酸的浓度,进而增大氯水的漂白效果;向氯水中加入亚硫酸钙粉末,亚硫酸钙中的硫为+4价,具有较强的还原性,能和次氯酸发生氧化还原反应,不能增大氯水的漂白效果,故错误。
15.正确
【详解】Na2SO3具有还原性,会被溶解在溶液中的O2氧化为Na2SO4,向其中加入足量BaCl2溶液时,Na2SO4与BaCl2反应产生既不溶于水也不溶于酸的BaSO4沉淀;而未氧化变质的Na2SO3与BaCl2反应产生BaSO3不溶于水的沉淀,当向白色沉淀中加入足量稀盐酸,BaSO3与盐酸反应产生可溶性BaCl2及H2O、SO2,故向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,说明溶液中部分Na2SO3被氧化,该说法是正确的。
16.(1) 分液漏斗 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)SO2+H2OH2SO3
(3) 不能 SO2与BaCl2不反应
(4) 取装置B中所得白色沉淀少许,滴加浓硫酸,将生成的气体通入品红溶液中,若品红溶液颜色变浅(或褪色),说明含有Ag2SO3,若品红溶液无明显变化,则说明不含 Ag2SO3可能在酸性环境中被NO氧化
【分析】
装置A中亚硫酸钠与浓硫酸反应生成二氧化硫,装置B用于探究二氧化硫的性质,装置C吸收多余的二氧化硫,防止污染环境。
【详解】(1)实验室用浓硫酸和固体亚硫酸钠制备,盛装浓硫酸的仪器名称为分液漏斗,制备的化学方程式为。
(2)和的反应为可逆反应:。
(3)与不反应,故B中不能观察到有白色沉淀生成。
(4)①取装置B中所得白色沉淀少许,滴加浓硫酸,将生成的气体通入品红溶液中,若品红溶液颜色变浅(或褪色),说明含有,若品红溶液无明显变化,则说明不含;
②具有还原性,在酸性环境中被氧化。
17.(1) >
(2) 硫化钠溶液至不再产生黑色固体,过滤
(3)在碱性加热条件下生成了银单质和硫酸根
(4)两者都是四面体结构,硫酸根中是氧原子和银离子形成配位,可看作外围的一个O被S替换的结果,氧的电负性更强不易于硫原子,银离子形成配位,配位键不稳定,S与银离子形成的配位键更稳定,所以与的配位倾向:
【详解】(1)①由实验Ⅰ推测:均为白色,难溶于水,黄色沉淀,硝酸银加入混合液溶液产生黄色沉淀可知与结合倾向> ;
②取两等份浊液,分别滴加等浓度、等体积的和溶液,前者无明显现象,后者浊液变澄清,说明亚硫酸根和银离子结合能力弱于溴离子,澄清溶液中说明形成了配合物和银离子结合能力强于溴离子,价银的主要存在形式;
(2)①实验Ⅲ中白色沉淀消失的离子方程式;
②实验Ⅳ中白色沉淀变为黑色的化学方程式:;
③溶液可用作定影液。向溶液溶解之后的废定影液中,加入硫化钠溶液至不再产生黑色固体,过滤,可重新得到;
(3)分析试管1出现银镜的原因在碱性加热条件下生成了银单质和硫酸根;
(4)与结构相似,可看作外围的一个O被S替换的结果。但与的配位倾向:,原因是两者都是四面体结构,硫酸根中是氧原子和银离子形成配位,可看作外围的一个O被S替换的结果,氧的电负性更强不易于硫原子,银离子形成配位,配位键不稳定,S与银离子形成的配位键更稳定,所以与的配位倾向:。
18.(1)出现黄色沉淀
(2)排除对检验的干扰
(3)
(4)
(5) NaOH
【分析】某小组通过实验探究NO的某些性质,用排水法收集一瓶NO,将其倒扣在盛有碱性溶液的水槽中,振荡,观察到集气瓶中液面上升,的氧化产物为硫酸根离子, 被还原为,检验反应产物时,要排除硫酸根离子等的干扰,以此解答。
【详解】(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴的溶液,根据信息:与反应生成黄色沉淀、结合分析可知,实验现象为:出现黄色沉淀。
(2)银离子能与硫酸根离子产生沉淀,再利用信息:Ag+与反应生成黄色沉淀,则实验Ⅱ的目的是:排除对检验的干扰。
(3)据分析,NO与碱性溶液反应生成、和H2O,反应中,氮元素从+2价升高到+1价、硫元素从+4价升高到+6价,则按得失电子数守恒、电荷守恒、元素质量守恒得离子方程式。
(4)氧化反应为:的氧化产物为硫酸根离子,硫元素化合价升高,结合守恒可知相应的离子方程式为。
(5)某同学结合所学知识设计处理工业废气中和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的,生成,则同时生成亚硫酸钠,该反应的离子方程式:。
②根据资料ⅰ可知:应再向生成的溶液中加入一定量NaOH,以此溶液来吸收NO气体。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
