氧化还原反应基本概念试题 高考化学考前专项复习(含解析)
文档属性
| 名称 | 氧化还原反应基本概念试题 高考化学考前专项复习(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-08 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
氧化还原反应基本概念
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知TNT为烈性炸药,其爆炸时的方程式为:TNT +21O228CO2+10H2O+6N2,下列有关该反应的说法正确的是( )
A.TNT在反应中只做还原剂
B.TNT中的N元素化合价为+5价
C.方程式中TNT前的化学计量数为2
D.当1molTNT参加反应时,转移的电子数为30×6.02×1023
2.下列实验中的颜色变化,与氧化还原反应无关的是
A B C D
FeCl3溶液滴入Mg(OH)2浊液中 AgNO3溶液滴入氯水中 Na块放在坩埚里并加热 H2C2O4溶液滴入KMnO4酸性溶液中
白色浑浊转化为红褐色沉淀 产生白色沉淀,随后溶液淡黄绿色褪去 发出黄色火焰,生成淡黄色固体 产生气泡, 随后紫色褪去
A.A B.B C.C D.D
3.我国首艘使用了钛合金材料的国产航母已成功下水,钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是
A.步骤Ⅰ、II中均发生氧化还原反应 B.步骤Ⅰ、Ⅱ中碳元素的化合价均升高
C.步骤Ⅲ中反应可在空气中进行 D.可用稀硫酸除去金属钛中的少量镁杂质
4.根据下列实验活动与现象得出的结论正确的是
选项 实验活动与现象 结论
A 溶液中依次滴入稀硫酸、KSCN溶液后,溶液变红色 已变质
B 向某待测液中滴加盐酸,产生白色沉淀 该待测液中一定含有
C 溶于稀硫酸得到红色固体和蓝色溶液 具有氧化性和还原性
D 向少量酸性溶液中滴入适量白葡萄酒,溶液褪色 白葡萄酒中一定含有
A.A B.B C.C D.D
5.在西汉刘安编撰的《淮南万毕术》中,有“曾青得铁则化为铜”的记载。说明西汉时期,我国劳动人民就已经发现铁能从某些含铜(+2价)化合物的溶液中置换出铜,这个方法是现代湿法冶金的基础,下列说法中,不正确的是
A.该反应的离子反应方程式为:Fe+Cu2+=Cu+Fe2+
B.该反应属于氧化还原反应,反应中铁被氧化
C.该反应说明金属单质都能与盐发生反应
D.该反应说明铁的金属性比铜的强
6.下列关于H2S、NO及CO三种气体的说法中正确的是
A.都易溶于水 B.都属于非电解质
C.都能与碱溶液反应 D.都能被氧化
7.下列说法正确的是( )
A.制备Fe(OH)3胶体,可以将NaOH浓溶液滴加到饱和FeCl3溶液中
B.利用丁达尔效应无法区别蛋白质溶液和氯化钠溶液
C.阴离子不含金属元素,阳离子含金属元素
D.作为反应物时,金属单质在氧化还原反应中只能作还原剂
8.下列反应中,属于氧化还原反应的是
A. B.
C. D.
9.化学与生活密切相关。下列说法错误的是
A.氢氧化铝可用于治疗胃酸过多 B.焰火中紫色源自钠盐灼烧
C.食物的腐败涉及氧化还原反应 D.漂粉精可用于游泳池消毒
10.三元WO3/C3N4/Ni(OH)x光催化剂产氢机理如图。下列说法正确的是
A.TEOA→TEOA+为还原反应
B.Ni(OH)x降低了H+→H2的活化能
C.能量转化形式为太阳能→电能→化学能
D.WO3没有参与制氢反应过程
二、判断题
11.向溶液中滴加溶液,溶液褪色,可证明具有氧化性。(_________)
12.在化学反应中,得电子越多的氧化剂,其氧化性就越强。(______)
13.有单质生成的反应一定是氧化还原反应。
14.NO2溶于水发生氧化还原反应。
15.MnO2不与稀盐酸反应是因为H+浓度小。(______)
三、解答题
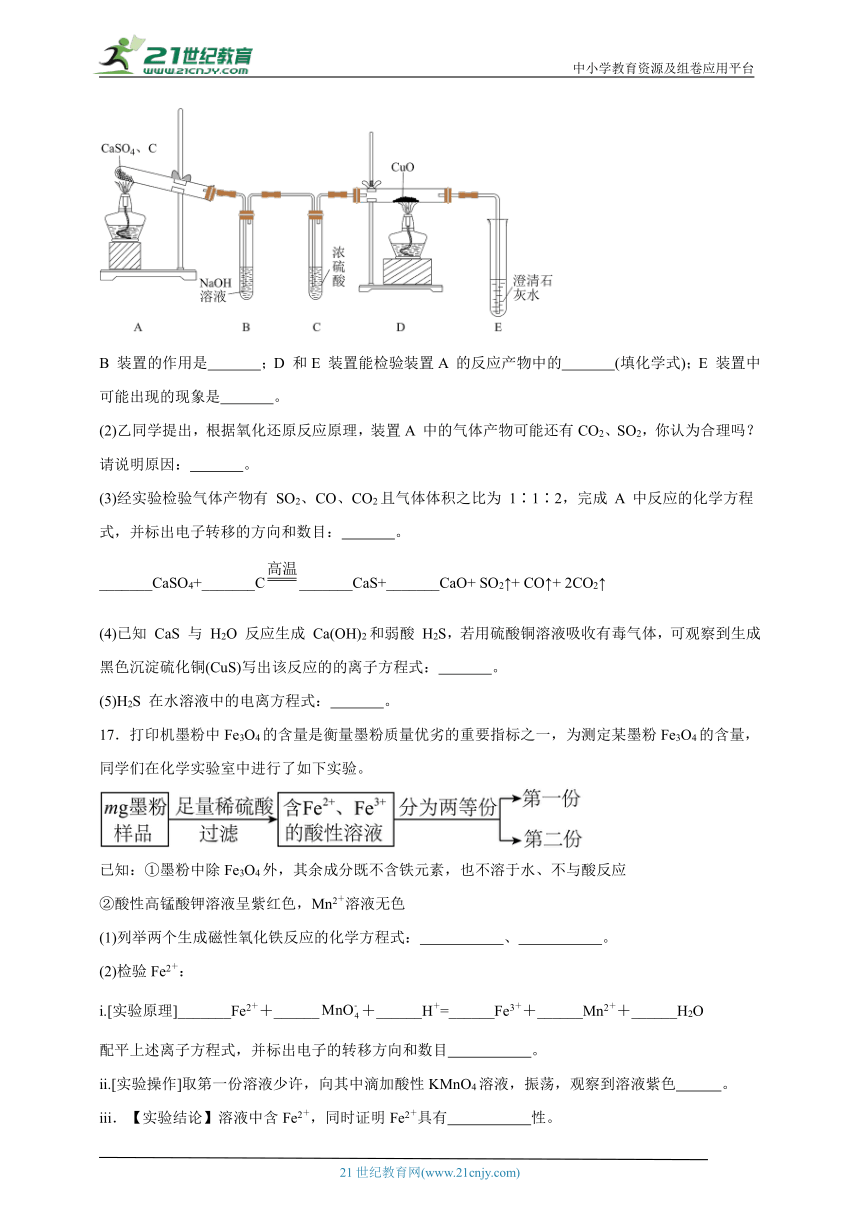
16.CaS 用于制备除虫剂、发光材料等。某课题组拟用硫酸钙与焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图所示实验装置检验气体产物。
B 装置的作用是 ;D 和E 装置能检验装置A 的反应产物中的 (填化学式);E 装置中可能出现的现象是 。
(2)乙同学提出,根据氧化还原反应原理,装置A 中的气体产物可能还有CO2、SO2,你认为合理吗?请说明原因: 。
(3)经实验检验气体产物有 SO2、CO、CO2且气体体积之比为 1∶1∶2,完成 A 中反应的化学方程式,并标出电子转移的方向和数目: 。_______CaSO4+_______C_______CaS+_______CaO+ SO2↑+ CO↑+ 2CO2↑
(4)已知 CaS 与 H2O 反应生成 Ca(OH)2和弱酸 H2S,若用硫酸铜溶液吸收有毒气体,可观察到生成黑色沉淀硫化铜(CuS)写出该反应的的离子方程式: 。
(5)H2S 在水溶液中的电离方程式: 。
17.打印机墨粉中Fe3O4的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉Fe3O4的含量,同学们在化学实验室中进行了如下实验。
已知:①墨粉中除Fe3O4外,其余成分既不含铁元素,也不溶于水、不与酸反应
②酸性高锰酸钾溶液呈紫红色,Mn2+溶液无色
(1)列举两个生成磁性氧化铁反应的化学方程式: 、 。
(2)检验Fe2+:
i.[实验原理]_______Fe2++______+______H+=______Fe3++______Mn2++______H2O
配平上述离子方程式,并标出电子的转移方向和数目 。
ii.[实验操作]取第一份溶液少许,向其中滴加酸性KMnO4溶液,振荡,观察到溶液紫色 。
iii.【实验结论】溶液中含Fe2+,同时证明Fe2+具有 性。
(3)测定Fe3O4的含量:
i.加入足量氯水的目的是 ,有关反应的离子方程式是 。
ii.加入足量NaOH溶液后观察到的现象是 。
iii.沉淀加热时发生反应的化学方程式是 。
物质世界的多姿多彩源自元素及其化合物的多种多样。
Ⅰ.补铁剂中的铁--检验其中铁元素的价态
【查阅资料】该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
18.试剂1是 。
19.写出上述条件下与发生反应的离子方程式 。
20.能证明溶液①中含有的实验现象是 。
Ⅱ.硫元素是动植物生长不可缺少的元素。
21.X与Y反应中氧化剂与还原剂的物质的量之比为 。
22.水溶液易变质,实验室检验水溶液是否变质的基本操作是 。
23.已知通入酸性,可以生成和,则的溶液最多可以吸收 。
参考答案:
1.D
【详解】A.TNT的分子式为C7H5O6N3,TNT在爆炸时,不仅碳的化合价升高,还有氮的化合价由+3价降低至0价,所以TNT在反应中既是氧化剂,也是还原剂,A项错误;
B.TNT中H的化合价为+1价,O的化合价为-2价,C的平均化合价为-价,TNT中氮元素应显+3价,B项错误;
C.据氮原子守恒和TNT每分子中含有3个氮原子可知,TNT前的计量数为4,C项错误;
D.反应中只有碳的化合价升高,每个碳原子升高的价态为(+4)-(-)=,所以1molTNT发生反应时转移的电子数为7××6.02×1023=30×6.02×1023,D项正确;
所以答案选择D项。
2.A
【详解】A.FeCl3溶液滴入Mg(OH)2浊液中,发生沉淀的转化,2FeCl3+3Mg(OH)2=2Fe(OH)3+3MgCl2,产生红褐色沉淀为Fe(OH)3,没有化合价的变化,不属于氧化还原反应,A符合题意;
B.AgNO3溶液滴入氯水中,生成氯化银沉淀,促进了氯气与水反应,Cl2+H2OHCl+HClO,淡黄绿色褪去,Cl元素化合价发生变化,属于氧化还原反应,B不符合题意;
C.Na块放在坩埚里并加热,发出黄色火焰,生成淡黄色固体过氧化钠,Na、O元素化合价发生变化,属于氧化还原反应,C不符合题意;
D.H2C2O4溶液滴入KMnO4酸性溶液中,发生反应2KMnO +5H C O +3H SO =2MnSO +K SO +10CO ↑+8H O,C、Mn元素化合价变化,属于氧化还原反应,D不符合题意;
故选A。
3.C
【分析】由题给流程可知,步骤Ⅰ发生的反应为钛铁矿中的氧化亚铁碳在高温下发生氧化还原反应,生成和一氧化碳,步骤Ⅱ发生的反应为二氧化钛与碳,氯气在高温下反应生成四氯化钛和一氧化碳,步骤Ⅲ发生的反应为四氯化钛和足量镁粉在高温下发生置换反应生成氯化镁和钛。
【详解】A.由分析可知,步骤Ⅰ、II中均有元素发生化合价变化,发生的反应都是氧化还原反应,故A正确;
B.由分析可知,步骤Ⅰ、II中碳元素的化合价均升高被氧化,碳都是反应的还原剂,故B正确;
C.步骤Ⅲ为四氯化钛和过量镁粉在高温下发生置换反应生成氯化镁和钛,镁是活泼的金属,钛在高温下能被空气氧化,所以步骤Ⅲ需在氩气环境中进行,防止金属被空气氧化,不能在空气中进行,故C错误;
D.钛在常温下与酸、碱均不反应,镁与稀硫酸反应,可用稀硫酸除去金属钛中的少量镁杂质,故D正确;
故选C。
4.C
【详解】A.酸性条件下,Fe2+能被氧化为Fe3+,溶液中依次滴入稀硫酸、KSCN溶液后,溶液变红色,不能证明已变质,故A错误;
B.向某待测液中滴加盐酸,产生白色沉淀,生成的沉淀可能是氯化银或硅酸,所以待测液中一定含有或Ag+,故B错误;
C.溶于稀硫酸得到红色固体和蓝色溶液,既是氧化剂又是还原剂,所以具有氧化性和还原性,故C正确;
D.向少量酸性溶液中滴入适量白葡萄酒,溶液褪色,说明白葡萄酒中含有还原性物质,不一定含有,故D错误;
选C。
5.C
【详解】A.铁能从某些含铜离子(+2价)化合物的溶液中置换出铜,则反应的离子方程式为: ,故A选项正确;
B.该反应属于氧化还原反应,反应中铁被氧化,铜离子被还原,故B选项正确;
C.Na、K等活泼性很强的金属,能与水反应,不能与盐反应,故C选项错误;
D.铁能从某些含铜(+2价)化合物的溶液中置换出铜,活泼性强的金属能置换活泼性弱的金属,则该反应说明铁的金属活动性比铜的强,故D选项正确;
故选C选项。
6.D
【详解】A、NO、CO均难溶于水,故A错误;
B、H2S属于弱电解质,NO、CO为弱电解质,故B错误;
C、H2S能与碱溶液反应,NO、CO则不能反应,故C错误;
D、-2价的硫、+2价的氮、+2价的碳都具有还原性,都能被氧化,故D正确;
故选D。
7.D
【详解】A.将NaOH浓溶液滴加到饱和FeCl3溶液中只能生成Fe(OH)3沉淀,无法得到Fe(OH)3胶体,故A错误;
B.蛋白质溶液是胶体,有丁达尔效应,而NaCl溶液无丁达尔效应,则利用丁达尔效应可区别蛋白质溶液和氯化钠溶液,故B错误;
C.阴离子含金属元素,阳离子不含金属元素,故C错误;
D.金属元素无负价态,则作为反应物时,金属单质在氧化还原反应中元素化合价只能升高,只能作还原剂,故D正确;
故答案为D。
8.A
【详解】A.该反应中有O元素化合价的升降,因此反应属于氧化还原反应,A符合题意;
B.该反应中没有元素化合价的升降,因此反应不属于氧化还原反应,B不符合题意;
C.该反应中没有元素化合价的升降,因此反应不属于氧化还原反应,C不符合题意;
D.该反应中没有元素化合价的升降,因此反应不属于氧化还原反应,D不符合题意;
故合理选项是A。
9.B
【详解】A.氢氧化铝能与盐酸反应,中和多余的胃酸,因此可用于治疗胃酸过多,A正确;
B.焰色试验中,钠的焰色为黄色,焰火中紫色来源于钾盐灼烧,B错误;
C.食物酸败为食物缓慢氧化的过程,为氧化还原反应,C正确;
D.漂粉精用于游泳池水的杀菌消毒是利用其成分中次氯酸根的氧化性,D正确;
故选B。
10.B
【详解】A. TEOA→TEOA+为失去电子的反应,是氧化反应,故A错误;
B.如图所示,Ni(OH)x是H+→H2的催化剂,故其可以降低该反应的活化能,故B正确;
C. 如图所示,能量转化形式为太阳能→化学能,故C错误;
D. 如图所示WO3作为催化剂,参与了制氢反应过程,故D错误,
故选B。
【点睛】解决此题的关键是看清图片信息,分析反应过程中的中间产物及了解催化剂的催化原理。
11.错误
【详解】向溶液中滴加溶液,溶液褪色,该过程中被氧化,体现还原性,该说法错误。
12.错误
【详解】在化学反应中氧化剂的强弱与得电子的能力有关,与得电子的数目无关,说法错误。
13.错误
【详解】有单质生成的反应不一定是氧化还原反应,例如O2转化为O3的反应,故错误;
14.正确
【详解】NO2溶于水生成硝酸,N的化合价改变,发生氧化还原反应,故正确;
15.错误
【详解】MnO2不与稀盐酸反应是因为稀盐酸还原性不够强,故错误。
16.(1) 除去酸性气体 CO 溶液变浑浊
(2)高温条件下CaSO4和C发生氧化还原反应,生成CO2和SO2
(3)
(4)CuSO4+H2S=CuS↓+H2SO4
(5),
【分析】硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,CuO氧化CO生成红色的Cu和CO2,CO2使石灰水变浑浊。验证A中的气体产物可能还有CO2、SO2,必须先用品红验证SO2后再用酸性高锰酸钾除去SO2,再用澄清石灰水检验CO2,据此分析解答。
【详解】(1)硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,因此氢氧化钠溶液可吸收除去酸性气体,但不能吸收CO;通过一氧化碳还原氧化铜由黑色变红色和CO2能够使澄清石灰水变浑浊的现象,证明装置A的反应产物是CO;反应生成的二氧化碳能够使E装置中的澄清石灰水变浑浊,故答案为除去酸性气体;CO;溶液变浑浊;
(2)根据乙同学的猜想:A 中的气体产物可能还有CO2、SO2,说明高温条件下可能CaSO4和C发生氧化还原反应,生成CO2和SO2,反应的化学方程式为:2CaSO4+3C CaS+CaO+SO2↑+2CO2↑+CO↑;
(3)根据得失电子数配平方程式,并用单线桥标出电子转移的方向和数目:;
(4)用硫酸铜溶液吸收硫化氢气体,产生黑色沉淀为CuS,反应的化学方程式为CuSO4+H2S=CuS↓+H2SO4;
(5)H2S是二元弱酸,在水溶液中分两步电离,所以电离方程式是:第一步,第二步。
17.(1)
(2) 褪去 还原
(3) 将亚铁离子全部氧化成铁离子 Cl2+2Fe2+=2Cl-+2Fe3+ 生成红褐色沉淀,溶液由黄色变为无色 2Fe(OH)3Fe2O3+3H2O
【分析】mg墨粉样品中加入足量稀硫酸,Fe3O4与稀硫酸反应生成Fe2+和Fe3+,过滤得到的滤液中含有Fe2+、Fe3+。
【详解】(1)铁在纯氧中燃烧生成四氧化三铁,铁和水蒸气高温下反应生成四氧化三铁,化学方程式分别为,。
(2)i.一个亚铁离子转化为铁离子失去一个电子,一个高锰酸根离子转化为锰离子,得到5个电子,则Fe2+与的物质的量之比为5:1,再根据原子守恒,可得离子方程式为。
ii.第一份溶液中含有Fe2+,加入酸性高锰酸钾后两者反应生成铁离子和锰离子,可观察到溶液紫色褪去。
iii.Fe2+能还原高锰酸根离子生成锰离子,证明Fe2+具有还原性。
(3)i.第二份溶液中含有亚铁离子和铁离子,加入足量的氯水,目的是将亚铁离子全部氧化成铁离子,离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+。
ii.加入NaOH,铁离子与NaOH反应生成氢氧化铁沉淀,实验现象为生成红褐色沉淀,溶液由黄色变为无色。
iii.沉淀为Fe(OH)3,加热Fe(OH)3促使其分解生成Fe2O3,化学方程式为2Fe(OH)3Fe2O3+3H2O。
18.盐酸 19.2Fe2++2H++H2O2=2Fe3++2H2O 20.加入H2O2溶液后,溶液②由浅红色变成深红色,说明溶液中有更多的Fe3+生成,是Fe2+被H2O2氧化产生的 21.1:2 22.取少量溶液于试管中,滴加硝酸,再加硝酸银,产生白色沉淀,则SO2水溶液变质 23.
【分析】将补铁剂碾碎,然后向其中加入足量盐酸,使二者充分接触发生反应,看到溶液几乎无色。向与盐酸反应后的溶液中加入KSCN溶液,看到溶液显浅红色,说明其中含有少量Fe3+;然后再加入绿色氧化剂H2O2,看到溶液变为深红色,说明该溶液中同时含有Fe2+,H2O2将Fe2+氧化为Fe3+。
18.根据上述分析可知试剂1是盐酸,试剂2是KSCN溶液
19.能证明溶液①中含有Fe2+的实验现象是:加入H2O2溶液后,溶液②由浅红色变成深红色,说明溶液中有更多的Fe3+生成,是Fe2+被H2O2氧化产生的;
20.在该反应中Fe元素化合价由反应前Fe2+中的+ 2价变为反应后Fe3+的+3价,升高1价;O元素化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,所以Fe2+、Fe3+的系数是2,H2O2的系数是1,然后根据电荷守恒可知H+的系数是2,最后根据原子守恒可知H2O的系数是2,则配平后的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O;
21.X为H2S,Y是SO2,两者反应生成S,H2S做还原剂,升高2价,SO2是氧化剂,降4价,根据守恒,氧化剂与还原剂的物质的量之比为1:2
22.取少量溶液于试管中,滴加硝酸,再加硝酸银,产生白色沉淀,则SO2水溶液变质。
23.20mL0.02mol L 1的K2Cr2O7溶液物质的量为0.0004mol,根据则n(SO2)=0.0012mol,则
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
氧化还原反应基本概念
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知TNT为烈性炸药,其爆炸时的方程式为:TNT +21O228CO2+10H2O+6N2,下列有关该反应的说法正确的是( )
A.TNT在反应中只做还原剂
B.TNT中的N元素化合价为+5价
C.方程式中TNT前的化学计量数为2
D.当1molTNT参加反应时,转移的电子数为30×6.02×1023
2.下列实验中的颜色变化,与氧化还原反应无关的是
A B C D
FeCl3溶液滴入Mg(OH)2浊液中 AgNO3溶液滴入氯水中 Na块放在坩埚里并加热 H2C2O4溶液滴入KMnO4酸性溶液中
白色浑浊转化为红褐色沉淀 产生白色沉淀,随后溶液淡黄绿色褪去 发出黄色火焰,生成淡黄色固体 产生气泡, 随后紫色褪去
A.A B.B C.C D.D
3.我国首艘使用了钛合金材料的国产航母已成功下水,钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化,由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是
A.步骤Ⅰ、II中均发生氧化还原反应 B.步骤Ⅰ、Ⅱ中碳元素的化合价均升高
C.步骤Ⅲ中反应可在空气中进行 D.可用稀硫酸除去金属钛中的少量镁杂质
4.根据下列实验活动与现象得出的结论正确的是
选项 实验活动与现象 结论
A 溶液中依次滴入稀硫酸、KSCN溶液后,溶液变红色 已变质
B 向某待测液中滴加盐酸,产生白色沉淀 该待测液中一定含有
C 溶于稀硫酸得到红色固体和蓝色溶液 具有氧化性和还原性
D 向少量酸性溶液中滴入适量白葡萄酒,溶液褪色 白葡萄酒中一定含有
A.A B.B C.C D.D
5.在西汉刘安编撰的《淮南万毕术》中,有“曾青得铁则化为铜”的记载。说明西汉时期,我国劳动人民就已经发现铁能从某些含铜(+2价)化合物的溶液中置换出铜,这个方法是现代湿法冶金的基础,下列说法中,不正确的是
A.该反应的离子反应方程式为:Fe+Cu2+=Cu+Fe2+
B.该反应属于氧化还原反应,反应中铁被氧化
C.该反应说明金属单质都能与盐发生反应
D.该反应说明铁的金属性比铜的强
6.下列关于H2S、NO及CO三种气体的说法中正确的是
A.都易溶于水 B.都属于非电解质
C.都能与碱溶液反应 D.都能被氧化
7.下列说法正确的是( )
A.制备Fe(OH)3胶体,可以将NaOH浓溶液滴加到饱和FeCl3溶液中
B.利用丁达尔效应无法区别蛋白质溶液和氯化钠溶液
C.阴离子不含金属元素,阳离子含金属元素
D.作为反应物时,金属单质在氧化还原反应中只能作还原剂
8.下列反应中,属于氧化还原反应的是
A. B.
C. D.
9.化学与生活密切相关。下列说法错误的是
A.氢氧化铝可用于治疗胃酸过多 B.焰火中紫色源自钠盐灼烧
C.食物的腐败涉及氧化还原反应 D.漂粉精可用于游泳池消毒
10.三元WO3/C3N4/Ni(OH)x光催化剂产氢机理如图。下列说法正确的是
A.TEOA→TEOA+为还原反应
B.Ni(OH)x降低了H+→H2的活化能
C.能量转化形式为太阳能→电能→化学能
D.WO3没有参与制氢反应过程
二、判断题
11.向溶液中滴加溶液,溶液褪色,可证明具有氧化性。(_________)
12.在化学反应中,得电子越多的氧化剂,其氧化性就越强。(______)
13.有单质生成的反应一定是氧化还原反应。
14.NO2溶于水发生氧化还原反应。
15.MnO2不与稀盐酸反应是因为H+浓度小。(______)
三、解答题
16.CaS 用于制备除虫剂、发光材料等。某课题组拟用硫酸钙与焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图所示实验装置检验气体产物。
B 装置的作用是 ;D 和E 装置能检验装置A 的反应产物中的 (填化学式);E 装置中可能出现的现象是 。
(2)乙同学提出,根据氧化还原反应原理,装置A 中的气体产物可能还有CO2、SO2,你认为合理吗?请说明原因: 。
(3)经实验检验气体产物有 SO2、CO、CO2且气体体积之比为 1∶1∶2,完成 A 中反应的化学方程式,并标出电子转移的方向和数目: 。_______CaSO4+_______C_______CaS+_______CaO+ SO2↑+ CO↑+ 2CO2↑
(4)已知 CaS 与 H2O 反应生成 Ca(OH)2和弱酸 H2S,若用硫酸铜溶液吸收有毒气体,可观察到生成黑色沉淀硫化铜(CuS)写出该反应的的离子方程式: 。
(5)H2S 在水溶液中的电离方程式: 。
17.打印机墨粉中Fe3O4的含量是衡量墨粉质量优劣的重要指标之一,为测定某墨粉Fe3O4的含量,同学们在化学实验室中进行了如下实验。
已知:①墨粉中除Fe3O4外,其余成分既不含铁元素,也不溶于水、不与酸反应
②酸性高锰酸钾溶液呈紫红色,Mn2+溶液无色
(1)列举两个生成磁性氧化铁反应的化学方程式: 、 。
(2)检验Fe2+:
i.[实验原理]_______Fe2++______+______H+=______Fe3++______Mn2++______H2O
配平上述离子方程式,并标出电子的转移方向和数目 。
ii.[实验操作]取第一份溶液少许,向其中滴加酸性KMnO4溶液,振荡,观察到溶液紫色 。
iii.【实验结论】溶液中含Fe2+,同时证明Fe2+具有 性。
(3)测定Fe3O4的含量:
i.加入足量氯水的目的是 ,有关反应的离子方程式是 。
ii.加入足量NaOH溶液后观察到的现象是 。
iii.沉淀加热时发生反应的化学方程式是 。
物质世界的多姿多彩源自元素及其化合物的多种多样。
Ⅰ.补铁剂中的铁--检验其中铁元素的价态
【查阅资料】该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。
18.试剂1是 。
19.写出上述条件下与发生反应的离子方程式 。
20.能证明溶液①中含有的实验现象是 。
Ⅱ.硫元素是动植物生长不可缺少的元素。
21.X与Y反应中氧化剂与还原剂的物质的量之比为 。
22.水溶液易变质,实验室检验水溶液是否变质的基本操作是 。
23.已知通入酸性,可以生成和,则的溶液最多可以吸收 。
参考答案:
1.D
【详解】A.TNT的分子式为C7H5O6N3,TNT在爆炸时,不仅碳的化合价升高,还有氮的化合价由+3价降低至0价,所以TNT在反应中既是氧化剂,也是还原剂,A项错误;
B.TNT中H的化合价为+1价,O的化合价为-2价,C的平均化合价为-价,TNT中氮元素应显+3价,B项错误;
C.据氮原子守恒和TNT每分子中含有3个氮原子可知,TNT前的计量数为4,C项错误;
D.反应中只有碳的化合价升高,每个碳原子升高的价态为(+4)-(-)=,所以1molTNT发生反应时转移的电子数为7××6.02×1023=30×6.02×1023,D项正确;
所以答案选择D项。
2.A
【详解】A.FeCl3溶液滴入Mg(OH)2浊液中,发生沉淀的转化,2FeCl3+3Mg(OH)2=2Fe(OH)3+3MgCl2,产生红褐色沉淀为Fe(OH)3,没有化合价的变化,不属于氧化还原反应,A符合题意;
B.AgNO3溶液滴入氯水中,生成氯化银沉淀,促进了氯气与水反应,Cl2+H2OHCl+HClO,淡黄绿色褪去,Cl元素化合价发生变化,属于氧化还原反应,B不符合题意;
C.Na块放在坩埚里并加热,发出黄色火焰,生成淡黄色固体过氧化钠,Na、O元素化合价发生变化,属于氧化还原反应,C不符合题意;
D.H2C2O4溶液滴入KMnO4酸性溶液中,发生反应2KMnO +5H C O +3H SO =2MnSO +K SO +10CO ↑+8H O,C、Mn元素化合价变化,属于氧化还原反应,D不符合题意;
故选A。
3.C
【分析】由题给流程可知,步骤Ⅰ发生的反应为钛铁矿中的氧化亚铁碳在高温下发生氧化还原反应,生成和一氧化碳,步骤Ⅱ发生的反应为二氧化钛与碳,氯气在高温下反应生成四氯化钛和一氧化碳,步骤Ⅲ发生的反应为四氯化钛和足量镁粉在高温下发生置换反应生成氯化镁和钛。
【详解】A.由分析可知,步骤Ⅰ、II中均有元素发生化合价变化,发生的反应都是氧化还原反应,故A正确;
B.由分析可知,步骤Ⅰ、II中碳元素的化合价均升高被氧化,碳都是反应的还原剂,故B正确;
C.步骤Ⅲ为四氯化钛和过量镁粉在高温下发生置换反应生成氯化镁和钛,镁是活泼的金属,钛在高温下能被空气氧化,所以步骤Ⅲ需在氩气环境中进行,防止金属被空气氧化,不能在空气中进行,故C错误;
D.钛在常温下与酸、碱均不反应,镁与稀硫酸反应,可用稀硫酸除去金属钛中的少量镁杂质,故D正确;
故选C。
4.C
【详解】A.酸性条件下,Fe2+能被氧化为Fe3+,溶液中依次滴入稀硫酸、KSCN溶液后,溶液变红色,不能证明已变质,故A错误;
B.向某待测液中滴加盐酸,产生白色沉淀,生成的沉淀可能是氯化银或硅酸,所以待测液中一定含有或Ag+,故B错误;
C.溶于稀硫酸得到红色固体和蓝色溶液,既是氧化剂又是还原剂,所以具有氧化性和还原性,故C正确;
D.向少量酸性溶液中滴入适量白葡萄酒,溶液褪色,说明白葡萄酒中含有还原性物质,不一定含有,故D错误;
选C。
5.C
【详解】A.铁能从某些含铜离子(+2价)化合物的溶液中置换出铜,则反应的离子方程式为: ,故A选项正确;
B.该反应属于氧化还原反应,反应中铁被氧化,铜离子被还原,故B选项正确;
C.Na、K等活泼性很强的金属,能与水反应,不能与盐反应,故C选项错误;
D.铁能从某些含铜(+2价)化合物的溶液中置换出铜,活泼性强的金属能置换活泼性弱的金属,则该反应说明铁的金属活动性比铜的强,故D选项正确;
故选C选项。
6.D
【详解】A、NO、CO均难溶于水,故A错误;
B、H2S属于弱电解质,NO、CO为弱电解质,故B错误;
C、H2S能与碱溶液反应,NO、CO则不能反应,故C错误;
D、-2价的硫、+2价的氮、+2价的碳都具有还原性,都能被氧化,故D正确;
故选D。
7.D
【详解】A.将NaOH浓溶液滴加到饱和FeCl3溶液中只能生成Fe(OH)3沉淀,无法得到Fe(OH)3胶体,故A错误;
B.蛋白质溶液是胶体,有丁达尔效应,而NaCl溶液无丁达尔效应,则利用丁达尔效应可区别蛋白质溶液和氯化钠溶液,故B错误;
C.阴离子含金属元素,阳离子不含金属元素,故C错误;
D.金属元素无负价态,则作为反应物时,金属单质在氧化还原反应中元素化合价只能升高,只能作还原剂,故D正确;
故答案为D。
8.A
【详解】A.该反应中有O元素化合价的升降,因此反应属于氧化还原反应,A符合题意;
B.该反应中没有元素化合价的升降,因此反应不属于氧化还原反应,B不符合题意;
C.该反应中没有元素化合价的升降,因此反应不属于氧化还原反应,C不符合题意;
D.该反应中没有元素化合价的升降,因此反应不属于氧化还原反应,D不符合题意;
故合理选项是A。
9.B
【详解】A.氢氧化铝能与盐酸反应,中和多余的胃酸,因此可用于治疗胃酸过多,A正确;
B.焰色试验中,钠的焰色为黄色,焰火中紫色来源于钾盐灼烧,B错误;
C.食物酸败为食物缓慢氧化的过程,为氧化还原反应,C正确;
D.漂粉精用于游泳池水的杀菌消毒是利用其成分中次氯酸根的氧化性,D正确;
故选B。
10.B
【详解】A. TEOA→TEOA+为失去电子的反应,是氧化反应,故A错误;
B.如图所示,Ni(OH)x是H+→H2的催化剂,故其可以降低该反应的活化能,故B正确;
C. 如图所示,能量转化形式为太阳能→化学能,故C错误;
D. 如图所示WO3作为催化剂,参与了制氢反应过程,故D错误,
故选B。
【点睛】解决此题的关键是看清图片信息,分析反应过程中的中间产物及了解催化剂的催化原理。
11.错误
【详解】向溶液中滴加溶液,溶液褪色,该过程中被氧化,体现还原性,该说法错误。
12.错误
【详解】在化学反应中氧化剂的强弱与得电子的能力有关,与得电子的数目无关,说法错误。
13.错误
【详解】有单质生成的反应不一定是氧化还原反应,例如O2转化为O3的反应,故错误;
14.正确
【详解】NO2溶于水生成硝酸,N的化合价改变,发生氧化还原反应,故正确;
15.错误
【详解】MnO2不与稀盐酸反应是因为稀盐酸还原性不够强,故错误。
16.(1) 除去酸性气体 CO 溶液变浑浊
(2)高温条件下CaSO4和C发生氧化还原反应,生成CO2和SO2
(3)
(4)CuSO4+H2S=CuS↓+H2SO4
(5),
【分析】硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,CuO氧化CO生成红色的Cu和CO2,CO2使石灰水变浑浊。验证A中的气体产物可能还有CO2、SO2,必须先用品红验证SO2后再用酸性高锰酸钾除去SO2,再用澄清石灰水检验CO2,据此分析解答。
【详解】(1)硫酸钙和焦炭在高温下反应制备硫化钙的反应中可能产生使氧化铜还原的气体应为CO,因此氢氧化钠溶液可吸收除去酸性气体,但不能吸收CO;通过一氧化碳还原氧化铜由黑色变红色和CO2能够使澄清石灰水变浑浊的现象,证明装置A的反应产物是CO;反应生成的二氧化碳能够使E装置中的澄清石灰水变浑浊,故答案为除去酸性气体;CO;溶液变浑浊;
(2)根据乙同学的猜想:A 中的气体产物可能还有CO2、SO2,说明高温条件下可能CaSO4和C发生氧化还原反应,生成CO2和SO2,反应的化学方程式为:2CaSO4+3C CaS+CaO+SO2↑+2CO2↑+CO↑;
(3)根据得失电子数配平方程式,并用单线桥标出电子转移的方向和数目:;
(4)用硫酸铜溶液吸收硫化氢气体,产生黑色沉淀为CuS,反应的化学方程式为CuSO4+H2S=CuS↓+H2SO4;
(5)H2S是二元弱酸,在水溶液中分两步电离,所以电离方程式是:第一步,第二步。
17.(1)
(2) 褪去 还原
(3) 将亚铁离子全部氧化成铁离子 Cl2+2Fe2+=2Cl-+2Fe3+ 生成红褐色沉淀,溶液由黄色变为无色 2Fe(OH)3Fe2O3+3H2O
【分析】mg墨粉样品中加入足量稀硫酸,Fe3O4与稀硫酸反应生成Fe2+和Fe3+,过滤得到的滤液中含有Fe2+、Fe3+。
【详解】(1)铁在纯氧中燃烧生成四氧化三铁,铁和水蒸气高温下反应生成四氧化三铁,化学方程式分别为,。
(2)i.一个亚铁离子转化为铁离子失去一个电子,一个高锰酸根离子转化为锰离子,得到5个电子,则Fe2+与的物质的量之比为5:1,再根据原子守恒,可得离子方程式为。
ii.第一份溶液中含有Fe2+,加入酸性高锰酸钾后两者反应生成铁离子和锰离子,可观察到溶液紫色褪去。
iii.Fe2+能还原高锰酸根离子生成锰离子,证明Fe2+具有还原性。
(3)i.第二份溶液中含有亚铁离子和铁离子,加入足量的氯水,目的是将亚铁离子全部氧化成铁离子,离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+。
ii.加入NaOH,铁离子与NaOH反应生成氢氧化铁沉淀,实验现象为生成红褐色沉淀,溶液由黄色变为无色。
iii.沉淀为Fe(OH)3,加热Fe(OH)3促使其分解生成Fe2O3,化学方程式为2Fe(OH)3Fe2O3+3H2O。
18.盐酸 19.2Fe2++2H++H2O2=2Fe3++2H2O 20.加入H2O2溶液后,溶液②由浅红色变成深红色,说明溶液中有更多的Fe3+生成,是Fe2+被H2O2氧化产生的 21.1:2 22.取少量溶液于试管中,滴加硝酸,再加硝酸银,产生白色沉淀,则SO2水溶液变质 23.
【分析】将补铁剂碾碎,然后向其中加入足量盐酸,使二者充分接触发生反应,看到溶液几乎无色。向与盐酸反应后的溶液中加入KSCN溶液,看到溶液显浅红色,说明其中含有少量Fe3+;然后再加入绿色氧化剂H2O2,看到溶液变为深红色,说明该溶液中同时含有Fe2+,H2O2将Fe2+氧化为Fe3+。
18.根据上述分析可知试剂1是盐酸,试剂2是KSCN溶液
19.能证明溶液①中含有Fe2+的实验现象是:加入H2O2溶液后,溶液②由浅红色变成深红色,说明溶液中有更多的Fe3+生成,是Fe2+被H2O2氧化产生的;
20.在该反应中Fe元素化合价由反应前Fe2+中的+ 2价变为反应后Fe3+的+3价,升高1价;O元素化合价由反应前H2O2中的-1价变为反应后H2O中的-2价,所以Fe2+、Fe3+的系数是2,H2O2的系数是1,然后根据电荷守恒可知H+的系数是2,最后根据原子守恒可知H2O的系数是2,则配平后的离子方程式为:2H++2Fe2++H2O2=2Fe3++2H2O;
21.X为H2S,Y是SO2,两者反应生成S,H2S做还原剂,升高2价,SO2是氧化剂,降4价,根据守恒,氧化剂与还原剂的物质的量之比为1:2
22.取少量溶液于试管中,滴加硝酸,再加硝酸银,产生白色沉淀,则SO2水溶液变质。
23.20mL0.02mol L 1的K2Cr2O7溶液物质的量为0.0004mol,根据则n(SO2)=0.0012mol,则
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
