10.1常见的酸和碱同步练习(含解析) 人教版化学九年级下册
文档属性
| 名称 | 10.1常见的酸和碱同步练习(含解析) 人教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 303.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-09 21:44:09 | ||
图片预览


文档简介
10.1常见的酸和碱
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.针对下列事实解释正确的是
选项 事实 解释
A 金刚石和石墨的硬度不同 碳原子核外电子的排列方式不同
B NaOH 溶液能够导电 溶液中有可自由移动的电子
C 一氧化碳有毒,二氧化碳无毒 分子中含有的原子数不同
D 氢氧化钡溶液和氨水都能使酚酞变红色 溶液中都含有氢氧根离子
A.A B.B C.C D.D
2.下列几种物质的名称中,表示同一种物质的是
A.盐酸、胃酸、氯化氢
B.冰、干冰、水
C.氢氧化钠、烧碱、苛性钠
D.氧化钙、消石灰、生石灰
3.下列物质不能与稀盐酸反应的是
A.Fe B.CO2 C.Fe2O3 D.Ca(OH)2
4.下列关于“一定”的说法中,正确的是
A.带电的微粒一定是离子 B.由同种元素组成的物质一定是单质
C.原子核中一定存在质子 D.能使酚酞溶液变红的一定是碱
5.向下列溶液中滴加几滴酚酞,溶液显红色的是
A.氯化钠溶液 B.氢氧化钠溶液 C.浓硫酸 D.稀盐酸
6.在实验室中,下列物质具有强烈腐蚀性的是( )
A.稀HCl B.NaCl溶液 C.KNO3溶液 D.98%的浓H2SO4
7.下列物质必须密封保存的是
A.木炭 B.氢氧化钠 C.石灰石 D.氯化钠
8.下列有关实验现象的描述中,正确的是
A.点燃一氧化碳和甲烷的混合气体,发出很大的爆鸣声
B.打开盛浓硫酸的试剂瓶瓶塞,有刺激性气味并产生白雾
C.木炭在空气中燃绕,木炭发红并放出热量,生成无色无味的气体
D.将细铁丝在氧气中点燃,剧烈燃烧,火星四射,生成四氧化三铁
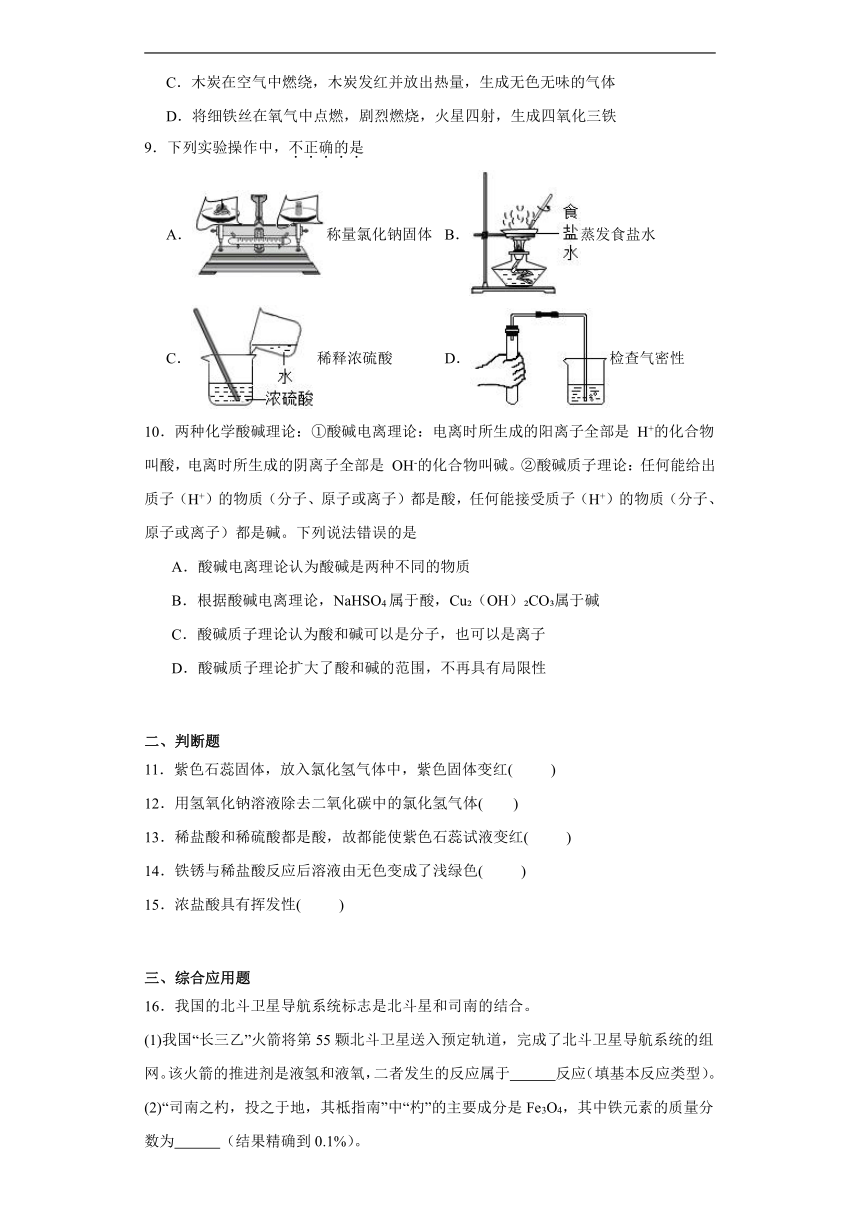
9.下列实验操作中,不正确的是
A.称量氯化钠固体 B.蒸发食盐水
C.稀释浓硫酸 D.检查气密性
10.两种化学酸碱理论:①酸碱电离理论:电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生成的阴离子全部是 OH-的化合物叫碱。②酸碱质子理论:任何能给出质子(H+)的物质(分子、原子或离子)都是酸,任何能接受质子(H+)的物质(分子、原子或离子)都是碱。下列说法错误的是
A.酸碱电离理论认为酸碱是两种不同的物质
B.根据酸碱电离理论,NaHSO4属于酸,Cu (OH) CO 属于碱
C.酸碱质子理论认为酸和碱可以是分子,也可以是离子
D.酸碱质子理论扩大了酸和碱的范围,不再具有局限性
二、判断题
11.紫色石蕊固体,放入氯化氢气体中,紫色固体变红( )
12.用氢氧化钠溶液除去二氧化碳中的氯化氢气体( )
13.稀盐酸和稀硫酸都是酸,故都能使紫色石蕊试液变红( )
14.铁锈与稀盐酸反应后溶液由无色变成了浅绿色( )
15.浓盐酸具有挥发性( )
三、综合应用题
16.我国的北斗卫星导航系统标志是北斗星和司南的结合。
(1)我国“长三乙”火箭将第55颗北斗卫星送入预定轨道,完成了北斗卫星导航系统的组网。该火箭的推进剂是液氢和液氧,二者发生的反应属于 反应(填基本反应类型)。
(2)“司南之杓,投之于地,其柢指南”中“杓”的主要成分是Fe3O4,其中铁元素的质量分数为 (结果精确到0.1%)。
(3)如图“北斗七星”代表7种初中化学常见的物质,“—”表示相邻的物质间能发生反应,“→”表示能一步实现的物质转化方向。已知A、C的元素组成相同且常温下均为液体,D可作食品干燥剂,F是农业生产中常用的气体肥料。
①写出A的名称: 。
②B在空气中的体积分数约为 。“铁丝在氧气中燃烧实验”中C的作用是 。
③写出D→E的化学方程式: 。
④写出F的另一种用途: 。若G能与血红蛋白结合导致人体中毒,则其化学式为 。
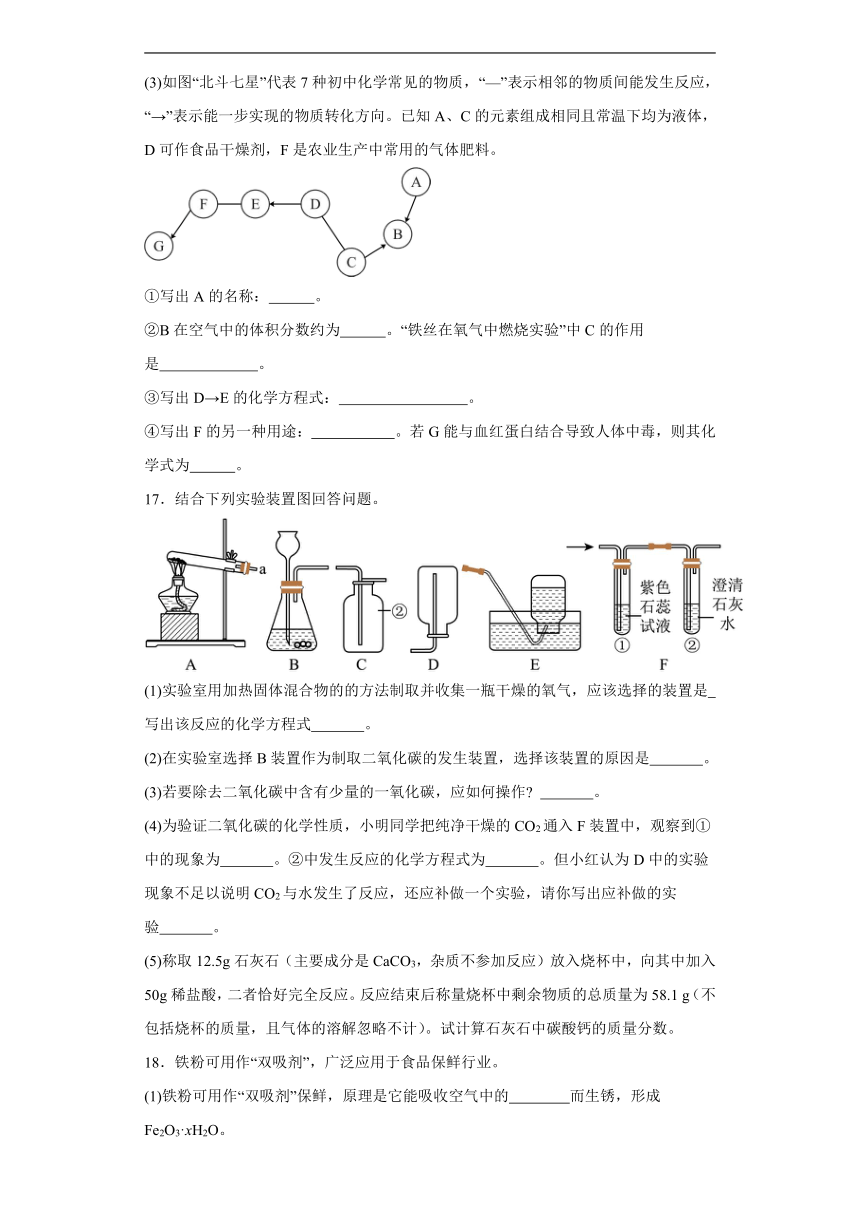
17.结合下列实验装置图回答问题。
(1)实验室用加热固体混合物的的方法制取并收集一瓶干燥的氧气,应该选择的装置是 写出该反应的化学方程式 。
(2)在实验室选择B装置作为制取二氧化碳的发生装置,选择该装置的原因是 。
(3)若要除去二氧化碳中含有少量的一氧化碳,应如何操作 。
(4)为验证二氧化碳的化学性质,小明同学把纯净干燥的CO2通入F装置中,观察到①中的现象为 。②中发生反应的化学方程式为 。但小红认为D中的实验现象不足以说明CO2与水发生了反应,还应补做一个实验,请你写出应补做的实验 。
(5)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1 g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中碳酸钙的质量分数。
18.铁粉可用作“双吸剂”,广泛应用于食品保鲜行业。
(1)铁粉可用作“双吸剂”保鲜,原理是它能吸收空气中的 而生锈,形成Fe2O3·xH2O。
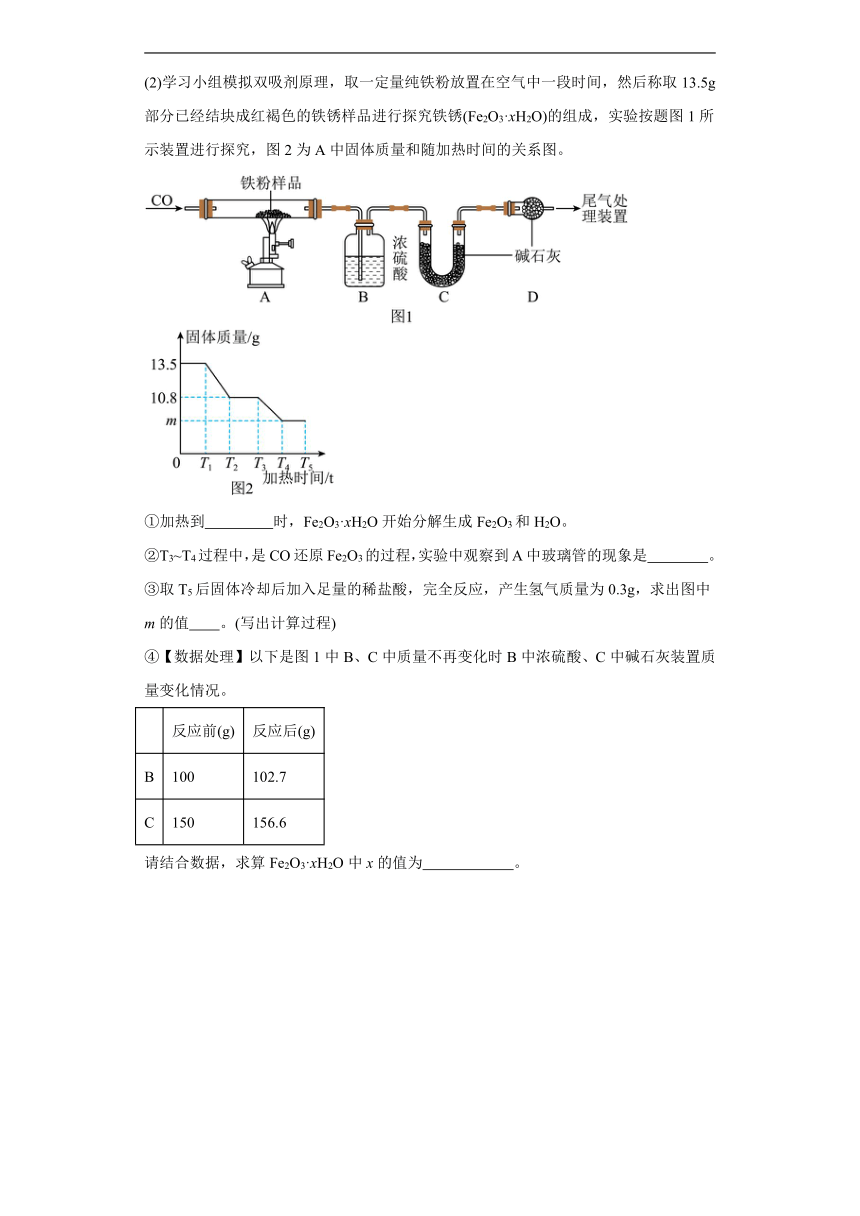
(2)学习小组模拟双吸剂原理,取一定量纯铁粉放置在空气中一段时间,然后称取13.5g部分已经结块成红褐色的铁锈样品进行探究铁锈(Fe2O3·xH2O)的组成,实验按题图1所示装置进行探究,图2为A中固体质量和随加热时间的关系图。
①加热到 时,Fe2O3·xH2O开始分解生成Fe2O3和H2O。
②T3~T4过程中,是CO还原Fe2O3的过程,实验中观察到A中玻璃管的现象是 。
③取T5后固体冷却后加入足量的稀盐酸,完全反应,产生氢气质量为0.3g,求出图中m的值 。(写出计算过程)
④【数据处理】以下是图1中B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。
反应前(g) 反应后(g)
B 100 102.7
C 150 156.6
请结合数据,求算Fe2O3·xH2O中x的值为 。
参考答案:
1.D
【详解】A、金刚石和石墨的碳原子排列方式不同,硬度不同,选项错误;
B、氢氧化钠是由钠离子和氢氧根离子构成,NaOH溶液能够导电,是因为溶液中有可自由移动的离子,选项错误;
C、分子时保持物质化学性质的最小粒子,一氧化碳有毒,二氧化碳无毒,是因为分子的构成不同,错误;
D、氢氧化钡溶液和氨水都能使酚酞变红色,是因为溶液中都含有氢氧根离子,显碱性,正确。
故选D。
2.C
【详解】A、盐酸和胃酸的都是混合,氯化氢是纯净物,不属于同种物质;故选项错误;
B、冰和水都是由水分子构成的,干冰是固体二氧化碳,不属于同种物质;故选项错误;
C、氢氧化钠的俗名是:烧碱、苛性钠,属于同种物质;故选项正确;
D、生石灰的俗名是氧化钙,消石灰是氢氧化钙的俗名,不属于同种物质;故选项错误;
故选:C。
3.B
【分析】金属氧化物和酸反应生成盐和水,活泼金属和酸反应生成盐和氢气,酸和碱反应生成盐和水。
【详解】A、铁和稀盐酸反应生成氯化亚铁和氢气,故A正确;
B、二氧化碳和稀盐酸不反应,故B不正确;
C、氧化铁和稀盐酸反应生成氯化铁和水,故C正确;
D、氢氧化钙和稀盐酸反应生成氯化钙和水,故D正确;
4.C
【详解】A、带电的微粒不一定是离子,离子是带电的原子或原子团,质子和电子也带电, 但不属于离子,故A错误;B、单质是由不同元素组成的,但同种元素组成的物质不一定是单质,例如氧气和臭氧,故B错误;C、原子核中一定存在质子,但不一定存在中子,故C正确;D、能使酚酞溶液变红的不一定是碱,一定是碱性溶液,例如碳酸钠属于盐,其水溶液呈碱性,使酚酞溶液变红,故D错误。
点睛∶离子是带电的原子或原子团,原子核中一定存在质子,但不一定存在中子。能使酚酞溶液变红的不一定是碱,一定是碱性溶液。
5.B
【详解】A、氯化钠的溶液呈中性,不能使无色酚酞试剂变红色,故选项不符合题意;
B、氢氧化钠的溶液呈碱性,能使无色酚酞试剂变红色,故选项符合题意;
C、浓硫酸呈酸性,不能使无色酚酞试剂变红色,故选项不符合题意;
D、稀盐酸呈酸性,不能使无色酚酞试剂变红色,故选项不符合题意。
故选B。
6.D
【详解】A、稀盐酸具有挥发性,不具有强烈腐蚀性,故选项错误;B、氯化钠溶液显中性,不具有强烈腐蚀性,故选项错误;C、硝酸钾溶液显中性,不具有强烈腐蚀性,故选项错误;D、98%的浓H2SO4具有脱水性和强氧化性,具有强烈腐蚀性,故选项正确。故选D。
7.B
【详解】A、常温下,木炭在空气中的化学性质比较稳定,不需要密封保存;
B、氢氧化钠容易吸水,且能与空气中的二氧化碳反应生成碳酸钠而变质,需要密封保存;
C、石灰石在空气中的化学性质比较稳定,不需要密封保存;
D、纯净的氯化钠在空气中很稳定,不需要密封保存。
故选B。
8.C
【详解】A、可燃性气体不纯(含有助燃气体氧气),点燃时会产生爆鸣声,一氧化碳和甲烷均属于可燃性气体,如未混入氧气,点燃不会产生很大的爆鸣声,故选项说法错误。
B、浓硫酸具有吸水性,打开盛有浓硫酸的试剂瓶瓶盖,瓶口上方无明显现象,故选项说法错误。
C、木炭在空气中燃绕,木炭发红并放出热量,生成无色无味的气体,故选项说法正确。
D、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,生成四氧化三铁是实验结论而不是实验现象,故选项说法错误。
故选:C。
9.C
【详解】A、用托盘天平称量药品时,药品放在左盘,砝码放在右盘,此选项正确;B、蒸发食盐水时,蒸发皿放在铁圈上,边加热边用玻璃棒搅拌,此选项正确;C、稀释浓硫酸时,将浓硫酸沿烧杯内壁慢慢倒入水中,并用玻璃棒不断地搅拌,此选项错误;D、将导气管放入水中,用手握住试管的外壁,如果导管口有气泡冒出,说明装置气密性良好,此选项正确。故选C。
10.B
【详解】A、电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生成的阴离子全部是 OH-的化合物叫碱,酸碱电离理论认为酸碱是两种不同的物质,正确。
B、根据酸碱电离理论,NaHSO4不属于酸,因为电离出阳离子有钠离子,Cu (OH) CO 不属于碱,因为解离出阴离子有碳酸根离子,错误。
C、任何能给出质子(H+)的物质(分子、原子或离子)都是酸,任何能接受质子(H+)的物质(分子、原子或离子)都是碱,故酸碱质子理论认为酸和碱可以是分子,也可以是离子,正确。
D、酸碱质子理论扩大了酸和碱的范围,不再具有局限性,正确。
故选:B。
11.错误
【分析】紫色石蕊试液遇酸性物质变红色,遇碱性物质变蓝色,遇中性物质不变色(紫色)
【详解】氯化氢气体溶于水后形成盐酸,盐酸中有大量氢离子使得盐酸呈酸性,而氯化氢气体不具备酸的性质。故该说法错误
故答案为错误
12.错误
【详解】氢氧化钠不仅会和氯化氢气体反应生成氯化钠和水,也会和二氧化碳气体反应生成碳酸钠和水,不符合除杂原则,故错误。
13.正确
【详解】稀盐酸和稀硫酸均是电离时产生的阳离子都是氢离子的化合物,均属于酸,均显酸性,均能使紫色石蕊试液变红,故正确。
14.错误
【详解】铁锈主要成分是Fe2O3,与稀盐酸反应后会产生FeCl3和水,FeCl3溶液呈黄色。
故题干说法错误。
15.正确
【分析】浓盐酸物理性质:浓盐酸为无色、有刺激性气味的液体,具有挥发性,打开瓶口时瓶口会有白雾(盐酸小液滴)。
【详解】浓盐酸由氯化氢气体溶于水形成,具有挥发性,故该说法正确。
16.(1)化合
(2)72.4%
(3) 过氧化氢 21% 防止高温熔融物溅落炸裂瓶底 人工降雨(合理即可) CO
【详解】(1)火箭的推进剂是液氢和液氧,二者发生的反应是氢气和氧气在点燃的条件下生成水,该反应是由两种物质生成一种物质的反应,属于化合反应;
(2)“柢指南”中“构”的主要成分是Fe3O4,铁元素的质量分数为;
(3)A、C的元素组成相同且常温下均为液体,A、B都会转化成C,过氧化氢在二氧化锰催化作用下分解生成水和氧气,水通电分解生成氢气和氧气,所以A是过氧化氢,B是氧气,C是水,D可作食品干燥剂,所以D是氧化钙,F是农业生产中常用的气体肥料,二氧化碳参与光合作用,所以F是二氧化碳,氧化钙转化成的E会与二氧化碳反应,所以E是氢氧化钙,氢氧化钙会转化成G,所以G可以是碳酸钙,经过验证,推导正确。
①A的名称是过氧化氢;
②B是氧气,在空气中的体积分数约为21%;细铁丝在氧气中燃烧放出大量的热,生成物的温度较高,“铁丝在氧气中燃烧实验”中C的作用是:防止高温熔融物溅落炸裂瓶底;
③D→E的反应是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
④F是二氧化碳,另一种用途是人工降雨;一氧化碳易人体中血红蛋白结合,使人体因缺氧而中毒,若G能与血红蛋白结合导致人体中毒,其化学式为CO。
17.(1) AC 2KClO32KCl+3O2↑
(2)反应物为固体和液体,反应条件不需要加热
(3)将混合气体通过灼热的氧化铜
(4) 紫色石蕊溶液变红 将干燥的紫色石蕊试纸放入干燥的二氧化碳气体中
(5)80%
解:二氧化碳的质量为:12.5g+50g-58.1g=4.4g
设石灰石中碳酸钙的质量分数为x
x=80%
答:石灰石中碳酸钙的质量分数为80%。
【详解】(1)实验室用加热固体混合物的的方法制取并收集一瓶干燥的氧气,反应物为固体,需要加热,选择A为发生装置;氧气的密度大于空气,不易溶于水,要收集干燥的氧气,应选择C为收集装置;用A装置制取氧气,药品选择氯酸钾和二氧化锰,氯酸钾在二氧化锰的作用下加热生成氯化钾和氧气,化学方程式为:;
(2)B为固液不加热型装置,选择此装置要求:反应物为固体和液体,反应条件不需要加热;
(3)除去二氧化碳中含有少量的一氧化碳,可将混合气体通过灼热的氧化铜,一氧化碳和氧化铜加热生成铜和二氧化碳,符合除杂原则;
(4)二氧化碳和水反应生成碳酸,碳酸显酸性,能使石蕊变红,故能观察到①中溶液变红;②中二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:;小红认为D中的实验现象不足以说明CO2与水发生了反应,因为不能排除二氧化碳使石蕊变红的可能,所以需要将干燥的紫色石蕊试纸放入干燥的二氧化碳气体中,能观察到石蕊试纸不变红,说明二氧化碳不能使石蕊变红;
(5)根据质量守恒定律,反应前后的质量差为生成的二氧化碳的质量,即为:12.5g+50g-58.1g=4.4g;再利用二氧化碳的质量计算碳酸钙的质量,过程见答案。
18.(1)氧气和水蒸气
(2) T1 红色固体变为黑色 8.4
设铁的质量为x。
所以图中m的值8.4。 3
【详解】(1)铁粉可吸收空气中的氧气和水蒸气而生锈,故填:氧气和水蒸气。
(2)①由图可知,加热到T1时,Fe2O3·xH2O开始分解生成Fe2O3和H2O,故填:T1。
②在高温条件下,CO还原Fe2O3生成铁和二氧化碳,实验中观察到A中玻璃管的现象是红色固体变为黑色,故填:红色固体变为黑色。
③见答案 。
④C增重156.6g-150g=6.6g,说明生成二氧化碳6.6g;B增重102.7g-100g=2.7g,说明生成水2.7g,设氧化铁质量为y。
Fe2O3·xH2O生成氧化铁和水的质量比8g:2.7g=160:(18×x),x=3,所以Fe2O3·xH2O中x的值为:3。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.针对下列事实解释正确的是
选项 事实 解释
A 金刚石和石墨的硬度不同 碳原子核外电子的排列方式不同
B NaOH 溶液能够导电 溶液中有可自由移动的电子
C 一氧化碳有毒,二氧化碳无毒 分子中含有的原子数不同
D 氢氧化钡溶液和氨水都能使酚酞变红色 溶液中都含有氢氧根离子
A.A B.B C.C D.D
2.下列几种物质的名称中,表示同一种物质的是
A.盐酸、胃酸、氯化氢
B.冰、干冰、水
C.氢氧化钠、烧碱、苛性钠
D.氧化钙、消石灰、生石灰
3.下列物质不能与稀盐酸反应的是
A.Fe B.CO2 C.Fe2O3 D.Ca(OH)2
4.下列关于“一定”的说法中,正确的是
A.带电的微粒一定是离子 B.由同种元素组成的物质一定是单质
C.原子核中一定存在质子 D.能使酚酞溶液变红的一定是碱
5.向下列溶液中滴加几滴酚酞,溶液显红色的是
A.氯化钠溶液 B.氢氧化钠溶液 C.浓硫酸 D.稀盐酸
6.在实验室中,下列物质具有强烈腐蚀性的是( )
A.稀HCl B.NaCl溶液 C.KNO3溶液 D.98%的浓H2SO4
7.下列物质必须密封保存的是
A.木炭 B.氢氧化钠 C.石灰石 D.氯化钠
8.下列有关实验现象的描述中,正确的是
A.点燃一氧化碳和甲烷的混合气体,发出很大的爆鸣声
B.打开盛浓硫酸的试剂瓶瓶塞,有刺激性气味并产生白雾
C.木炭在空气中燃绕,木炭发红并放出热量,生成无色无味的气体
D.将细铁丝在氧气中点燃,剧烈燃烧,火星四射,生成四氧化三铁
9.下列实验操作中,不正确的是
A.称量氯化钠固体 B.蒸发食盐水
C.稀释浓硫酸 D.检查气密性
10.两种化学酸碱理论:①酸碱电离理论:电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生成的阴离子全部是 OH-的化合物叫碱。②酸碱质子理论:任何能给出质子(H+)的物质(分子、原子或离子)都是酸,任何能接受质子(H+)的物质(分子、原子或离子)都是碱。下列说法错误的是
A.酸碱电离理论认为酸碱是两种不同的物质
B.根据酸碱电离理论,NaHSO4属于酸,Cu (OH) CO 属于碱
C.酸碱质子理论认为酸和碱可以是分子,也可以是离子
D.酸碱质子理论扩大了酸和碱的范围,不再具有局限性
二、判断题
11.紫色石蕊固体,放入氯化氢气体中,紫色固体变红( )
12.用氢氧化钠溶液除去二氧化碳中的氯化氢气体( )
13.稀盐酸和稀硫酸都是酸,故都能使紫色石蕊试液变红( )
14.铁锈与稀盐酸反应后溶液由无色变成了浅绿色( )
15.浓盐酸具有挥发性( )
三、综合应用题
16.我国的北斗卫星导航系统标志是北斗星和司南的结合。
(1)我国“长三乙”火箭将第55颗北斗卫星送入预定轨道,完成了北斗卫星导航系统的组网。该火箭的推进剂是液氢和液氧,二者发生的反应属于 反应(填基本反应类型)。
(2)“司南之杓,投之于地,其柢指南”中“杓”的主要成分是Fe3O4,其中铁元素的质量分数为 (结果精确到0.1%)。
(3)如图“北斗七星”代表7种初中化学常见的物质,“—”表示相邻的物质间能发生反应,“→”表示能一步实现的物质转化方向。已知A、C的元素组成相同且常温下均为液体,D可作食品干燥剂,F是农业生产中常用的气体肥料。
①写出A的名称: 。
②B在空气中的体积分数约为 。“铁丝在氧气中燃烧实验”中C的作用是 。
③写出D→E的化学方程式: 。
④写出F的另一种用途: 。若G能与血红蛋白结合导致人体中毒,则其化学式为 。
17.结合下列实验装置图回答问题。
(1)实验室用加热固体混合物的的方法制取并收集一瓶干燥的氧气,应该选择的装置是 写出该反应的化学方程式 。
(2)在实验室选择B装置作为制取二氧化碳的发生装置,选择该装置的原因是 。
(3)若要除去二氧化碳中含有少量的一氧化碳,应如何操作 。
(4)为验证二氧化碳的化学性质,小明同学把纯净干燥的CO2通入F装置中,观察到①中的现象为 。②中发生反应的化学方程式为 。但小红认为D中的实验现象不足以说明CO2与水发生了反应,还应补做一个实验,请你写出应补做的实验 。
(5)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1 g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算石灰石中碳酸钙的质量分数。
18.铁粉可用作“双吸剂”,广泛应用于食品保鲜行业。
(1)铁粉可用作“双吸剂”保鲜,原理是它能吸收空气中的 而生锈,形成Fe2O3·xH2O。
(2)学习小组模拟双吸剂原理,取一定量纯铁粉放置在空气中一段时间,然后称取13.5g部分已经结块成红褐色的铁锈样品进行探究铁锈(Fe2O3·xH2O)的组成,实验按题图1所示装置进行探究,图2为A中固体质量和随加热时间的关系图。
①加热到 时,Fe2O3·xH2O开始分解生成Fe2O3和H2O。
②T3~T4过程中,是CO还原Fe2O3的过程,实验中观察到A中玻璃管的现象是 。
③取T5后固体冷却后加入足量的稀盐酸,完全反应,产生氢气质量为0.3g,求出图中m的值 。(写出计算过程)
④【数据处理】以下是图1中B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。
反应前(g) 反应后(g)
B 100 102.7
C 150 156.6
请结合数据,求算Fe2O3·xH2O中x的值为 。
参考答案:
1.D
【详解】A、金刚石和石墨的碳原子排列方式不同,硬度不同,选项错误;
B、氢氧化钠是由钠离子和氢氧根离子构成,NaOH溶液能够导电,是因为溶液中有可自由移动的离子,选项错误;
C、分子时保持物质化学性质的最小粒子,一氧化碳有毒,二氧化碳无毒,是因为分子的构成不同,错误;
D、氢氧化钡溶液和氨水都能使酚酞变红色,是因为溶液中都含有氢氧根离子,显碱性,正确。
故选D。
2.C
【详解】A、盐酸和胃酸的都是混合,氯化氢是纯净物,不属于同种物质;故选项错误;
B、冰和水都是由水分子构成的,干冰是固体二氧化碳,不属于同种物质;故选项错误;
C、氢氧化钠的俗名是:烧碱、苛性钠,属于同种物质;故选项正确;
D、生石灰的俗名是氧化钙,消石灰是氢氧化钙的俗名,不属于同种物质;故选项错误;
故选:C。
3.B
【分析】金属氧化物和酸反应生成盐和水,活泼金属和酸反应生成盐和氢气,酸和碱反应生成盐和水。
【详解】A、铁和稀盐酸反应生成氯化亚铁和氢气,故A正确;
B、二氧化碳和稀盐酸不反应,故B不正确;
C、氧化铁和稀盐酸反应生成氯化铁和水,故C正确;
D、氢氧化钙和稀盐酸反应生成氯化钙和水,故D正确;
4.C
【详解】A、带电的微粒不一定是离子,离子是带电的原子或原子团,质子和电子也带电, 但不属于离子,故A错误;B、单质是由不同元素组成的,但同种元素组成的物质不一定是单质,例如氧气和臭氧,故B错误;C、原子核中一定存在质子,但不一定存在中子,故C正确;D、能使酚酞溶液变红的不一定是碱,一定是碱性溶液,例如碳酸钠属于盐,其水溶液呈碱性,使酚酞溶液变红,故D错误。
点睛∶离子是带电的原子或原子团,原子核中一定存在质子,但不一定存在中子。能使酚酞溶液变红的不一定是碱,一定是碱性溶液。
5.B
【详解】A、氯化钠的溶液呈中性,不能使无色酚酞试剂变红色,故选项不符合题意;
B、氢氧化钠的溶液呈碱性,能使无色酚酞试剂变红色,故选项符合题意;
C、浓硫酸呈酸性,不能使无色酚酞试剂变红色,故选项不符合题意;
D、稀盐酸呈酸性,不能使无色酚酞试剂变红色,故选项不符合题意。
故选B。
6.D
【详解】A、稀盐酸具有挥发性,不具有强烈腐蚀性,故选项错误;B、氯化钠溶液显中性,不具有强烈腐蚀性,故选项错误;C、硝酸钾溶液显中性,不具有强烈腐蚀性,故选项错误;D、98%的浓H2SO4具有脱水性和强氧化性,具有强烈腐蚀性,故选项正确。故选D。
7.B
【详解】A、常温下,木炭在空气中的化学性质比较稳定,不需要密封保存;
B、氢氧化钠容易吸水,且能与空气中的二氧化碳反应生成碳酸钠而变质,需要密封保存;
C、石灰石在空气中的化学性质比较稳定,不需要密封保存;
D、纯净的氯化钠在空气中很稳定,不需要密封保存。
故选B。
8.C
【详解】A、可燃性气体不纯(含有助燃气体氧气),点燃时会产生爆鸣声,一氧化碳和甲烷均属于可燃性气体,如未混入氧气,点燃不会产生很大的爆鸣声,故选项说法错误。
B、浓硫酸具有吸水性,打开盛有浓硫酸的试剂瓶瓶盖,瓶口上方无明显现象,故选项说法错误。
C、木炭在空气中燃绕,木炭发红并放出热量,生成无色无味的气体,故选项说法正确。
D、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,生成四氧化三铁是实验结论而不是实验现象,故选项说法错误。
故选:C。
9.C
【详解】A、用托盘天平称量药品时,药品放在左盘,砝码放在右盘,此选项正确;B、蒸发食盐水时,蒸发皿放在铁圈上,边加热边用玻璃棒搅拌,此选项正确;C、稀释浓硫酸时,将浓硫酸沿烧杯内壁慢慢倒入水中,并用玻璃棒不断地搅拌,此选项错误;D、将导气管放入水中,用手握住试管的外壁,如果导管口有气泡冒出,说明装置气密性良好,此选项正确。故选C。
10.B
【详解】A、电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生成的阴离子全部是 OH-的化合物叫碱,酸碱电离理论认为酸碱是两种不同的物质,正确。
B、根据酸碱电离理论,NaHSO4不属于酸,因为电离出阳离子有钠离子,Cu (OH) CO 不属于碱,因为解离出阴离子有碳酸根离子,错误。
C、任何能给出质子(H+)的物质(分子、原子或离子)都是酸,任何能接受质子(H+)的物质(分子、原子或离子)都是碱,故酸碱质子理论认为酸和碱可以是分子,也可以是离子,正确。
D、酸碱质子理论扩大了酸和碱的范围,不再具有局限性,正确。
故选:B。
11.错误
【分析】紫色石蕊试液遇酸性物质变红色,遇碱性物质变蓝色,遇中性物质不变色(紫色)
【详解】氯化氢气体溶于水后形成盐酸,盐酸中有大量氢离子使得盐酸呈酸性,而氯化氢气体不具备酸的性质。故该说法错误
故答案为错误
12.错误
【详解】氢氧化钠不仅会和氯化氢气体反应生成氯化钠和水,也会和二氧化碳气体反应生成碳酸钠和水,不符合除杂原则,故错误。
13.正确
【详解】稀盐酸和稀硫酸均是电离时产生的阳离子都是氢离子的化合物,均属于酸,均显酸性,均能使紫色石蕊试液变红,故正确。
14.错误
【详解】铁锈主要成分是Fe2O3,与稀盐酸反应后会产生FeCl3和水,FeCl3溶液呈黄色。
故题干说法错误。
15.正确
【分析】浓盐酸物理性质:浓盐酸为无色、有刺激性气味的液体,具有挥发性,打开瓶口时瓶口会有白雾(盐酸小液滴)。
【详解】浓盐酸由氯化氢气体溶于水形成,具有挥发性,故该说法正确。
16.(1)化合
(2)72.4%
(3) 过氧化氢 21% 防止高温熔融物溅落炸裂瓶底 人工降雨(合理即可) CO
【详解】(1)火箭的推进剂是液氢和液氧,二者发生的反应是氢气和氧气在点燃的条件下生成水,该反应是由两种物质生成一种物质的反应,属于化合反应;
(2)“柢指南”中“构”的主要成分是Fe3O4,铁元素的质量分数为;
(3)A、C的元素组成相同且常温下均为液体,A、B都会转化成C,过氧化氢在二氧化锰催化作用下分解生成水和氧气,水通电分解生成氢气和氧气,所以A是过氧化氢,B是氧气,C是水,D可作食品干燥剂,所以D是氧化钙,F是农业生产中常用的气体肥料,二氧化碳参与光合作用,所以F是二氧化碳,氧化钙转化成的E会与二氧化碳反应,所以E是氢氧化钙,氢氧化钙会转化成G,所以G可以是碳酸钙,经过验证,推导正确。
①A的名称是过氧化氢;
②B是氧气,在空气中的体积分数约为21%;细铁丝在氧气中燃烧放出大量的热,生成物的温度较高,“铁丝在氧气中燃烧实验”中C的作用是:防止高温熔融物溅落炸裂瓶底;
③D→E的反应是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
④F是二氧化碳,另一种用途是人工降雨;一氧化碳易人体中血红蛋白结合,使人体因缺氧而中毒,若G能与血红蛋白结合导致人体中毒,其化学式为CO。
17.(1) AC 2KClO32KCl+3O2↑
(2)反应物为固体和液体,反应条件不需要加热
(3)将混合气体通过灼热的氧化铜
(4) 紫色石蕊溶液变红 将干燥的紫色石蕊试纸放入干燥的二氧化碳气体中
(5)80%
解:二氧化碳的质量为:12.5g+50g-58.1g=4.4g
设石灰石中碳酸钙的质量分数为x
x=80%
答:石灰石中碳酸钙的质量分数为80%。
【详解】(1)实验室用加热固体混合物的的方法制取并收集一瓶干燥的氧气,反应物为固体,需要加热,选择A为发生装置;氧气的密度大于空气,不易溶于水,要收集干燥的氧气,应选择C为收集装置;用A装置制取氧气,药品选择氯酸钾和二氧化锰,氯酸钾在二氧化锰的作用下加热生成氯化钾和氧气,化学方程式为:;
(2)B为固液不加热型装置,选择此装置要求:反应物为固体和液体,反应条件不需要加热;
(3)除去二氧化碳中含有少量的一氧化碳,可将混合气体通过灼热的氧化铜,一氧化碳和氧化铜加热生成铜和二氧化碳,符合除杂原则;
(4)二氧化碳和水反应生成碳酸,碳酸显酸性,能使石蕊变红,故能观察到①中溶液变红;②中二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:;小红认为D中的实验现象不足以说明CO2与水发生了反应,因为不能排除二氧化碳使石蕊变红的可能,所以需要将干燥的紫色石蕊试纸放入干燥的二氧化碳气体中,能观察到石蕊试纸不变红,说明二氧化碳不能使石蕊变红;
(5)根据质量守恒定律,反应前后的质量差为生成的二氧化碳的质量,即为:12.5g+50g-58.1g=4.4g;再利用二氧化碳的质量计算碳酸钙的质量,过程见答案。
18.(1)氧气和水蒸气
(2) T1 红色固体变为黑色 8.4
设铁的质量为x。
所以图中m的值8.4。 3
【详解】(1)铁粉可吸收空气中的氧气和水蒸气而生锈,故填:氧气和水蒸气。
(2)①由图可知,加热到T1时,Fe2O3·xH2O开始分解生成Fe2O3和H2O,故填:T1。
②在高温条件下,CO还原Fe2O3生成铁和二氧化碳,实验中观察到A中玻璃管的现象是红色固体变为黑色,故填:红色固体变为黑色。
③见答案 。
④C增重156.6g-150g=6.6g,说明生成二氧化碳6.6g;B增重102.7g-100g=2.7g,说明生成水2.7g,设氧化铁质量为y。
Fe2O3·xH2O生成氧化铁和水的质量比8g:2.7g=160:(18×x),x=3,所以Fe2O3·xH2O中x的值为:3。
同课章节目录
