江苏省宿迁市马陵中学2015-2016高一上学期期中考试化学试题
文档属性
| 名称 | 江苏省宿迁市马陵中学2015-2016高一上学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 88.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-19 09:19:53 | ||
图片预览


文档简介
2015—2016学年度第一学期马陵中学期中考试
高一化学
试卷满分100分 考试时间75分钟
相对原子质量: H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Mg-24 Al-27 Ca—40 Fe—56 Cu-64 Ba—137
第Ⅰ卷(选择题 共69分)
一、单项选择题(本部共23题,每题3分,共69分。每题只有1个选项是符合要求)
1.随着社会的发展,人们日益重视环境问题,下列做法或说法正确的是
A.对农作物秸秆进行焚烧还田,以增加土壤肥力
B.为提高农作物产量大量使用农药和化肥
C.PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
D.推广使用无磷洗衣粉,以减少水体富营养化
2.血液化验单中“葡萄糖”一项的结果为4.94×10-3 mol·L-1。这里的“4.94×10-3 mol·L-1”表示葡萄糖的
A.物质的量 B.物质的量浓度 C.质量分数 D.摩尔质量
3.下列各组物质,按化合物、单质、混合物的顺序排列的是
A.烧碱、液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢 D.空气、氮气、胆矾
4.下列一种变化与其它三种变化有本质区别,这种变化是
A. 碳燃烧产生气体 B.硫燃烧产生气体
C.高锰酸钾加热产生气体 D.水加热产生气体
5.2012年2月新华网报道,加拿大开发出生产医用放射性同位素:4399Te的简单方法。下列关于4399Te的叙述正确的是
A.原子序数是99 B.电子数是43
C.中子数是99 D.质量数是43
6.下列说法中正确的是
A.O2的摩尔质量是16g
B.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
C.同温、同压下,1mol任何气体所含的气体分子数目都相等
D. 标准状况下,体积是22.4升的物质,其物质的量一点是1摩尔
7.用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为1 NA
B.100mL 1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.48gO2和O3的混合气体中氧原子数目为3NA
8.下列仪器的使用、记录的数据或实验的结论正确的是
A.用25mL量筒量取22.30mL盐酸
B.用托盘天平称量8.75g食盐
C.将20gNa2CO3溶于80g水中制得20%的Na2CO3溶液
D.将标准状况下22.4LHCl气体溶于1L水中可制得1mol/L盐酸
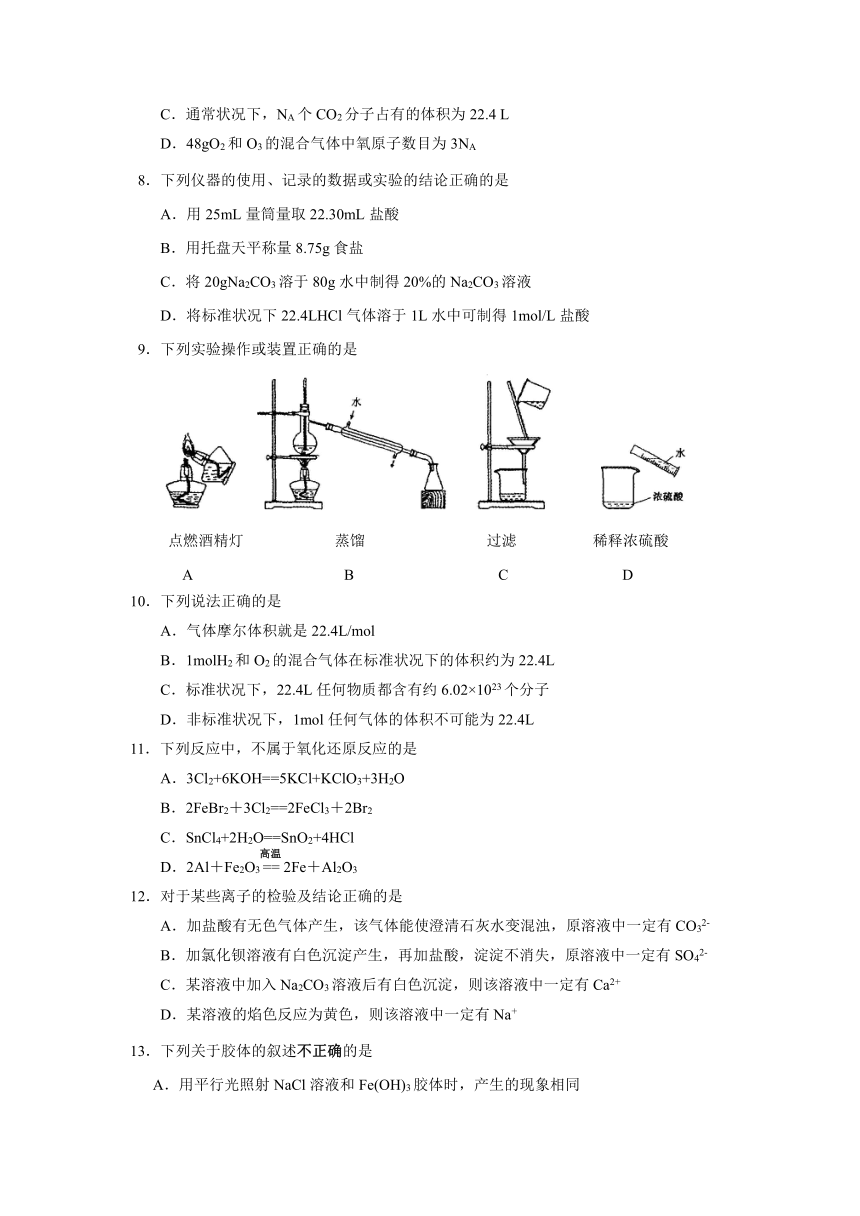
9.下列实验操作或装置正确的是
( http: / / www.21cnjy.com )
点燃酒精灯 蒸馏 过滤 稀释浓硫酸
A B C D
10.下列说法正确的是
A.气体摩尔体积就是22.4L/mol
B.1molH2和O2的混合气体在标准状况下的体积约为22.4L
C.标准状况下,22.4L任何物质都含有约6.02×1023个分子
D.非标准状况下,1mol任何气体的体积不可能为22.4L
11.下列反应中,不属于氧化还原反应的是
A.3Cl2+6KOH==5KCl+KClO3+3H2O
B.2FeBr2+3Cl2==2FeCl3+2Br2
C.SnCl4+2H2O==SnO2+4HCl
D.2Al+Fe2O3 == 2Fe+Al2O3
12.对于某些离子的检验及结论正确的是
A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32-
B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42-
C.某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+
D.某溶液的焰色反应为黄色,则该溶液中一定有Na+
13.下列关于胶体的叙述不正确的是
A.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
B.一束光线透过胶体时,胶体中可发生丁达尔效应
C.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~ 100nm之间
D.Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
14.核外电子排布相同的一组微粒是
A.Mg2+、Al3+、Cl-、Ne B.Na+、F-、S2-、Ar
C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、S2-
15.下列变化必须加入还原剂才能实现的是
A.HCl→Cl2 B.H2O→O2
C.SO2→ S D.CO32-→CO2
16.溴化碘(IBr)的化学性质与卤素单质 ( http: / / www.21cnjy.com )(如氯气、溴)相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O==HBr+HIO.下列有关叙述中不正确的是
A.IBr是双原子分子
B.IBr与水反应时,它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaBr和NaIO
17.配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A.称量时,将Na2CO3固体直接放在托盘天平的右盘上
B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
18.下列实验操作中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C.分液操作时,分液漏斗中下层液体及上层液体均从下口放出
D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
19.下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液
⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③⑤ D.③
20.实验室需要480 mL0.1mol·L-1硫酸铜溶液,以下操作中正确的是
A.称取7.86g硫酸铜,配制480mL溶液
B.称取12.0g胆矾,配制480mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾,配制500mL溶液
21.实验室制取氧气的反应为2KClO32KCl+3O2↑,反应后从剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
A.溶解、过滤、蒸发、洗涤 B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤 D.溶解、洗涤、过滤、加热
22.下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
A. 150 mL 1 mol·L-1的NaCl溶液 B. 75 mL 2 mol·L-1 NH4Cl溶液
C. 150 mL 2 mol·L-1的MgCl2溶液 D. 75 mL 1 mol·L-1的FeCl3溶液
23.将一定量的氯气通入3 ( http: / / www.21cnjy.com )0 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.若反应中转移的电子为n mol,则n一定大于0.15 mol
C.n(Na+)∶n(Cl-) 可能为7∶3
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1
第Ⅱ卷(非选择题,共31分)
二、填空题(本题包括3小题,共31分)
24.(7分)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)标出上述反应电子转移的方向和数目 。
(2)上述反应中氧化产物是 ,上述反应中氧化剂与还原剂的物质的量之
比为 。
(3)若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是 。
25.(10分)某实验室从化学试剂商店 ( http: / / www.21cnjy.com )买回浓度为18.4 mol·L-1的“化学纯”硫酸。现用该浓硫酸配制90 mL、1 mol·L-1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少
的仪器有 。
(2)配制100 mL 1 mol·L-1的稀硫酸需要上述浓硫酸的体积为__ __mL(保留一位
小数),量取浓硫酸时应选用 (选填①10 mL、②50 mL、③100 mL)规
格的量筒。
(3)实验中造成所配溶液浓度偏低的原因可能是 。
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.量取浓硫酸时仰视量筒刻度线
F.向容量瓶中加水定容时眼睛一直仰视刻度线
26.(14分)化工中把电解饱和食盐水的工业生产叫“氯碱工业”,其生产流程如下:
( http: / / www.21cnjy.com )
(1)除去食盐水中的Ca2+、Mg2+、SO42﹣,应分别加入下列溶液:①NaOH溶液、
②Na2CO3溶液、③BaCl2溶液,加入沉淀剂的顺序为 (填序号),
加入盐酸的作用为 。
(2)如右图为实验室电解饱和食盐水的实验装置:X、Y
均为石墨电极,两极周围溶液均滴有几滴酚酞试液。
电解一段时间后,X电极及附近溶液能观察到的现象是 。
检验Y电极产生的气体的方法是 。
(3)电解饱和食盐水的方程式为 。
若饱和食盐水体积为200mL,且忽略电解过程中的溶液体积变化及气体溶解,当两极
共收集到气体44.8mL(标准状况)时,计算电解后溶液中碱的物质的量浓度。
(写出计算的过程)
2015—2016学年度第一学期马陵中学期中考试
高一化学
参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 D B A D B C D C C B C D
题号 13 14 15 16 17 18 19 20 21 22 23
答案 A C C B B D C D B D C
.(7分) 得到3e-╳2
(1)
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (2分)
失去2e-╳3
(2)Cu(NO3)2 (1分); 2:3 (2分)
(3)4.48L (2分)
25.(10分)
(1)②④ (2分各1分) 100 mL容量瓶(2分)
(2)5.4 mL (2分) ① (2分)
(3) C F(2分)
26.(14分)
(1)③①② 或③②① (2分) 除去NaOH、Na2CO3杂质,调节溶液PH值 (2分)
(2)溶液变红 (2分) 用湿润的淀粉碘化钾试纸放在支管口(2分)
(3)2H2O+2NaClH2↑+Cl2↑+2NaOH(2分)
解:由2H2O+2NaClH2↑+Cl2↑+2NaOH 知
V(H2)= V(Cl2)=44.8mL/2=22.4 mL (1分)
n(H2)= 22.4 mL/(22.4 L·mol-1) = 0.001mol (1分)
2NaOH H2
2 1
n 0.001 mol
n= 0.002 mol (1分)
c(NaOH)= 0.002 mol/0.2L= 0.01 mol·L-1 (1分)
(本卷的其他合理答案均可参照给分)
高温
高一化学
试卷满分100分 考试时间75分钟
相对原子质量: H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Mg-24 Al-27 Ca—40 Fe—56 Cu-64 Ba—137
第Ⅰ卷(选择题 共69分)
一、单项选择题(本部共23题,每题3分,共69分。每题只有1个选项是符合要求)
1.随着社会的发展,人们日益重视环境问题,下列做法或说法正确的是
A.对农作物秸秆进行焚烧还田,以增加土壤肥力
B.为提高农作物产量大量使用农药和化肥
C.PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
D.推广使用无磷洗衣粉,以减少水体富营养化
2.血液化验单中“葡萄糖”一项的结果为4.94×10-3 mol·L-1。这里的“4.94×10-3 mol·L-1”表示葡萄糖的
A.物质的量 B.物质的量浓度 C.质量分数 D.摩尔质量
3.下列各组物质,按化合物、单质、混合物的顺序排列的是
A.烧碱、液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢 D.空气、氮气、胆矾
4.下列一种变化与其它三种变化有本质区别,这种变化是
A. 碳燃烧产生气体 B.硫燃烧产生气体
C.高锰酸钾加热产生气体 D.水加热产生气体
5.2012年2月新华网报道,加拿大开发出生产医用放射性同位素:4399Te的简单方法。下列关于4399Te的叙述正确的是
A.原子序数是99 B.电子数是43
C.中子数是99 D.质量数是43
6.下列说法中正确的是
A.O2的摩尔质量是16g
B.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
C.同温、同压下,1mol任何气体所含的气体分子数目都相等
D. 标准状况下,体积是22.4升的物质,其物质的量一点是1摩尔
7.用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为1 NA
B.100mL 1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.48gO2和O3的混合气体中氧原子数目为3NA
8.下列仪器的使用、记录的数据或实验的结论正确的是
A.用25mL量筒量取22.30mL盐酸
B.用托盘天平称量8.75g食盐
C.将20gNa2CO3溶于80g水中制得20%的Na2CO3溶液
D.将标准状况下22.4LHCl气体溶于1L水中可制得1mol/L盐酸
9.下列实验操作或装置正确的是
( http: / / www.21cnjy.com )
点燃酒精灯 蒸馏 过滤 稀释浓硫酸
A B C D
10.下列说法正确的是
A.气体摩尔体积就是22.4L/mol
B.1molH2和O2的混合气体在标准状况下的体积约为22.4L
C.标准状况下,22.4L任何物质都含有约6.02×1023个分子
D.非标准状况下,1mol任何气体的体积不可能为22.4L
11.下列反应中,不属于氧化还原反应的是
A.3Cl2+6KOH==5KCl+KClO3+3H2O
B.2FeBr2+3Cl2==2FeCl3+2Br2
C.SnCl4+2H2O==SnO2+4HCl
D.2Al+Fe2O3 == 2Fe+Al2O3
12.对于某些离子的检验及结论正确的是
A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32-
B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42-
C.某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+
D.某溶液的焰色反应为黄色,则该溶液中一定有Na+
13.下列关于胶体的叙述不正确的是
A.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
B.一束光线透过胶体时,胶体中可发生丁达尔效应
C.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~ 100nm之间
D.Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
14.核外电子排布相同的一组微粒是
A.Mg2+、Al3+、Cl-、Ne B.Na+、F-、S2-、Ar
C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、S2-
15.下列变化必须加入还原剂才能实现的是
A.HCl→Cl2 B.H2O→O2
C.SO2→ S D.CO32-→CO2
16.溴化碘(IBr)的化学性质与卤素单质 ( http: / / www.21cnjy.com )(如氯气、溴)相似,能跟大多数金属反应生成金属卤化物,能跟水反应IBr+H2O==HBr+HIO.下列有关叙述中不正确的是
A.IBr是双原子分子
B.IBr与水反应时,它既是氧化剂,又是还原剂
C.在很多化学反应中IBr作氧化剂
D.跟NaOH溶液反应可生成NaBr和NaIO
17.配制一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A.称量时,将Na2CO3固体直接放在托盘天平的右盘上
B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
18.下列实验操作中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C.分液操作时,分液漏斗中下层液体及上层液体均从下口放出
D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
19.下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液
⑤除去Cl2气体中的HCl,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③⑤ D.③
20.实验室需要480 mL0.1mol·L-1硫酸铜溶液,以下操作中正确的是
A.称取7.86g硫酸铜,配制480mL溶液
B.称取12.0g胆矾,配制480mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾,配制500mL溶液
21.实验室制取氧气的反应为2KClO32KCl+3O2↑,反应后从剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
A.溶解、过滤、蒸发、洗涤 B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤 D.溶解、洗涤、过滤、加热
22.下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
A. 150 mL 1 mol·L-1的NaCl溶液 B. 75 mL 2 mol·L-1 NH4Cl溶液
C. 150 mL 2 mol·L-1的MgCl2溶液 D. 75 mL 1 mol·L-1的FeCl3溶液
23.将一定量的氯气通入3 ( http: / / www.21cnjy.com )0 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.若反应中转移的电子为n mol,则n一定大于0.15 mol
C.n(Na+)∶n(Cl-) 可能为7∶3
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1
第Ⅱ卷(非选择题,共31分)
二、填空题(本题包括3小题,共31分)
24.(7分)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)标出上述反应电子转移的方向和数目 。
(2)上述反应中氧化产物是 ,上述反应中氧化剂与还原剂的物质的量之
比为 。
(3)若反应中转移了0.6 mol电子,产生的气体在标准状况下的体积是 。
25.(10分)某实验室从化学试剂商店 ( http: / / www.21cnjy.com )买回浓度为18.4 mol·L-1的“化学纯”硫酸。现用该浓硫酸配制90 mL、1 mol·L-1的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少
的仪器有 。
(2)配制100 mL 1 mol·L-1的稀硫酸需要上述浓硫酸的体积为__ __mL(保留一位
小数),量取浓硫酸时应选用 (选填①10 mL、②50 mL、③100 mL)规
格的量筒。
(3)实验中造成所配溶液浓度偏低的原因可能是 。
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.量取浓硫酸时仰视量筒刻度线
F.向容量瓶中加水定容时眼睛一直仰视刻度线
26.(14分)化工中把电解饱和食盐水的工业生产叫“氯碱工业”,其生产流程如下:
( http: / / www.21cnjy.com )
(1)除去食盐水中的Ca2+、Mg2+、SO42﹣,应分别加入下列溶液:①NaOH溶液、
②Na2CO3溶液、③BaCl2溶液,加入沉淀剂的顺序为 (填序号),
加入盐酸的作用为 。
(2)如右图为实验室电解饱和食盐水的实验装置:X、Y
均为石墨电极,两极周围溶液均滴有几滴酚酞试液。
电解一段时间后,X电极及附近溶液能观察到的现象是 。
检验Y电极产生的气体的方法是 。
(3)电解饱和食盐水的方程式为 。
若饱和食盐水体积为200mL,且忽略电解过程中的溶液体积变化及气体溶解,当两极
共收集到气体44.8mL(标准状况)时,计算电解后溶液中碱的物质的量浓度。
(写出计算的过程)
2015—2016学年度第一学期马陵中学期中考试
高一化学
参考答案
题号 1 2 3 4 5 6 7 8 9 10 11 12
答案 D B A D B C D C C B C D
题号 13 14 15 16 17 18 19 20 21 22 23
答案 A C C B B D C D B D C
.(7分) 得到3e-╳2
(1)
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (2分)
失去2e-╳3
(2)Cu(NO3)2 (1分); 2:3 (2分)
(3)4.48L (2分)
25.(10分)
(1)②④ (2分各1分) 100 mL容量瓶(2分)
(2)5.4 mL (2分) ① (2分)
(3) C F(2分)
26.(14分)
(1)③①② 或③②① (2分) 除去NaOH、Na2CO3杂质,调节溶液PH值 (2分)
(2)溶液变红 (2分) 用湿润的淀粉碘化钾试纸放在支管口(2分)
(3)2H2O+2NaClH2↑+Cl2↑+2NaOH(2分)
解:由2H2O+2NaClH2↑+Cl2↑+2NaOH 知
V(H2)= V(Cl2)=44.8mL/2=22.4 mL (1分)
n(H2)= 22.4 mL/(22.4 L·mol-1) = 0.001mol (1分)
2NaOH H2
2 1
n 0.001 mol
n= 0.002 mol (1分)
c(NaOH)= 0.002 mol/0.2L= 0.01 mol·L-1 (1分)
(本卷的其他合理答案均可参照给分)
高温
同课章节目录
