重庆市万州第二高级中学2023-2024学年高一下学期期中考试化学(含答案)
文档属性
| 名称 | 重庆市万州第二高级中学2023-2024学年高一下学期期中考试化学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 752.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-10 12:36:12 | ||
图片预览


文档简介
万州二中教育集团高2023级高一下期期中联考
化学试题
注意事项:
1.答题前,考生务必将自己的姓名、准考证号、班级、学校在答题卡上填写清楚。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。在试卷上作答无效。
3.考试结束后,请将答题卡交回,试卷自行保存。满分100分,考试用时75分钟.
可能用到的相对原子质量:
一、单项选择题(本题有14个小题,每小题3分,共42分)
1. 化学是一门充满乐趣的学科。下列叙述正确的是( )
A.二氧化硫具有氧化性,因此常用于丝织品的漂白
B.可利用高温下铝粉与氧化铁的反应来焊接钢轨
C.向燃煤中加入生石灰可以减少酸雨的形成和温室气体的排放
D.碳酸钡在医疗上常用作消化系统X射线检查的内服药剂
2.下列化学用语书写正确的是( )
A.CH4的球棍模型:
B.HF的电离方程式:HF=H++Cl-
C.氯化钠的分子式:NaCl
D.CS2的结构式:S=C=S
3.NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.标况下11.2 L CH4和22.4 L Cl2在光照条件下充分反应后的分子数为1.5 NA
B.1 mol NH4Cl晶体中中含有共价键数目为3NA
C.18 g中含有中子数为10NA
D.100 mL 0.1 mol · L-1 NaOH溶液中O原子数目为0.01NA
4.下列微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:
B.某透明溶液中:
C.饱和食盐水中:
D.强碱性溶液中:
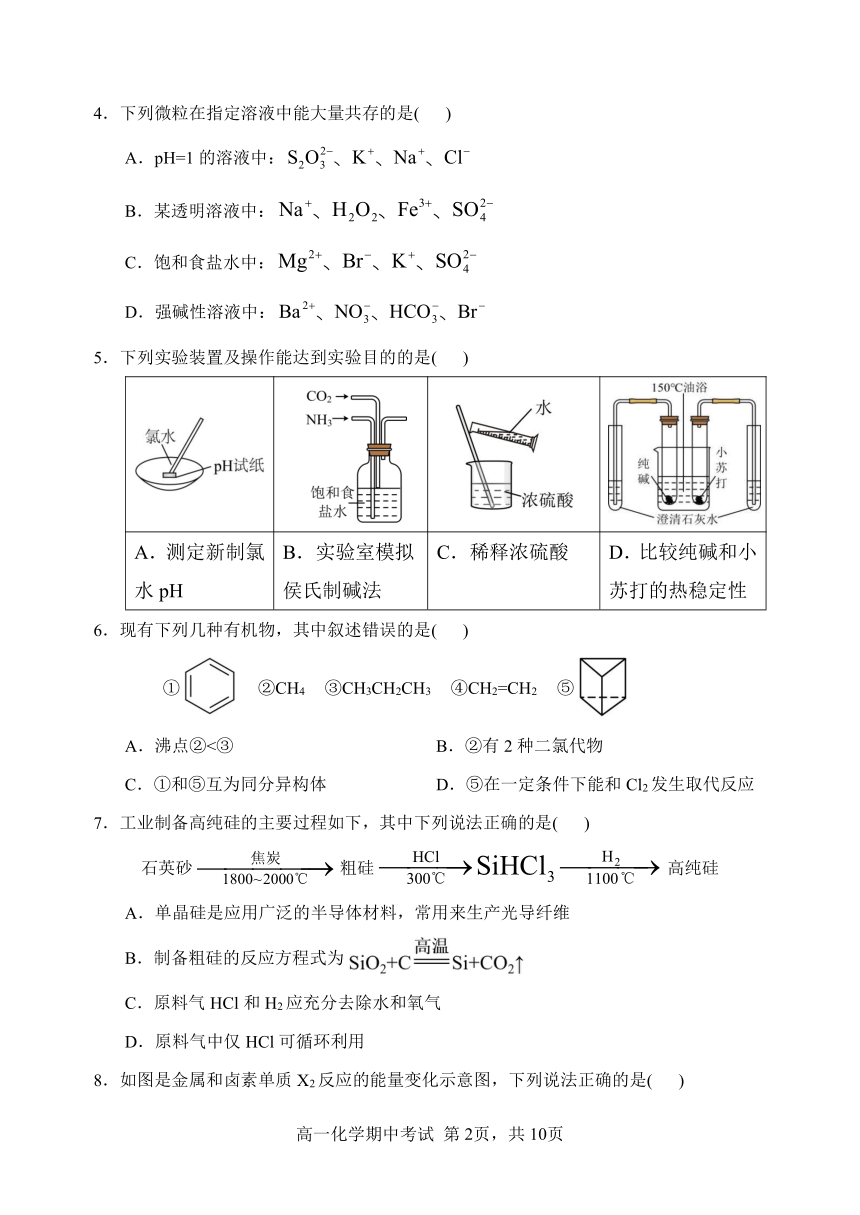
5.下列实验装置及操作能达到实验目的的是( )
A.测定新制氯水pH B.实验室模拟侯氏制碱法 C.稀释浓硫酸 D.比较纯碱和小苏打的热稳定性
现有下列几种有机物,其中叙述错误的是( )
① ②CH4 ③CH3CH2CH3 ④CH2=CH2 ⑤
A.沸点②<③ B.②有2种二氯代物
C.①和⑤互为同分异构体 D.⑤在一定条件下能和Cl2发生取代反应
7.工业制备高纯硅的主要过程如下,其中下列说法正确的是( )
石英砂粗硅高纯硅
A.单晶硅是应用广泛的半导体材料,常用来生产光导纤维
B.制备粗硅的反应方程式为
C.原料气HCl和H2应充分去除水和氧气
D.原料气中仅HCl可循环利用
8.如图是金属和卤素单质X2反应的能量变化示意图,下列说法正确的是( )
A.稳定性:MgF2(s)>MgCl2(s)>MgBr2(s)>MgI2(s)
B.由MgI2(s)转化为MgCl2(s)需要吸收能量
C.22.4 L F2(g)与足量Mg反应生成MgF2(s)放热1124 kJ
D.由图可知,MgBr2(s)分解吸收的能量比MgCl2(s)多
9.反应Fe3+ + 3SCN- Fe(SCN)3,将一定量的Fe3+与SCN-混合形成2 L溶液发生反应(忽略反应过程中的体积变化),测得SCN-的物质的量数据如下表。下列说法正确的是( )
t/min 0 1 2 4
n(SCN-)/mol 3 1.5 0.6 0.6
A.2 min时,v(SCN-)=0.6 mol·L-1·min-1
B.4 min时,溶液中剩余Fe3+物质的量为0.2 mol
C.2 min内,v(Fe3+)=0.2 mol·L-1·min-1
D.2 min时,n(Fe3+):n(SCN):n[Fe(SCN)3]=1:3:1
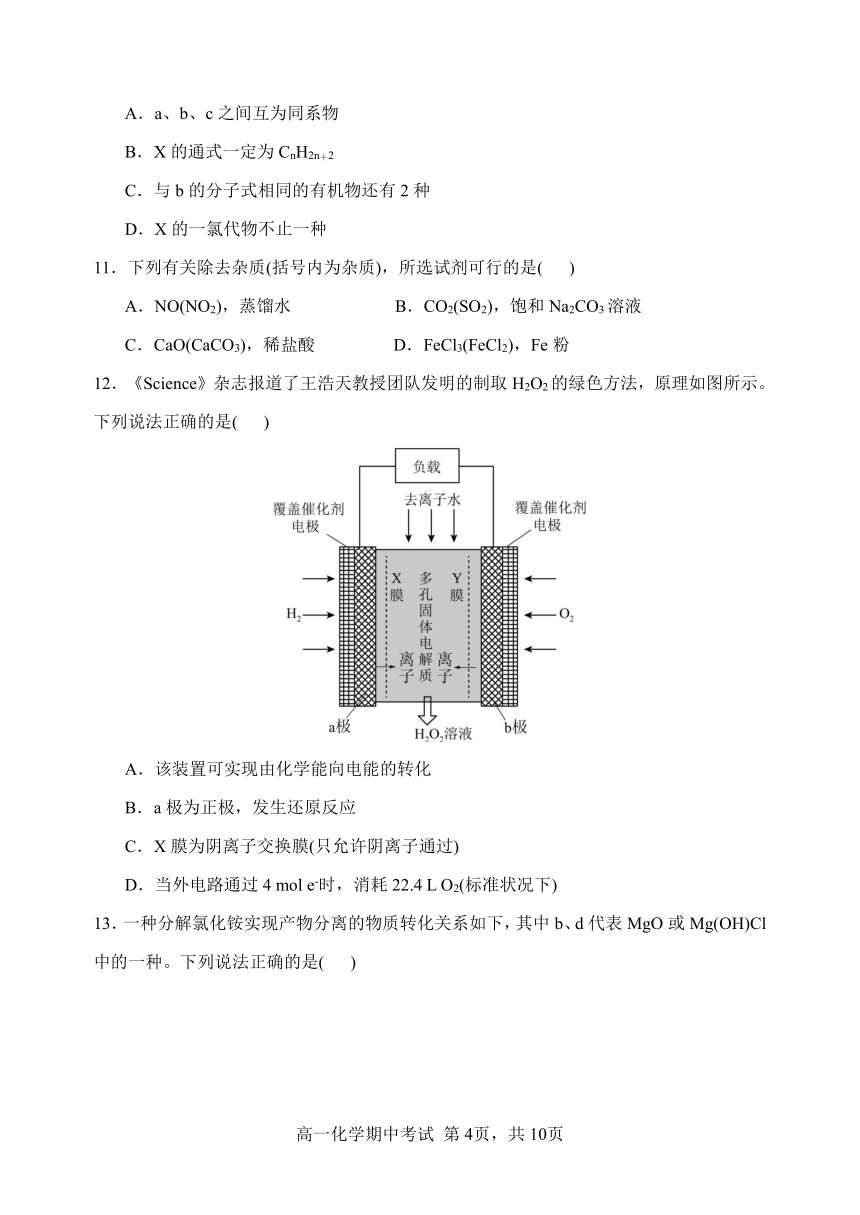
10.对称变换是一种建模方法。依据甲烷的一氯代物只有一种,采用如下代换:
下列说法错误的是( )
A.a、b、c之间互为同系物
B.X的通式一定为CnH2n+2
C.与b的分子式相同的有机物还有2种
D.X的一氯代物不止一种
11.下列有关除去杂质(括号内为杂质),所选试剂可行的是( )
A.NO(NO2),蒸馏水 B.CO2(SO2),饱和Na2CO3溶液
C.CaO(CaCO3),稀盐酸 D.FeCl3(FeCl2),Fe粉
12.《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示。下列说法正确的是( )
A.该装置可实现由化学能向电能的转化
B.a极为正极,发生还原反应
C.X膜为阴离子交换膜(只允许阴离子通过)
D.当外电路通过4 mol e-时,消耗22.4 L O2(标准状况下)
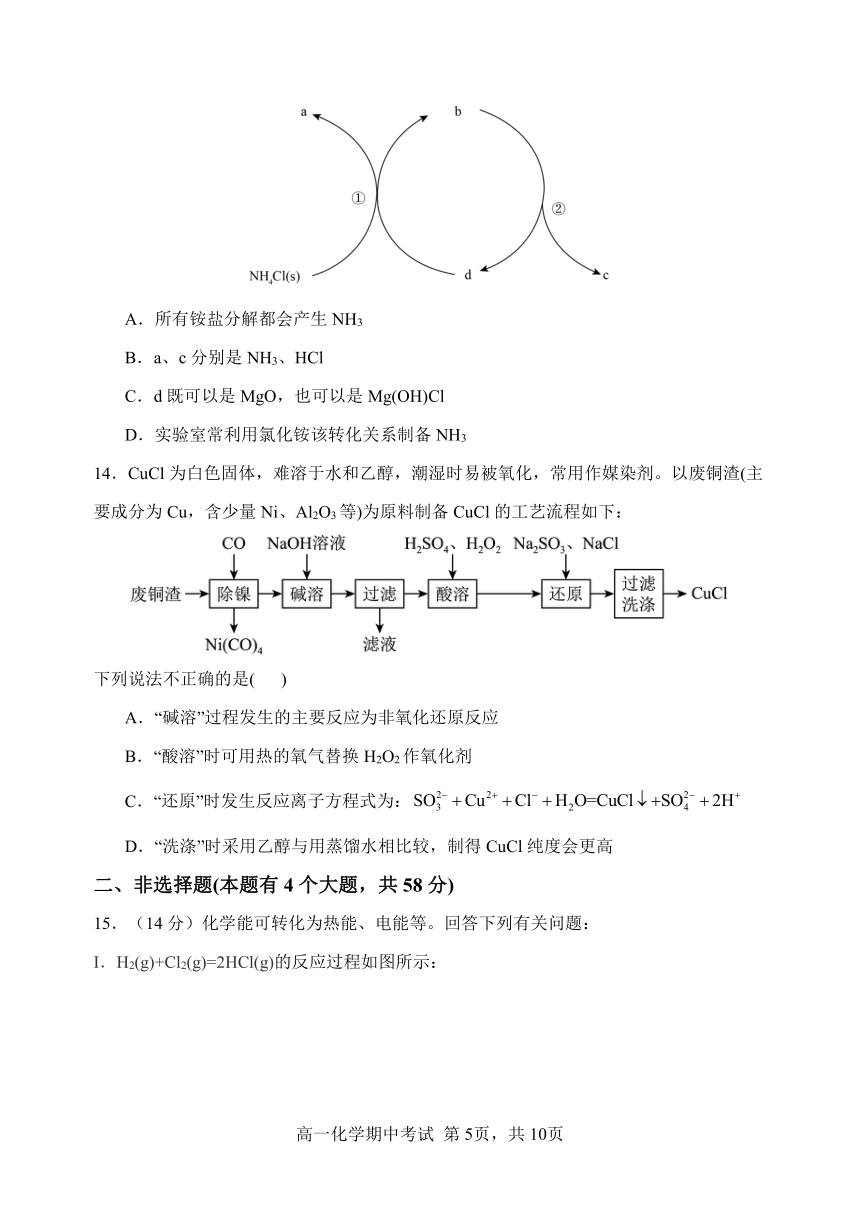
13.一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是( )
A.所有铵盐分解都会产生NH3
B.a、c分别是NH3、HCl
C.d既可以是MgO,也可以是Mg(OH)Cl
D.实验室常利用氯化铵该转化关系制备NH3
14.CuCl为白色固体,难溶于水和乙醇,潮湿时易被氧化,常用作媒染剂。以废铜渣(主要成分为Cu,含少量Ni、Al2O3等)为原料制备CuCl的工艺流程如下:
下列说法不正确的是( )
A.“碱溶”过程发生的主要反应为非氧化还原反应
B.“酸溶”时可用热的氧气替换H2O2作氧化剂
C.“还原”时发生反应离子方程式为:
D.“洗涤”时采用乙醇与用蒸馏水相比较,制得CuCl纯度会更高
二、非选择题(本题有4个大题,共58分)
15.(14分)化学能可转化为热能、电能等。回答下列有关问题:
Ⅰ.H2(g)+Cl2(g)=2HCl(g)的反应过程如图所示:
每生成2 mol HCl(g)时,该反应需要 (填“吸收”或“放出”)的热量为 。
Ⅱ.下图是一套原电池的装置示意图。请回答:
(2)若A为Pb,B为PbO2,溶液C为H2SO4溶液,工作时的总反应为Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O,则B电极反应式为 该电池在工作时,A电极的质量将 (填“‘增加”减小”或“不变”)
(3)若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为 。
(4)甲醇(CH3OH)和O2在下列装置中反应可以设计成为燃料电池,其结构示意图如下:
则物质b是 ,电极c的反应式为 。
16.(14分)在体积固定为2 L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示,已知物质C也为气体。则:
(1)在第4 s时,该反应的正反应速率 (填“>”、“<”或“=”)逆反应速率;该反应达到最大限度的时间是 s。经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为 。
(2)从反应开始到12 s内,A的转化率为 。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,反应相同时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3 mol·L-1·s-1;乙:v(B)=0.12 mol·L-1·s-1;丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为 (用甲、乙、丙表示)。
(4)一定能够判断该反应达到平衡状态的依据是___________(填选项)。
A.该条件下,混合气体的密度不再发生变化
B.该条件下,混合气体的压强不再发生变化
C.该条件下,单位时间内消耗3 mol A的同时生成2 mol C
D.该条件下,n(A):n(B):n(C)=2:3:4
E.该条件下,混合气体颜色不再发生变化
(5)为加快上述反应速率的,可以改变的外界条件是 (写出一种即可)。
17.(15分)NaAlH4是常用的还原剂;Na2FeO4常做净水剂和消毒剂。工业上以制备硫酸的烧渣(主要成分为Fe3O4、Fe2O3和Al2O3含少量SiO2)为原料制备NaAlH4和Na2FeO4的流程如下:
回答下列问题:
(1)NaAlH4中氢的化合价为 。
(2)浸渣的主要成分是 (填化学式);“转化”中Cl2的作用是 (用离子方程式表示)。
(3)由Fe(OH)3制备Na2FeO4的离子方程式为 ;“分离”中铝元素转化成 (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是 。
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为 。
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为 (计算结果保留三位有效数字)。
(15分)S2Cl2常温下是一种黄红色液体,沸点为137 ℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140 ℃反应制得。
Ⅰ.选用以下装置制取少量S2Cl2(加热及夹持装置已省略):
已知:玻璃纤维为多孔结构,具有一定吸附性;m为冷凝装置
(1)A中发生反应的化学方程式为 。
(2)装置的连接顺序为A→ → → → 。
(3)B中玻璃纤维的作用是 。
(4)D装置的作用为 。
Ⅱ.S2Cl2遇水会生成SO2气体、HCl和一种淡黄色固体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
(5)S2Cl2遇水反应化学方程式为 。
(6)W溶液可以是 (填一种即可);若无溶液W,测得SO2体积分数会 。
(7)该混合气体中SO2的体积分数为 (用含V、m的代数式表示)。
万州二中教育集团高2023级高一下期期中联考
(化学)答案
1-14 BDACD BCACD AABC
15.
Ⅰ.(1)放出;183 kJ
Ⅱ.(2);增加
(3)0.1 NA
(4)O2;CH3OH-6e-+H2O=CO2↑+6H+
16.
(1)>;12;3A(g)+B(g) 2C(g)
(2)75%
乙>甲>丙
(4)BD
(5)合理即可。
17.
-1
(2)SiO2;2Fe2++Cl2=2Fe3++2Cl-
(3);[Al(OH)4]-
(4)Na2CO3
(5)AlCl3+4NaH=NaAlH4+3NaCl
(6)0.148 g
18.
(1)
(2)CBED
(3)增大S与Cl2接触面积,加快反应,使反应更充分(答防止装置堵塞得1分)
(4)防止空气中水蒸气进入;吸收多余尾气HCl,防止污染环境
(5)2S2Cl2+2H2O=SO2↑+4HCl+3S↓
(6)H2O2、新制氯水等;偏小(或偏低,表达合理即可)
(7)
高一化学期中考试 第1页,共3页
化学试题
注意事项:
1.答题前,考生务必将自己的姓名、准考证号、班级、学校在答题卡上填写清楚。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。在试卷上作答无效。
3.考试结束后,请将答题卡交回,试卷自行保存。满分100分,考试用时75分钟.
可能用到的相对原子质量:
一、单项选择题(本题有14个小题,每小题3分,共42分)
1. 化学是一门充满乐趣的学科。下列叙述正确的是( )
A.二氧化硫具有氧化性,因此常用于丝织品的漂白
B.可利用高温下铝粉与氧化铁的反应来焊接钢轨
C.向燃煤中加入生石灰可以减少酸雨的形成和温室气体的排放
D.碳酸钡在医疗上常用作消化系统X射线检查的内服药剂
2.下列化学用语书写正确的是( )
A.CH4的球棍模型:
B.HF的电离方程式:HF=H++Cl-
C.氯化钠的分子式:NaCl
D.CS2的结构式:S=C=S
3.NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.标况下11.2 L CH4和22.4 L Cl2在光照条件下充分反应后的分子数为1.5 NA
B.1 mol NH4Cl晶体中中含有共价键数目为3NA
C.18 g中含有中子数为10NA
D.100 mL 0.1 mol · L-1 NaOH溶液中O原子数目为0.01NA
4.下列微粒在指定溶液中能大量共存的是( )
A.pH=1的溶液中:
B.某透明溶液中:
C.饱和食盐水中:
D.强碱性溶液中:
5.下列实验装置及操作能达到实验目的的是( )
A.测定新制氯水pH B.实验室模拟侯氏制碱法 C.稀释浓硫酸 D.比较纯碱和小苏打的热稳定性
现有下列几种有机物,其中叙述错误的是( )
① ②CH4 ③CH3CH2CH3 ④CH2=CH2 ⑤
A.沸点②<③ B.②有2种二氯代物
C.①和⑤互为同分异构体 D.⑤在一定条件下能和Cl2发生取代反应
7.工业制备高纯硅的主要过程如下,其中下列说法正确的是( )
石英砂粗硅高纯硅
A.单晶硅是应用广泛的半导体材料,常用来生产光导纤维
B.制备粗硅的反应方程式为
C.原料气HCl和H2应充分去除水和氧气
D.原料气中仅HCl可循环利用
8.如图是金属和卤素单质X2反应的能量变化示意图,下列说法正确的是( )
A.稳定性:MgF2(s)>MgCl2(s)>MgBr2(s)>MgI2(s)
B.由MgI2(s)转化为MgCl2(s)需要吸收能量
C.22.4 L F2(g)与足量Mg反应生成MgF2(s)放热1124 kJ
D.由图可知,MgBr2(s)分解吸收的能量比MgCl2(s)多
9.反应Fe3+ + 3SCN- Fe(SCN)3,将一定量的Fe3+与SCN-混合形成2 L溶液发生反应(忽略反应过程中的体积变化),测得SCN-的物质的量数据如下表。下列说法正确的是( )
t/min 0 1 2 4
n(SCN-)/mol 3 1.5 0.6 0.6
A.2 min时,v(SCN-)=0.6 mol·L-1·min-1
B.4 min时,溶液中剩余Fe3+物质的量为0.2 mol
C.2 min内,v(Fe3+)=0.2 mol·L-1·min-1
D.2 min时,n(Fe3+):n(SCN):n[Fe(SCN)3]=1:3:1
10.对称变换是一种建模方法。依据甲烷的一氯代物只有一种,采用如下代换:
下列说法错误的是( )
A.a、b、c之间互为同系物
B.X的通式一定为CnH2n+2
C.与b的分子式相同的有机物还有2种
D.X的一氯代物不止一种
11.下列有关除去杂质(括号内为杂质),所选试剂可行的是( )
A.NO(NO2),蒸馏水 B.CO2(SO2),饱和Na2CO3溶液
C.CaO(CaCO3),稀盐酸 D.FeCl3(FeCl2),Fe粉
12.《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示。下列说法正确的是( )
A.该装置可实现由化学能向电能的转化
B.a极为正极,发生还原反应
C.X膜为阴离子交换膜(只允许阴离子通过)
D.当外电路通过4 mol e-时,消耗22.4 L O2(标准状况下)
13.一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是( )
A.所有铵盐分解都会产生NH3
B.a、c分别是NH3、HCl
C.d既可以是MgO,也可以是Mg(OH)Cl
D.实验室常利用氯化铵该转化关系制备NH3
14.CuCl为白色固体,难溶于水和乙醇,潮湿时易被氧化,常用作媒染剂。以废铜渣(主要成分为Cu,含少量Ni、Al2O3等)为原料制备CuCl的工艺流程如下:
下列说法不正确的是( )
A.“碱溶”过程发生的主要反应为非氧化还原反应
B.“酸溶”时可用热的氧气替换H2O2作氧化剂
C.“还原”时发生反应离子方程式为:
D.“洗涤”时采用乙醇与用蒸馏水相比较,制得CuCl纯度会更高
二、非选择题(本题有4个大题,共58分)
15.(14分)化学能可转化为热能、电能等。回答下列有关问题:
Ⅰ.H2(g)+Cl2(g)=2HCl(g)的反应过程如图所示:
每生成2 mol HCl(g)时,该反应需要 (填“吸收”或“放出”)的热量为 。
Ⅱ.下图是一套原电池的装置示意图。请回答:
(2)若A为Pb,B为PbO2,溶液C为H2SO4溶液,工作时的总反应为Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O,则B电极反应式为 该电池在工作时,A电极的质量将 (填“‘增加”减小”或“不变”)
(3)若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为 。
(4)甲醇(CH3OH)和O2在下列装置中反应可以设计成为燃料电池,其结构示意图如下:
则物质b是 ,电极c的反应式为 。
16.(14分)在体积固定为2 L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示,已知物质C也为气体。则:
(1)在第4 s时,该反应的正反应速率 (填“>”、“<”或“=”)逆反应速率;该反应达到最大限度的时间是 s。经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为 。
(2)从反应开始到12 s内,A的转化率为 。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,反应相同时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3 mol·L-1·s-1;乙:v(B)=0.12 mol·L-1·s-1;丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为 (用甲、乙、丙表示)。
(4)一定能够判断该反应达到平衡状态的依据是___________(填选项)。
A.该条件下,混合气体的密度不再发生变化
B.该条件下,混合气体的压强不再发生变化
C.该条件下,单位时间内消耗3 mol A的同时生成2 mol C
D.该条件下,n(A):n(B):n(C)=2:3:4
E.该条件下,混合气体颜色不再发生变化
(5)为加快上述反应速率的,可以改变的外界条件是 (写出一种即可)。
17.(15分)NaAlH4是常用的还原剂;Na2FeO4常做净水剂和消毒剂。工业上以制备硫酸的烧渣(主要成分为Fe3O4、Fe2O3和Al2O3含少量SiO2)为原料制备NaAlH4和Na2FeO4的流程如下:
回答下列问题:
(1)NaAlH4中氢的化合价为 。
(2)浸渣的主要成分是 (填化学式);“转化”中Cl2的作用是 (用离子方程式表示)。
(3)由Fe(OH)3制备Na2FeO4的离子方程式为 ;“分离”中铝元素转化成 (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是 。
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为 。
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为 (计算结果保留三位有效数字)。
(15分)S2Cl2常温下是一种黄红色液体,沸点为137 ℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140 ℃反应制得。
Ⅰ.选用以下装置制取少量S2Cl2(加热及夹持装置已省略):
已知:玻璃纤维为多孔结构,具有一定吸附性;m为冷凝装置
(1)A中发生反应的化学方程式为 。
(2)装置的连接顺序为A→ → → → 。
(3)B中玻璃纤维的作用是 。
(4)D装置的作用为 。
Ⅱ.S2Cl2遇水会生成SO2气体、HCl和一种淡黄色固体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
(5)S2Cl2遇水反应化学方程式为 。
(6)W溶液可以是 (填一种即可);若无溶液W,测得SO2体积分数会 。
(7)该混合气体中SO2的体积分数为 (用含V、m的代数式表示)。
万州二中教育集团高2023级高一下期期中联考
(化学)答案
1-14 BDACD BCACD AABC
15.
Ⅰ.(1)放出;183 kJ
Ⅱ.(2);增加
(3)0.1 NA
(4)O2;CH3OH-6e-+H2O=CO2↑+6H+
16.
(1)>;12;3A(g)+B(g) 2C(g)
(2)75%
乙>甲>丙
(4)BD
(5)合理即可。
17.
-1
(2)SiO2;2Fe2++Cl2=2Fe3++2Cl-
(3);[Al(OH)4]-
(4)Na2CO3
(5)AlCl3+4NaH=NaAlH4+3NaCl
(6)0.148 g
18.
(1)
(2)CBED
(3)增大S与Cl2接触面积,加快反应,使反应更充分(答防止装置堵塞得1分)
(4)防止空气中水蒸气进入;吸收多余尾气HCl,防止污染环境
(5)2S2Cl2+2H2O=SO2↑+4HCl+3S↓
(6)H2O2、新制氯水等;偏小(或偏低,表达合理即可)
(7)
高一化学期中考试 第1页,共3页
同课章节目录
