乙醇-高考化学考前专项练习试题(含答案)
文档属性
| 名称 | 乙醇-高考化学考前专项练习试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 468.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-10 18:54:13 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
乙醇
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列物质的性质与应用对应关系正确的是
A.氢氟酸具有弱酸性,可用作玻璃蚀刻剂
B.干冰气化时吸热,可用作制冷剂
C.钠与水反应,可用于除去乙醇中少量的水
D.硅酸钠易溶于水,可用作木材防火剂
2.(本题5分)化学与人类生活密切相关。下列说法正确的是
A.丙烯和氯乙烯可以合成食品包装材料
B.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
C.丙三醇俗称甘油,可用作冬天干燥天气的护肤品,因为它具有吸湿性
D.涂改液中常含有三氯甲烷,用作溶剂,学生要少用,因为三氯甲烷有毒难挥发
3.(本题5分)能一次区分乙酸、乙醇、苯、四氯化碳四种物质的试液是
A.水 B.氢氧化钠溶液
C.Na2CO3稀溶液 D.稀硫酸
4.(本题5分)根据下列实验操作和现象所得到结论正确的是
操作和现象 结论
A 将乙醇与浓H2SO4混合加热,将产生的气体通入酸性KMnO4溶液,溶液紫红色褪去 产生的气体中一定含有乙烯
B 向苯酚浊液中滴加碳酸钠溶液,浊液变澄清 苯酚的酸性强于碳酸的酸性
C 向1—溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 1—溴丙烷没有水解
D 向20%蔗糖溶液中加入稀硫酸加热,再加入NaOH溶液调成碱性,再加入银氨溶液水浴加热,出现银镜 蔗糖水解产物具有还原性
A.A B.B C.C D.D
5.(本题5分)下列关于乙醇的说法中,不正确的是
A.乙醇是无色透明、有特殊香味的液体
B.乙醇可以使酸性高锰酸钾溶液褪色
C.乙醇属于烃类物质
D.无水硫酸铜常用于检验乙醇中是否含有水
6.(本题5分)化学与人类生活、生产和社会可持续发展密切相关。下列说法不正确的是( )
A.成分为盐酸的洁厕灵与84消毒液混合使用易中毒
B.利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验是否酒后驾车
C.水泥冶金厂常用高压电除尘,是因为烟尘在空气中形成胶体且发生丁达尔效应
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是产生雾霾天气的主要因素
7.(本题5分)下列实验现象与实验操作不相匹配的是
选项 实验操作 实验现象
A 向淀粉在稀硫酸催化下的水解液中滴入少量新制的银氨溶液并加热 有银白色物质生成
B 将装有CuCl22H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸 试纸变为红色
C 向盛有酸性高锰酸钾溶液的试管中加入足量的乙醇振荡后静置 溶液紫色逐渐褪去
D 向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液 溶液显蓝色
A.A B.B C.C D.D
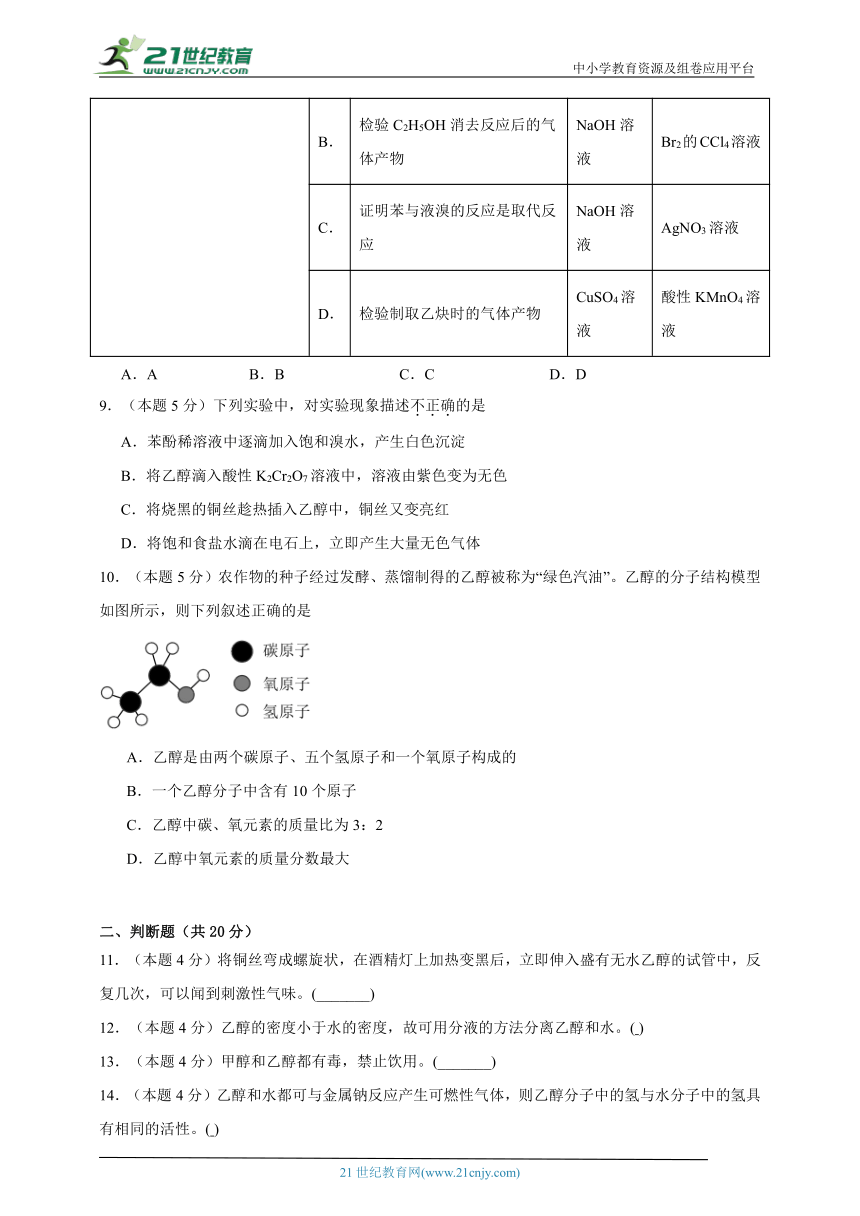
8.(本题5分)实验室用如图装置完成表中的四个实验,不能达到实验目的的是
实验装置 实验目的 试剂X 试剂Y
A. 检验C2H5Br消去反应后的气体产物 水 酸性KMnO4溶液
B. 检验C2H5OH消去反应后的气体产物 NaOH溶液 Br2的CCl4溶液
C. 证明苯与液溴的反应是取代反应 NaOH溶液 AgNO3溶液
D. 检验制取乙炔时的气体产物 CuSO4溶液 酸性KMnO4溶液
A.A B.B C.C D.D
9.(本题5分)下列实验中,对实验现象描述不正确的是
A.苯酚稀溶液中逐滴加入饱和溴水,产生白色沉淀
B.将乙醇滴入酸性K2Cr2O7溶液中,溶液由紫色变为无色
C.将烧黑的铜丝趁热插入乙醇中,铜丝又变亮红
D.将饱和食盐水滴在电石上,立即产生大量无色气体
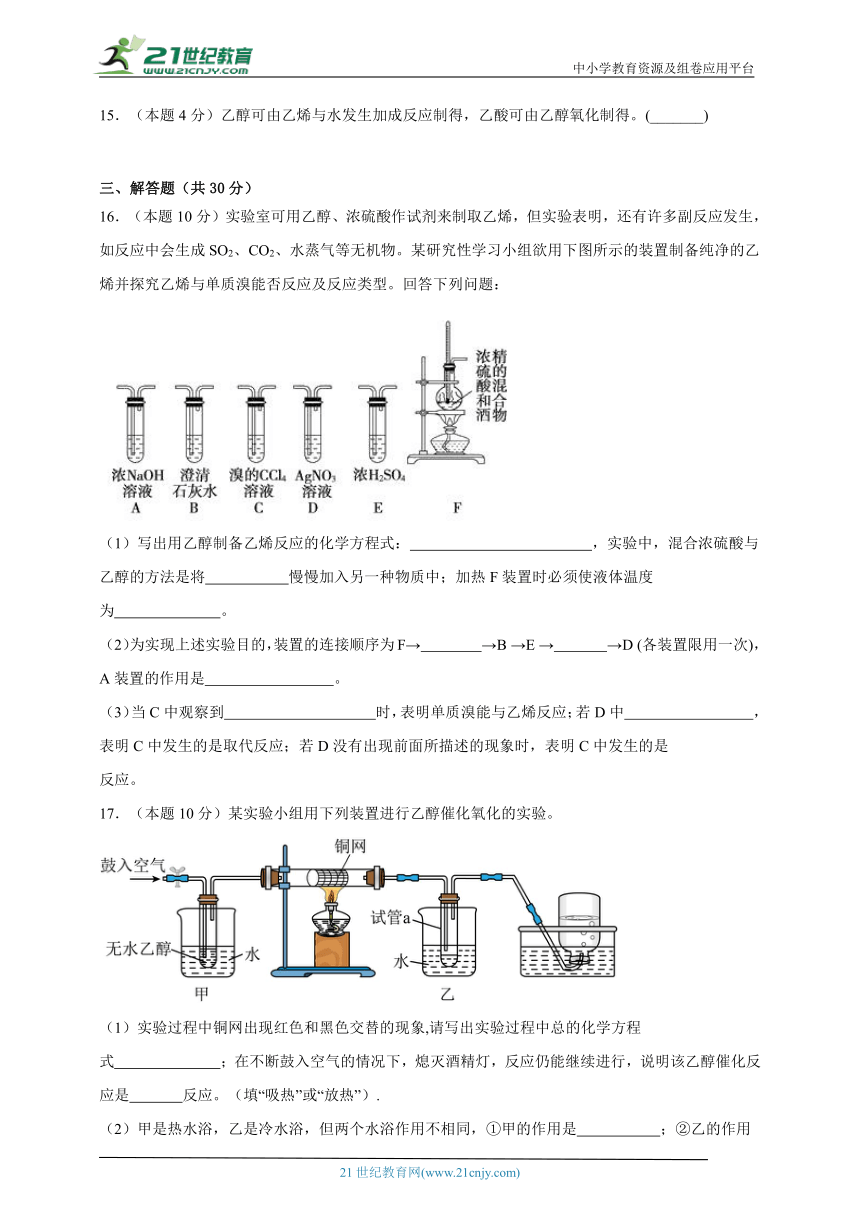
10.(本题5分)农作物的种子经过发酵、蒸馏制得的乙醇被称为“绿色汽油”。乙醇的分子结构模型如图所示,则下列叙述正确的是
A.乙醇是由两个碳原子、五个氢原子和一个氧原子构成的
B.一个乙醇分子中含有10个原子
C.乙醇中碳、氧元素的质量比为3:2
D.乙醇中氧元素的质量分数最大
二、判断题(共20分)
11.(本题4分)将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复几次,可以闻到刺激性气味。(_______)
12.(本题4分)乙醇的密度小于水的密度,故可用分液的方法分离乙醇和水。( )
13.(本题4分)甲醇和乙醇都有毒,禁止饮用。(_______)
14.(本题4分)乙醇和水都可与金属钠反应产生可燃性气体,则乙醇分子中的氢与水分子中的氢具有相同的活性。( )
15.(本题4分)乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得。(_______)
三、解答题(共30分)
16.(本题10分)实验室可用乙醇、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
(1)写出用乙醇制备乙烯反应的化学方程式: ,实验中,混合浓硫酸与乙醇的方法是将 慢慢加入另一种物质中;加热F装置时必须使液体温度为 。
(2)为实现上述实验目的,装置的连接顺序为F→ →B →E → →D (各装置限用一次),A装置的作用是 。
(3)当C中观察到 时,表明单质溴能与乙烯反应;若D中 ,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是 反应。
17.(本题10分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出实验过程中总的化学方程式 ;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应。(填“吸热”或“放热”).
(2)甲是热水浴,乙是冷水浴,但两个水浴作用不相同,①甲的作用是 ;②乙的作用是 。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有 。要除去该物质,可先在混合液中加入 (填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
18.(本题10分)乙醇(CH3CH2OH)既是生活中常见的有机物,又是重要的化工原料。
(1)工业上可用乙烯制备乙醇的化学方程式为:CH2 = CH2+H2OCH3CH2OH,该反应属于 反应(填“加成”或“取代”)。
(2)官能团决定有机物的性质。乙醇中含有的官能团名称是 。
(3)为探究乙醇的性质,某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,说明乙醇具有 性。
(4)萃取是物质分离的一种方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行: (填“是”或“否”),判断的理由是 。
(5)某液态有机物不溶于水,将它和水分离开来的方法是 。
参考答案:
1.B
【详解】A. 氢氟酸用作玻璃蚀刻剂,不是因为具有弱酸性,是因为生成挥发性的硅化物,故A错误;B. 干冰气化时吸热,使得周围环境温度降低,可用作制冷剂,故B正确;C. 钠也能与乙醇反应,故C错误;D. 硅酸钠用作木材防火剂,与易溶于水无关,故D错误;故选B。
2.C
【详解】A.制备食品包装材料的原料是聚乙烯,氯乙烯有毒,长期接触引发癌症,A错误;
B.煤干馏得到的煤焦油可以分离出苯,但苯是有特殊气味的液态烃,B错误;
C.丙三醇俗称甘油,具有吸湿性,对皮肤友好,可用作冬天干燥天气的护肤品,C正确;
D.三氯甲烷为无色透明液体,有特殊气味,易挥发,遇光照会与空气中的氧作用,逐渐分解而生成剧毒的光气(碳酰氯)和氯化氢,D错误;
故选C。
3.C
【详解】苯和四氯化碳均不溶于水,其中苯的密度比水小,四氯化碳的密度比水大;
A.乙醇、乙酸与水均不反应不分层,现象相同,不能区分,故A错误;
B.加入NaOH溶液,乙酸与NaOH发生中和反应,乙醇与NaOH溶液混溶,均无明显现象,不能鉴别乙酸、乙醇,故B错误;
C.乙酸与碳酸钠溶液反应生成气体,乙醇与碳酸钠溶液混溶,苯不溶于水,密度比水小,在溶液上层,四氯化碳不溶于水,密度比水大,在溶液下层,可鉴别,故C正确;
D.加入稀硫酸,不能鉴别乙酸、乙醇,故D错误;
答案选C。
4.D
【详解】A.挥发的乙醇及反应产生的乙烯都可以被酸性KMnO4溶液氧化而使溶液褪色,因此不能根据溶液褪色确定产生的气体中一定含有乙烯,故A错误;
B.向苯酚浊液中滴加碳酸钠溶液,浊液变澄清,是由于苯酚与碳酸钠反应产生可溶性苯酚钠和碳酸氢钠,可证明酸性:苯酚>HCO,故B错误;
C.检验1—溴丙烷水解后溶液中含有Br-应该在酸性溶液中加入硝酸银,实验中水解后溶液中没有加入硝酸至溶液显酸性,因此不能检验,故C错误;
D.蔗糖在稀硫酸作催化剂的条件下加热,发生水解反应,然后向水解后的溶液中加入NaOH溶液使溶液显碱性,再加入银氨溶液水浴加热,若出现银镜,就证明蔗糖水解产物具有还原性,能被银氨溶液氧化,故D正确;
选D。
5.C
【详解】A、乙醇是无色透明、有特殊香味的液体,故A正确;
B、乙醇能被高锰酸钾氧化,乙醇可以使酸性高锰酸钾溶液褪色,故B正确;
C、乙醇含有氧原子,不属于烃类物质,故C错误;
D、水能使无水硫酸铜变蓝,无水硫酸铜常用于检验乙醇中是否含有水,故D正确;
答案选C。
6.C
【详解】A项、洁厕灵的主要成分是盐酸,84消毒液的主要成分是次氯酸钠,两者混合使用,盐酸和次氯酸钠发生如下反应:Cl-+ClO-+2H+═Cl2↑+H2O,反应生成有毒的氯气容易使人中毒,故A正确;
B项、乙醇具有还原性,能与Cr2O72-反应生成Cr3+,依据Cr3+和Cr2O72-的颜色不同检验是否酒后驾车,故B正确;
C项、水泥冶金厂的烟尘在空气中形成胶体,因为胶粒带电荷,用高压电对气溶胶作用以除去大量烟尘,其原理是电泳,故C错误;
D项、PM2.5在大气中的停留时间长、输送距离远,会导致城市人为能见度下降,产生雾霾天气,故D正确。
故选C。
【点睛】本题考查化学与生活,侧重分析与应用能力的考查,把握物质的性质、性质与用途的关系为解答的关键。
7.A
【详解】A.淀粉水解液显酸性,应该加碱中和后再加银氨溶液,若不加碱,则不会有银白色银产生,故A符合题意;
B.将装有CuCl22H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸,试纸变为红色,说明产生了酸性气体,是因为氯化铜水解放出的氯化氢显酸性,故B不符合题意;
C.酸性高锰酸钾可以氧化乙醇,使其本身褪色,故C不符合题意;
D.溴水氧化KI生成I2,I2遇到淀粉变蓝,故D不符合题意;
故选A。
8.C
【详解】A.C2H5Br发生消去反应生成乙烯和溴化氢,乙烯和溴化氢均能使酸性高锰酸钾溶液褪色,为防止溴化氢对乙烯的干扰,试剂X可除去溴化氢,因此可达到实验目的,A项正确;
B.乙醇发生消去反应生成乙烯,反应过程中浓硫酸可能会与有机物反应生成SO2,生成的SO2会和溴反应,将干扰实验结果,所以用X溶液吸收可能产生的SO2,用Y溶液检验乙烯,表格中所列试剂能实现实验目的,B项正确;
C.苯与液溴发生取代反应生成HBr,同时溴挥发会干扰HBr检验,应用四氯化碳除去HBr中的溴蒸气,若用NaOH会同时吸收HBr,C项错误;
D.电石和食盐水反应生成乙炔,同时还生成杂质气体硫化氢等,硫化氢能和硫酸铜反应生成CuS沉淀,且硫化氢、乙炔都能被酸性高锰酸钾溶液氧化,X能除去硫化氢气体,防止乙炔的检验,Y能检验乙炔,能实现实验目的,D项正确;
故选:C。
9.B
【详解】A项、三溴苯酚不溶于水,苯酚稀溶液中逐滴加入饱和溴水,苯酚稀溶液和饱和溴水发生取代反应生成三溴苯酚白色沉淀,故A正确;
B项、将乙醇滴入酸性K2Cr2O7溶液中,乙醇与酸性K2Cr2O7溶液发生氧化还原反应生成氯化钾、氯化铬、乙酸和水,溶液由橙色变为绿色,故B错误;
C项、将烧黑的铜丝趁热插入乙醇中,氧化铜与乙醇加热条件下发生氧化还原反应生成铜、乙醛和水,铜丝黑色变亮红,故C正确;
D项、将饱和食盐水滴在电石上,电石与水立即反应生成氢氧化钙和乙炔气体,故D正确;
故选B。
【点睛】本题考查化学实验现象分析,注意把握常见有机物的性质,明确反应的类型和生成物的性质是解答关键。
10.C
【详解】A.由乙醇分子的结构可知,一个乙醇分子是由两个碳原子、六个氢原子和一个氧原子构成的,A错误;
B.一个乙醇分子中含有9个原子,B错误;
C.乙醇中碳、氧元素的质量比=24:16=3:2,C正确;
D.根据选项C可判断乙醇中碳元素的质量分数最大,D错误。
答案选C。
11.正确
【详解】加热变黑生成CuO,再与乙醇发生氧化反应,重复几次,完成乙醇氧化为乙醛的实验,实验合理,故正确。
12.错误
【解析】略
13.错误
【详解】主要是利用薯类、谷物类、糖类作为原料经过蒸煮、糖化、发酵等处理而得的食用酒精,可以饮用。
14.错误
【详解】乙醇与水均会与钠反应生成H2,但Na与水反应更剧烈,故水分子中氢的活性强于乙醇分子中氢的活性,需要注意的是乙醇分子中只有一OH中的H能与Na反应,乙醇分子中氢的活性不完全相同,故B错误;
15.正确
【详解】乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得,正确。
16. C2H5OHCH2=CH2↑+H2O 浓硫酸 迅速升高到170℃ A C 除去乙烯中SO2、CO2气体杂质 溶液褪色 有浅黄色沉淀生成 加成
【详解】分析:(1)乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯和水;类比浓硫酸的稀释方法解答,即应该将浓硫酸加入乙醇中;温度在140℃时会发生副反应生成乙醚;(2)根据实验目的及题干信息,应该先用氢氧化钠溶液除去SO2、CO2,再用澄清石灰水检验杂质是否除尽,然后用浓硫酸干燥乙烯,再用溴的四氯化碳溶液检验乙烯的性质,用D检验是否有溴化氢生成从而判断乙烯与溴的反应类型;(3)当装置C中溴的四氯化碳褪色可以证明溴与乙烯发生了反应;根据D中是否出现浅黄色沉淀判断乙烯与溴发生的是取代反应还是加成反应。
详解:(1)乙醇在170℃时发生消去生成乙烯,温度必须是170℃,反应方程式为:C2H5OHCH2=CH2↑+H2O;浓硫酸密度大于乙醇,且混合过程中放热大量热,所以应该将浓硫酸加入乙醇中,边加边搅拌;温度在140℃时会发生副反应生成乙醚,为了避免副反应发生,所以必须将混合液温度迅速升高到反应温度;故答案为C2H5OHCH2=CH2↑+H2O;将浓硫酸加入乙醇中;迅速升高到170℃ ;
(2)浓硫酸具有脱水性和强氧化性,浓硫酸使乙醇脱水,然后浓硫酸氧化碳生成二氧化碳,同时生成二氧化硫气体,为得到纯净的乙烯,应用NaOH溶液(A装置)除去杂质气体SO2、CO2,(并用石灰水检验是否除尽),然后用浓硫酸干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,所以装置连接顺序为:F→A→B→E→C→D,正确答案为:A、C;除去乙烯中SO2、CO2气体杂质;
(3)当C中观察到溴水褪色时,表明单质溴能与乙烯反应;若D中硝酸银溶液中出现浅黄色沉淀时,表明C中生成了溴化银沉淀,发生的是取代反应;若D没有出现浅黄色沉淀现象时,表明溴化氢生成,C中发生的是加成反应,正确答案为:溶液褪色;有浅黄色沉淀生成;加成。
17. 2CH3CH2OH + O22CH3CHO + 2H2O 放热 提供乙醇蒸气 冷却产生的乙醛等气体 乙醛、乙醇、水 乙酸 C
【分析】(1)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;熄灭酒精灯,反应仍能继续进行,说明反应放热;
(2)甲为热水浴,乙为冷水浴,结合实验的原理分析解答;
(3)根据物质的沸点高低不同来确定获得的物质;
(4)能使紫色石蕊试纸变红,说明该物质显酸性,结合乙酸的性质和选项是否反应分析判断。
【详解】(1)铜与氧气反应生成黑色的氧化铜,氧化铜与乙醇发生氧化反应生成铜和乙醛、水,反应的方程式:2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+Cu+H2O,反应的总反应方程式为2CH3CH2OH + O22CH3CHO + 2H2O;熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是放热反应,放出的热量足以维持反应进行,故答案为2CH3CH2OH + O22CH3CHO + 2H2O;放热;
(2)甲和乙两个水浴作用不相同,甲是热水浴,作用是乙醇平稳气化成乙醇蒸气,乙是冷水浴,目的是将乙醛冷却下来,故答案为提供乙醇蒸气;冷却产生的乙醛等气体;
(3)乙醇的催化氧化实验中的物质:乙醇、乙醛和水的沸点高低不同,在试管a中能收集这些不同的物质,故答案为乙醛、乙醇、水;
(4)若试管a中收集到的液体用蓝色石蕊试纸检验,试纸显红色,说明溶液呈酸性,则溶液中含有乙酸;乙酸具有酸的通性,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,然后再通过蒸馏即可分离除去乙酸,故答案为乙酸;C。
18. 加成 羟基 还原性 否 乙醇和水任意比互溶,不能做萃取剂 分液
【详解】(1)工业上可用乙烯和水加成制备乙醇,化学方程式为:CH2 = CH2+H2OCH3CH2OH,该反应属于加成反应。故答案为:加成;
(2)乙醇中含有的官能团是-OH,名称是羟基。故答案为:羟基;
(3)某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,氧化铜被还原成铜,说明乙醇具有还原性性。故答案为:还原性;
(4)萃取利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行:否(填“是”或“否”),判断的理由是乙醇和水任意比互溶,不能做萃取剂。故答案为:否;乙醇和水任意比互溶,不能做萃取剂;
(5)分离互不相溶(或微溶)的两种液体混合物用分液,某液态有机物不溶于水,将它和水分离开来的方法是分液。故答案为:分液。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
乙醇
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列物质的性质与应用对应关系正确的是
A.氢氟酸具有弱酸性,可用作玻璃蚀刻剂
B.干冰气化时吸热,可用作制冷剂
C.钠与水反应,可用于除去乙醇中少量的水
D.硅酸钠易溶于水,可用作木材防火剂
2.(本题5分)化学与人类生活密切相关。下列说法正确的是
A.丙烯和氯乙烯可以合成食品包装材料
B.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
C.丙三醇俗称甘油,可用作冬天干燥天气的护肤品,因为它具有吸湿性
D.涂改液中常含有三氯甲烷,用作溶剂,学生要少用,因为三氯甲烷有毒难挥发
3.(本题5分)能一次区分乙酸、乙醇、苯、四氯化碳四种物质的试液是
A.水 B.氢氧化钠溶液
C.Na2CO3稀溶液 D.稀硫酸
4.(本题5分)根据下列实验操作和现象所得到结论正确的是
操作和现象 结论
A 将乙醇与浓H2SO4混合加热,将产生的气体通入酸性KMnO4溶液,溶液紫红色褪去 产生的气体中一定含有乙烯
B 向苯酚浊液中滴加碳酸钠溶液,浊液变澄清 苯酚的酸性强于碳酸的酸性
C 向1—溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 1—溴丙烷没有水解
D 向20%蔗糖溶液中加入稀硫酸加热,再加入NaOH溶液调成碱性,再加入银氨溶液水浴加热,出现银镜 蔗糖水解产物具有还原性
A.A B.B C.C D.D
5.(本题5分)下列关于乙醇的说法中,不正确的是
A.乙醇是无色透明、有特殊香味的液体
B.乙醇可以使酸性高锰酸钾溶液褪色
C.乙醇属于烃类物质
D.无水硫酸铜常用于检验乙醇中是否含有水
6.(本题5分)化学与人类生活、生产和社会可持续发展密切相关。下列说法不正确的是( )
A.成分为盐酸的洁厕灵与84消毒液混合使用易中毒
B.利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验是否酒后驾车
C.水泥冶金厂常用高压电除尘,是因为烟尘在空气中形成胶体且发生丁达尔效应
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是产生雾霾天气的主要因素
7.(本题5分)下列实验现象与实验操作不相匹配的是
选项 实验操作 实验现象
A 向淀粉在稀硫酸催化下的水解液中滴入少量新制的银氨溶液并加热 有银白色物质生成
B 将装有CuCl22H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸 试纸变为红色
C 向盛有酸性高锰酸钾溶液的试管中加入足量的乙醇振荡后静置 溶液紫色逐渐褪去
D 向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液 溶液显蓝色
A.A B.B C.C D.D
8.(本题5分)实验室用如图装置完成表中的四个实验,不能达到实验目的的是
实验装置 实验目的 试剂X 试剂Y
A. 检验C2H5Br消去反应后的气体产物 水 酸性KMnO4溶液
B. 检验C2H5OH消去反应后的气体产物 NaOH溶液 Br2的CCl4溶液
C. 证明苯与液溴的反应是取代反应 NaOH溶液 AgNO3溶液
D. 检验制取乙炔时的气体产物 CuSO4溶液 酸性KMnO4溶液
A.A B.B C.C D.D
9.(本题5分)下列实验中,对实验现象描述不正确的是
A.苯酚稀溶液中逐滴加入饱和溴水,产生白色沉淀
B.将乙醇滴入酸性K2Cr2O7溶液中,溶液由紫色变为无色
C.将烧黑的铜丝趁热插入乙醇中,铜丝又变亮红
D.将饱和食盐水滴在电石上,立即产生大量无色气体
10.(本题5分)农作物的种子经过发酵、蒸馏制得的乙醇被称为“绿色汽油”。乙醇的分子结构模型如图所示,则下列叙述正确的是
A.乙醇是由两个碳原子、五个氢原子和一个氧原子构成的
B.一个乙醇分子中含有10个原子
C.乙醇中碳、氧元素的质量比为3:2
D.乙醇中氧元素的质量分数最大
二、判断题(共20分)
11.(本题4分)将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复几次,可以闻到刺激性气味。(_______)
12.(本题4分)乙醇的密度小于水的密度,故可用分液的方法分离乙醇和水。( )
13.(本题4分)甲醇和乙醇都有毒,禁止饮用。(_______)
14.(本题4分)乙醇和水都可与金属钠反应产生可燃性气体,则乙醇分子中的氢与水分子中的氢具有相同的活性。( )
15.(本题4分)乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得。(_______)
三、解答题(共30分)
16.(本题10分)实验室可用乙醇、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
(1)写出用乙醇制备乙烯反应的化学方程式: ,实验中,混合浓硫酸与乙醇的方法是将 慢慢加入另一种物质中;加热F装置时必须使液体温度为 。
(2)为实现上述实验目的,装置的连接顺序为F→ →B →E → →D (各装置限用一次),A装置的作用是 。
(3)当C中观察到 时,表明单质溴能与乙烯反应;若D中 ,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是 反应。
17.(本题10分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出实验过程中总的化学方程式 ;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应。(填“吸热”或“放热”).
(2)甲是热水浴,乙是冷水浴,但两个水浴作用不相同,①甲的作用是 ;②乙的作用是 。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有 。要除去该物质,可先在混合液中加入 (填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
18.(本题10分)乙醇(CH3CH2OH)既是生活中常见的有机物,又是重要的化工原料。
(1)工业上可用乙烯制备乙醇的化学方程式为:CH2 = CH2+H2OCH3CH2OH,该反应属于 反应(填“加成”或“取代”)。
(2)官能团决定有机物的性质。乙醇中含有的官能团名称是 。
(3)为探究乙醇的性质,某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,说明乙醇具有 性。
(4)萃取是物质分离的一种方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行: (填“是”或“否”),判断的理由是 。
(5)某液态有机物不溶于水,将它和水分离开来的方法是 。
参考答案:
1.B
【详解】A. 氢氟酸用作玻璃蚀刻剂,不是因为具有弱酸性,是因为生成挥发性的硅化物,故A错误;B. 干冰气化时吸热,使得周围环境温度降低,可用作制冷剂,故B正确;C. 钠也能与乙醇反应,故C错误;D. 硅酸钠用作木材防火剂,与易溶于水无关,故D错误;故选B。
2.C
【详解】A.制备食品包装材料的原料是聚乙烯,氯乙烯有毒,长期接触引发癌症,A错误;
B.煤干馏得到的煤焦油可以分离出苯,但苯是有特殊气味的液态烃,B错误;
C.丙三醇俗称甘油,具有吸湿性,对皮肤友好,可用作冬天干燥天气的护肤品,C正确;
D.三氯甲烷为无色透明液体,有特殊气味,易挥发,遇光照会与空气中的氧作用,逐渐分解而生成剧毒的光气(碳酰氯)和氯化氢,D错误;
故选C。
3.C
【详解】苯和四氯化碳均不溶于水,其中苯的密度比水小,四氯化碳的密度比水大;
A.乙醇、乙酸与水均不反应不分层,现象相同,不能区分,故A错误;
B.加入NaOH溶液,乙酸与NaOH发生中和反应,乙醇与NaOH溶液混溶,均无明显现象,不能鉴别乙酸、乙醇,故B错误;
C.乙酸与碳酸钠溶液反应生成气体,乙醇与碳酸钠溶液混溶,苯不溶于水,密度比水小,在溶液上层,四氯化碳不溶于水,密度比水大,在溶液下层,可鉴别,故C正确;
D.加入稀硫酸,不能鉴别乙酸、乙醇,故D错误;
答案选C。
4.D
【详解】A.挥发的乙醇及反应产生的乙烯都可以被酸性KMnO4溶液氧化而使溶液褪色,因此不能根据溶液褪色确定产生的气体中一定含有乙烯,故A错误;
B.向苯酚浊液中滴加碳酸钠溶液,浊液变澄清,是由于苯酚与碳酸钠反应产生可溶性苯酚钠和碳酸氢钠,可证明酸性:苯酚>HCO,故B错误;
C.检验1—溴丙烷水解后溶液中含有Br-应该在酸性溶液中加入硝酸银,实验中水解后溶液中没有加入硝酸至溶液显酸性,因此不能检验,故C错误;
D.蔗糖在稀硫酸作催化剂的条件下加热,发生水解反应,然后向水解后的溶液中加入NaOH溶液使溶液显碱性,再加入银氨溶液水浴加热,若出现银镜,就证明蔗糖水解产物具有还原性,能被银氨溶液氧化,故D正确;
选D。
5.C
【详解】A、乙醇是无色透明、有特殊香味的液体,故A正确;
B、乙醇能被高锰酸钾氧化,乙醇可以使酸性高锰酸钾溶液褪色,故B正确;
C、乙醇含有氧原子,不属于烃类物质,故C错误;
D、水能使无水硫酸铜变蓝,无水硫酸铜常用于检验乙醇中是否含有水,故D正确;
答案选C。
6.C
【详解】A项、洁厕灵的主要成分是盐酸,84消毒液的主要成分是次氯酸钠,两者混合使用,盐酸和次氯酸钠发生如下反应:Cl-+ClO-+2H+═Cl2↑+H2O,反应生成有毒的氯气容易使人中毒,故A正确;
B项、乙醇具有还原性,能与Cr2O72-反应生成Cr3+,依据Cr3+和Cr2O72-的颜色不同检验是否酒后驾车,故B正确;
C项、水泥冶金厂的烟尘在空气中形成胶体,因为胶粒带电荷,用高压电对气溶胶作用以除去大量烟尘,其原理是电泳,故C错误;
D项、PM2.5在大气中的停留时间长、输送距离远,会导致城市人为能见度下降,产生雾霾天气,故D正确。
故选C。
【点睛】本题考查化学与生活,侧重分析与应用能力的考查,把握物质的性质、性质与用途的关系为解答的关键。
7.A
【详解】A.淀粉水解液显酸性,应该加碱中和后再加银氨溶液,若不加碱,则不会有银白色银产生,故A符合题意;
B.将装有CuCl22H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸,试纸变为红色,说明产生了酸性气体,是因为氯化铜水解放出的氯化氢显酸性,故B不符合题意;
C.酸性高锰酸钾可以氧化乙醇,使其本身褪色,故C不符合题意;
D.溴水氧化KI生成I2,I2遇到淀粉变蓝,故D不符合题意;
故选A。
8.C
【详解】A.C2H5Br发生消去反应生成乙烯和溴化氢,乙烯和溴化氢均能使酸性高锰酸钾溶液褪色,为防止溴化氢对乙烯的干扰,试剂X可除去溴化氢,因此可达到实验目的,A项正确;
B.乙醇发生消去反应生成乙烯,反应过程中浓硫酸可能会与有机物反应生成SO2,生成的SO2会和溴反应,将干扰实验结果,所以用X溶液吸收可能产生的SO2,用Y溶液检验乙烯,表格中所列试剂能实现实验目的,B项正确;
C.苯与液溴发生取代反应生成HBr,同时溴挥发会干扰HBr检验,应用四氯化碳除去HBr中的溴蒸气,若用NaOH会同时吸收HBr,C项错误;
D.电石和食盐水反应生成乙炔,同时还生成杂质气体硫化氢等,硫化氢能和硫酸铜反应生成CuS沉淀,且硫化氢、乙炔都能被酸性高锰酸钾溶液氧化,X能除去硫化氢气体,防止乙炔的检验,Y能检验乙炔,能实现实验目的,D项正确;
故选:C。
9.B
【详解】A项、三溴苯酚不溶于水,苯酚稀溶液中逐滴加入饱和溴水,苯酚稀溶液和饱和溴水发生取代反应生成三溴苯酚白色沉淀,故A正确;
B项、将乙醇滴入酸性K2Cr2O7溶液中,乙醇与酸性K2Cr2O7溶液发生氧化还原反应生成氯化钾、氯化铬、乙酸和水,溶液由橙色变为绿色,故B错误;
C项、将烧黑的铜丝趁热插入乙醇中,氧化铜与乙醇加热条件下发生氧化还原反应生成铜、乙醛和水,铜丝黑色变亮红,故C正确;
D项、将饱和食盐水滴在电石上,电石与水立即反应生成氢氧化钙和乙炔气体,故D正确;
故选B。
【点睛】本题考查化学实验现象分析,注意把握常见有机物的性质,明确反应的类型和生成物的性质是解答关键。
10.C
【详解】A.由乙醇分子的结构可知,一个乙醇分子是由两个碳原子、六个氢原子和一个氧原子构成的,A错误;
B.一个乙醇分子中含有9个原子,B错误;
C.乙醇中碳、氧元素的质量比=24:16=3:2,C正确;
D.根据选项C可判断乙醇中碳元素的质量分数最大,D错误。
答案选C。
11.正确
【详解】加热变黑生成CuO,再与乙醇发生氧化反应,重复几次,完成乙醇氧化为乙醛的实验,实验合理,故正确。
12.错误
【解析】略
13.错误
【详解】主要是利用薯类、谷物类、糖类作为原料经过蒸煮、糖化、发酵等处理而得的食用酒精,可以饮用。
14.错误
【详解】乙醇与水均会与钠反应生成H2,但Na与水反应更剧烈,故水分子中氢的活性强于乙醇分子中氢的活性,需要注意的是乙醇分子中只有一OH中的H能与Na反应,乙醇分子中氢的活性不完全相同,故B错误;
15.正确
【详解】乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得,正确。
16. C2H5OHCH2=CH2↑+H2O 浓硫酸 迅速升高到170℃ A C 除去乙烯中SO2、CO2气体杂质 溶液褪色 有浅黄色沉淀生成 加成
【详解】分析:(1)乙醇在浓硫酸作用下加热到170℃发生消去反应生成乙烯和水;类比浓硫酸的稀释方法解答,即应该将浓硫酸加入乙醇中;温度在140℃时会发生副反应生成乙醚;(2)根据实验目的及题干信息,应该先用氢氧化钠溶液除去SO2、CO2,再用澄清石灰水检验杂质是否除尽,然后用浓硫酸干燥乙烯,再用溴的四氯化碳溶液检验乙烯的性质,用D检验是否有溴化氢生成从而判断乙烯与溴的反应类型;(3)当装置C中溴的四氯化碳褪色可以证明溴与乙烯发生了反应;根据D中是否出现浅黄色沉淀判断乙烯与溴发生的是取代反应还是加成反应。
详解:(1)乙醇在170℃时发生消去生成乙烯,温度必须是170℃,反应方程式为:C2H5OHCH2=CH2↑+H2O;浓硫酸密度大于乙醇,且混合过程中放热大量热,所以应该将浓硫酸加入乙醇中,边加边搅拌;温度在140℃时会发生副反应生成乙醚,为了避免副反应发生,所以必须将混合液温度迅速升高到反应温度;故答案为C2H5OHCH2=CH2↑+H2O;将浓硫酸加入乙醇中;迅速升高到170℃ ;
(2)浓硫酸具有脱水性和强氧化性,浓硫酸使乙醇脱水,然后浓硫酸氧化碳生成二氧化碳,同时生成二氧化硫气体,为得到纯净的乙烯,应用NaOH溶液(A装置)除去杂质气体SO2、CO2,(并用石灰水检验是否除尽),然后用浓硫酸干燥;乙烯与单质溴之间可能发生加成反应,也可能发生取代反应,若是取代反应,则会有HBr生成,HBr与AgNO3溶液反应会产生浅黄色沉淀,所以装置连接顺序为:F→A→B→E→C→D,正确答案为:A、C;除去乙烯中SO2、CO2气体杂质;
(3)当C中观察到溴水褪色时,表明单质溴能与乙烯反应;若D中硝酸银溶液中出现浅黄色沉淀时,表明C中生成了溴化银沉淀,发生的是取代反应;若D没有出现浅黄色沉淀现象时,表明溴化氢生成,C中发生的是加成反应,正确答案为:溶液褪色;有浅黄色沉淀生成;加成。
17. 2CH3CH2OH + O22CH3CHO + 2H2O 放热 提供乙醇蒸气 冷却产生的乙醛等气体 乙醛、乙醇、水 乙酸 C
【分析】(1)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;熄灭酒精灯,反应仍能继续进行,说明反应放热;
(2)甲为热水浴,乙为冷水浴,结合实验的原理分析解答;
(3)根据物质的沸点高低不同来确定获得的物质;
(4)能使紫色石蕊试纸变红,说明该物质显酸性,结合乙酸的性质和选项是否反应分析判断。
【详解】(1)铜与氧气反应生成黑色的氧化铜,氧化铜与乙醇发生氧化反应生成铜和乙醛、水,反应的方程式:2Cu+O22CuO,CH3CH2OH+CuOCH3CHO+Cu+H2O,反应的总反应方程式为2CH3CH2OH + O22CH3CHO + 2H2O;熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化反应是放热反应,放出的热量足以维持反应进行,故答案为2CH3CH2OH + O22CH3CHO + 2H2O;放热;
(2)甲和乙两个水浴作用不相同,甲是热水浴,作用是乙醇平稳气化成乙醇蒸气,乙是冷水浴,目的是将乙醛冷却下来,故答案为提供乙醇蒸气;冷却产生的乙醛等气体;
(3)乙醇的催化氧化实验中的物质:乙醇、乙醛和水的沸点高低不同,在试管a中能收集这些不同的物质,故答案为乙醛、乙醇、水;
(4)若试管a中收集到的液体用蓝色石蕊试纸检验,试纸显红色,说明溶液呈酸性,则溶液中含有乙酸;乙酸具有酸的通性,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,然后再通过蒸馏即可分离除去乙酸,故答案为乙酸;C。
18. 加成 羟基 还原性 否 乙醇和水任意比互溶,不能做萃取剂 分液
【详解】(1)工业上可用乙烯和水加成制备乙醇,化学方程式为:CH2 = CH2+H2OCH3CH2OH,该反应属于加成反应。故答案为:加成;
(2)乙醇中含有的官能团是-OH,名称是羟基。故答案为:羟基;
(3)某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,氧化铜被还原成铜,说明乙醇具有还原性性。故答案为:还原性;
(4)萃取利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行:否(填“是”或“否”),判断的理由是乙醇和水任意比互溶,不能做萃取剂。故答案为:否;乙醇和水任意比互溶,不能做萃取剂;
(5)分离互不相溶(或微溶)的两种液体混合物用分液,某液态有机物不溶于水,将它和水分离开来的方法是分液。故答案为:分液。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
