乙酸-高考化学考前专项练习试题(含答案)
文档属性
| 名称 | 乙酸-高考化学考前专项练习试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 869.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-10 18:54:36 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
乙酸
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列有关乙酸性质的叙述错误的是
A.乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇
B.乙酸的沸点比乙醇高
C.乙酸的酸性比碳酸强,它是一元酸,能与碳酸盐反应
D.在发生酯化反应时,乙酸分子羧基中的氢原子跟醇分子中的羟基结合成水
2.(本题5分)下列说法正确的是
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口倒出有机层
B.欲除去H2S气体中混有的HCl,可将混合气体通入饱和Na2S溶液
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.用pH试纸分别测量等物质的量浓度的NaCN和NaClO溶液的pH,可比较HCN和HClO的酸性强弱
3.(本题5分)阿司匹林是一种解热镇痛药物,其结构如图所示,下列有关阿司匹林的说法正确的是
A.分子中含有三种官能团
B.长期服用阿司匹林可预防某些疾病,没有副作用
C.一定条件下,分子能与乙醇发生取代反应
D.阿司匹林和蛋白质分别在空气中完全燃烧,产物相同
4.(本题5分)利用如图所示装置进行实验,b中现象不能证明a中产物生成的是
a中反应 b中检测试剂及现象 装置
A CH3COOH与CH3CH2OH生成乙酸乙酯 饱和碳酸钠溶液上方出现油状液体
B Cu与浓H2SO4生成SO2 品红溶液褪色
C 铁单质与水蒸气生成氢气 肥皂水-导管口冒气泡
D 石蜡分解生成不饱和烃 溴的四氯化碳溶液褪色
A.A B.B C.C D.D
5.(本题5分)下列实验装置或实验操作正确,且能完成相应实验的是
A.按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯
B.利用图乙所示装置收集NO气体
C.将通入图丙所示装置中进行尾气吸收
D.利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
6.(本题5分)下列化学方程式书写不正确的是
A.乙酸乙酯的制备:CH3COOH + CH3CH218OHCH3COOCH2CH3 + H218O
B.溴乙烷与氢氧化钠溶液共热:CH3CH2Br + NaOHCH3CH2OH + NaBr
C.实验室用液溴和苯在催化剂作用下制溴苯:+Br2 +HBr
D.苯的硝化反应:+HNO3+H2O
7.(本题5分)如图进行乙酸乙酯的制备实验,过程中发现收集装置中溶液的红色逐渐褪去,振荡后有少量气体生成,此过程中一定存在且书写正确的化学方程式是
A.CH3COOH+C2H518OHCH3COOC2H5+H218O
B.+2H2OH2CO3+2OH-
C.Na2CO3+H2SO4→Na2SO4+H2O+CO2↑
D.Na2CO3+CH3COOH→CH3COONa+NaHCO3
8.(本题5分)下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.甲酸溶液与滴入少量的新制氢氧化铜后共热:HCOOH+2Cu(OH)2Cu2O+CO2↑+3H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-CO32-+2NH4++4Ag↓+6NH3+2H2O
9.(本题5分)根据乙醇的性质,可推测丙醇()的性质。下列说法错误的是
A.丙醇可与乙酸发生取代反应
B.丙醇与金属钠反应比水与金属钠反应剧烈
C.丙醇能使酸性高锰酸钾溶液褪色
D.丙醇能发生氧化反应
10.(本题5分)已知有转化关系:,则反应①、②、③的反应类型分别为
A.取代反应、加成反应、取代反应 B.取代反应、取代反应、加成反应
C.氧化反应、加成反应、加成反应 D.加成反应、氧化反应、氧化反应
二、判断题(共20分)
11.(本题4分)乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应。(_______)
12.(本题4分)向混合液中加入生石灰后蒸馏,以除去乙酸中混有的乙醇。(_____)
13.(本题4分)乙酸乙酯中混有乙酸,加入氢氧化钠溶液,再加热蒸馏。(______)
14.(本题4分)乙酸与乙醇的反应是中和反应。(_______)
15.(本题4分)用碳酸钠溶液可鉴别乙醇、乙酸和乙酸乙酯。(_______)
三、解答题(共30分)
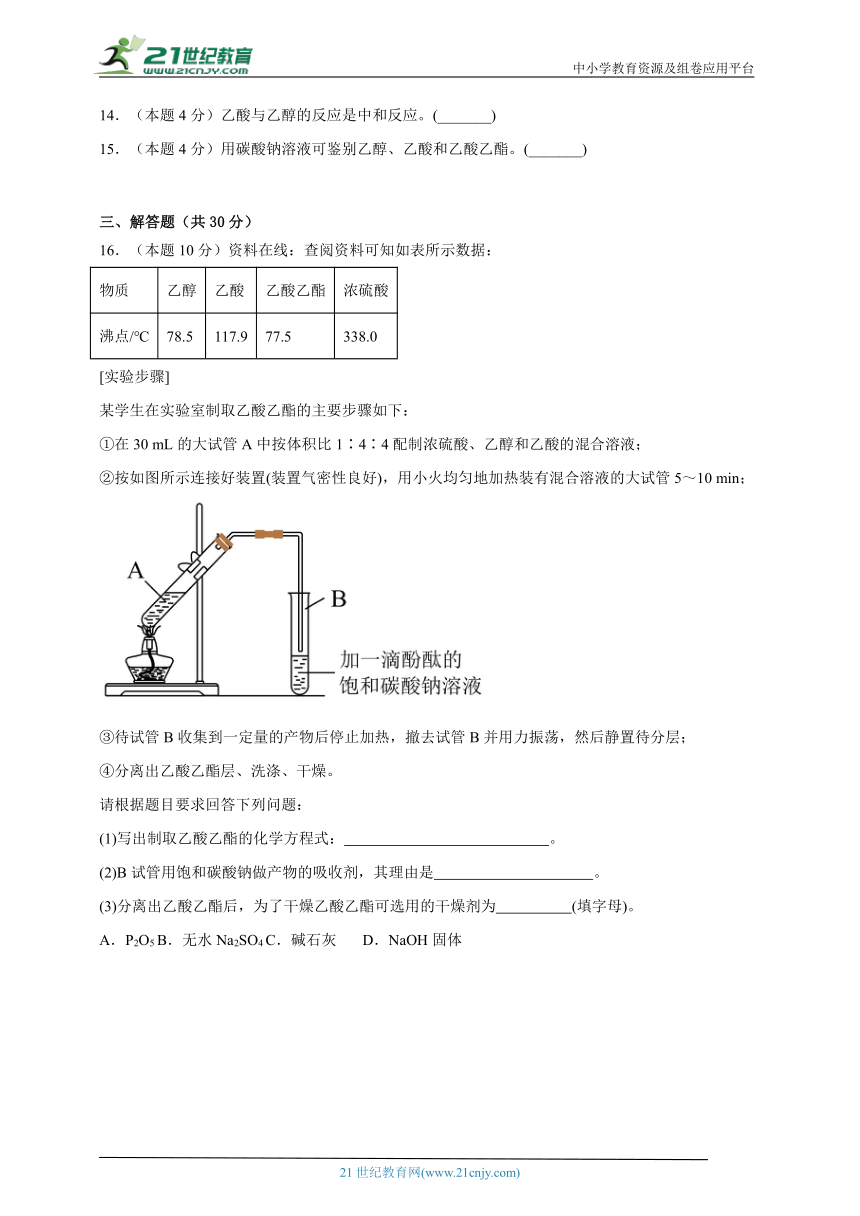
16.(本题10分)资料在线:查阅资料可知如表所示数据:
物质 乙醇 乙酸 乙酸乙酯 浓硫酸
沸点/℃ 78.5 117.9 77.5 338.0
[实验步骤]
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液;
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式: 。
(2)B试管用饱和碳酸钠做产物的吸收剂,其理由是 。
(3)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为 (填字母)。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
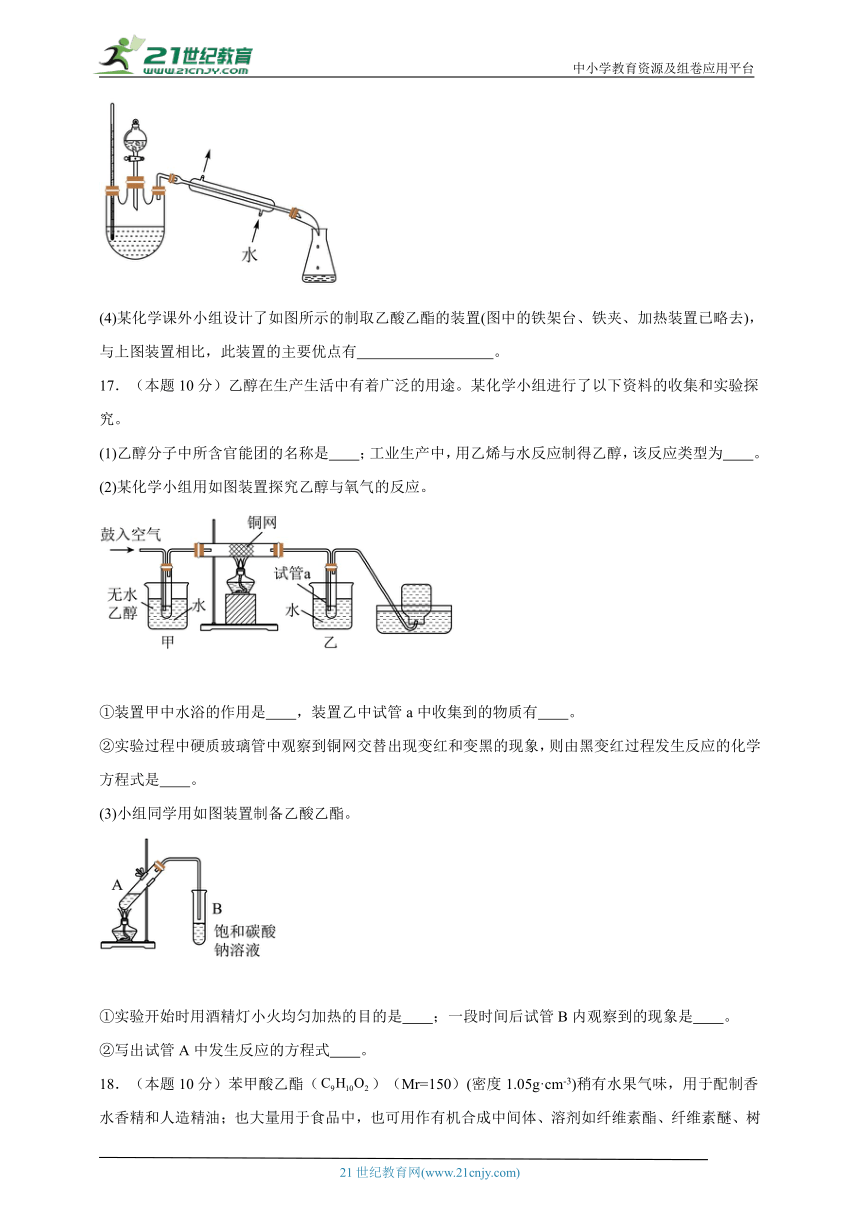
(4)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有 。
17.(本题10分)乙醇在生产生活中有着广泛的用途。某化学小组进行了以下资料的收集和实验探究。
(1)乙醇分子中所含官能团的名称是 ;工业生产中,用乙烯与水反应制得乙醇,该反应类型为 。
(2)某化学小组用如图装置探究乙醇与氧气的反应。
①装置甲中水浴的作用是 ,装置乙中试管a中收集到的物质有 。
②实验过程中硬质玻璃管中观察到铜网交替出现变红和变黑的现象,则由黑变红过程发生反应的化学方程式是 。
(3)小组同学用如图装置制备乙酸乙酯。
①实验开始时用酒精灯小火均匀加热的目的是 ;一段时间后试管B内观察到的现象是 。
②写出试管A中发生反应的方程式 。
18.(本题10分)苯甲酸乙酯()(Mr=150)(密度1.05g·cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。可能用到的数据:
沸点(°C,1atm)
苯甲酸 苯甲酸乙酯 石油醚 水 乙醇 环己烷 共沸物(环己烷-水-乙醇)
249 212.6 40-80 100 78.3 80.75 62.6
其制备原理如下 : +C2H5OH +H2O
制备过程:
Ⅰ、制备粗产品:如右图所示的装置中,于50mL圆底烧瓶中加入8.0g苯甲酸(固体)(Mr=122)、20mL乙醇(Mr=46)、15mL环己烷、3mL浓硫酸,摇匀,加沸石。在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。
Ⅱ、粗产品的纯化:加水30mL,分批加入固体NaHCO3。分液,水层用20mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210-213℃馏分。
(1)仪器d的名称 ,水流方向为 进 出。
(2)该反应水浴控制的温度为 。
(3)该反应加过量乙醇的目的为 。
(4)分水器的作用 ,分水器的检漏方法 。如何利用实验现象判断反应已基本完成 。
(5)固体碳酸氢钠的作用 ,加至 为止。
(6)经精馏得210-213℃馏分7.0mL,则该反应的产率为 。
参考答案:
1.D
【详解】乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇,沸点高于乙醇,含有一个羧基属于一元酸,酸性强于碳酸,能和碳酸盐反应,发生酯化反应时乙酸分子脱羟基,故选D。
2.A
【详解】A.苯的密度比水小,萃取后有机层位于上层,水层位于下层,因此分液时先从分液漏斗下口放出水层,再从上口倒出有机层,故A正确;
B.H2S与Na2S溶液能够发生反应生成NaHS,因此不能用饱和Na2S溶液除去H2S气体中混有的HCl,故B错误;
C.乙酸乙酯制备实验中,导管需离液面一小段距离,防止倒吸,故C错误;
D.NaClO具有漂白性,不能用pH试纸测定溶液的pH,故D错误;
故答案为:A。
【点睛】测定溶液pH时需注意:①用pH试纸测定溶液pH时,试纸不能湿润,否则可能存在实验误差;②不能用pH试纸测定具有漂白性溶液的pH,常见具有漂白性的溶液有:新制氯水、NaClO溶液、H2O2溶液等。
3.C
【详解】A.阿司匹林的官能团有酯基和羧基两种,A错误;
B.长期服用阿司匹林对人体有一定的副作用,最常见的是由于其对胃肠黏膜的刺激引起的消化道出血,B错误;
C.阿司匹林分子中含有羧基,能与乙醇发生酯化反应,属于取代反应,C正确;
D.阿司匹林分子中不含N元素,蛋白质中含有N元素,因此燃烧产物不同,D错误;
故选C。
4.C
【详解】A.该反应b中导管在液面以上起到防倒吸作用,挥发出的乙醇、乙酸会被碳酸钠溶液吸收,酯类物质难溶于水,故饱和碳酸钠溶液上方出现油状液体可以说明CH3COOH与CH3CH2OH反应生成乙酸乙酯,不符合题意,A项错误;
B.Cu与浓H2SO4反应,有漂白性的物质是SO2,故品红溶液褪色可以说明Cu与浓H2SO4生成SO2,不符合题意,B项错误;
C.铁单质与水蒸气反应需要高温条件,加热装置应选择酒精喷灯,且导管口冒气泡不能说明生成氢气,空气受热膨胀导管口也会冒气泡,符合题意,C项正确;
D.石蜡分油解实验中,将分解生成的气体通入溴的四氯化碳溶液中,溶液褪色说明分解产物中有不饱和烃生成,不符合题意,D项错误;
答案选C。
5.A
【详解】A.浓硫酸的混合应该为酸入水防止稀释过程中液体飞溅,所以应该在试管中先加乙醇,再慢慢加入浓硫酸,最后加冰醋酸,A项正确;
B.NO与空气接触时会被氧化成,利用图乙所示装置收集不到纯净的NO,B项错误;
C.将通入图丙所示装置中进行尾气吸收时,与水直接接触,易产生倒吸现象,C项错误;
D.大试管温度更高,为了排除温度差异导致的Na2CO3不分解,所有将Na2CO3置于温度更高的大试管中,而碳酸氢钠应置于小试管中,D项错误;
故选A。
6.A
【详解】A. 酯化反应中“酸脱羟基,醇脱氢”,正确的方程式为:CH3COOH + CH3CH218OHCH3CO18OCH2CH3 + H2O,故A错误;
B. 卤代烃在碱性水溶液加热条件下发生取代反应,由溴乙烷变成乙醇,生成乙醇与溴化钠方程式为:CH3CH2Br + NaOHCH3CH2OH + NaBr,故B正确;
C. 实验室用液溴和苯在催化剂作用下反生取代反应,生成溴苯和溴化氢,方程式为:+Br2+HBr,故C正确;
D. 苯和硝酸在浓硫酸的催化下发生取代反应,生成硝基苯和水,方程式为:+HNO3+H2O,故D正确;
故选A。
7.D
【详解】A.根据羧酸脱羟基,醇脱羟基上的氢,因此,故A错误;
B.碳酸根水解是+H2O +OH-,故B错误;
C.Na2CO3+H2SO4 = Na2SO4+H2O+CO2↑,故C正确;
D.振荡后有少量气体生成,说明Na2CO3+2CH3COOH = 2CH3COONa+ H2O+CO2↑,故D错误。
综上所述,答案为C。
8.D
【详解】A.乙酸与碳酸钠溶液反应的离子反应为2CH3COOH+CO32-═CO2↑+H2O+2CH3COO-,故A错误;
B.甲酸溶液与滴入少量的新制氢氧化铜后共热的离子反应为2HCOOH+Cu(OH)2Cu2++2HCOO-+2H2O,故B错误;
C.苯酚钠溶液中通入少量二氧化碳的离子反应为C6H5O-+CO2+H2OC6H5OH+HCO3-,故C错误;
D.甲醛溶液与足量的银氨溶液共热的离子反应为HCHO+4[Ag(NH3)2]++4OH-CO32-+2NH4++4Ag↓+6NH3+2H2O,故D正确;
故答案为D。
9.B
【分析】乙醇和丙醇是同系物,结构相似,则化学性质相似。
【详解】A.乙醇可与乙酸发生酯化反应即取代反应,则丙醇也可与乙酸发生取代反应,故A正确;
B.乙醇和金属钠反应比水与金属钠反应缓慢,则丙醇与金属钠反应也比水与金属钠反应缓慢,故B错误;
C.乙醇能使酸性高锰酸钾溶液褪色,则丙醇也能使酸性高锰酸钾溶液褪色,故C正确;
D.乙醇能发生催化氧化、被酸性高锰酸钾溶液氧化,丙醇也能发生类似的氧化反应,故D正确;
故选B。
10.D
【详解】乙烯和水发生加成反应生成乙醇,乙醇发生催化氧化反应生成乙醛,乙醛发生氧化反应生成乙酸,则反应①、②、③的反应类型分别为加成反应、氧化反应、氧化反应,故选D。
11.错误
【详解】油脂在碱性条件下水解为皂化反应,属于不可逆反应,错误。
12.错误
【详解】乙酸会与氧化钙反应生成成乙酸钙,故错误。
13.错误
【详解】乙酸乙酯中混有乙酸,不能用氢氧化钠溶液除乙酸,因为乙酸乙酯也会与氢氧化钠溶液反应,应用饱和碳酸钠溶液,再分液即可,故错误。
14.错误
【详解】乙醇属于非电解质,不属于碱,乙酸与乙醇发生CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O,该反应属于酯化反应或取代反应,不属于中和反应,故错误;
答案为错误。
15.正确
【详解】碳酸钠溶液遇乙醇互溶,遇乙酸产生气泡,遇乙酸乙酯分层,可以鉴别,正确;
16. CH3COOH+C2H5OHCH3COOC2H5+H2O 中和乙酸,吸收乙醇,且因为乙酸乙酯在饱和碳酸钠溶液中的溶解度小,有利于分层析出 B ①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的产生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯
【分析】根据乙酸乙酯的制备原理、结合物质的性质差异和装置图分析解答。
【详解】(1)乙酸与乙醇反应生成乙酸乙酯和水,化学反应方程式:CH3COOH+C2H5OHCH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OHCH3COOC2H5+H2O;
(2)饱和碳酸钠可以中和挥发的乙酸,吸收乙醇,且因为乙酸乙酯在饱和碳酸钠溶液中的溶解度小,有利于分层析出,故答案为:中和乙酸,吸收乙醇,且因为乙酸乙酯在饱和碳酸钠溶液中的溶解度小,有利于分层析出;
(3)乙酸乙酯粗产品的提纯方法步骤为:①向粗产品中加入碳酸钠粉末(目的是除去粗产品中的乙酸);②向其中加入饱和食盐水与饱和氯化钙溶液,振荡、静置、分液(目的是除去粗产品中的乙醇);③向其中加入无水硫酸钠(目的是除去粗产品中的水);④最后将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集温度在76~78℃之间的馏分即得纯的乙酸乙酯,酸性或碱性干燥剂容易使乙酸乙酯水解,所以干燥乙酸乙酯可选用的干燥剂为无水Na2SO4,选B,故答案为:B。
(4)对比两个实验装置图,结合乙酸乙酯制备过程中的各种条件控制,可以看出后者的三个突出的优点:①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的产生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了水冷凝装置,有利于收集产物乙酸乙酯,故答案为:①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的产生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯。
17.(1) 羟基 加成反应
(2) 加热无水乙醇,使无水乙醇气化 乙醛、乙醇、水 CH3CH2OH+CuOCH3CHO+H2O
(3) 加快反应速率,同时防止反应物挥发降低产率 饱和碳酸钠溶液上方有无色透明油状液体 CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
【分析】探究乙醇与氧气反应的装置中,为了能使乙醇蒸气和氧化铜反应,所以把无水乙醇放到热水中加热,同时鼓入空气,加速乙醇挥发,给铜丝带来氧气,使反应能持续进行下去,生成的乙醛,乙醇蒸气,水蒸气经冷水冷凝被液化,剩余的空气主要是氮气用排水法收集,据此分析解答。
【详解】(1)乙醇分子的结构简式为CH3CH2OH,其所含官能团的名称是羟基,乙烯与水反应制取乙醇,反应类型是加成反应。
(2)①乙醇在常温下是液体,参加反应的是乙醇蒸气,故装置甲中水浴的作用是加热乙醇,由于是连续反应,从硬质玻璃管出来的气体有生成的乙醛,剩余的乙醇和反应生成的水蒸气,故装置乙中的水起冷凝作用,则试管a中收集到的物质有乙醛、乙醇、水。
②加热条件下,铜和氧气反应生成黑色的氧化铜,氧化铜又被乙醇还原成红色的铜,因此实验过程中铜网出现黑色和红色交替的现象,则由黑变红过程发生反应的化学方程式是CH3CH2OH+CuOCH3CHO+H2O。
(3)①乙酸、乙醇具有挥发性,挥发会降低产率,但为了加快反应速率,所以只能小火均匀加热,故答案是加快反应速率,同时防止反应物挥发降低产率;反应一段时间后,由于生成的乙酸乙酯难容于饱和的碳酸钠溶液 ,会在碳酸钠溶液液面上析出,故现象是饱和碳酸钠溶液上方有无色透明油状液体。
②试管A中是乙酸和乙醇发生酯化反应生成乙酸乙酯,则其发生反应的化学方程式为CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O。
18.(1) 球形冷凝管 a b
(2)略高于62.6℃
(3)乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇
(4) 分离产生的水,使平衡向正反应方向移动,提高转化率 关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水 加热回流至分水器中水位不再上升为止
(5) 中和硫酸和未反应的苯甲酸 不再有气泡产生或pH=7
(6)74.7%
【分析】圆底烧瓶中加入苯甲酸、乙醇、环己烷、浓硫酸,摇匀,加沸石,在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应生成苯甲酸乙酯粗品;反应后混合液加入碳酸氢钠除去硫酸和未反应的苯甲酸,使用石油醚萃取分液,有机层用无水硫酸镁干燥后回收石油醚,加热精馏,收集210-213℃馏分得到苯甲酸乙酯。
【详解】(1)仪器d的名称为球形冷凝管,为防止高温气体急剧冷却而炸裂冷凝管,则离蒸气温度高的是出水口,离蒸气温度低的是进水口,所以水流方向为a进b出;
(2)已知,乙醇沸点78.3℃、共沸物(环己烷-水-乙醇) 沸点62.6℃;反应基本完成时继续蒸出多余的环己烷和乙醇,则水浴温度应该略高于62.6℃;
(3)增大某一廉价反应物的浓度能提高另一反应物的转化率,且恒沸物也需要乙醇,所以加过量乙醇,故答案为乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇;
(4)分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率;分水器的检漏方法为:关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水;当该反应完成后,就不再生成水,则判断反应已基本完成的现象为:加热回流至分水器中水位不再上升;
(5)碳酸氢钠具有碱性,能和硫酸和苯甲酸反应生成盐,所以加入碳酸氢钠的目的是中和硫酸和未反应的苯甲酸,当反应器中不再有气泡产生或溶液呈中性时,则酸被完全中和,故答案为中和硫酸和未反应的苯甲酸;不再有气泡产生或pH=7;
(6)8.0g苯甲酸(固体)和乙醇反应生成苯甲酸乙酯的质量:×150g/mol=9.84g,实际上苯甲酸乙酯的质量:1.05g·cm-3×7.0mL=7.35g,则该反应的产率为×100%=74.7%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
乙酸
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)下列有关乙酸性质的叙述错误的是
A.乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇
B.乙酸的沸点比乙醇高
C.乙酸的酸性比碳酸强,它是一元酸,能与碳酸盐反应
D.在发生酯化反应时,乙酸分子羧基中的氢原子跟醇分子中的羟基结合成水
2.(本题5分)下列说法正确的是
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口倒出有机层
B.欲除去H2S气体中混有的HCl,可将混合气体通入饱和Na2S溶液
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.用pH试纸分别测量等物质的量浓度的NaCN和NaClO溶液的pH,可比较HCN和HClO的酸性强弱
3.(本题5分)阿司匹林是一种解热镇痛药物,其结构如图所示,下列有关阿司匹林的说法正确的是
A.分子中含有三种官能团
B.长期服用阿司匹林可预防某些疾病,没有副作用
C.一定条件下,分子能与乙醇发生取代反应
D.阿司匹林和蛋白质分别在空气中完全燃烧,产物相同
4.(本题5分)利用如图所示装置进行实验,b中现象不能证明a中产物生成的是
a中反应 b中检测试剂及现象 装置
A CH3COOH与CH3CH2OH生成乙酸乙酯 饱和碳酸钠溶液上方出现油状液体
B Cu与浓H2SO4生成SO2 品红溶液褪色
C 铁单质与水蒸气生成氢气 肥皂水-导管口冒气泡
D 石蜡分解生成不饱和烃 溴的四氯化碳溶液褪色
A.A B.B C.C D.D
5.(本题5分)下列实验装置或实验操作正确,且能完成相应实验的是
A.按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯
B.利用图乙所示装置收集NO气体
C.将通入图丙所示装置中进行尾气吸收
D.利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
6.(本题5分)下列化学方程式书写不正确的是
A.乙酸乙酯的制备:CH3COOH + CH3CH218OHCH3COOCH2CH3 + H218O
B.溴乙烷与氢氧化钠溶液共热:CH3CH2Br + NaOHCH3CH2OH + NaBr
C.实验室用液溴和苯在催化剂作用下制溴苯:+Br2 +HBr
D.苯的硝化反应:+HNO3+H2O
7.(本题5分)如图进行乙酸乙酯的制备实验,过程中发现收集装置中溶液的红色逐渐褪去,振荡后有少量气体生成,此过程中一定存在且书写正确的化学方程式是
A.CH3COOH+C2H518OHCH3COOC2H5+H218O
B.+2H2OH2CO3+2OH-
C.Na2CO3+H2SO4→Na2SO4+H2O+CO2↑
D.Na2CO3+CH3COOH→CH3COONa+NaHCO3
8.(本题5分)下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.甲酸溶液与滴入少量的新制氢氧化铜后共热:HCOOH+2Cu(OH)2Cu2O+CO2↑+3H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-CO32-+2NH4++4Ag↓+6NH3+2H2O
9.(本题5分)根据乙醇的性质,可推测丙醇()的性质。下列说法错误的是
A.丙醇可与乙酸发生取代反应
B.丙醇与金属钠反应比水与金属钠反应剧烈
C.丙醇能使酸性高锰酸钾溶液褪色
D.丙醇能发生氧化反应
10.(本题5分)已知有转化关系:,则反应①、②、③的反应类型分别为
A.取代反应、加成反应、取代反应 B.取代反应、取代反应、加成反应
C.氧化反应、加成反应、加成反应 D.加成反应、氧化反应、氧化反应
二、判断题(共20分)
11.(本题4分)乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应。(_______)
12.(本题4分)向混合液中加入生石灰后蒸馏,以除去乙酸中混有的乙醇。(_____)
13.(本题4分)乙酸乙酯中混有乙酸,加入氢氧化钠溶液,再加热蒸馏。(______)
14.(本题4分)乙酸与乙醇的反应是中和反应。(_______)
15.(本题4分)用碳酸钠溶液可鉴别乙醇、乙酸和乙酸乙酯。(_______)
三、解答题(共30分)
16.(本题10分)资料在线:查阅资料可知如表所示数据:
物质 乙醇 乙酸 乙酸乙酯 浓硫酸
沸点/℃ 78.5 117.9 77.5 338.0
[实验步骤]
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液;
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式: 。
(2)B试管用饱和碳酸钠做产物的吸收剂,其理由是 。
(3)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为 (填字母)。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有 。
17.(本题10分)乙醇在生产生活中有着广泛的用途。某化学小组进行了以下资料的收集和实验探究。
(1)乙醇分子中所含官能团的名称是 ;工业生产中,用乙烯与水反应制得乙醇,该反应类型为 。
(2)某化学小组用如图装置探究乙醇与氧气的反应。
①装置甲中水浴的作用是 ,装置乙中试管a中收集到的物质有 。
②实验过程中硬质玻璃管中观察到铜网交替出现变红和变黑的现象,则由黑变红过程发生反应的化学方程式是 。
(3)小组同学用如图装置制备乙酸乙酯。
①实验开始时用酒精灯小火均匀加热的目的是 ;一段时间后试管B内观察到的现象是 。
②写出试管A中发生反应的方程式 。
18.(本题10分)苯甲酸乙酯()(Mr=150)(密度1.05g·cm-3)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。可能用到的数据:
沸点(°C,1atm)
苯甲酸 苯甲酸乙酯 石油醚 水 乙醇 环己烷 共沸物(环己烷-水-乙醇)
249 212.6 40-80 100 78.3 80.75 62.6
其制备原理如下 : +C2H5OH +H2O
制备过程:
Ⅰ、制备粗产品:如右图所示的装置中,于50mL圆底烧瓶中加入8.0g苯甲酸(固体)(Mr=122)、20mL乙醇(Mr=46)、15mL环己烷、3mL浓硫酸,摇匀,加沸石。在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应基本完成。记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。
Ⅱ、粗产品的纯化:加水30mL,分批加入固体NaHCO3。分液,水层用20mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210-213℃馏分。
(1)仪器d的名称 ,水流方向为 进 出。
(2)该反应水浴控制的温度为 。
(3)该反应加过量乙醇的目的为 。
(4)分水器的作用 ,分水器的检漏方法 。如何利用实验现象判断反应已基本完成 。
(5)固体碳酸氢钠的作用 ,加至 为止。
(6)经精馏得210-213℃馏分7.0mL,则该反应的产率为 。
参考答案:
1.D
【详解】乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇,沸点高于乙醇,含有一个羧基属于一元酸,酸性强于碳酸,能和碳酸盐反应,发生酯化反应时乙酸分子脱羟基,故选D。
2.A
【详解】A.苯的密度比水小,萃取后有机层位于上层,水层位于下层,因此分液时先从分液漏斗下口放出水层,再从上口倒出有机层,故A正确;
B.H2S与Na2S溶液能够发生反应生成NaHS,因此不能用饱和Na2S溶液除去H2S气体中混有的HCl,故B错误;
C.乙酸乙酯制备实验中,导管需离液面一小段距离,防止倒吸,故C错误;
D.NaClO具有漂白性,不能用pH试纸测定溶液的pH,故D错误;
故答案为:A。
【点睛】测定溶液pH时需注意:①用pH试纸测定溶液pH时,试纸不能湿润,否则可能存在实验误差;②不能用pH试纸测定具有漂白性溶液的pH,常见具有漂白性的溶液有:新制氯水、NaClO溶液、H2O2溶液等。
3.C
【详解】A.阿司匹林的官能团有酯基和羧基两种,A错误;
B.长期服用阿司匹林对人体有一定的副作用,最常见的是由于其对胃肠黏膜的刺激引起的消化道出血,B错误;
C.阿司匹林分子中含有羧基,能与乙醇发生酯化反应,属于取代反应,C正确;
D.阿司匹林分子中不含N元素,蛋白质中含有N元素,因此燃烧产物不同,D错误;
故选C。
4.C
【详解】A.该反应b中导管在液面以上起到防倒吸作用,挥发出的乙醇、乙酸会被碳酸钠溶液吸收,酯类物质难溶于水,故饱和碳酸钠溶液上方出现油状液体可以说明CH3COOH与CH3CH2OH反应生成乙酸乙酯,不符合题意,A项错误;
B.Cu与浓H2SO4反应,有漂白性的物质是SO2,故品红溶液褪色可以说明Cu与浓H2SO4生成SO2,不符合题意,B项错误;
C.铁单质与水蒸气反应需要高温条件,加热装置应选择酒精喷灯,且导管口冒气泡不能说明生成氢气,空气受热膨胀导管口也会冒气泡,符合题意,C项正确;
D.石蜡分油解实验中,将分解生成的气体通入溴的四氯化碳溶液中,溶液褪色说明分解产物中有不饱和烃生成,不符合题意,D项错误;
答案选C。
5.A
【详解】A.浓硫酸的混合应该为酸入水防止稀释过程中液体飞溅,所以应该在试管中先加乙醇,再慢慢加入浓硫酸,最后加冰醋酸,A项正确;
B.NO与空气接触时会被氧化成,利用图乙所示装置收集不到纯净的NO,B项错误;
C.将通入图丙所示装置中进行尾气吸收时,与水直接接触,易产生倒吸现象,C项错误;
D.大试管温度更高,为了排除温度差异导致的Na2CO3不分解,所有将Na2CO3置于温度更高的大试管中,而碳酸氢钠应置于小试管中,D项错误;
故选A。
6.A
【详解】A. 酯化反应中“酸脱羟基,醇脱氢”,正确的方程式为:CH3COOH + CH3CH218OHCH3CO18OCH2CH3 + H2O,故A错误;
B. 卤代烃在碱性水溶液加热条件下发生取代反应,由溴乙烷变成乙醇,生成乙醇与溴化钠方程式为:CH3CH2Br + NaOHCH3CH2OH + NaBr,故B正确;
C. 实验室用液溴和苯在催化剂作用下反生取代反应,生成溴苯和溴化氢,方程式为:+Br2+HBr,故C正确;
D. 苯和硝酸在浓硫酸的催化下发生取代反应,生成硝基苯和水,方程式为:+HNO3+H2O,故D正确;
故选A。
7.D
【详解】A.根据羧酸脱羟基,醇脱羟基上的氢,因此,故A错误;
B.碳酸根水解是+H2O +OH-,故B错误;
C.Na2CO3+H2SO4 = Na2SO4+H2O+CO2↑,故C正确;
D.振荡后有少量气体生成,说明Na2CO3+2CH3COOH = 2CH3COONa+ H2O+CO2↑,故D错误。
综上所述,答案为C。
8.D
【详解】A.乙酸与碳酸钠溶液反应的离子反应为2CH3COOH+CO32-═CO2↑+H2O+2CH3COO-,故A错误;
B.甲酸溶液与滴入少量的新制氢氧化铜后共热的离子反应为2HCOOH+Cu(OH)2Cu2++2HCOO-+2H2O,故B错误;
C.苯酚钠溶液中通入少量二氧化碳的离子反应为C6H5O-+CO2+H2OC6H5OH+HCO3-,故C错误;
D.甲醛溶液与足量的银氨溶液共热的离子反应为HCHO+4[Ag(NH3)2]++4OH-CO32-+2NH4++4Ag↓+6NH3+2H2O,故D正确;
故答案为D。
9.B
【分析】乙醇和丙醇是同系物,结构相似,则化学性质相似。
【详解】A.乙醇可与乙酸发生酯化反应即取代反应,则丙醇也可与乙酸发生取代反应,故A正确;
B.乙醇和金属钠反应比水与金属钠反应缓慢,则丙醇与金属钠反应也比水与金属钠反应缓慢,故B错误;
C.乙醇能使酸性高锰酸钾溶液褪色,则丙醇也能使酸性高锰酸钾溶液褪色,故C正确;
D.乙醇能发生催化氧化、被酸性高锰酸钾溶液氧化,丙醇也能发生类似的氧化反应,故D正确;
故选B。
10.D
【详解】乙烯和水发生加成反应生成乙醇,乙醇发生催化氧化反应生成乙醛,乙醛发生氧化反应生成乙酸,则反应①、②、③的反应类型分别为加成反应、氧化反应、氧化反应,故选D。
11.错误
【详解】油脂在碱性条件下水解为皂化反应,属于不可逆反应,错误。
12.错误
【详解】乙酸会与氧化钙反应生成成乙酸钙,故错误。
13.错误
【详解】乙酸乙酯中混有乙酸,不能用氢氧化钠溶液除乙酸,因为乙酸乙酯也会与氢氧化钠溶液反应,应用饱和碳酸钠溶液,再分液即可,故错误。
14.错误
【详解】乙醇属于非电解质,不属于碱,乙酸与乙醇发生CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O,该反应属于酯化反应或取代反应,不属于中和反应,故错误;
答案为错误。
15.正确
【详解】碳酸钠溶液遇乙醇互溶,遇乙酸产生气泡,遇乙酸乙酯分层,可以鉴别,正确;
16. CH3COOH+C2H5OHCH3COOC2H5+H2O 中和乙酸,吸收乙醇,且因为乙酸乙酯在饱和碳酸钠溶液中的溶解度小,有利于分层析出 B ①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的产生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯
【分析】根据乙酸乙酯的制备原理、结合物质的性质差异和装置图分析解答。
【详解】(1)乙酸与乙醇反应生成乙酸乙酯和水,化学反应方程式:CH3COOH+C2H5OHCH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OHCH3COOC2H5+H2O;
(2)饱和碳酸钠可以中和挥发的乙酸,吸收乙醇,且因为乙酸乙酯在饱和碳酸钠溶液中的溶解度小,有利于分层析出,故答案为:中和乙酸,吸收乙醇,且因为乙酸乙酯在饱和碳酸钠溶液中的溶解度小,有利于分层析出;
(3)乙酸乙酯粗产品的提纯方法步骤为:①向粗产品中加入碳酸钠粉末(目的是除去粗产品中的乙酸);②向其中加入饱和食盐水与饱和氯化钙溶液,振荡、静置、分液(目的是除去粗产品中的乙醇);③向其中加入无水硫酸钠(目的是除去粗产品中的水);④最后将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集温度在76~78℃之间的馏分即得纯的乙酸乙酯,酸性或碱性干燥剂容易使乙酸乙酯水解,所以干燥乙酸乙酯可选用的干燥剂为无水Na2SO4,选B,故答案为:B。
(4)对比两个实验装置图,结合乙酸乙酯制备过程中的各种条件控制,可以看出后者的三个突出的优点:①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的产生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了水冷凝装置,有利于收集产物乙酸乙酯,故答案为:①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的产生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯。
17.(1) 羟基 加成反应
(2) 加热无水乙醇,使无水乙醇气化 乙醛、乙醇、水 CH3CH2OH+CuOCH3CHO+H2O
(3) 加快反应速率,同时防止反应物挥发降低产率 饱和碳酸钠溶液上方有无色透明油状液体 CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O
【分析】探究乙醇与氧气反应的装置中,为了能使乙醇蒸气和氧化铜反应,所以把无水乙醇放到热水中加热,同时鼓入空气,加速乙醇挥发,给铜丝带来氧气,使反应能持续进行下去,生成的乙醛,乙醇蒸气,水蒸气经冷水冷凝被液化,剩余的空气主要是氮气用排水法收集,据此分析解答。
【详解】(1)乙醇分子的结构简式为CH3CH2OH,其所含官能团的名称是羟基,乙烯与水反应制取乙醇,反应类型是加成反应。
(2)①乙醇在常温下是液体,参加反应的是乙醇蒸气,故装置甲中水浴的作用是加热乙醇,由于是连续反应,从硬质玻璃管出来的气体有生成的乙醛,剩余的乙醇和反应生成的水蒸气,故装置乙中的水起冷凝作用,则试管a中收集到的物质有乙醛、乙醇、水。
②加热条件下,铜和氧气反应生成黑色的氧化铜,氧化铜又被乙醇还原成红色的铜,因此实验过程中铜网出现黑色和红色交替的现象,则由黑变红过程发生反应的化学方程式是CH3CH2OH+CuOCH3CHO+H2O。
(3)①乙酸、乙醇具有挥发性,挥发会降低产率,但为了加快反应速率,所以只能小火均匀加热,故答案是加快反应速率,同时防止反应物挥发降低产率;反应一段时间后,由于生成的乙酸乙酯难容于饱和的碳酸钠溶液 ,会在碳酸钠溶液液面上析出,故现象是饱和碳酸钠溶液上方有无色透明油状液体。
②试管A中是乙酸和乙醇发生酯化反应生成乙酸乙酯,则其发生反应的化学方程式为CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O。
18.(1) 球形冷凝管 a b
(2)略高于62.6℃
(3)乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇
(4) 分离产生的水,使平衡向正反应方向移动,提高转化率 关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水 加热回流至分水器中水位不再上升为止
(5) 中和硫酸和未反应的苯甲酸 不再有气泡产生或pH=7
(6)74.7%
【分析】圆底烧瓶中加入苯甲酸、乙醇、环己烷、浓硫酸,摇匀,加沸石,在分水器上加水至c处,接通冷凝水,水浴回流约2h,反应生成苯甲酸乙酯粗品;反应后混合液加入碳酸氢钠除去硫酸和未反应的苯甲酸,使用石油醚萃取分液,有机层用无水硫酸镁干燥后回收石油醚,加热精馏,收集210-213℃馏分得到苯甲酸乙酯。
【详解】(1)仪器d的名称为球形冷凝管,为防止高温气体急剧冷却而炸裂冷凝管,则离蒸气温度高的是出水口,离蒸气温度低的是进水口,所以水流方向为a进b出;
(2)已知,乙醇沸点78.3℃、共沸物(环己烷-水-乙醇) 沸点62.6℃;反应基本完成时继续蒸出多余的环己烷和乙醇,则水浴温度应该略高于62.6℃;
(3)增大某一廉价反应物的浓度能提高另一反应物的转化率,且恒沸物也需要乙醇,所以加过量乙醇,故答案为乙醇相对廉价,增大反应物浓度,使平衡向正反应方向移动,提高苯甲酸的转化率,提高产率;形成恒沸物需要添加乙醇;
(4)分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率;分水器的检漏方法为:关闭活塞,在分水器中加适量的水,观察是否漏水,若不漏水,旋转活塞180°,若仍不漏水,说明分水器不漏水;当该反应完成后,就不再生成水,则判断反应已基本完成的现象为:加热回流至分水器中水位不再上升;
(5)碳酸氢钠具有碱性,能和硫酸和苯甲酸反应生成盐,所以加入碳酸氢钠的目的是中和硫酸和未反应的苯甲酸,当反应器中不再有气泡产生或溶液呈中性时,则酸被完全中和,故答案为中和硫酸和未反应的苯甲酸;不再有气泡产生或pH=7;
(6)8.0g苯甲酸(固体)和乙醇反应生成苯甲酸乙酯的质量:×150g/mol=9.84g,实际上苯甲酸乙酯的质量:1.05g·cm-3×7.0mL=7.35g,则该反应的产率为×100%=74.7%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
