江苏省苏州市第五中学2015-2016学年高一上学期期中考试化学试题
文档属性
| 名称 | 江苏省苏州市第五中学2015-2016学年高一上学期期中考试化学试题 |
|
|
| 格式 | zip | ||
| 文件大小 | 75.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-11-21 00:00:00 | ||
图片预览



文档简介
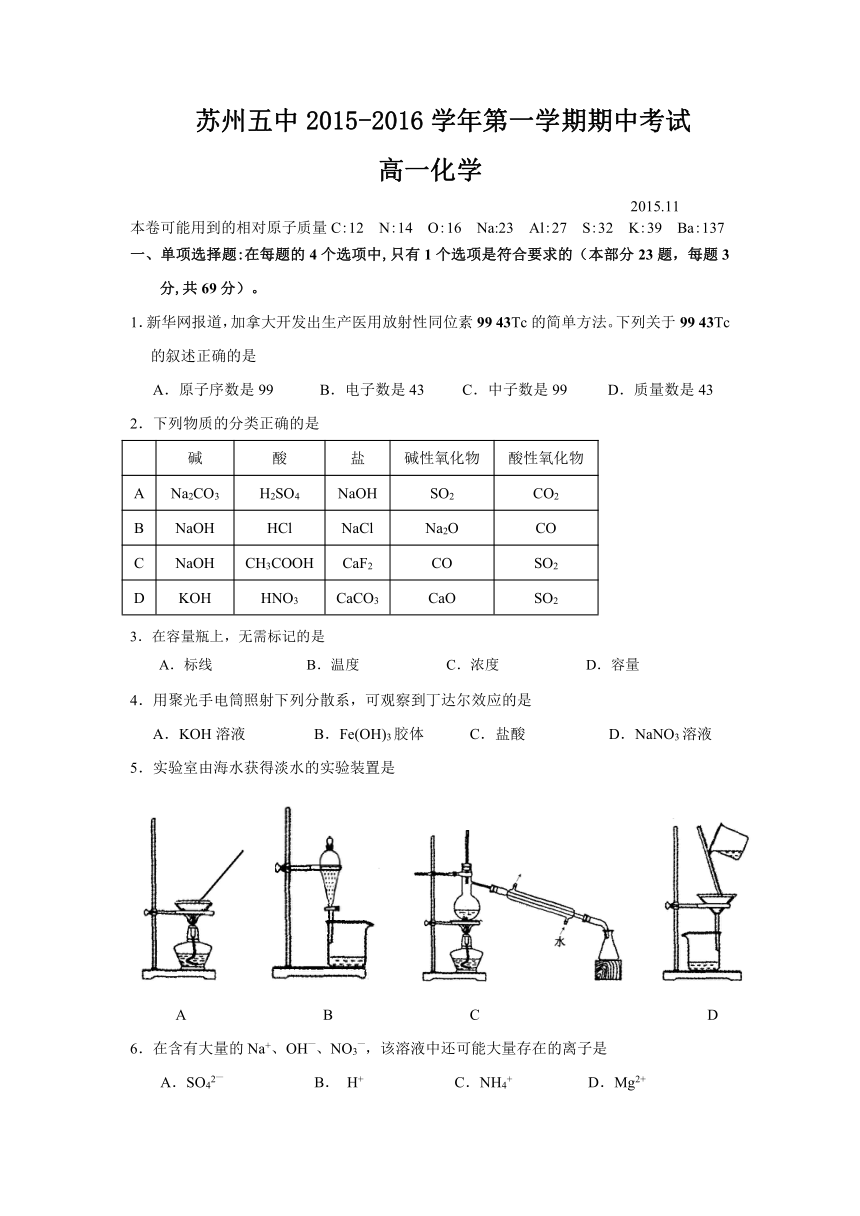
苏州五中2015-2016学年第一学期期中考试
高一化学
2015.11
本卷可能用到的相对原子质量C:12 N:14 O:16 Na:23 Al:27 S:32 K:39 Ba:137
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1.新华网报道,加拿大开发出生产医用放射性同位素99 43Tc的简单方法。下列关于99 43Tc的叙述正确的是
A.原子序数是99 B.电子数是43 C.中子数是99 D.质量数是43
2.下列物质的分类正确的是
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O CO
C NaOH CH3COOH CaF2 CO SO2
D KOH HNO3 CaCO3 CaO SO2
3.在容量瓶上,无需标记的是
A.标线 B.温度 C.浓度 D.容量
4.用聚光手电筒照射下列分散系,可观察到丁达尔效应的是
A.KOH溶液 B.Fe ( http: / / www.21cnjy.com )(OH)3胶体 C.盐酸 D.NaNO3溶液
5.实验室由海水获得淡水的实验装置是
A B C D
6.在含有大量的Na+、OH—、NO3—,该溶液中还可能大量存在的离子是
A.SO42— B. H+ C.NH4+ D.Mg2+
7.用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L O2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
8.下列反应的离子方程式书写正确的是
A.稀硫酸和氨水:H++OH—=H2O
B.碳酸氢钙溶液跟稀盐酸反应:HCO3-+H+=H2O+CO2↑
C.氢氧化铜与稀硫酸反应:OH—+ H+=H2O
D.碳酸钙与稀硝酸反应:CO32-+2H+=H2O+CO2↑
9.对于下列反应的反应类型的判断,不正确的是
A.Fe2O3+3CO=2Fe+3CO2 置换反应
B.Cu(OH) = CuO+H2O 分解反应
C.CO2+H2O=H2CO3 化合反应
D.NaCl+AgNO3=AgCl↓+NaNO3 复分解反应
10.ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne为同一种核素
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
11.某物质灼烧时,焰色反应为黄色,下列判断中正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定不含钾元素 D.该物质一定是金属钠
12.下列说法正确的是
A.32g O2占有的体积约为22.4L
B.22.4L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4L水的质量约为18g
D.22g CO2与标准状况下11.2L HCl含有相同的分子数
13.下列反应属于氧化还原反应的是
A.H2SO4+2NaOH=Na2SO4+2H2O B.2NaHCO3 △ Na2CO3+CO2↑+H2O
C. CuO+H2 △ Cu+H2O D. NH3+HCl=NH4C1
14.已知元素X 、Y的核电荷数分别是a和 ( http: / / www.21cnjy.com )b,它们的离子Xm+ 、 Yn-的核外电子排布相同,则下列关系式正确的是
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n
15.下列物质中,与0.3molH2O含相同氢原子数的物质是
A.0.3molHNO3 B.3.612×1023个HNO3分子
C.0.1molH3PO4 D.0.2molCH4
16.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是
①密度比为16∶11 ②密度比为11∶16 ③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
17.下列实验方法正确的是
A.某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该溶液中一定含有CO32-
B.某溶液加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.某溶液中加入AgNO3溶液有白色沉淀生成,一定有Cl-存在
D.某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+
18.下表是某加碘盐包装袋上的部分文字说明:
配料 氯化钠(NaCl)、碘酸钾(KIO3)
含碘量 (35±15)mg kg﹣1(以I计)
食用方法 菜未烧熟不宜加入加碘盐,菜烧熟后加入加碘盐最佳.
根据这一说明某学生作出如下判断,其中正确的是
A. 此食盐是纯净物
B.“加碘食盐”中的“碘”是指碘单质
C. 1kg此食盐中含碘酸钾(35±15)mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
19.下列溶液中的c (Cl -)与50mL1mol·L-1 氯化铝溶液中的c (Cl -)相等的是
A.150mL 1mol·L-1 氯化钠溶液 B.75mL 2mol·L-1 氯化铵溶液
C.150mL 3mol·L-1 氯化钾溶液 D.75mL 2mol·L-1 氯化钡溶液
20.下列离子在溶液中可以 ( http: / / www.21cnjy.com )大量共存的一组是 A. Al3+、 Na+、 OH- B. K+、 H+、 CO32-
C. Na+、 NO3-、 Cl- D.Ca2+、 SO42-、CO32-
21.下列化学方程式中,不可以用H++OH-=H2O表示的是
A.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O B.Ba(OH)2+2HCl=BaCl2+2H2O
C.2NaOH+H2SO4 = Na2SO4+2H2O D.KOH+HCl=KCl+H2O
22.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1 ②它 ( http: / / www.21cnjy.com )们所含的O原子数目之比为1∶2 ③它们所含的原子数目之比为2∶3 ④它们所含的C原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
23.某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
A.Na+和NO3-来自同一工厂 B.Cl- 和NO3-一定来自同一工厂
C.SO42-和OH- 一定来自同一工厂 D.Ag+和Na+可能来自同一工厂
二、非选择题(本部分3题,共31分)
24.(15分)按要求填空
(1)写出下列各组混合物分离时所需分离方法或实验步骤的名称:
①泥沙与水 ▲ ;② 汽油与水 ▲ ; ③ 从溴水中提取溴 ▲ ;
④ 分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) ▲ 。
(2)现有以下物质:①铝线、②氨气、③液氯、④氯水、⑤液态HCl、⑥熔化的KNO3、⑦蔗糖晶体、⑧BaSO4晶体、⑨乙醇。
其中能导电的是(请用序号填空,下同 ( http: / / www.21cnjy.com )) ▲ ,属于电解质的是 ▲ ,既不是电解质,也不是非电解质的是 ▲ 。
(3)有一包白色粉末状混合物,可能 ( http: / / www.21cnjy.com )含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
I. 由上述实验现象可知,原混合物中肯定没有 ▲ ,肯定有 ▲ ,不能确定是否含有 ▲ 。
II.写出实验②中发生的反应的离子方程式: ▲
(4)在一定条件下,21.6gA单质与1.2 ( http: / / www.21cnjy.com )0molCl2完全反应,生成0.800molAClx,则x= ▲ ,A的摩尔质量为 ▲ 。
25.(10分)化学实验需要0.1 mol·L-1NaOH溶液230mL,甲同学负责配制,
右图Ⅰ是他转移溶液的示意图,请你帮助解决下列问题:
(1)图中的一个重要操作错误是 ▲ 。
(2)甲同学应选择 ▲ mL的容量瓶,用天平称取 ▲ g NaOH。
(3)请填写下列各步骤中的 ( http: / / www.21cnjy.com )空白,并排列“配制一定物质的量浓度溶液”的正确的操作顺序(用字母表示,每个字母只能用一次) ▲ 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,在操作过程中不能损失点滴液体,否则会使溶液的浓度 ▲ (填“偏高”或“偏低”)。
B.准确称取计算好的NaOH固体于烧杯中,再加入少量水,用玻璃板慢慢搅拌,使其充分溶解。
C.将溶解的NaOH溶液冷却到室温后,转移入容量瓶中。若趁热转移会使溶液的浓度 ▲ (填“偏高”或“偏低” )。
D.将容量瓶盖紧,振荡,摇匀,并转移入试剂瓶中,贴上标签。
E.继续往容量 ( http: / / www.21cnjy.com )瓶内小心地加水,直到液面接近刻度线1~2 cm处,改用 ▲ (填 仪器名称)加水定容,下面各图中液面位置正确的是 ▲ (填序号)。
① ② ③
若加水超过刻度线,处理方法是应该 ▲ 。
(4)有人认为,用这种方法只能配置0. ( http: / / www.21cnjy.com )1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得其理由是 ▲ 。
26.(6分)为测定某K2SO4溶液的 ( http: / / www.21cnjy.com )浓度,取25.00mL待测液,向其中加入过量的BaCl2溶液,充分反应后过滤并干燥,得到1.165g沉淀。该K2SO4溶液的物质的量浓度是多少?
苏州五中2015~2016学年第一学期期中考试
高一化学 答题卷
二、非选择题(本部分3题,共31分)
24.(15分)
(1)_______________,_______________,_______________,_______________。
(2) , , 。
(3)I. ______________________________,
______________________________,
______________________________,
II. _____________________________________________________________________。
(4) __________,___________________。
25.(10分)
(1) __________________________________________。
(2) ______________,______________。
(3) __________________________。
A.______________
C._______________
E._______________________,______________,_________________________
(4) ____________________________________________________________________
26.(6分)
苏州五中2015-2016学年第一学期期中考试
高一化学(参考答案)
单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1 2 3 4 5 6 7 8 9 10 11 12
B D C B C A C B A A B D
13 14 15 16 17 18 19 20 21 22 23
C A B B D D C C A D C
非选择题(本部分3题,共31分)
24.(15分)
(1) ① 过滤 , ②分液 , ③萃取, ④ 蒸馏 (每空1分)
(2) ①④⑥, ⑤⑥⑧, ①③④。 (每空1分)
(3)I. CaCO3、CuSO4、Na2CO3 (1分)
Na2SO4、MgCl2 (1分)
KNO3、NaCl、KCl (1分)
II. Ba2+ + SO42- == BaSO4 ↓(1分) Mg2++2OH-=Mg(OH)2↓(1分)
(4) 3 ( 1分) , 27 g·mol-1 (数值和单位各1分)
25.(10分) (每空1分)
(1)转移液体时未用玻璃棒引流
(2)250 1.0
(3)BCAED
偏低
偏高
胶头滴管 ② 重新配制
(4)由于NaOH固体极易潮解,无法称取1.000gNaOH固体
26.(6分)
0.2 mol·L-1
高温
高一化学
2015.11
本卷可能用到的相对原子质量C:12 N:14 O:16 Na:23 Al:27 S:32 K:39 Ba:137
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1.新华网报道,加拿大开发出生产医用放射性同位素99 43Tc的简单方法。下列关于99 43Tc的叙述正确的是
A.原子序数是99 B.电子数是43 C.中子数是99 D.质量数是43
2.下列物质的分类正确的是
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O CO
C NaOH CH3COOH CaF2 CO SO2
D KOH HNO3 CaCO3 CaO SO2
3.在容量瓶上,无需标记的是
A.标线 B.温度 C.浓度 D.容量
4.用聚光手电筒照射下列分散系,可观察到丁达尔效应的是
A.KOH溶液 B.Fe ( http: / / www.21cnjy.com )(OH)3胶体 C.盐酸 D.NaNO3溶液
5.实验室由海水获得淡水的实验装置是
A B C D
6.在含有大量的Na+、OH—、NO3—,该溶液中还可能大量存在的离子是
A.SO42— B. H+ C.NH4+ D.Mg2+
7.用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L O2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
8.下列反应的离子方程式书写正确的是
A.稀硫酸和氨水:H++OH—=H2O
B.碳酸氢钙溶液跟稀盐酸反应:HCO3-+H+=H2O+CO2↑
C.氢氧化铜与稀硫酸反应:OH—+ H+=H2O
D.碳酸钙与稀硝酸反应:CO32-+2H+=H2O+CO2↑
9.对于下列反应的反应类型的判断,不正确的是
A.Fe2O3+3CO=2Fe+3CO2 置换反应
B.Cu(OH) = CuO+H2O 分解反应
C.CO2+H2O=H2CO3 化合反应
D.NaCl+AgNO3=AgCl↓+NaNO3 复分解反应
10.ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne为同一种核素
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
11.某物质灼烧时,焰色反应为黄色,下列判断中正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定不含钾元素 D.该物质一定是金属钠
12.下列说法正确的是
A.32g O2占有的体积约为22.4L
B.22.4L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4L水的质量约为18g
D.22g CO2与标准状况下11.2L HCl含有相同的分子数
13.下列反应属于氧化还原反应的是
A.H2SO4+2NaOH=Na2SO4+2H2O B.2NaHCO3 △ Na2CO3+CO2↑+H2O
C. CuO+H2 △ Cu+H2O D. NH3+HCl=NH4C1
14.已知元素X 、Y的核电荷数分别是a和 ( http: / / www.21cnjy.com )b,它们的离子Xm+ 、 Yn-的核外电子排布相同,则下列关系式正确的是
A.a=b+m+n B.a=b-m+n C.a=b+m-n D.a=b-m-n
15.下列物质中,与0.3molH2O含相同氢原子数的物质是
A.0.3molHNO3 B.3.612×1023个HNO3分子
C.0.1molH3PO4 D.0.2molCH4
16.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是
①密度比为16∶11 ②密度比为11∶16 ③体积比为16∶11 ④体积比为11∶16
A.①③ B.①④ C.②③ D.②④
17.下列实验方法正确的是
A.某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,该溶液中一定含有CO32-
B.某溶液加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.某溶液中加入AgNO3溶液有白色沉淀生成,一定有Cl-存在
D.某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+
18.下表是某加碘盐包装袋上的部分文字说明:
配料 氯化钠(NaCl)、碘酸钾(KIO3)
含碘量 (35±15)mg kg﹣1(以I计)
食用方法 菜未烧熟不宜加入加碘盐,菜烧熟后加入加碘盐最佳.
根据这一说明某学生作出如下判断,其中正确的是
A. 此食盐是纯净物
B.“加碘食盐”中的“碘”是指碘单质
C. 1kg此食盐中含碘酸钾(35±15)mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
19.下列溶液中的c (Cl -)与50mL1mol·L-1 氯化铝溶液中的c (Cl -)相等的是
A.150mL 1mol·L-1 氯化钠溶液 B.75mL 2mol·L-1 氯化铵溶液
C.150mL 3mol·L-1 氯化钾溶液 D.75mL 2mol·L-1 氯化钡溶液
20.下列离子在溶液中可以 ( http: / / www.21cnjy.com )大量共存的一组是 A. Al3+、 Na+、 OH- B. K+、 H+、 CO32-
C. Na+、 NO3-、 Cl- D.Ca2+、 SO42-、CO32-
21.下列化学方程式中,不可以用H++OH-=H2O表示的是
A.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O B.Ba(OH)2+2HCl=BaCl2+2H2O
C.2NaOH+H2SO4 = Na2SO4+2H2O D.KOH+HCl=KCl+H2O
22.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1 ②它 ( http: / / www.21cnjy.com )们所含的O原子数目之比为1∶2 ③它们所含的原子数目之比为2∶3 ④它们所含的C原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
23.某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是
A.Na+和NO3-来自同一工厂 B.Cl- 和NO3-一定来自同一工厂
C.SO42-和OH- 一定来自同一工厂 D.Ag+和Na+可能来自同一工厂
二、非选择题(本部分3题,共31分)
24.(15分)按要求填空
(1)写出下列各组混合物分离时所需分离方法或实验步骤的名称:
①泥沙与水 ▲ ;② 汽油与水 ▲ ; ③ 从溴水中提取溴 ▲ ;
④ 分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) ▲ 。
(2)现有以下物质:①铝线、②氨气、③液氯、④氯水、⑤液态HCl、⑥熔化的KNO3、⑦蔗糖晶体、⑧BaSO4晶体、⑨乙醇。
其中能导电的是(请用序号填空,下同 ( http: / / www.21cnjy.com )) ▲ ,属于电解质的是 ▲ ,既不是电解质,也不是非电解质的是 ▲ 。
(3)有一包白色粉末状混合物,可能 ( http: / / www.21cnjy.com )含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,在另一份中加入NaOH溶液,也产生白色沉淀。
I. 由上述实验现象可知,原混合物中肯定没有 ▲ ,肯定有 ▲ ,不能确定是否含有 ▲ 。
II.写出实验②中发生的反应的离子方程式: ▲
(4)在一定条件下,21.6gA单质与1.2 ( http: / / www.21cnjy.com )0molCl2完全反应,生成0.800molAClx,则x= ▲ ,A的摩尔质量为 ▲ 。
25.(10分)化学实验需要0.1 mol·L-1NaOH溶液230mL,甲同学负责配制,
右图Ⅰ是他转移溶液的示意图,请你帮助解决下列问题:
(1)图中的一个重要操作错误是 ▲ 。
(2)甲同学应选择 ▲ mL的容量瓶,用天平称取 ▲ g NaOH。
(3)请填写下列各步骤中的 ( http: / / www.21cnjy.com )空白,并排列“配制一定物质的量浓度溶液”的正确的操作顺序(用字母表示,每个字母只能用一次) ▲ 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,在操作过程中不能损失点滴液体,否则会使溶液的浓度 ▲ (填“偏高”或“偏低”)。
B.准确称取计算好的NaOH固体于烧杯中,再加入少量水,用玻璃板慢慢搅拌,使其充分溶解。
C.将溶解的NaOH溶液冷却到室温后,转移入容量瓶中。若趁热转移会使溶液的浓度 ▲ (填“偏高”或“偏低” )。
D.将容量瓶盖紧,振荡,摇匀,并转移入试剂瓶中,贴上标签。
E.继续往容量 ( http: / / www.21cnjy.com )瓶内小心地加水,直到液面接近刻度线1~2 cm处,改用 ▲ (填 仪器名称)加水定容,下面各图中液面位置正确的是 ▲ (填序号)。
① ② ③
若加水超过刻度线,处理方法是应该 ▲ 。
(4)有人认为,用这种方法只能配置0. ( http: / / www.21cnjy.com )1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得其理由是 ▲ 。
26.(6分)为测定某K2SO4溶液的 ( http: / / www.21cnjy.com )浓度,取25.00mL待测液,向其中加入过量的BaCl2溶液,充分反应后过滤并干燥,得到1.165g沉淀。该K2SO4溶液的物质的量浓度是多少?
苏州五中2015~2016学年第一学期期中考试
高一化学 答题卷
二、非选择题(本部分3题,共31分)
24.(15分)
(1)_______________,_______________,_______________,_______________。
(2) , , 。
(3)I. ______________________________,
______________________________,
______________________________,
II. _____________________________________________________________________。
(4) __________,___________________。
25.(10分)
(1) __________________________________________。
(2) ______________,______________。
(3) __________________________。
A.______________
C._______________
E._______________________,______________,_________________________
(4) ____________________________________________________________________
26.(6分)
苏州五中2015-2016学年第一学期期中考试
高一化学(参考答案)
单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1 2 3 4 5 6 7 8 9 10 11 12
B D C B C A C B A A B D
13 14 15 16 17 18 19 20 21 22 23
C A B B D D C C A D C
非选择题(本部分3题,共31分)
24.(15分)
(1) ① 过滤 , ②分液 , ③萃取, ④ 蒸馏 (每空1分)
(2) ①④⑥, ⑤⑥⑧, ①③④。 (每空1分)
(3)I. CaCO3、CuSO4、Na2CO3 (1分)
Na2SO4、MgCl2 (1分)
KNO3、NaCl、KCl (1分)
II. Ba2+ + SO42- == BaSO4 ↓(1分) Mg2++2OH-=Mg(OH)2↓(1分)
(4) 3 ( 1分) , 27 g·mol-1 (数值和单位各1分)
25.(10分) (每空1分)
(1)转移液体时未用玻璃棒引流
(2)250 1.0
(3)BCAED
偏低
偏高
胶头滴管 ② 重新配制
(4)由于NaOH固体极易潮解,无法称取1.000gNaOH固体
26.(6分)
0.2 mol·L-1
高温
同课章节目录
