课题1 常见的酸和碱 -碱的化学性质 课件(共19张PPT)
文档属性
| 名称 | 课题1 常见的酸和碱 -碱的化学性质 课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-12 17:32:06 | ||
图片预览






文档简介
(共19张PPT)
常见的酸和碱(碱的化学性质)
年 级:九年级 学 科:化学(人教版)
请列举出一些常见的酸和碱
复习回顾
复习回顾
酸有哪些相似的化学性质?
(酸的通性)
1、能与酸碱指示剂反应
2、能与氢前金属反应
3、能与金属氧化物反应
4、能与碱反应
5、能与某些盐反应
思考:根据酸的通性推测碱的化学性质
知识讲解:碱的化学性质
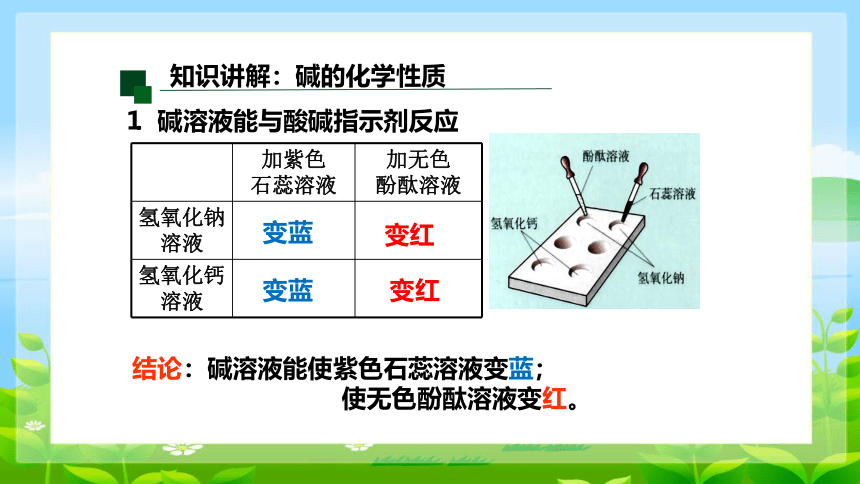
⒈ 碱溶液能与酸碱指示剂反应
加紫色 石蕊溶液 加无色
酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
变蓝
结论:碱溶液能使紫色石蕊溶液变蓝;
使无色酚酞溶液变红。
变蓝
变红
变红
知识讲解:碱的化学性质
石灰浆将
树干刷白
石灰浆抹墙后变硬
澄清石灰水变浑浊
久置石灰水底部有白膜
以上的事实和现象涉及到哪些物质?
请写出相关的化学方程式。
2. 碱溶液能与非金属氧化物反应
结论:碱 + 非金属氧化物 = 盐 + 水
CO 2 + Ca(OH)2 =CaCO3↓+H2O
二氧化碳+氢氧化钠
三氧化硫+氢氧化钠
练习:
CO2 + 2 NaOH = Na2CO3 +H2O
SO3 +2 NaOH =Na2SO4+H2O
知识讲解:碱的化学性质
3. 碱溶液能与酸反应
化学方程式
氢氧化钠+盐酸
氢氧化钙+盐酸
氢氧化钠+硫酸
氢氧化钙+硫酸
NaOH + HCl = NaCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
结论:碱 + 酸 = 盐 + 水
知识讲解:碱的化学性质
实验:在硫酸铜溶液中加入氢氧化钠溶液
知识讲解:碱的化学性质
实验:在硫酸铜溶液中加入氢氧化钠溶液
现象:产生蓝色沉淀
化学方程式:
练习:请写出氢氧化钙溶液与碳酸钠溶液
反应的化学方程式
知识讲解:碱的化学性质
4. 碱溶液能与某些盐溶液反应
结论:碱 + 盐 = 新碱 + 新盐
知识讲解:碱的化学性质
思考
不同的酸为什么有相似的化学性质?
不同的碱为什么也有相似的化学性质?
知识讲解:溶液的导电性
酸
盐酸
硫酸
酸的构成: H++酸根离子
碱
氢氧化钠
氢氧化钙
碱的构成:金属离子+OH-
知识讲解:溶液的导电性
结论:
1、酸在水溶液中能解离出H 和酸根离子,不同的酸溶液都含有H+,所以酸有一些相似的性质。
2、碱在水溶液中能解离出OH - 和金属离子,不同的碱溶液都含有OH - ,所以碱有一些相似的性质。
+
知识讲解:溶液的导电性
碳酸钠和氯化钠的溶液也能够导电,说明它们在水溶液中也能离解出能够导电的离子。
Na2CO3 2Na+ + CO32-
NaCl Na+ + Cl-
盐
盐的构成: 金属离子+酸根离子
盐:在水溶液中解离出金属离子和酸根离子的化合物。
练习
1、医院做心电图检查时,在皮肤上涂抹少量的生理盐水(0.9%的NaCl溶液),生理盐水能导电的原因是其中含有自由移动的( )
A、水分子 B、钠离子和氯离子
C、氧分子 D、氯化钠分子
B
练习
2、根据下图总结NaOH的四类化学性质(即NaOH能与四类物质发生化学反应)。
(1)为验证性质1,将无色酚酞滴入NaOH溶液,溶液颜色由无色变为 ( )。
(2)根据性质2,写出NaOH与盐酸反应的化学方程式
(3)为了验证性质3,可以选择的物质是( )
A、H2CO3 B、CO2 C、FeCl3 D、CuO
(4)性质4说明NaOH会吸收空气中的( )
红色
NaOH + HCl = NaCl + H2O
C
CO2
课堂小结
学完本节课你应该知道:
1、与酸碱指示剂反应(可溶性碱)
2、与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
3、与酸反应
碱 + 酸 → 盐 + 水
4、与某些盐溶液反应
碱溶液 + 盐溶液 → 新碱+ 新盐
一、碱的化学性质(碱的通性)
二、酸溶液中都含有氢离子,碱溶液中都含有氢氧根离子。所以,酸和碱分别有相似的化学性质。
课后作业
请完成课后作业对应内容
结语
化学源于生活,用于生活。
希望各位同学好好学习,热爱化学,热爱生活。
感谢聆听!
常见的酸和碱(碱的化学性质)
年 级:九年级 学 科:化学(人教版)
请列举出一些常见的酸和碱
复习回顾
复习回顾
酸有哪些相似的化学性质?
(酸的通性)
1、能与酸碱指示剂反应
2、能与氢前金属反应
3、能与金属氧化物反应
4、能与碱反应
5、能与某些盐反应
思考:根据酸的通性推测碱的化学性质
知识讲解:碱的化学性质
⒈ 碱溶液能与酸碱指示剂反应
加紫色 石蕊溶液 加无色
酚酞溶液
氢氧化钠溶液
氢氧化钙溶液
变蓝
结论:碱溶液能使紫色石蕊溶液变蓝;
使无色酚酞溶液变红。
变蓝
变红
变红
知识讲解:碱的化学性质
石灰浆将
树干刷白
石灰浆抹墙后变硬
澄清石灰水变浑浊
久置石灰水底部有白膜
以上的事实和现象涉及到哪些物质?
请写出相关的化学方程式。
2. 碱溶液能与非金属氧化物反应
结论:碱 + 非金属氧化物 = 盐 + 水
CO 2 + Ca(OH)2 =CaCO3↓+H2O
二氧化碳+氢氧化钠
三氧化硫+氢氧化钠
练习:
CO2 + 2 NaOH = Na2CO3 +H2O
SO3 +2 NaOH =Na2SO4+H2O
知识讲解:碱的化学性质
3. 碱溶液能与酸反应
化学方程式
氢氧化钠+盐酸
氢氧化钙+盐酸
氢氧化钠+硫酸
氢氧化钙+硫酸
NaOH + HCl = NaCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
结论:碱 + 酸 = 盐 + 水
知识讲解:碱的化学性质
实验:在硫酸铜溶液中加入氢氧化钠溶液
知识讲解:碱的化学性质
实验:在硫酸铜溶液中加入氢氧化钠溶液
现象:产生蓝色沉淀
化学方程式:
练习:请写出氢氧化钙溶液与碳酸钠溶液
反应的化学方程式
知识讲解:碱的化学性质
4. 碱溶液能与某些盐溶液反应
结论:碱 + 盐 = 新碱 + 新盐
知识讲解:碱的化学性质
思考
不同的酸为什么有相似的化学性质?
不同的碱为什么也有相似的化学性质?
知识讲解:溶液的导电性
酸
盐酸
硫酸
酸的构成: H++酸根离子
碱
氢氧化钠
氢氧化钙
碱的构成:金属离子+OH-
知识讲解:溶液的导电性
结论:
1、酸在水溶液中能解离出H 和酸根离子,不同的酸溶液都含有H+,所以酸有一些相似的性质。
2、碱在水溶液中能解离出OH - 和金属离子,不同的碱溶液都含有OH - ,所以碱有一些相似的性质。
+
知识讲解:溶液的导电性
碳酸钠和氯化钠的溶液也能够导电,说明它们在水溶液中也能离解出能够导电的离子。
Na2CO3 2Na+ + CO32-
NaCl Na+ + Cl-
盐
盐的构成: 金属离子+酸根离子
盐:在水溶液中解离出金属离子和酸根离子的化合物。
练习
1、医院做心电图检查时,在皮肤上涂抹少量的生理盐水(0.9%的NaCl溶液),生理盐水能导电的原因是其中含有自由移动的( )
A、水分子 B、钠离子和氯离子
C、氧分子 D、氯化钠分子
B
练习
2、根据下图总结NaOH的四类化学性质(即NaOH能与四类物质发生化学反应)。
(1)为验证性质1,将无色酚酞滴入NaOH溶液,溶液颜色由无色变为 ( )。
(2)根据性质2,写出NaOH与盐酸反应的化学方程式
(3)为了验证性质3,可以选择的物质是( )
A、H2CO3 B、CO2 C、FeCl3 D、CuO
(4)性质4说明NaOH会吸收空气中的( )
红色
NaOH + HCl = NaCl + H2O
C
CO2
课堂小结
学完本节课你应该知道:
1、与酸碱指示剂反应(可溶性碱)
2、与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
3、与酸反应
碱 + 酸 → 盐 + 水
4、与某些盐溶液反应
碱溶液 + 盐溶液 → 新碱+ 新盐
一、碱的化学性质(碱的通性)
二、酸溶液中都含有氢离子,碱溶液中都含有氢氧根离子。所以,酸和碱分别有相似的化学性质。
课后作业
请完成课后作业对应内容
结语
化学源于生活,用于生活。
希望各位同学好好学习,热爱化学,热爱生活。
感谢聆听!
同课章节目录
