2024江苏中考化学二轮中考考点研究 第11讲 物质的检验、鉴别、除杂(含分离)和推断 课件 (共41张PPT)
文档属性
| 名称 | 2024江苏中考化学二轮中考考点研究 第11讲 物质的检验、鉴别、除杂(含分离)和推断 课件 (共41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 446.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-12 21:14:11 | ||
图片预览








文档简介
(共41张PPT)
第11讲 物质的检验、鉴别、除杂(含分离)和推断
考点特训营
2
江苏近年真题精选
1
1. 现有4种试剂:①紫色石蕊试液;②稀硫酸;
③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A. ②
B. ②③
C. ①②③
D. ②③④
物质的检验与鉴别
B
江苏近年真题精选
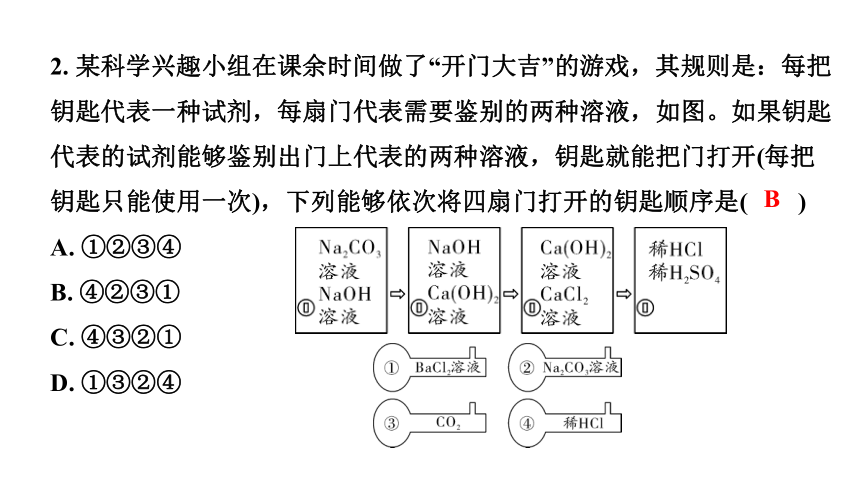
2. 某科学兴趣小组在课余时间做了“开门大吉”的游戏,其规则是:每把钥匙代表一种试剂,每扇门代表需要鉴别的两种溶液,如图。如果钥匙代表的试剂能够鉴别出门上代表的两种溶液,钥匙就能把门打开(每把钥匙只能使用一次),下列能够依次将四扇门打开的钥匙顺序是( )
A. ①②③④
B. ④②③①
C. ④③②①
D. ①③②④
B
3. 厨房里有两瓶白色固体,分别为食盐(NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是______。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是_______。
方案二:加水溶解,分别滴加______溶液。有沉淀产生的是纯碱。
食盐
纯碱
CaCl2
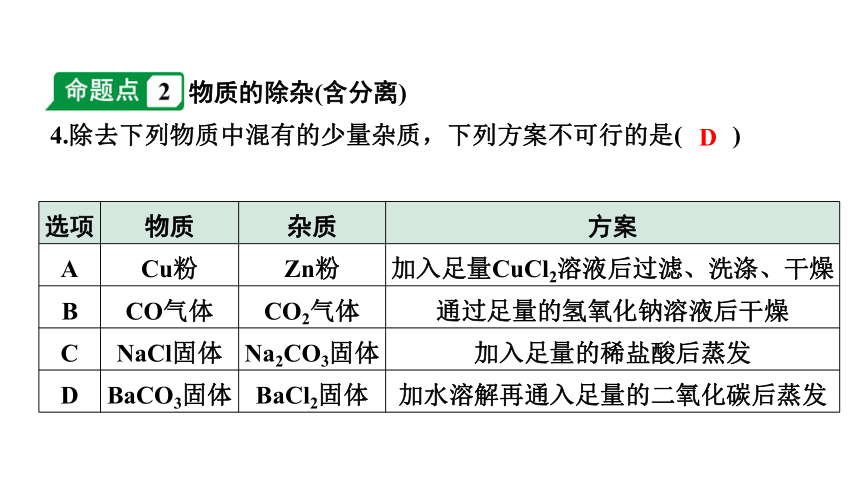
4.除去下列物质中混有的少量杂质,下列方案不可行的是( )
物质的除杂(含分离)
选项 物质 杂质 方案
A Cu粉 Zn粉 加入足量CuCl2溶液后过滤、洗涤、干燥
B CO气体 CO2气体 通过足量的氢氧化钠溶液后干燥
C NaCl固体 Na2CO3固体 加入足量的稀盐酸后蒸发
D BaCO3固体 BaCl2固体 加水溶解再通入足量的二氧化碳后蒸发
D
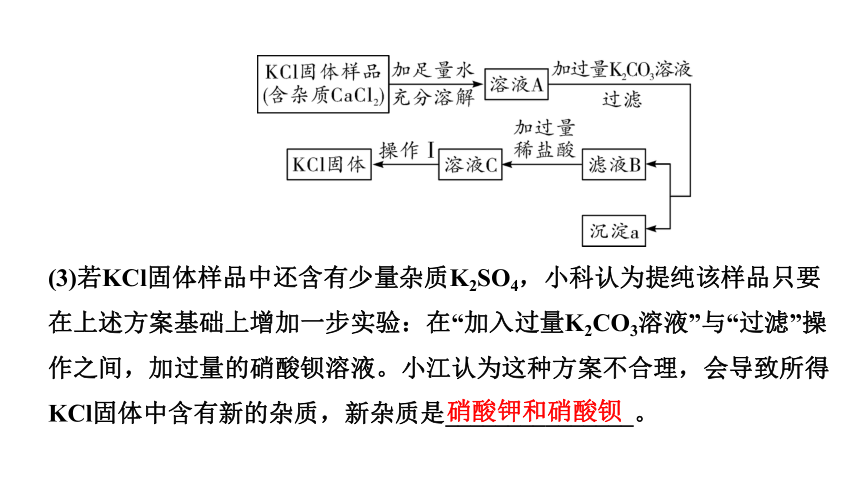
5.某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下(氯化钾溶解度受温度影响较小)。
(1)沉淀a是________。
(2)操作Ⅰ是____。
①冷却热饱和溶液
②蒸发结晶
碳酸钙
②
(3)若KCl固体样品中还含有少量杂质K2SO4,小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是_______________。
硝酸钾和硝酸钡
混合物成分的推断
6.某固体由Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。
则该固体中一定含有( )
A. Na+、 、 B. Cu2+、 、
C. Cl-、 、 D. Na+、Ba2+、Cl-
A
7.有一固体物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种。现需要对此物质成分进行检测。甲同学向固体中加入足量的水,形成无色溶液;乙同学向固体中加入足量氢氧化钡溶液,产生白色沉淀,放出刺激性气体。
(1)该气体为_____(写化学式)。
(2)根据两同学的实验现象可推定此物质的组成是_______________。
NH3
硫酸钾、硝酸铵
8. 学习了物质推断专题内容后,科学研究小组同学设计了如下实验方案进行探究。步骤如下:
①往镁粉和氧化铜的混合物中加入过量稀硫酸,充分反应并过滤,得到滤渣甲和滤液A;
②往滴有无色酚酞的氢氧化钠和硝酸钡的混合溶液中,加入一定量的稀硫酸,充分反应并过滤,得到沉淀乙和无色滤液B;
③将滤液A和B充分混合后,得到沉淀丙和滤液C;
④往滤液C中滴加氯化钡溶液,没有沉淀产生。
回答下列问题:
(1)步骤②中沉淀乙的化学式为__________。
(2)滤液C中除酚酞外,一定含有的溶质是________________________。
BaSO4
HNO3、Mg(NO3)2、NaNO3
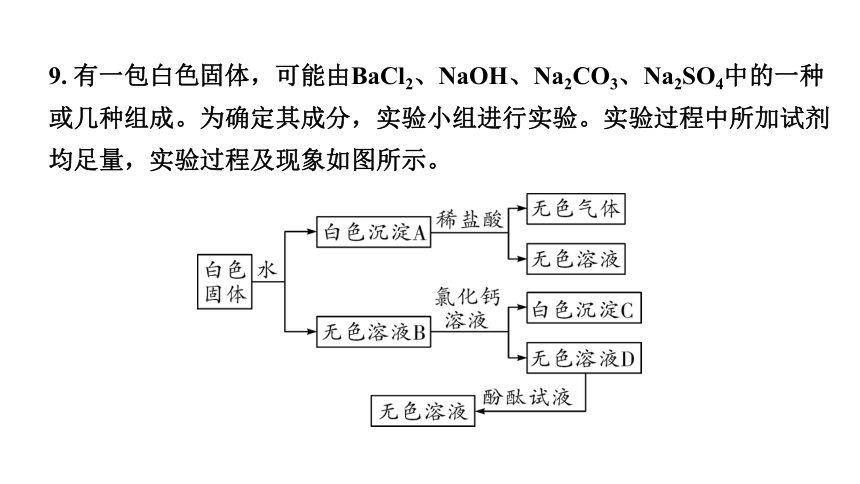
9. 有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为____________________
__________________。
(2)白色沉淀C的化学式为________。
(3)这包白色固体是由______________(填化学式)组成的。
BaCO3+2HCl === BaCl2+H2O+CO2↑
CaCO3
BaCl2、Na2CO3
10. 取敞口放置的氢氧化钠溶液于烧杯中,倒入一定量的稀硫酸充分反应。为探究反应后所得溶液X的成分,兴趣小组进行了如下实验(所加试剂均足量):
(1)过滤中玻璃棒的作用是_____。
(2)产生的无色气体是_____。
(3)溶液X的溶质是
________________________。
(4)计算滤液A中氯化钠的质量。
(4)解:设硫酸钠与氯化钡反应生成的氯化钠的质量为x
BaCl2+Na2SO4=== BaSO4↓+2NaCl
233 117
4.66 g x
x=2.34 g
生成碳酸钡沉淀的质量为12.54 g-4.66 g=7.88 g
(1)引流
(2)CO2
(3)NaOH、Na2CO3、Na2SO4
设碳酸钠与氯化钡反应生成的氯化钠的质量为y
BaCl2+Na2CO3=== BaCO3↓+2NaCl
197 117
7.88g y
y=4.68 g
氯化钠的质量为2.34 g+4.68 g=7.02 g
答:滤液A中氯化钠的质量为7.02 g。
11.下列依据实验现象得出的结论错误的是( )
综合考查(杭州3考)
选项 实验操作与现象 实验结论
A 将1 g白磷、1 g红磷分别放入两支带塞的试管中,再将试管同时浸入约80 ℃的热水里,只有白磷燃烧 白磷的着火点比红
磷低
B 将二氧化碳通入紫色石蕊试液,试液变红 二氧化碳是一种酸
C 在常温常压下,硫在氧气中燃烧比在空气中燃烧更剧烈 该条件下,氧气的浓度越大,硫燃烧的越剧烈
D 将铁粉﹑硫粉按一定比例混合加热后,所得固体物质不能被磁铁吸引 铁粉已跟硫粉发生了化学反应
B
12. 下列依据实验目的所进行的操作,正确的是( )
选项 实验目的 操作
A 用氯酸钾和二氧化锰制取氧气后,回收其中的二氧化锰 将反应得到的混合物溶解后直接加热蒸发
B 用向上排空气法收集氧气时,检验氧气是否收集满 用带火星的木条伸入到集气瓶中,观察木条是否复燃
C 鉴别盐酸和硫酸 取样后滴加氯化钡溶液,观察是否变浑浊
D 比较铜和银的化学活动性顺序 将两种金属与等质量且同浓度的盐酸反应,观察产生气泡的快慢
C
13. 下列实验中,实验原理和主要操作方法都符合实验目的的是( )
实验目的 实验原理 主要操作方法
A 除去粗盐中的泥沙 各成分的溶解性差异 蒸发
B 分离水与酒精的混合物 各成分的密度差异 蒸馏
C 鉴别稀盐酸和稀硫酸 酸根离子的化学性质差异 加碳酸钠溶液,观察产生气泡
快慢
D 除去FeSO4、CuSO4混合溶液中的CuSO4 金属活动性差异 加过量铁粉,充分反应后过滤
D
物质的检验
1. 检验原则:根据物质的某一特性,用物理或
化学的方法来确定物质的组成。
2. 检验方法:
(1)根据物理性质:颜色、状态、气味、密度、
溶解性、熔点、沸点等。如物质间有明显的溶
解性差异、溶解时的吸放热现象、水溶液的颜色差异等。
(2)根据化学性质:根据物质间发生反应的现象,如火焰颜色、变色、生成沉淀、放出气体等。
3. 常见气体的检验
气体 检验方法 现象
O2 将带火星的木条伸入集气瓶中 木条________
H2 点燃,在火焰上方罩一个干燥的冷烧杯,燃烧后迅速倒转,加入澄清石灰水 产生淡蓝色火焰,烧杯内壁有水珠,澄清石灰水不变浑浊
CO 产生_____色火焰,澄清石灰水变浑浊
CO2 将气体通入澄清石灰水中 澄清石灰水_________
复燃
蓝
变浑浊
气体 检验方法 现象
水蒸气 通过无水硫酸铜粉末(白色) 白色粉末变______
NH3 将湿润的红色石蕊试纸放在试管口 红色石蕊试纸变____
HCl 通入稀硝酸酸化的硝酸银溶液中 有________生成
蓝
蓝
白色沉淀
4. 常见离子的检验
离子 检验方法 现象
H+(酸) 滴加紫色石蕊溶液 石蕊溶液变____
用pH试纸测pH pH_____7
加入锌粒等活泼金属 有气泡产生
加入Na2CO3等碳酸盐 有______产生
OH-(碱) 滴加紫色石蕊溶液 溶液变_____
滴加无色酚酞溶液 溶液变_____
用pH试纸测pH pH_____7
红
<
气泡
蓝
红
>
离子 检验方法 现象
OH-(碱) 滴入可溶性铜盐溶液,如CuSO4溶液 生成____色絮状沉淀
滴入可溶性铁盐溶液,如FeCl3溶液 生成______色沉淀
滴加钙盐或钡盐溶液,过滤,向滤渣中加入足量稀硝酸,将生成的气体通入澄清石灰水中 产生白色沉淀,加入稀硝酸后产生气泡,气体能使澄清石灰水________
蓝
红褐
变浑浊
离子 检验方法 现象
(铵盐) 加入碱溶液并微热,用湿润的红色石蕊试纸检验生成的气体 生成有刺激性气味的气体,湿润的红色石蕊试纸变_____
Cl- 先滴入AgNO3溶液,再滴加稀硝酸 产生____色沉淀,且沉淀不溶解
滴入稀盐酸,再滴入BaCl2溶液 开始无现象,滴入BaCl2溶液后产生________
滴入Ba(NO3)2溶液和稀硝酸 产生___色沉淀且沉淀不溶解
蓝
白
白色沉淀
白
1. 原理:用物理或化学的方法把几种物质区分开。
2. 鉴别方法
(1)物理方法:依据物质特殊的物理性质,如特殊颜色、气味、溶解现象、磁性等进行鉴别。
物质的鉴别
依据 举例
颜色 含Cu2+的溶液显____色、含Fe3+的溶液显____色、KMnO4固体为____色
气味 如SO2、NH3均有________气味
硬度 纯金属与该金属的合金互相刻画,有明显划痕的为纯金属,反之为合金
溶解性 CaCO3等难溶于水
特殊性质 铁粉具有磁性,可以被磁铁吸引
蓝
黄
暗紫
刺激性
(2)化学方法:借助试剂,通过反应现象进行鉴别
①利用指示剂或pH试纸进行鉴别
若几种溶液的酸碱性不同时,可选择适当的指示剂或pH试纸进行鉴别。
如:鉴别盐酸、NaCl溶液、NaOH溶液
思路分析:盐酸(酸性溶液)能使紫色石蕊溶液变___色,NaCl溶液(显中性)不能使紫色石蕊溶液变色,NaOH溶液(碱性溶液)能使紫色石蕊溶液变___色,所以可以选用紫色石蕊溶液来鉴别。
红
蓝
②根据发生复分解反应时的不同现象进行鉴别
常见的鉴别试剂有:稀硫酸、稀盐酸、Na2CO3溶液、CuSO4溶液、BaCl2 溶液、Ba(OH)2溶液、AgNO3溶液等,通过加入这些试剂,使反应呈现不同现象,如生成气体或沉淀等。
如:鉴别Na2CO3溶液和NaOH溶液
思路分析:由于Na2CO3溶液和NaOH溶液均显碱性,均能使无色酚酞溶液变红,使紫色石蕊溶液变蓝,故不能用酸碱指示剂进行鉴别,但Na2CO3溶液与稀盐酸反应有_________,NaOH溶液与稀盐酸反应无明显现象,故可用稀盐酸来鉴别这两种溶液。
气泡产生
3. 常见物质的鉴别
软水
硬水
天然
合成
一、物质的除杂
1. 基本原则
物质的除杂(含分离)
2. 常见物质的除杂
(1)气体的除杂
方法一:将杂质气体通过物质吸收、反应除去
物质 杂质 方法
H2 HCl、水蒸气 通过装有足量生石灰和烧碱混合固体的干燥管
H2 水蒸气 通过________
O2 CO CO2 浓硫酸
方法二:将杂质气体转化为主气体
物质 杂质 方法
CO2 HCl 通过饱和的____________溶液,再通过浓硫酸
CO2 CO 通过灼热的氧化铜
碳酸氢钠
(2)固体的除杂
①优先选择用水溶解、过滤、蒸发滤液的方法除杂。
②根据被提纯物质和杂质在性质上的差异选用气体或液体除杂试剂。
常见固体的除杂:
物质 杂质 方法
NaCl Na2CO3 加入适量____________,过滤、蒸发
Cu Fe 加入足量的________,过滤、洗涤、干燥
Cu CuO 加入足量的稀硫酸(或稀盐酸),过滤、洗涤、干燥
CuO Cu 在空气(或氧气流)中充分灼烧
Ca(OH)2 CaO 加入适量的水,蒸发
CaCO3 CaCl2 加水溶解,过滤、洗涤、干燥
CaCl2溶液
稀硫酸
(3)液体的除杂
液体之间的除杂,一般为酸、碱、盐之间的除杂,其实质为溶液中阴、阳离子的除杂。
方法:①对比两种物质,找出两种物质中含有的离子;
②根据各离子的化学性质,判断出杂质离子与非杂质离子,找出与杂质离子不共存且不引进新杂质的离子,确定除杂试剂。
如:除去NaCl中的Na2CO3
思路分析:
二、物质的分离
1. 原理:运用合理的物理或化学方法把混合物里的几种物质分开,得到各种成分的原来状态的过程。
2. 分离方法
(1)物理方法:
①过滤法:分离不溶于水的固体和液体(或可溶性固体与不溶性固体)组成的混合物,如分离二氧化锰和氯酸钾的固体混合物,操作如下:
②蒸馏法:分离沸点相差较大的液体混合物,如分离水和酒精的混合物、石油的分馏等。
③磁铁吸引法:分离具有铁磁性和不具有铁磁性的物质,如分离碳粉和铁粉。
(2)化学方法:针对使用物理方法不能分离的物质,可利用化学反应进行分离。如分离CuCl2固体和NaCl固体,操作如下:
第11讲 物质的检验、鉴别、除杂(含分离)和推断
考点特训营
2
江苏近年真题精选
1
1. 现有4种试剂:①紫色石蕊试液;②稀硫酸;
③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A. ②
B. ②③
C. ①②③
D. ②③④
物质的检验与鉴别
B
江苏近年真题精选
2. 某科学兴趣小组在课余时间做了“开门大吉”的游戏,其规则是:每把钥匙代表一种试剂,每扇门代表需要鉴别的两种溶液,如图。如果钥匙代表的试剂能够鉴别出门上代表的两种溶液,钥匙就能把门打开(每把钥匙只能使用一次),下列能够依次将四扇门打开的钥匙顺序是( )
A. ①②③④
B. ④②③①
C. ④③②①
D. ①③②④
B
3. 厨房里有两瓶白色固体,分别为食盐(NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是______。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是_______。
方案二:加水溶解,分别滴加______溶液。有沉淀产生的是纯碱。
食盐
纯碱
CaCl2
4.除去下列物质中混有的少量杂质,下列方案不可行的是( )
物质的除杂(含分离)
选项 物质 杂质 方案
A Cu粉 Zn粉 加入足量CuCl2溶液后过滤、洗涤、干燥
B CO气体 CO2气体 通过足量的氢氧化钠溶液后干燥
C NaCl固体 Na2CO3固体 加入足量的稀盐酸后蒸发
D BaCO3固体 BaCl2固体 加水溶解再通入足量的二氧化碳后蒸发
D
5.某KCl固体样品中含有少量CaCl2杂质,实验室提纯氯化钾的流程如下(氯化钾溶解度受温度影响较小)。
(1)沉淀a是________。
(2)操作Ⅰ是____。
①冷却热饱和溶液
②蒸发结晶
碳酸钙
②
(3)若KCl固体样品中还含有少量杂质K2SO4,小科认为提纯该样品只要在上述方案基础上增加一步实验:在“加入过量K2CO3溶液”与“过滤”操作之间,加过量的硝酸钡溶液。小江认为这种方案不合理,会导致所得KCl固体中含有新的杂质,新杂质是_______________。
硝酸钾和硝酸钡
混合物成分的推断
6.某固体由Ba2+、Cu2+、Na+、Cl-、 、 中的几种离子构成,取一定质量的该固体样品,进行如下实验:
①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。
③在滤液中滴加AgNO3溶液,产生白色沉淀。
则该固体中一定含有( )
A. Na+、 、 B. Cu2+、 、
C. Cl-、 、 D. Na+、Ba2+、Cl-
A
7.有一固体物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种。现需要对此物质成分进行检测。甲同学向固体中加入足量的水,形成无色溶液;乙同学向固体中加入足量氢氧化钡溶液,产生白色沉淀,放出刺激性气体。
(1)该气体为_____(写化学式)。
(2)根据两同学的实验现象可推定此物质的组成是_______________。
NH3
硫酸钾、硝酸铵
8. 学习了物质推断专题内容后,科学研究小组同学设计了如下实验方案进行探究。步骤如下:
①往镁粉和氧化铜的混合物中加入过量稀硫酸,充分反应并过滤,得到滤渣甲和滤液A;
②往滴有无色酚酞的氢氧化钠和硝酸钡的混合溶液中,加入一定量的稀硫酸,充分反应并过滤,得到沉淀乙和无色滤液B;
③将滤液A和B充分混合后,得到沉淀丙和滤液C;
④往滤液C中滴加氯化钡溶液,没有沉淀产生。
回答下列问题:
(1)步骤②中沉淀乙的化学式为__________。
(2)滤液C中除酚酞外,一定含有的溶质是________________________。
BaSO4
HNO3、Mg(NO3)2、NaNO3
9. 有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为____________________
__________________。
(2)白色沉淀C的化学式为________。
(3)这包白色固体是由______________(填化学式)组成的。
BaCO3+2HCl === BaCl2+H2O+CO2↑
CaCO3
BaCl2、Na2CO3
10. 取敞口放置的氢氧化钠溶液于烧杯中,倒入一定量的稀硫酸充分反应。为探究反应后所得溶液X的成分,兴趣小组进行了如下实验(所加试剂均足量):
(1)过滤中玻璃棒的作用是_____。
(2)产生的无色气体是_____。
(3)溶液X的溶质是
________________________。
(4)计算滤液A中氯化钠的质量。
(4)解:设硫酸钠与氯化钡反应生成的氯化钠的质量为x
BaCl2+Na2SO4=== BaSO4↓+2NaCl
233 117
4.66 g x
x=2.34 g
生成碳酸钡沉淀的质量为12.54 g-4.66 g=7.88 g
(1)引流
(2)CO2
(3)NaOH、Na2CO3、Na2SO4
设碳酸钠与氯化钡反应生成的氯化钠的质量为y
BaCl2+Na2CO3=== BaCO3↓+2NaCl
197 117
7.88g y
y=4.68 g
氯化钠的质量为2.34 g+4.68 g=7.02 g
答:滤液A中氯化钠的质量为7.02 g。
11.下列依据实验现象得出的结论错误的是( )
综合考查(杭州3考)
选项 实验操作与现象 实验结论
A 将1 g白磷、1 g红磷分别放入两支带塞的试管中,再将试管同时浸入约80 ℃的热水里,只有白磷燃烧 白磷的着火点比红
磷低
B 将二氧化碳通入紫色石蕊试液,试液变红 二氧化碳是一种酸
C 在常温常压下,硫在氧气中燃烧比在空气中燃烧更剧烈 该条件下,氧气的浓度越大,硫燃烧的越剧烈
D 将铁粉﹑硫粉按一定比例混合加热后,所得固体物质不能被磁铁吸引 铁粉已跟硫粉发生了化学反应
B
12. 下列依据实验目的所进行的操作,正确的是( )
选项 实验目的 操作
A 用氯酸钾和二氧化锰制取氧气后,回收其中的二氧化锰 将反应得到的混合物溶解后直接加热蒸发
B 用向上排空气法收集氧气时,检验氧气是否收集满 用带火星的木条伸入到集气瓶中,观察木条是否复燃
C 鉴别盐酸和硫酸 取样后滴加氯化钡溶液,观察是否变浑浊
D 比较铜和银的化学活动性顺序 将两种金属与等质量且同浓度的盐酸反应,观察产生气泡的快慢
C
13. 下列实验中,实验原理和主要操作方法都符合实验目的的是( )
实验目的 实验原理 主要操作方法
A 除去粗盐中的泥沙 各成分的溶解性差异 蒸发
B 分离水与酒精的混合物 各成分的密度差异 蒸馏
C 鉴别稀盐酸和稀硫酸 酸根离子的化学性质差异 加碳酸钠溶液,观察产生气泡
快慢
D 除去FeSO4、CuSO4混合溶液中的CuSO4 金属活动性差异 加过量铁粉,充分反应后过滤
D
物质的检验
1. 检验原则:根据物质的某一特性,用物理或
化学的方法来确定物质的组成。
2. 检验方法:
(1)根据物理性质:颜色、状态、气味、密度、
溶解性、熔点、沸点等。如物质间有明显的溶
解性差异、溶解时的吸放热现象、水溶液的颜色差异等。
(2)根据化学性质:根据物质间发生反应的现象,如火焰颜色、变色、生成沉淀、放出气体等。
3. 常见气体的检验
气体 检验方法 现象
O2 将带火星的木条伸入集气瓶中 木条________
H2 点燃,在火焰上方罩一个干燥的冷烧杯,燃烧后迅速倒转,加入澄清石灰水 产生淡蓝色火焰,烧杯内壁有水珠,澄清石灰水不变浑浊
CO 产生_____色火焰,澄清石灰水变浑浊
CO2 将气体通入澄清石灰水中 澄清石灰水_________
复燃
蓝
变浑浊
气体 检验方法 现象
水蒸气 通过无水硫酸铜粉末(白色) 白色粉末变______
NH3 将湿润的红色石蕊试纸放在试管口 红色石蕊试纸变____
HCl 通入稀硝酸酸化的硝酸银溶液中 有________生成
蓝
蓝
白色沉淀
4. 常见离子的检验
离子 检验方法 现象
H+(酸) 滴加紫色石蕊溶液 石蕊溶液变____
用pH试纸测pH pH_____7
加入锌粒等活泼金属 有气泡产生
加入Na2CO3等碳酸盐 有______产生
OH-(碱) 滴加紫色石蕊溶液 溶液变_____
滴加无色酚酞溶液 溶液变_____
用pH试纸测pH pH_____7
红
<
气泡
蓝
红
>
离子 检验方法 现象
OH-(碱) 滴入可溶性铜盐溶液,如CuSO4溶液 生成____色絮状沉淀
滴入可溶性铁盐溶液,如FeCl3溶液 生成______色沉淀
滴加钙盐或钡盐溶液,过滤,向滤渣中加入足量稀硝酸,将生成的气体通入澄清石灰水中 产生白色沉淀,加入稀硝酸后产生气泡,气体能使澄清石灰水________
蓝
红褐
变浑浊
离子 检验方法 现象
(铵盐) 加入碱溶液并微热,用湿润的红色石蕊试纸检验生成的气体 生成有刺激性气味的气体,湿润的红色石蕊试纸变_____
Cl- 先滴入AgNO3溶液,再滴加稀硝酸 产生____色沉淀,且沉淀不溶解
滴入稀盐酸,再滴入BaCl2溶液 开始无现象,滴入BaCl2溶液后产生________
滴入Ba(NO3)2溶液和稀硝酸 产生___色沉淀且沉淀不溶解
蓝
白
白色沉淀
白
1. 原理:用物理或化学的方法把几种物质区分开。
2. 鉴别方法
(1)物理方法:依据物质特殊的物理性质,如特殊颜色、气味、溶解现象、磁性等进行鉴别。
物质的鉴别
依据 举例
颜色 含Cu2+的溶液显____色、含Fe3+的溶液显____色、KMnO4固体为____色
气味 如SO2、NH3均有________气味
硬度 纯金属与该金属的合金互相刻画,有明显划痕的为纯金属,反之为合金
溶解性 CaCO3等难溶于水
特殊性质 铁粉具有磁性,可以被磁铁吸引
蓝
黄
暗紫
刺激性
(2)化学方法:借助试剂,通过反应现象进行鉴别
①利用指示剂或pH试纸进行鉴别
若几种溶液的酸碱性不同时,可选择适当的指示剂或pH试纸进行鉴别。
如:鉴别盐酸、NaCl溶液、NaOH溶液
思路分析:盐酸(酸性溶液)能使紫色石蕊溶液变___色,NaCl溶液(显中性)不能使紫色石蕊溶液变色,NaOH溶液(碱性溶液)能使紫色石蕊溶液变___色,所以可以选用紫色石蕊溶液来鉴别。
红
蓝
②根据发生复分解反应时的不同现象进行鉴别
常见的鉴别试剂有:稀硫酸、稀盐酸、Na2CO3溶液、CuSO4溶液、BaCl2 溶液、Ba(OH)2溶液、AgNO3溶液等,通过加入这些试剂,使反应呈现不同现象,如生成气体或沉淀等。
如:鉴别Na2CO3溶液和NaOH溶液
思路分析:由于Na2CO3溶液和NaOH溶液均显碱性,均能使无色酚酞溶液变红,使紫色石蕊溶液变蓝,故不能用酸碱指示剂进行鉴别,但Na2CO3溶液与稀盐酸反应有_________,NaOH溶液与稀盐酸反应无明显现象,故可用稀盐酸来鉴别这两种溶液。
气泡产生
3. 常见物质的鉴别
软水
硬水
天然
合成
一、物质的除杂
1. 基本原则
物质的除杂(含分离)
2. 常见物质的除杂
(1)气体的除杂
方法一:将杂质气体通过物质吸收、反应除去
物质 杂质 方法
H2 HCl、水蒸气 通过装有足量生石灰和烧碱混合固体的干燥管
H2 水蒸气 通过________
O2 CO CO2 浓硫酸
方法二:将杂质气体转化为主气体
物质 杂质 方法
CO2 HCl 通过饱和的____________溶液,再通过浓硫酸
CO2 CO 通过灼热的氧化铜
碳酸氢钠
(2)固体的除杂
①优先选择用水溶解、过滤、蒸发滤液的方法除杂。
②根据被提纯物质和杂质在性质上的差异选用气体或液体除杂试剂。
常见固体的除杂:
物质 杂质 方法
NaCl Na2CO3 加入适量____________,过滤、蒸发
Cu Fe 加入足量的________,过滤、洗涤、干燥
Cu CuO 加入足量的稀硫酸(或稀盐酸),过滤、洗涤、干燥
CuO Cu 在空气(或氧气流)中充分灼烧
Ca(OH)2 CaO 加入适量的水,蒸发
CaCO3 CaCl2 加水溶解,过滤、洗涤、干燥
CaCl2溶液
稀硫酸
(3)液体的除杂
液体之间的除杂,一般为酸、碱、盐之间的除杂,其实质为溶液中阴、阳离子的除杂。
方法:①对比两种物质,找出两种物质中含有的离子;
②根据各离子的化学性质,判断出杂质离子与非杂质离子,找出与杂质离子不共存且不引进新杂质的离子,确定除杂试剂。
如:除去NaCl中的Na2CO3
思路分析:
二、物质的分离
1. 原理:运用合理的物理或化学方法把混合物里的几种物质分开,得到各种成分的原来状态的过程。
2. 分离方法
(1)物理方法:
①过滤法:分离不溶于水的固体和液体(或可溶性固体与不溶性固体)组成的混合物,如分离二氧化锰和氯酸钾的固体混合物,操作如下:
②蒸馏法:分离沸点相差较大的液体混合物,如分离水和酒精的混合物、石油的分馏等。
③磁铁吸引法:分离具有铁磁性和不具有铁磁性的物质,如分离碳粉和铁粉。
(2)化学方法:针对使用物理方法不能分离的物质,可利用化学反应进行分离。如分离CuCl2固体和NaCl固体,操作如下:
同课章节目录
