电化学计算-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 电化学计算-高考化学考前专项练习试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 863.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 10:47:50 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
电化学计算
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)用NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A.标准状况下,1.12L 1H2和0.2g2H2均含有0.1NA个质子
B.1mol Na2CO3晶体中含有的CO32-数目一定为NA
C.常温常压下,92g NO2和N2O4的混合气体中含有的原子数为6NA
D.惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
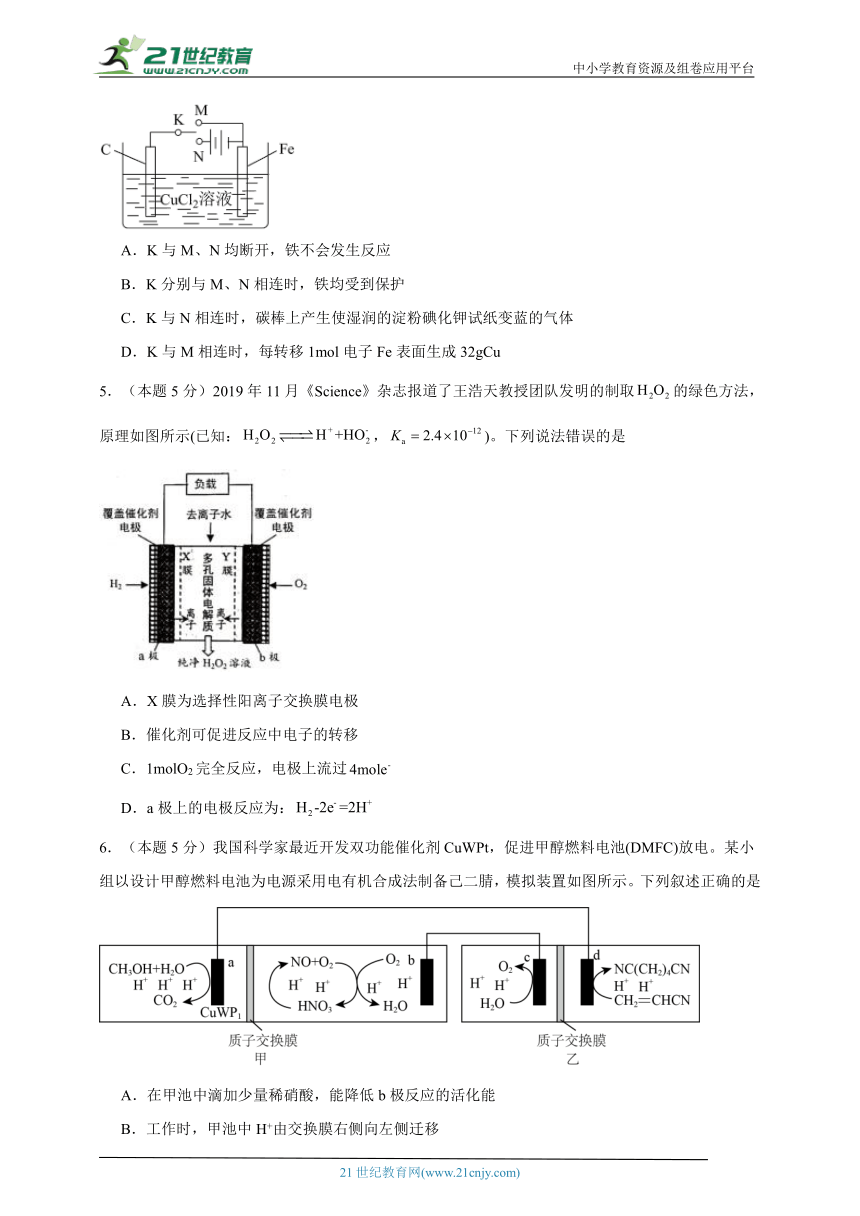
2.(本题5分)我国科学家设计的间接电化学氧化法可同时去除烟气中的SO2和NO2,原理如图。下列说法正确的是
A.通过质子交换膜向m电极移动
B.NO2发生的反应:
C.n电极的电极反应式:
D.若产生22.4 L H2(标准状况下),则气—液吸收柱中处理了64 g SO2
3.(本题5分)把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.6:3:2 B.6:3:1 C.1:2:3 D.3:2:1
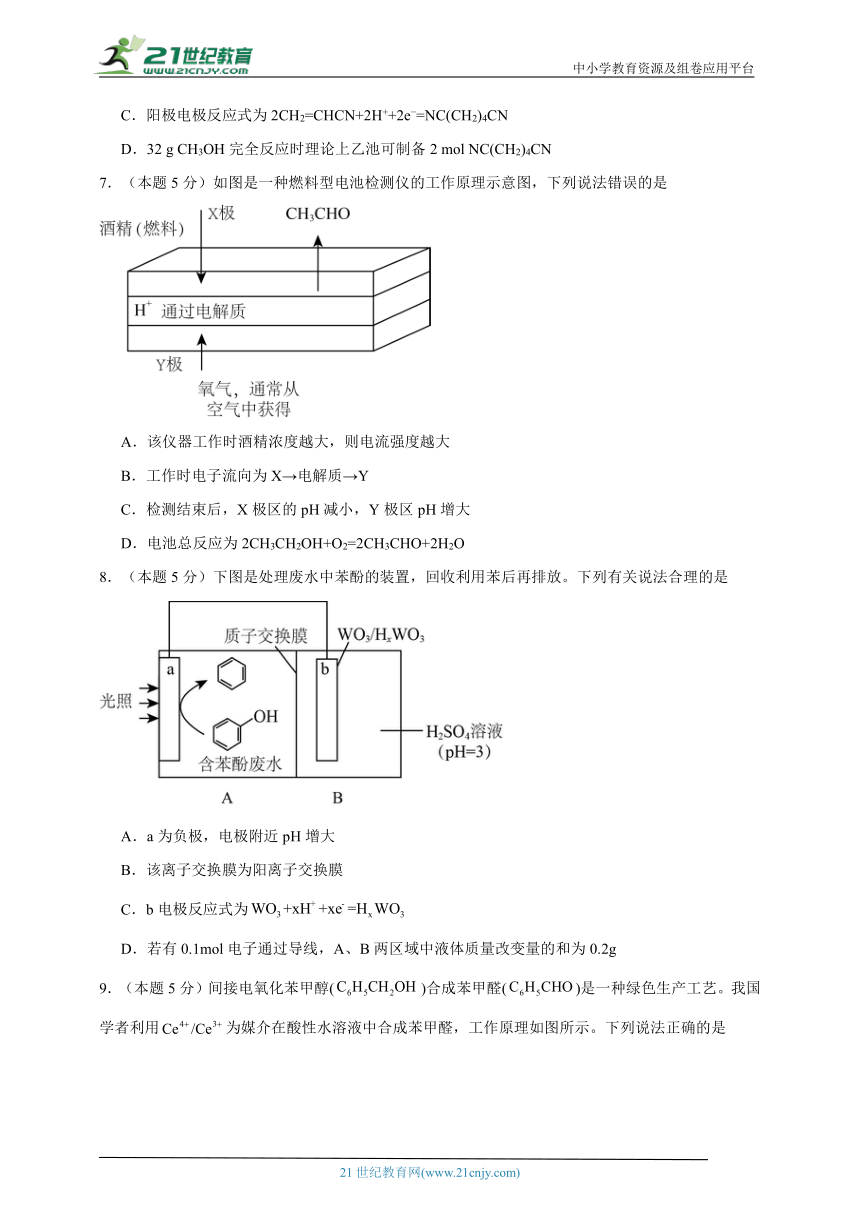
4.(本题5分)某学习小组为研究电化学原理,设计如图装置。下列叙述正确的是( )
A.K与M、N均断开,铁不会发生反应
B.K分别与M、N相连时,铁均受到保护
C.K与N相连时,碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
D.K与M相连时,每转移1mol电子Fe表面生成32gCu
5.(本题5分)2019年11月《Science》杂志报道了王浩天教授团队发明的制取的绿色方法,原理如图所示(已知:,)。下列说法错误的是
A.X膜为选择性阳离子交换膜电极
B.催化剂可促进反应中电子的转移
C.1molO2完全反应,电极上流过
D.a极上的电极反应为:
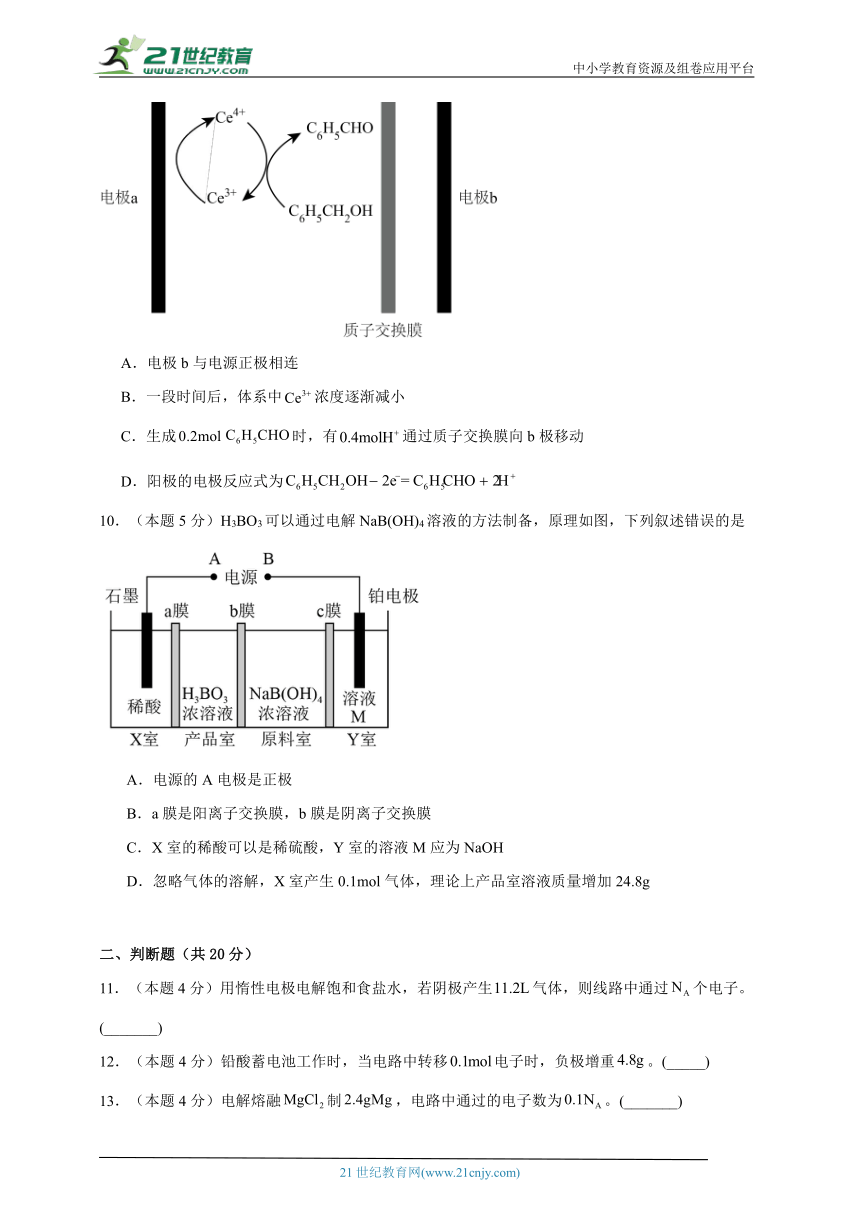
6.(本题5分)我国科学家最近开发双功能催化剂CuWPt,促进甲醇燃料电池(DMFC)放电。某小组以设计甲醇燃料电池为电源采用电有机合成法制备己二腈,模拟装置如图所示。下列叙述正确的是
A.在甲池中滴加少量稀硝酸,能降低b极反应的活化能
B.工作时,甲池中H+由交换膜右侧向左侧迁移
C.阳极电极反应式为2CH2=CHCN+2H++2e =NC(CH2)4CN
D.32 g CH3OH完全反应时理论上乙池可制备2 mol NC(CH2)4CN
7.(本题5分)如图是一种燃料型电池检测仪的工作原理示意图,下列说法错误的是
A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时电子流向为X→电解质→Y
C.检测结束后,X极区的pH减小,Y极区pH增大
D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O
8.(本题5分)下图是处理废水中苯酚的装置,回收利用苯后再排放。下列有关说法合理的是
A.a为负极,电极附近pH增大
B.该离子交换膜为阳离子交换膜
C.b电极反应式为
D.若有0.1mol电子通过导线,A、B两区域中液体质量改变量的和为0.2g
9.(本题5分)间接电氧化苯甲醇()合成苯甲醛()是一种绿色生产工艺。我国学者利用为媒介在酸性水溶液中合成苯甲醛,工作原理如图所示。下列说法正确的是
A.电极b与电源正极相连
B.一段时间后,体系中浓度逐渐减小
C.生成时,有通过质子交换膜向b极移动
D.阳极的电极反应式为
10.(本题5分)H3BO3可以通过电解NaB(OH)4溶液的方法制备,原理如图,下列叙述错误的是
A.电源的A电极是正极
B.a膜是阳离子交换膜,b膜是阴离子交换膜
C.X室的稀酸可以是稀硫酸,Y室的溶液M应为NaOH
D.忽略气体的溶解,X室产生0.1mol气体,理论上产品室溶液质量增加24.8g
二、判断题(共20分)
11.(本题4分)用惰性电极电解饱和食盐水,若阴极产生气体,则线路中通过个电子。(_______)
12.(本题4分)铅酸蓄电池工作时,当电路中转移电子时,负极增重。(_____)
13.(本题4分)电解熔融制,电路中通过的电子数为。(_______)
14.(本题4分)用惰性电极电解饱和食盐水,若线路中通过NA个电子,则阴极产生11.2 L气体
15.(本题4分)铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g。(_______)
三、解答题(共30分)
16.(本题10分)请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。
(1)A极发生的电极反应式是 ,
B极发生的电极反应式是 。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接 、 接 ;B接 、 接 。
(3)证明产物中有Cl2的实验现象是 。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为: 。
17.(本题10分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)石墨电极(C)作 极,甲中甲烷燃料电池的负极反应式为 。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为 L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是___________(填字母)。
A.a电极为纯铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为 。
(5)以铅蓄电池为电源,Pb+PbO2+2H2SO42PbSO4+2H2O,铅蓄电池放电时,负极反应式为 。
18.(本题10分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为 L ,丙装置中阴极析出铜的质量为 g;
(4)某同学利用甲烷燃料电池设计电解法制取Fe(OH)2的实验装置(如图所示),用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用 作电极。
参考答案:
1.D
【详解】A.标准状况下,1.12L1H2的物质的量为0.05mol,而0.2g2H2的物质的量也为0.05mol,而1H2和2H2中质子数均为2个,故0.05mol1H2和2H2均含0.1mol质子即0.1NA个,故A正确;B.碳酸钠由钠离子和碳酸根离子构成,1mol Na2CO3晶体中含CO32-数目一定为NA,故B正确;C.NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中所含原子数=×3×NA=6NA ,故C正确;D.惰性电极电解食盐水,阳极电极反应为2Cl--2e-=Cl2↑,若电路中通过NA个电子,物质的量为1mol,则阳极产生气体0.5mol,不一定是标准状况,气体体积不一定是11.2L,故D错误;故答案为D。
2.B
【分析】由图可知,H+在n电极得到电子,变为H2,n为阴极,电极反应式为,Ce3+在m电极失去电子变为Ce4+,m为阳极, SO2、NO2被Ce4+氧化为、从而被除去。
【详解】A.m为阳极,H+通过质子交换膜向阴极(电极n)移动,故A错误;
B.NO2被Ce4+氧化为,离子方程式为:,故B正确;
C.n为阴极,电极反应式为,故C错误;
D.n极电极反应式为:,若产生22.4 L H2(标准状况下),转移电子数为2mol,SO2被Ce4+氧化为,反应的离子方程式为:,当转移2mol电子时,消耗1molSO2,质量为64g,但实际上SO2、NO2同时与Ce4+反应,因此处理的SO2小于64 g,故D错误;
故选B。
3.A
【详解】三个电解槽串联,则转移的电子数相等,设均转移6mole-,由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,则6e-~6K~3Mg~2Al,所以析出钾、镁、铝的物质的量之比为6:3:2,故选A。
4.C
【分析】K与M、N均断开,发生的是化学腐蚀,铁和氯化铜反应生成铜;K与M相连形成原电池,铁做负极被腐蚀,K与N相连时形成电解池,铁做阴极被保护;以此解答。
【详解】A.K与M、N均断开,发生的是化学腐蚀,铁和氯化铜反应生成铜,离子方程式为:Fe+Cu2+=Cu+Fe2+,故A错误;
B.K与M相连形成原电池,铁做负极被腐蚀,K与N相连时形成电解池,铁做阴极被保护,故B错误;
C.K与N相连时形成电解池,碳棒是阳极,溶液中氯离子失电子生成氯气,2Cl 2e =Cl2↑,氯气和碘化钾反应生成碘单质,使湿润的淀粉碘化钾试纸变蓝,故C正确;
D.K与M相连时,铁做原电池负极失电子生成亚铁离子,碳棒上是溶液中的铜离子得到电子析出铜,则铜不会在铁表面析出,故D错误;
故选C。
5.C
【分析】由图示可知左边a电极通入氢气为负极,被氧化生成氢离子,电极方程式为:,氢离子经过X膜进入多孔固体电解质中,则X膜为选择性阳离子交换膜,右边b电极通入氧气为正极,被还原生成,反应为O2+2e-+H2O=OH-+,和OH-经过Y膜进入多孔固体电解质中,则Y膜为选择性阴离子交换膜,总反应为:H2+O2=H2O2,据此进行回答。
【详解】A.结合以上分析可知,X膜为选择性阳离子交换膜电极,故A正确;
B.催化剂可以加快反应速率,可以促进反应中电子的转移,故B正确;
C.根据总反应H2+O2=H2O2可知,消耗1mol氧气,转移电子2mol,所以1molO2完全反应,电极上流过,故C错误;
D.结合以上分析可知,a极上的电极反应为:,故D正确;
故选C。
6.A
【分析】根据题意可知,左侧为甲醇燃料电池,冲入甲醇的一极为负极,即a电极为负极,b电极为正极;右侧为电解池,e与电源正极相连,为阳极,d与电源负极相连,为阴极。
【详解】A.观察图示中反应可知,硝酸作催化剂,促进正极反应,A项正确;
B.甲池是原电池,放电时氢离子向正极迁移,即氢离子向b极迁移,B项错误;
C.e极为阳极,阳极反应式为2H2O 4e =4H++O2↑,d极为阴极,阴极反应式为2CH2=CHCN+2H++2e =NC(CH2)4CN,C项错误;
D.32gCH3OH的物质的量为1mol,甲池中负极反应式为CH3OH+H2O 6e =CO2↑+6H+,n(CH3OH)=1mol,则n(e )=6mol,根据d电极反应可知,理论上消耗1 mol CH3OH可制备3 mol NC(CH2)4CN,D项错误;
综上所述答案为A。
7.B
【分析】燃料电池中酒精通入的X极是负极,发生氧化反应生成乙醛;氧气通入的Y极是正极,发生还原反应,与从负极过来的H+结合生成H2O。
【详解】A.该仪器工作时酒精浓度越大,单位时间内参与氧化反应的乙醇越多,转移电子数越多,则电流强度越大,A正确;
B.电子在电极与外电路移动,电解质内没有电子通过,工作时电子流向为X→外电路→Y,B错误;
C.据分析,检测结束后,X极区是酒精失去电子生成乙醛和氢离子,溶液pH减小,Y极区是氧气得到电子结合H+,pH增大,C正确;
D.据分析,电池总反应是酒精与氧气的反应,反应方程式为2CH3CH2OH+O2→2CH3CHO+2H2O,D正确;
故选B。
8.B
【详解】A.a极为苯酚C6H6O变为C6H6,碳原子的化合价由价变为价,化合价降低,得到电子,a极为正极,电极反应式为:,电极附近pH增大,A错误;
B.自由移动的离子为,阳离子向正极移动,则离子交换膜为阳离子交换膜,从右向左移动,B项正确;
C.b电极为负极,失电子发生氧化反应,电极反应式为:,C项错误;
D.由电极反应可知:系统中没有气体逸出也没有固体析出,根据质量守恒定律,液体质量应该保持不变的,D项错误;
答案选B。
9.C
【详解】A.a电极上,发生氧化反应,电极a为阳极,则电极b为阴极,电极a
与电源正极相连,电极b与电源负极相连,故A错误;
B.阳极上放电生成,溶液中又还原生成,阴极上相当于2+2++2H+产生的氢离子放电,体系中浓度不变,故B错误;
C.由2+2++2H+可知,生成0.2mol时转移电子为0.4mol,则有通过质子交换膜向阴极极移动,故C正确;
D.阳极的电极反应式为,故D错误;
故选:C。
10.D
【分析】从图中可以看出,原料室中的通过b膜进入产品室,则X室中的H+通过a膜进入产品室;原料室中的Na+通过c膜进入Y室,则石墨电极为阳极,铂电极为阴极。
【详解】A.由分析可知,石墨电极为阳极,则与石墨电极相连的电源的A电极是正极,A正确;
B.由分析可知,H+通过a膜,则a膜是阳离子交换膜,通过b膜,则b膜是阴离子交换膜,B正确;
C.在X室,H2O失电子生成O2和H+,则稀酸可以是稀硫酸,在Y室,H2O得电子生成H2和OH-,原料室中的Na+通过c膜进入Y室,则溶液M应为NaOH,C正确;
D.忽略气体的溶解,X室产生0.1mol气体(O2),则转移电子为0.4mol,有0.4molH+进入产品室,发生反应H++=H3BO3+H2O,理论上产品室溶液质量增加0.4mol×(62+18)=32g,D错误;
故选D。
11.错误
【详解】进行气体体积计算时必须指明标况,题中没有指明,故说法错误。
12.正确
【详解】负极反应式为:Pb+SO-2e-=PbSO4,负极增重的质量为硫酸根离子的质量,电路中转移0.1mol电子,负极增重=4.8g,正确。
13.错误
【详解】电解熔融MgCl2过程中,1mol镁离子得2mol电子生成1molMg,想要制2.4gMg,可知n(Mg)0.1mol,则电路中通过的电子数为0.1mol×2×NA mol-1=0.2NA,故错误。
14.错误
【详解】用惰性电极电解饱和食盐水,阴极电极反应式为2H++2e-=H2↑,当线路中通过NA个电子时,生成0.5mol氢气,但题目未说明是标准状况下,则气体的体积不确定,故错。
15.错误
【详解】由铅蓄电池负极反应:Pb+-2e =PbSO4↓,知反应后负极由Pb转化为PbSO4,增加质量,由电极反应得关系式:Pb~PbSO4~2e-~△m=96 g,知电路通过2 mol电子,负极质量增加96 g,题干说法错误。
16. 2H++2e-=H2↑ 2Cl--2e-= Cl2↑ G F H D E C 淀粉碘化钾溶液变蓝色 0.08m0l/L
【分析】根据电解原理,判断电极材料的阴阳极,根据氢气和氯气的性质判断仪器的连接顺序,根据化学反应方程式和c=n/V计算浓度。
【详解】(1)A电极材料是铁,铁是活泼金属,B电极材料是碳棒,属于惰性电极,所以电解饱和食盐水时,铁做阴极与电源的负极相连,发生还原反应,其电极反应式为:2H++2e-=H2↑;碳棒端做阳极和电源的正极相连,发生氧化反应,其电极反应式为:2Cl--2e-= Cl 2↑答案:2H++2e-=H2↑;2Cl--2e-= Cl2↑;
(2)A极上产生的是氢气,密度比空气小,用排水法收集氢气,短导管为进气管,长导管为出水管,所以连接顺序为A→G→F;因为收集的氢气体积大于25mL,,所以要用100mL的量筒收集水,所以F连接H;B极上产生的气体是氯气,要检验氯气,可通过淀粉碘化钾溶液检验,氯气有强氧化性,能和碘化钾反应生成碘,碘遇淀粉变蓝色,氯气的密度大于空气,,所以长导管为进气管,短导管为出气管;氯气有毒不能直接排空污染大气,且氯气和碱反应生成无毒物质,所以可用碱液吸收多余的氯气,所以连接顺序为B→D→E→C;因此,本题正确答案是: G 、F H ; D E C 。
(3)因为Cl2+KI=I2+2KCl,碘遇淀粉变蓝色,所以观察到的现象是:淀粉碘化钾溶液变蓝色;因此,本题正确答案是:淀粉碘化钾溶液变蓝色.。
(4)2NaCl+2H2O=Cl2↑ + H2↑ + 2NaOH
22.4L 2mol
0.0448L 0.004mol
c=n/V=0.004mol /0.05Ll=0.08m0l/L
因此,本题正确答案是: 0.08m0l/L。
17.(1) 阳 CH4-8e-+10OH-=CO+7H2O
(2)4.48L
(3)AD
(4)2Al-6e-+3H2O=Al2O3+6H+
(5)Pb+SO-2e-=PbSO4
【详解】(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,则乙池中铁为阴极,C为阳极;负极上失电子发生氧化反应,电极反应式为: 。
(2)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量为,乙装置中铁电极上氢离子放电生成氢气,每生成1mol氢气转移2mol电子,转移0.4mol电子会生成0.2mol氢气,即标准状况下4.48L,故答案为4.48;
(3)电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应;电解时,溶液中的阳离子发生变化,铜离子浓度逐渐减小,锌离子等浓度逐渐增大;粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近,故答案为AD;
(4)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,该溶液为酸性溶液,且能使铝表面生成一层致密的氧化膜,该氧化膜为,所以该电极反应式为为。
(5)铅蓄电池放电时负极发生氧化反应失去电子,Pb作负极失去电子变成,但溶液中有硫酸根,会生成难溶物硫酸铅,所以负极反应式为:
18. CH4-8e-+10OH-=CO32-+7H2O 2Cl--2e-=Cl2↑ 4.48L 12.8 铁
【详解】试题分析:(1)甲烷燃料电池,甲烷在负极反应,方程式:CH4-8e-+10OH-=CO32-+7H2O。
(2)甲中氧气一极为正极,甲烷一极为负极,故乙中铁极为阴极,石墨为阳极,反应:2Cl--2e-=Cl2。
(3)标准状况下,2.24 L氧气物质的量=0.1mol,转移电子0.4mol,铁极反应:2H++2e-=H2,故生成0.2mol氢气,体积=0.2×22.4=4.48L;据转移电子相等,丙中阴极反应:Cu2++2e-=Cu,析出铜物质的量是0.2mol,质量=0.2×56=12.8g。
(4)为生成二价铁,阳极需用铁作电极。
考点:考查电解池和原电池
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
电化学计算
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)用NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A.标准状况下,1.12L 1H2和0.2g2H2均含有0.1NA个质子
B.1mol Na2CO3晶体中含有的CO32-数目一定为NA
C.常温常压下,92g NO2和N2O4的混合气体中含有的原子数为6NA
D.惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
2.(本题5分)我国科学家设计的间接电化学氧化法可同时去除烟气中的SO2和NO2,原理如图。下列说法正确的是
A.通过质子交换膜向m电极移动
B.NO2发生的反应:
C.n电极的电极反应式:
D.若产生22.4 L H2(标准状况下),则气—液吸收柱中处理了64 g SO2
3.(本题5分)把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.6:3:2 B.6:3:1 C.1:2:3 D.3:2:1
4.(本题5分)某学习小组为研究电化学原理,设计如图装置。下列叙述正确的是( )
A.K与M、N均断开,铁不会发生反应
B.K分别与M、N相连时,铁均受到保护
C.K与N相连时,碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
D.K与M相连时,每转移1mol电子Fe表面生成32gCu
5.(本题5分)2019年11月《Science》杂志报道了王浩天教授团队发明的制取的绿色方法,原理如图所示(已知:,)。下列说法错误的是
A.X膜为选择性阳离子交换膜电极
B.催化剂可促进反应中电子的转移
C.1molO2完全反应,电极上流过
D.a极上的电极反应为:
6.(本题5分)我国科学家最近开发双功能催化剂CuWPt,促进甲醇燃料电池(DMFC)放电。某小组以设计甲醇燃料电池为电源采用电有机合成法制备己二腈,模拟装置如图所示。下列叙述正确的是
A.在甲池中滴加少量稀硝酸,能降低b极反应的活化能
B.工作时,甲池中H+由交换膜右侧向左侧迁移
C.阳极电极反应式为2CH2=CHCN+2H++2e =NC(CH2)4CN
D.32 g CH3OH完全反应时理论上乙池可制备2 mol NC(CH2)4CN
7.(本题5分)如图是一种燃料型电池检测仪的工作原理示意图,下列说法错误的是
A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时电子流向为X→电解质→Y
C.检测结束后,X极区的pH减小,Y极区pH增大
D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O
8.(本题5分)下图是处理废水中苯酚的装置,回收利用苯后再排放。下列有关说法合理的是
A.a为负极,电极附近pH增大
B.该离子交换膜为阳离子交换膜
C.b电极反应式为
D.若有0.1mol电子通过导线,A、B两区域中液体质量改变量的和为0.2g
9.(本题5分)间接电氧化苯甲醇()合成苯甲醛()是一种绿色生产工艺。我国学者利用为媒介在酸性水溶液中合成苯甲醛,工作原理如图所示。下列说法正确的是
A.电极b与电源正极相连
B.一段时间后,体系中浓度逐渐减小
C.生成时,有通过质子交换膜向b极移动
D.阳极的电极反应式为
10.(本题5分)H3BO3可以通过电解NaB(OH)4溶液的方法制备,原理如图,下列叙述错误的是
A.电源的A电极是正极
B.a膜是阳离子交换膜,b膜是阴离子交换膜
C.X室的稀酸可以是稀硫酸,Y室的溶液M应为NaOH
D.忽略气体的溶解,X室产生0.1mol气体,理论上产品室溶液质量增加24.8g
二、判断题(共20分)
11.(本题4分)用惰性电极电解饱和食盐水,若阴极产生气体,则线路中通过个电子。(_______)
12.(本题4分)铅酸蓄电池工作时,当电路中转移电子时,负极增重。(_____)
13.(本题4分)电解熔融制,电路中通过的电子数为。(_______)
14.(本题4分)用惰性电极电解饱和食盐水,若线路中通过NA个电子,则阴极产生11.2 L气体
15.(本题4分)铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g。(_______)
三、解答题(共30分)
16.(本题10分)请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。
(1)A极发生的电极反应式是 ,
B极发生的电极反应式是 。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接 、 接 ;B接 、 接 。
(3)证明产物中有Cl2的实验现象是 。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为: 。
17.(本题10分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)石墨电极(C)作 极,甲中甲烷燃料电池的负极反应式为 。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为 L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是___________(填字母)。
A.a电极为纯铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为 。
(5)以铅蓄电池为电源,Pb+PbO2+2H2SO42PbSO4+2H2O,铅蓄电池放电时,负极反应式为 。
18.(本题10分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为 L ,丙装置中阴极析出铜的质量为 g;
(4)某同学利用甲烷燃料电池设计电解法制取Fe(OH)2的实验装置(如图所示),用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用 作电极。
参考答案:
1.D
【详解】A.标准状况下,1.12L1H2的物质的量为0.05mol,而0.2g2H2的物质的量也为0.05mol,而1H2和2H2中质子数均为2个,故0.05mol1H2和2H2均含0.1mol质子即0.1NA个,故A正确;B.碳酸钠由钠离子和碳酸根离子构成,1mol Na2CO3晶体中含CO32-数目一定为NA,故B正确;C.NO2和N2O4混合气体最简式相同为NO2,计算92gNO2中所含原子数=×3×NA=6NA ,故C正确;D.惰性电极电解食盐水,阳极电极反应为2Cl--2e-=Cl2↑,若电路中通过NA个电子,物质的量为1mol,则阳极产生气体0.5mol,不一定是标准状况,气体体积不一定是11.2L,故D错误;故答案为D。
2.B
【分析】由图可知,H+在n电极得到电子,变为H2,n为阴极,电极反应式为,Ce3+在m电极失去电子变为Ce4+,m为阳极, SO2、NO2被Ce4+氧化为、从而被除去。
【详解】A.m为阳极,H+通过质子交换膜向阴极(电极n)移动,故A错误;
B.NO2被Ce4+氧化为,离子方程式为:,故B正确;
C.n为阴极,电极反应式为,故C错误;
D.n极电极反应式为:,若产生22.4 L H2(标准状况下),转移电子数为2mol,SO2被Ce4+氧化为,反应的离子方程式为:,当转移2mol电子时,消耗1molSO2,质量为64g,但实际上SO2、NO2同时与Ce4+反应,因此处理的SO2小于64 g,故D错误;
故选B。
3.A
【详解】三个电解槽串联,则转移的电子数相等,设均转移6mole-,由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,则6e-~6K~3Mg~2Al,所以析出钾、镁、铝的物质的量之比为6:3:2,故选A。
4.C
【分析】K与M、N均断开,发生的是化学腐蚀,铁和氯化铜反应生成铜;K与M相连形成原电池,铁做负极被腐蚀,K与N相连时形成电解池,铁做阴极被保护;以此解答。
【详解】A.K与M、N均断开,发生的是化学腐蚀,铁和氯化铜反应生成铜,离子方程式为:Fe+Cu2+=Cu+Fe2+,故A错误;
B.K与M相连形成原电池,铁做负极被腐蚀,K与N相连时形成电解池,铁做阴极被保护,故B错误;
C.K与N相连时形成电解池,碳棒是阳极,溶液中氯离子失电子生成氯气,2Cl 2e =Cl2↑,氯气和碘化钾反应生成碘单质,使湿润的淀粉碘化钾试纸变蓝,故C正确;
D.K与M相连时,铁做原电池负极失电子生成亚铁离子,碳棒上是溶液中的铜离子得到电子析出铜,则铜不会在铁表面析出,故D错误;
故选C。
5.C
【分析】由图示可知左边a电极通入氢气为负极,被氧化生成氢离子,电极方程式为:,氢离子经过X膜进入多孔固体电解质中,则X膜为选择性阳离子交换膜,右边b电极通入氧气为正极,被还原生成,反应为O2+2e-+H2O=OH-+,和OH-经过Y膜进入多孔固体电解质中,则Y膜为选择性阴离子交换膜,总反应为:H2+O2=H2O2,据此进行回答。
【详解】A.结合以上分析可知,X膜为选择性阳离子交换膜电极,故A正确;
B.催化剂可以加快反应速率,可以促进反应中电子的转移,故B正确;
C.根据总反应H2+O2=H2O2可知,消耗1mol氧气,转移电子2mol,所以1molO2完全反应,电极上流过,故C错误;
D.结合以上分析可知,a极上的电极反应为:,故D正确;
故选C。
6.A
【分析】根据题意可知,左侧为甲醇燃料电池,冲入甲醇的一极为负极,即a电极为负极,b电极为正极;右侧为电解池,e与电源正极相连,为阳极,d与电源负极相连,为阴极。
【详解】A.观察图示中反应可知,硝酸作催化剂,促进正极反应,A项正确;
B.甲池是原电池,放电时氢离子向正极迁移,即氢离子向b极迁移,B项错误;
C.e极为阳极,阳极反应式为2H2O 4e =4H++O2↑,d极为阴极,阴极反应式为2CH2=CHCN+2H++2e =NC(CH2)4CN,C项错误;
D.32gCH3OH的物质的量为1mol,甲池中负极反应式为CH3OH+H2O 6e =CO2↑+6H+,n(CH3OH)=1mol,则n(e )=6mol,根据d电极反应可知,理论上消耗1 mol CH3OH可制备3 mol NC(CH2)4CN,D项错误;
综上所述答案为A。
7.B
【分析】燃料电池中酒精通入的X极是负极,发生氧化反应生成乙醛;氧气通入的Y极是正极,发生还原反应,与从负极过来的H+结合生成H2O。
【详解】A.该仪器工作时酒精浓度越大,单位时间内参与氧化反应的乙醇越多,转移电子数越多,则电流强度越大,A正确;
B.电子在电极与外电路移动,电解质内没有电子通过,工作时电子流向为X→外电路→Y,B错误;
C.据分析,检测结束后,X极区是酒精失去电子生成乙醛和氢离子,溶液pH减小,Y极区是氧气得到电子结合H+,pH增大,C正确;
D.据分析,电池总反应是酒精与氧气的反应,反应方程式为2CH3CH2OH+O2→2CH3CHO+2H2O,D正确;
故选B。
8.B
【详解】A.a极为苯酚C6H6O变为C6H6,碳原子的化合价由价变为价,化合价降低,得到电子,a极为正极,电极反应式为:,电极附近pH增大,A错误;
B.自由移动的离子为,阳离子向正极移动,则离子交换膜为阳离子交换膜,从右向左移动,B项正确;
C.b电极为负极,失电子发生氧化反应,电极反应式为:,C项错误;
D.由电极反应可知:系统中没有气体逸出也没有固体析出,根据质量守恒定律,液体质量应该保持不变的,D项错误;
答案选B。
9.C
【详解】A.a电极上,发生氧化反应,电极a为阳极,则电极b为阴极,电极a
与电源正极相连,电极b与电源负极相连,故A错误;
B.阳极上放电生成,溶液中又还原生成,阴极上相当于2+2++2H+产生的氢离子放电,体系中浓度不变,故B错误;
C.由2+2++2H+可知,生成0.2mol时转移电子为0.4mol,则有通过质子交换膜向阴极极移动,故C正确;
D.阳极的电极反应式为,故D错误;
故选:C。
10.D
【分析】从图中可以看出,原料室中的通过b膜进入产品室,则X室中的H+通过a膜进入产品室;原料室中的Na+通过c膜进入Y室,则石墨电极为阳极,铂电极为阴极。
【详解】A.由分析可知,石墨电极为阳极,则与石墨电极相连的电源的A电极是正极,A正确;
B.由分析可知,H+通过a膜,则a膜是阳离子交换膜,通过b膜,则b膜是阴离子交换膜,B正确;
C.在X室,H2O失电子生成O2和H+,则稀酸可以是稀硫酸,在Y室,H2O得电子生成H2和OH-,原料室中的Na+通过c膜进入Y室,则溶液M应为NaOH,C正确;
D.忽略气体的溶解,X室产生0.1mol气体(O2),则转移电子为0.4mol,有0.4molH+进入产品室,发生反应H++=H3BO3+H2O,理论上产品室溶液质量增加0.4mol×(62+18)=32g,D错误;
故选D。
11.错误
【详解】进行气体体积计算时必须指明标况,题中没有指明,故说法错误。
12.正确
【详解】负极反应式为:Pb+SO-2e-=PbSO4,负极增重的质量为硫酸根离子的质量,电路中转移0.1mol电子,负极增重=4.8g,正确。
13.错误
【详解】电解熔融MgCl2过程中,1mol镁离子得2mol电子生成1molMg,想要制2.4gMg,可知n(Mg)0.1mol,则电路中通过的电子数为0.1mol×2×NA mol-1=0.2NA,故错误。
14.错误
【详解】用惰性电极电解饱和食盐水,阴极电极反应式为2H++2e-=H2↑,当线路中通过NA个电子时,生成0.5mol氢气,但题目未说明是标准状况下,则气体的体积不确定,故错。
15.错误
【详解】由铅蓄电池负极反应:Pb+-2e =PbSO4↓,知反应后负极由Pb转化为PbSO4,增加质量,由电极反应得关系式:Pb~PbSO4~2e-~△m=96 g,知电路通过2 mol电子,负极质量增加96 g,题干说法错误。
16. 2H++2e-=H2↑ 2Cl--2e-= Cl2↑ G F H D E C 淀粉碘化钾溶液变蓝色 0.08m0l/L
【分析】根据电解原理,判断电极材料的阴阳极,根据氢气和氯气的性质判断仪器的连接顺序,根据化学反应方程式和c=n/V计算浓度。
【详解】(1)A电极材料是铁,铁是活泼金属,B电极材料是碳棒,属于惰性电极,所以电解饱和食盐水时,铁做阴极与电源的负极相连,发生还原反应,其电极反应式为:2H++2e-=H2↑;碳棒端做阳极和电源的正极相连,发生氧化反应,其电极反应式为:2Cl--2e-= Cl 2↑答案:2H++2e-=H2↑;2Cl--2e-= Cl2↑;
(2)A极上产生的是氢气,密度比空气小,用排水法收集氢气,短导管为进气管,长导管为出水管,所以连接顺序为A→G→F;因为收集的氢气体积大于25mL,,所以要用100mL的量筒收集水,所以F连接H;B极上产生的气体是氯气,要检验氯气,可通过淀粉碘化钾溶液检验,氯气有强氧化性,能和碘化钾反应生成碘,碘遇淀粉变蓝色,氯气的密度大于空气,,所以长导管为进气管,短导管为出气管;氯气有毒不能直接排空污染大气,且氯气和碱反应生成无毒物质,所以可用碱液吸收多余的氯气,所以连接顺序为B→D→E→C;因此,本题正确答案是: G 、F H ; D E C 。
(3)因为Cl2+KI=I2+2KCl,碘遇淀粉变蓝色,所以观察到的现象是:淀粉碘化钾溶液变蓝色;因此,本题正确答案是:淀粉碘化钾溶液变蓝色.。
(4)2NaCl+2H2O=Cl2↑ + H2↑ + 2NaOH
22.4L 2mol
0.0448L 0.004mol
c=n/V=0.004mol /0.05Ll=0.08m0l/L
因此,本题正确答案是: 0.08m0l/L。
17.(1) 阳 CH4-8e-+10OH-=CO+7H2O
(2)4.48L
(3)AD
(4)2Al-6e-+3H2O=Al2O3+6H+
(5)Pb+SO-2e-=PbSO4
【详解】(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,则乙池中铁为阴极,C为阳极;负极上失电子发生氧化反应,电极反应式为: 。
(2)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量为,乙装置中铁电极上氢离子放电生成氢气,每生成1mol氢气转移2mol电子,转移0.4mol电子会生成0.2mol氢气,即标准状况下4.48L,故答案为4.48;
(3)电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应;电解时,溶液中的阳离子发生变化,铜离子浓度逐渐减小,锌离子等浓度逐渐增大;粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近,故答案为AD;
(4)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,该溶液为酸性溶液,且能使铝表面生成一层致密的氧化膜,该氧化膜为,所以该电极反应式为为。
(5)铅蓄电池放电时负极发生氧化反应失去电子,Pb作负极失去电子变成,但溶液中有硫酸根,会生成难溶物硫酸铅,所以负极反应式为:
18. CH4-8e-+10OH-=CO32-+7H2O 2Cl--2e-=Cl2↑ 4.48L 12.8 铁
【详解】试题分析:(1)甲烷燃料电池,甲烷在负极反应,方程式:CH4-8e-+10OH-=CO32-+7H2O。
(2)甲中氧气一极为正极,甲烷一极为负极,故乙中铁极为阴极,石墨为阳极,反应:2Cl--2e-=Cl2。
(3)标准状况下,2.24 L氧气物质的量=0.1mol,转移电子0.4mol,铁极反应:2H++2e-=H2,故生成0.2mol氢气,体积=0.2×22.4=4.48L;据转移电子相等,丙中阴极反应:Cu2++2e-=Cu,析出铜物质的量是0.2mol,质量=0.2×56=12.8g。
(4)为生成二价铁,阳极需用铁作电极。
考点:考查电解池和原电池
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
