反应热-高考化学考前专项练习试题(含解析)
文档属性
| 名称 | 反应热-高考化学考前专项练习试题(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 908.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-13 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
反应热
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)杭州亚运会运用了多项高科技,下列有关说法正确的是
A.5G高速通信技术所用光纤的成分为两性氧化物
B.亚运会所用无人机的电源工作时,将电能转化为化学能
C.游泳池水消毒所用的具有强氧化性
D.“数字烟花”的原理与焰色试验相同
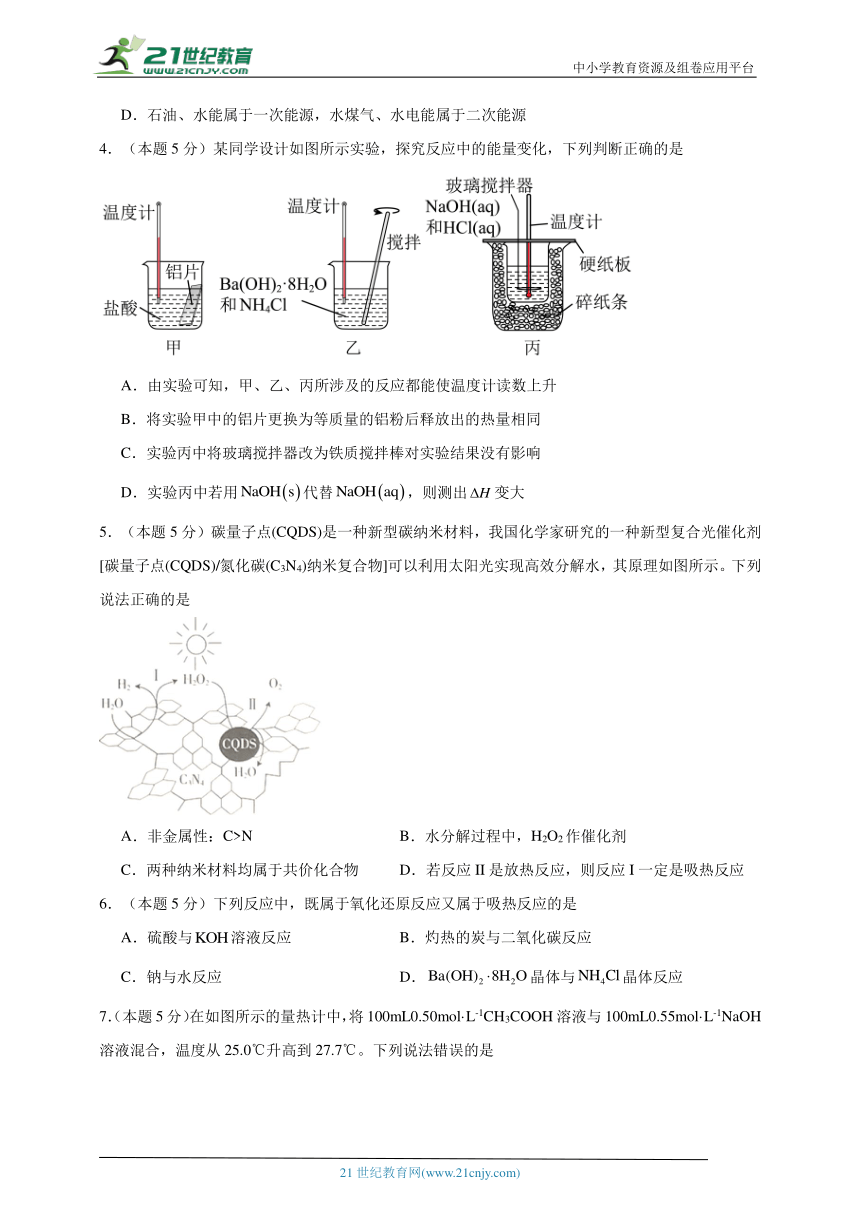
2.(本题5分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。(提示:原子利用率=目标生成物的质量/参加反应的所有反应物的质量×100%),下列说法正确的是
A.①→②吸收能量并形成了C―C键
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.该催化剂可有效提高反应物的平衡转化率
D.生成CH3COOH总反应的原子利用率小于100%
3.(本题5分)化学与人类生活、社会可持续发展密切相关,下列说法正确的是
A.天然气与沼气都属于不可再生能源
B.地热能、风能、天然气和氢能都属于新能源
C.人们可以把放热反应释放的能量转化为其他可利用的能量,而吸热反应没有利用价值
D.石油、水能属于一次能源,水煤气、水电能属于二次能源
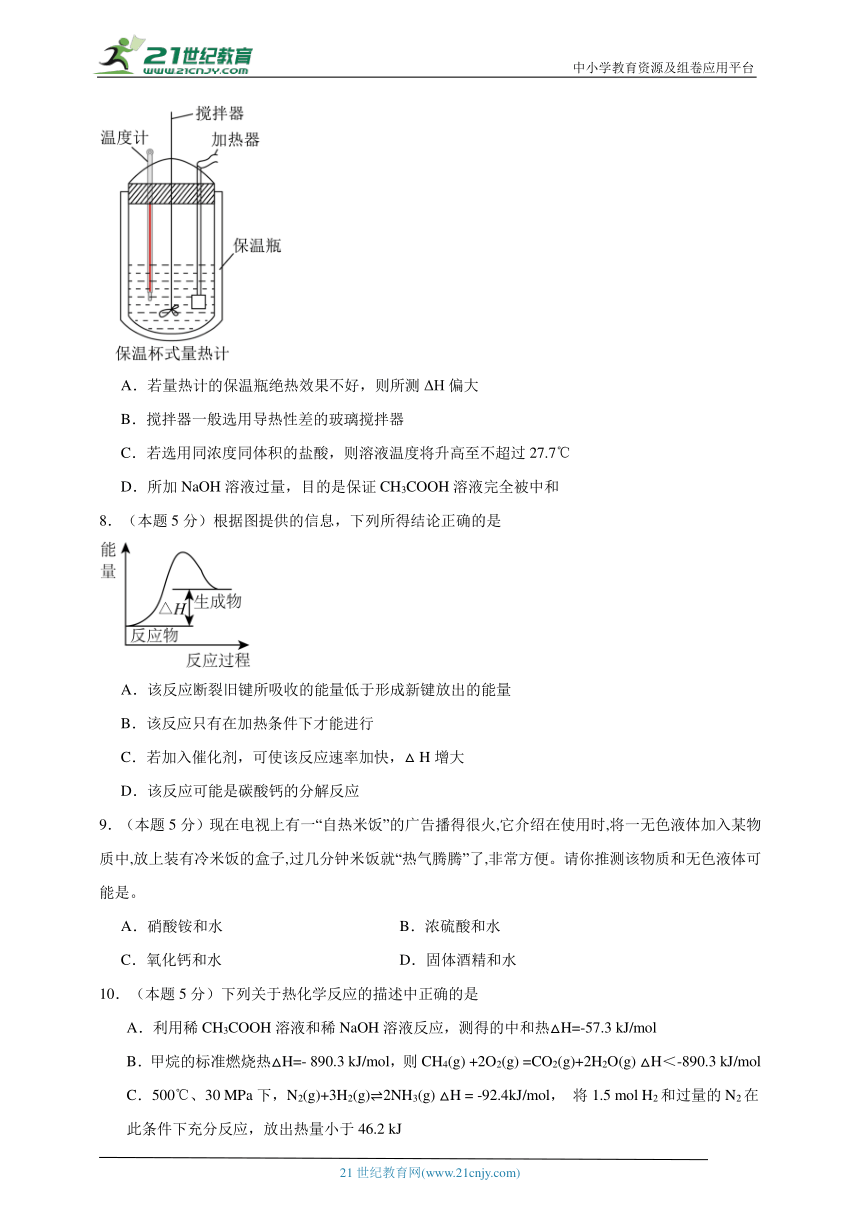
4.(本题5分)某同学设计如图所示实验,探究反应中的能量变化,下列判断正确的是
A.由实验可知,甲、乙、丙所涉及的反应都能使温度计读数上升
B.将实验甲中的铝片更换为等质量的铝粉后释放出的热量相同
C.实验丙中将玻璃搅拌器改为铁质搅拌棒对实验结果没有影响
D.实验丙中若用代替,则测出变大
5.(本题5分)碳量子点(CQDS)是一种新型碳纳米材料,我国化学家研究的一种新型复合光催化剂[碳量子点(CQDS)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
A.非金属性:C>N B.水分解过程中,H2O2作催化剂
C.两种纳米材料均属于共价化合物 D.若反应II是放热反应,则反应I一定是吸热反应
6.(本题5分)下列反应中,既属于氧化还原反应又属于吸热反应的是
A.硫酸与溶液反应 B.灼热的炭与二氧化碳反应
C.钠与水反应 D.晶体与晶体反应
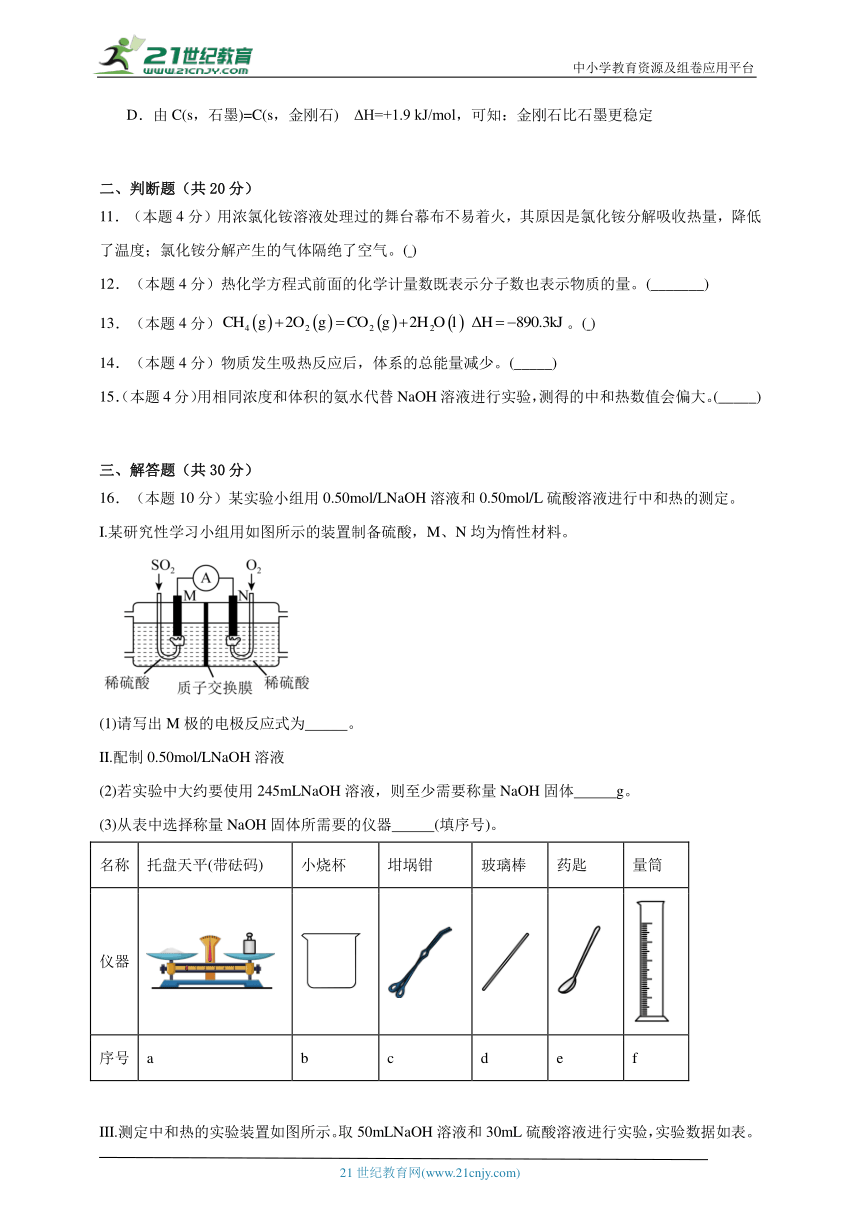
7.(本题5分)在如图所示的量热计中,将100mL0.50mol·L-1CH3COOH溶液与100mL0.55mol·L-1NaOH溶液混合,温度从25.0℃升高到27.7℃。下列说法错误的是
A.若量热计的保温瓶绝热效果不好,则所测ΔH偏大
B.搅拌器一般选用导热性差的玻璃搅拌器
C.若选用同浓度同体积的盐酸,则溶液温度将升高至不超过27.7℃
D.所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和
8.(本题5分)根据图提供的信息,下列所得结论正确的是
A.该反应断裂旧键所吸收的能量低于形成新键放出的能量
B.该反应只有在加热条件下才能进行
C.若加入催化剂,可使该反应速率加快,△H增大
D.该反应可能是碳酸钙的分解反应
9.(本题5分)现在电视上有一“自热米饭”的广告播得很火,它介绍在使用时,将一无色液体加入某物质中,放上装有冷米饭的盒子,过几分钟米饭就“热气腾腾”了,非常方便。请你推测该物质和无色液体可能是。
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.固体酒精和水
10.(本题5分)下列关于热化学反应的描述中正确的是
A.利用稀CH3COOH溶液和稀NaOH溶液反应,测得的中和热△H=-57.3 kJ/mol
B.甲烷的标准燃烧热△H=- 890.3 kJ/mol,则CH4(g) +2O2(g) =CO2(g)+2H2O(g) △H<-890.3 kJ/mol
C.500℃、30 MPa下,N2(g)+3H2(g) 2NH3(g) △H = -92.4kJ/mol, 将1.5 mol H2和过量的N2在此条件下充分反应,放出热量小于46.2 kJ
D.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ/mol,可知:金刚石比石墨更稳定
二、判断题(共20分)
11.(本题4分)用浓氯化铵溶液处理过的舞台幕布不易着火,其原因是氯化铵分解吸收热量,降低了温度;氯化铵分解产生的气体隔绝了空气。( )
12.(本题4分)热化学方程式前面的化学计量数既表示分子数也表示物质的量。(_______)
13.(本题4分)。( )
14.(本题4分)物质发生吸热反应后,体系的总能量减少。(_____)
15.(本题4分)用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热数值会偏大。(_____)
三、解答题(共30分)
16.(本题10分)某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
I.某研究性学习小组用如图所示的装置制备硫酸,M、N均为惰性材料。
(1)请写出M极的电极反应式为 。
II.配制0.50mol/LNaOH溶液
(2)若实验中大约要使用245mLNaOH溶液,则至少需要称量NaOH固体 g。
(3)从表中选择称量NaOH固体所需要的仪器 (填序号)。
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器
序号 a b c d e f
III.测定中和热的实验装置如图所示。取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
(4)请填写表中的空白:
温度实验次数 起始温度t1/℃ 终止温度 t2/℃ 温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
(5)近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g ℃)。则中和热ΔH= (取小数点后一位)。
(6)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
17.(本题10分)某实验小组设计用50mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液在如图装置中进行中和反应,测得的中和热为ΔH1。试回答下列问题:
(1)仪器A的名称为 。
(2)若用等浓度的醋酸代替盐酸,测得的中和热为ΔH2;若用浓硫酸代替盐酸,测得的中和热为ΔH3,下列说法正确的是 。
A.ΔH1>ΔH2>ΔH3 B.ΔH3>ΔH1>ΔH2
C.ΔH2>ΔH1>ΔH3 D.ΔH1=ΔH2>ΔH3
(3)实验中记录的数据如表:
温度 实验次数 起始温度T1/℃ 终止温度T2/℃
1 25.0 28.3
2 25.1 28.2
3 25.0 28.9
若NaOH溶液和盐酸的密度近似为1g/cm3,中和后溶液的比热容c=4.18J/(g·℃),则中和热ΔH1= (保留小数点后一位)。
(4)实验测得中和热ΔH1比-57.3kJ/mol偏大,产生误差的可能原因是 。
A.量热计的杯盖未盖严
B.使用铜质搅拌器搅拌
C.分多次把NaOH溶液倒入盛有盐酸的内筒中
D.用温度计测定盐酸起始温度后直接测定NaOH溶液温度
18.(本题10分)某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L氢氧化钠溶液在上图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)环形玻璃搅拌棒的作用是 。
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热 (填“偏大”“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 起始温度t1/℃ 终止温度t2/℃ 温差(t2-t1)/℃
盐酸 NaOH溶液 平均值
1 25.1 24.9 25.0 31.6 6.6
2 25.1 25.1 25.1 30.6 5.5
3 25.1 25.1 25.1 31.9 6.8
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的中和热为ΔH= 。
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会 (填“偏大”“偏小”或“不变”),其原因是 。
(5)在中和热测定实验中测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热数值 (填“偏大”“偏小”或“不变”)。
参考答案:
1.C
【详解】A.为酸性氧化物,故A错误;
B.电源工作时,将化学能转化成电能,故B错误;
C.具有强氧化性,可以用于泳池消毒,故C正确;
D.“数字烟花”是光电效应,故D错误;
故答案为C。
2.B
【分析】A、根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;
B、CH4选择性活化变为①过程中,有1个C-H键发生断裂;
C、催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率;
D、生成CH3COOH的总反应为CH4+CO2CH3COOH,原子利用率为100%。
【详解】A、根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,选项A正确;
B、CH4选择性活化变为①过程中,有1个C-H键发生断裂,选项B正确;
C、催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,选项C错误;
D、根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,选项D正确;
答案选B。
【点睛】本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变△H不能使化学平衡发生移动。
3.D
【详解】A.沼气是利用植物秸秆通过发酵生成的,沼气属于可再生能源;天然气属于不可再生能源,A错误;
B.能源分为传统能源和新能源。煤、石油和天然气为传统能源,而氢能、太阳能和核能为新能源,B错误;
C.有时需要通过吸热反应吸收的热量降低环境温度,有利用价值,如"摇摇冰”的上市就是利用了吸热反应原理,A错误;
D.能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源,石油、水能属于一次能源,水煤气、水电能属于二次能源,D正确;
故合理选项是D。
4.B
【详解】A.甲是金属与酸的反应,是放热反应;乙是氢氧化钡晶体与氯化铵反应,属于吸热反应;丙是酸碱中和反应是放热反应;因此放热反应只有甲丙,A错误;
B.铝粉和铝片本质一样,放出热量不变,只是铝粉参与反应,速率加快,B正确;
C.相较于环形玻璃搅拌棒,铁质搅拌棒导热快,会造成热量损失,对实验结果有影响,C错误;
D.氢氧化钠固体溶解时要放出热量,最终使测定中和热的数值偏高,由于放热焓变为负值,故测出变小,D错误;
故选B。
5.D
【详解】A.碳原子半径大于氮原子,质子数少于氮原子,所以失去电子的能力弱于氮原子,所以非金属性C<N,故A错误;
B.过程I中,水分解为氢气和过氧化氢,过程II,过氧化氢再分解为氧气和水,所以过氧化氢是中间产物,不是催化剂,故B错误;
C.CQDS是碳纳米材料,是碳单质,不是化合物,故C错误;
D.水分解是吸热反应,在此过程中,水分解分两步进行,若反应II是放热反应,则反应I一定是吸热反应,故D正确;
故选D。
6.B
【详解】A.硫酸与溶液发生中和反应,生成硫酸钾和水,为非氧化还原反应,为放热反应,A错误
B.灼热的炭与二氧化碳高温条件下反应生成一氧化碳,为氧化还原反应,为吸热反应,B正确;
C.钠与水反应生成氢氧化钠和氢气,为氧化还原反应,为放热反应,C错误;
D.晶体与晶体反应,为非氧化还原反应,为吸热反应,D错误;
答案选B。
7.C
【详解】A.中和反应为放热反应,焓变为负值,若量热计的保温瓶绝热效果不好,则所测ΔH偏大,A正确;
B.搅拌器一般选用导热性差的玻璃搅拌器,尽力减少热量损失,B正确;
C.醋酸为弱酸、电离过程会吸收热量导致热量损失;故若选用同浓度同体积的盐酸,则溶液温度将升高至超过27.7℃,C错误;
D.所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和,C正确;
故选C。
8.D
【分析】根据图象可知,反应物的总能量小于生成物的总能量,该反应为吸热反应;
【详解】A. 根据图象,该反应断裂旧键所吸收的能量高于形成新键放出的能量,A错误;
B.吸热反应不一定需要加热才可以发生,如氢氧化钡晶体和铵盐为吸热反应,不需加热即可进行,B错误;
C. 若加入催化剂,可使该反应速率加快,△H不影响,C错误;
D. 碳酸钙的分解反应为吸热反应,该反应可能是碳酸钙的分解反应,D正确;
答案为D
【点睛】吸热反应不一定要加热才能进行,可以在体系外进行吸热即可进行。
9.C
【详解】硝酸铵溶于水吸热,A项错误;浓硫酸具有腐蚀性,且操作不方便,B项错误;氧化钙与水反应放出大量的热量,C项正确;酒精溶于水时放热不明显,D项错误。
10.C
【详解】A.CH3COOH是弱酸,不能用稀CH3COOH溶液和稀NaOH溶液反应测定中和热,A项错误;
B.液态水变为气态水是吸热过程,甲烷的标准燃烧热△H=- 890.3 kJ/mol,则CH4(g) +2O2(g) =CO2(g)+2H2O(g) △H>-890.3 kJ/mol,B项错误;
C.500℃、30 MPa下,N2(g)+3H2(g)2NH3(g) △H= -92.4kJ/mol,合成氨反应是可逆反应,将1.5 mol H2和过量的N2在此条件下充分反应,实际消耗的氢气不足1.5 mol,放出热量小于46.2 kJ,C项正确;
D.C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ/mol,说明金刚石的能量高于石墨,能量越低越稳定,则石墨比金刚石更稳定,D项错误;
答案选C。
11.正确
【详解】氯化铵受热分解生成NH3和HCl,该分解反应为吸热反应,该反应发生时吸收热量,降低温度,达不到幕布的着火点,生成的NH3和HCl隔绝了空气,故用浓氯化铵溶液处理过的舞台幕布不易着火;正确。
12.错误
【详解】热化学方程式前面的化学计量数只表示物质的量,不表示分子数,所以可以用分数表示,故错误。
13.错误
【详解】反应热的单位是kJ/mol。
14.×
【详解】物质发生吸热反应后,体系的总能量增大,故错误;
15.错误
【详解】一水合氨是弱电解质,电离时要吸收热量,用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热数值会偏小,所测反应热的数值小于57.3,故答案为:错误。
16.(1)SO2+2H2O-2e-=SO+4H+
(2)5.0
(3)abe
(4)4.0
(5)-53.5kJ/mol
(6)acd
【详解】(1)该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,通入氧气的N电极是正极,原电池放电时,氢离子由负极移向正极,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+=2H2O,负极M上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2+2H2O-2e-=SO+4H+;
(2)只有250mL容量瓶,溶液体积按照250mL计算,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
(3)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有托盘天平、烧杯和药匙,故选abe;
(4)四次实验温度差依次为4℃、6.1℃、3.9℃、4.1℃,其中第2次数据明显有误,所以舍去,温度差平均值==4.0℃;
(5)50mL 0.50mol/L氢氧化钠与30mL 0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80ml×1g/ml=80g,温度变化的值为Δt=4℃,则生成0.025mol水放出的热量为Q=m c Δt=80g×4.18J/(g ℃)×4.0℃=1337.6J=1.3376kJ,所以实验测得的中和热ΔH=-=-53.5kJ/mol;
(6)上述实验结果的数值与57.3kJ/mol有偏差,测得数据偏小,
a.实验装置保温、隔热效果必须好,否则放出的热量会偏小,故a符合题意;
b.由于硫酸过量,量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏多,结果偏大,故b不符合题意;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致热量的损失,故c符合题意;
d.用温度计测定NaOH溶液起始温度后,要将温度计洗净之后,直再测定H2SO4溶液的温度,否则会导致部分热量损失,故d符合题意;
故答案为acd。
17.(1)玻璃搅拌器
(2)C
(3)-53.5kJ/mol
(4)ABCD
【分析】(1)根据仪器构造解答;
(2)中和热为强酸、强碱的稀溶液反应生成1molH2O所放出的热量,注意弱电解质的电离吸热、浓硫酸溶于水放热;
(3)依据Q=m·c·△T计算;
(4)依据实验关键是保温、实验操作知识判断。
【详解】(1)仪器A用于搅拌,名称为玻璃搅拌器。
(2)中和反应为放热反应,醋酸电离会吸收热量, 若用等浓度的醋酸代替盐酸,放出的热量减小,中和热ΔH2>ΔH1,浓硫酸溶于水放热,若用浓硫酸代替盐酸,放出的热量增多,中和热ΔH1>ΔH3,即ΔH2>ΔH1>ΔH3,答案选C。
(3)3次温度差分别为:3.3℃、3.1℃、3.9℃,第3组数据有误差,删掉,温度平均值为℃=3.2℃,50mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行中和反应生成水的物质的量为0.05L0.5mol/L=0.025mol,溶液的质量为100mL1g/cm3=100g,温度变化值△T=3.2℃,则生成0.025molH2O放出的热量为Q=m·c·△T=100g4.18J/(g·℃)3.2℃=1337.6J=1.3376kJ,中和热ΔH1=-=-53.5kJ/mol。
(4)A.量热计的杯盖未盖严,会造成热量损失,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,A正确;
B.铜的导热性好,散热快,使用铜质搅拌器搅拌,会造成热量损失,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,B正确;
C.分多次把NaOH溶液倒入盛有盐酸的内筒中,热量损失较多,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,C正确;
D.用温度计测定盐酸起始温度后直接测定NaOH溶液温度,温度计上盐酸与氢氧化钠反应放热,使得氢氧化钠溶液起始温度偏高,温差值偏小,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,D正确;
答案选ABCD。
18. 充分混合反应酸碱,加快反应速率,使上下温度一致 偏小 -56.01 kJ/mol 偏小 用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小 偏小
【详解】试题分析:(1)环形玻璃搅拌棒的作用是充分混合反应酸碱,加快反应速率,使上下温度一致。
(2)若盐酸挥发,则反应过程中放出的热量就偏少,因此测得得中和热就偏小。
(3)根据1、3次得实验数据可知,温差得平均值为6.7℃,所以反应过程中放出得热量是100g×4.18J/(g·℃)×6.7℃=2800.6J=2.8006kJ。反应中生成水是0.05mol,所以中和热是56.01KJ。
(4)用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小。
(5)在中和热测定实验中测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热数值偏小。
考点:考查中和热的测定。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
反应热
共18题,满分100分
题号 一 二 三 总分
得分
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请注意保持试卷整洁
一、单选题(共50分)
1.(本题5分)杭州亚运会运用了多项高科技,下列有关说法正确的是
A.5G高速通信技术所用光纤的成分为两性氧化物
B.亚运会所用无人机的电源工作时,将电能转化为化学能
C.游泳池水消毒所用的具有强氧化性
D.“数字烟花”的原理与焰色试验相同
2.(本题5分)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。(提示:原子利用率=目标生成物的质量/参加反应的所有反应物的质量×100%),下列说法正确的是
A.①→②吸收能量并形成了C―C键
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.该催化剂可有效提高反应物的平衡转化率
D.生成CH3COOH总反应的原子利用率小于100%
3.(本题5分)化学与人类生活、社会可持续发展密切相关,下列说法正确的是
A.天然气与沼气都属于不可再生能源
B.地热能、风能、天然气和氢能都属于新能源
C.人们可以把放热反应释放的能量转化为其他可利用的能量,而吸热反应没有利用价值
D.石油、水能属于一次能源,水煤气、水电能属于二次能源
4.(本题5分)某同学设计如图所示实验,探究反应中的能量变化,下列判断正确的是
A.由实验可知,甲、乙、丙所涉及的反应都能使温度计读数上升
B.将实验甲中的铝片更换为等质量的铝粉后释放出的热量相同
C.实验丙中将玻璃搅拌器改为铁质搅拌棒对实验结果没有影响
D.实验丙中若用代替,则测出变大
5.(本题5分)碳量子点(CQDS)是一种新型碳纳米材料,我国化学家研究的一种新型复合光催化剂[碳量子点(CQDS)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
A.非金属性:C>N B.水分解过程中,H2O2作催化剂
C.两种纳米材料均属于共价化合物 D.若反应II是放热反应,则反应I一定是吸热反应
6.(本题5分)下列反应中,既属于氧化还原反应又属于吸热反应的是
A.硫酸与溶液反应 B.灼热的炭与二氧化碳反应
C.钠与水反应 D.晶体与晶体反应
7.(本题5分)在如图所示的量热计中,将100mL0.50mol·L-1CH3COOH溶液与100mL0.55mol·L-1NaOH溶液混合,温度从25.0℃升高到27.7℃。下列说法错误的是
A.若量热计的保温瓶绝热效果不好,则所测ΔH偏大
B.搅拌器一般选用导热性差的玻璃搅拌器
C.若选用同浓度同体积的盐酸,则溶液温度将升高至不超过27.7℃
D.所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和
8.(本题5分)根据图提供的信息,下列所得结论正确的是
A.该反应断裂旧键所吸收的能量低于形成新键放出的能量
B.该反应只有在加热条件下才能进行
C.若加入催化剂,可使该反应速率加快,△H增大
D.该反应可能是碳酸钙的分解反应
9.(本题5分)现在电视上有一“自热米饭”的广告播得很火,它介绍在使用时,将一无色液体加入某物质中,放上装有冷米饭的盒子,过几分钟米饭就“热气腾腾”了,非常方便。请你推测该物质和无色液体可能是。
A.硝酸铵和水 B.浓硫酸和水
C.氧化钙和水 D.固体酒精和水
10.(本题5分)下列关于热化学反应的描述中正确的是
A.利用稀CH3COOH溶液和稀NaOH溶液反应,测得的中和热△H=-57.3 kJ/mol
B.甲烷的标准燃烧热△H=- 890.3 kJ/mol,则CH4(g) +2O2(g) =CO2(g)+2H2O(g) △H<-890.3 kJ/mol
C.500℃、30 MPa下,N2(g)+3H2(g) 2NH3(g) △H = -92.4kJ/mol, 将1.5 mol H2和过量的N2在此条件下充分反应,放出热量小于46.2 kJ
D.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ/mol,可知:金刚石比石墨更稳定
二、判断题(共20分)
11.(本题4分)用浓氯化铵溶液处理过的舞台幕布不易着火,其原因是氯化铵分解吸收热量,降低了温度;氯化铵分解产生的气体隔绝了空气。( )
12.(本题4分)热化学方程式前面的化学计量数既表示分子数也表示物质的量。(_______)
13.(本题4分)。( )
14.(本题4分)物质发生吸热反应后,体系的总能量减少。(_____)
15.(本题4分)用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热数值会偏大。(_____)
三、解答题(共30分)
16.(本题10分)某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
I.某研究性学习小组用如图所示的装置制备硫酸,M、N均为惰性材料。
(1)请写出M极的电极反应式为 。
II.配制0.50mol/LNaOH溶液
(2)若实验中大约要使用245mLNaOH溶液,则至少需要称量NaOH固体 g。
(3)从表中选择称量NaOH固体所需要的仪器 (填序号)。
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器
序号 a b c d e f
III.测定中和热的实验装置如图所示。取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如表。
(4)请填写表中的空白:
温度实验次数 起始温度t1/℃ 终止温度 t2/℃ 温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
(5)近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g ℃)。则中和热ΔH= (取小数点后一位)。
(6)上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
17.(本题10分)某实验小组设计用50mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液在如图装置中进行中和反应,测得的中和热为ΔH1。试回答下列问题:
(1)仪器A的名称为 。
(2)若用等浓度的醋酸代替盐酸,测得的中和热为ΔH2;若用浓硫酸代替盐酸,测得的中和热为ΔH3,下列说法正确的是 。
A.ΔH1>ΔH2>ΔH3 B.ΔH3>ΔH1>ΔH2
C.ΔH2>ΔH1>ΔH3 D.ΔH1=ΔH2>ΔH3
(3)实验中记录的数据如表:
温度 实验次数 起始温度T1/℃ 终止温度T2/℃
1 25.0 28.3
2 25.1 28.2
3 25.0 28.9
若NaOH溶液和盐酸的密度近似为1g/cm3,中和后溶液的比热容c=4.18J/(g·℃),则中和热ΔH1= (保留小数点后一位)。
(4)实验测得中和热ΔH1比-57.3kJ/mol偏大,产生误差的可能原因是 。
A.量热计的杯盖未盖严
B.使用铜质搅拌器搅拌
C.分多次把NaOH溶液倒入盛有盐酸的内筒中
D.用温度计测定盐酸起始温度后直接测定NaOH溶液温度
18.(本题10分)某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L氢氧化钠溶液在上图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)环形玻璃搅拌棒的作用是 。
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热 (填“偏大”“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
实验序号 起始温度t1/℃ 终止温度t2/℃ 温差(t2-t1)/℃
盐酸 NaOH溶液 平均值
1 25.1 24.9 25.0 31.6 6.6
2 25.1 25.1 25.1 30.6 5.5
3 25.1 25.1 25.1 31.9 6.8
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的中和热为ΔH= 。
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会 (填“偏大”“偏小”或“不变”),其原因是 。
(5)在中和热测定实验中测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热数值 (填“偏大”“偏小”或“不变”)。
参考答案:
1.C
【详解】A.为酸性氧化物,故A错误;
B.电源工作时,将化学能转化成电能,故B错误;
C.具有强氧化性,可以用于泳池消毒,故C正确;
D.“数字烟花”是光电效应,故D错误;
故答案为C。
2.B
【分析】A、根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;
B、CH4选择性活化变为①过程中,有1个C-H键发生断裂;
C、催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率;
D、生成CH3COOH的总反应为CH4+CO2CH3COOH,原子利用率为100%。
【详解】A、根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,选项A正确;
B、CH4选择性活化变为①过程中,有1个C-H键发生断裂,选项B正确;
C、催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,选项C错误;
D、根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,选项D正确;
答案选B。
【点睛】本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变△H不能使化学平衡发生移动。
3.D
【详解】A.沼气是利用植物秸秆通过发酵生成的,沼气属于可再生能源;天然气属于不可再生能源,A错误;
B.能源分为传统能源和新能源。煤、石油和天然气为传统能源,而氢能、太阳能和核能为新能源,B错误;
C.有时需要通过吸热反应吸收的热量降低环境温度,有利用价值,如"摇摇冰”的上市就是利用了吸热反应原理,A错误;
D.能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源,石油、水能属于一次能源,水煤气、水电能属于二次能源,D正确;
故合理选项是D。
4.B
【详解】A.甲是金属与酸的反应,是放热反应;乙是氢氧化钡晶体与氯化铵反应,属于吸热反应;丙是酸碱中和反应是放热反应;因此放热反应只有甲丙,A错误;
B.铝粉和铝片本质一样,放出热量不变,只是铝粉参与反应,速率加快,B正确;
C.相较于环形玻璃搅拌棒,铁质搅拌棒导热快,会造成热量损失,对实验结果有影响,C错误;
D.氢氧化钠固体溶解时要放出热量,最终使测定中和热的数值偏高,由于放热焓变为负值,故测出变小,D错误;
故选B。
5.D
【详解】A.碳原子半径大于氮原子,质子数少于氮原子,所以失去电子的能力弱于氮原子,所以非金属性C<N,故A错误;
B.过程I中,水分解为氢气和过氧化氢,过程II,过氧化氢再分解为氧气和水,所以过氧化氢是中间产物,不是催化剂,故B错误;
C.CQDS是碳纳米材料,是碳单质,不是化合物,故C错误;
D.水分解是吸热反应,在此过程中,水分解分两步进行,若反应II是放热反应,则反应I一定是吸热反应,故D正确;
故选D。
6.B
【详解】A.硫酸与溶液发生中和反应,生成硫酸钾和水,为非氧化还原反应,为放热反应,A错误
B.灼热的炭与二氧化碳高温条件下反应生成一氧化碳,为氧化还原反应,为吸热反应,B正确;
C.钠与水反应生成氢氧化钠和氢气,为氧化还原反应,为放热反应,C错误;
D.晶体与晶体反应,为非氧化还原反应,为吸热反应,D错误;
答案选B。
7.C
【详解】A.中和反应为放热反应,焓变为负值,若量热计的保温瓶绝热效果不好,则所测ΔH偏大,A正确;
B.搅拌器一般选用导热性差的玻璃搅拌器,尽力减少热量损失,B正确;
C.醋酸为弱酸、电离过程会吸收热量导致热量损失;故若选用同浓度同体积的盐酸,则溶液温度将升高至超过27.7℃,C错误;
D.所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和,C正确;
故选C。
8.D
【分析】根据图象可知,反应物的总能量小于生成物的总能量,该反应为吸热反应;
【详解】A. 根据图象,该反应断裂旧键所吸收的能量高于形成新键放出的能量,A错误;
B.吸热反应不一定需要加热才可以发生,如氢氧化钡晶体和铵盐为吸热反应,不需加热即可进行,B错误;
C. 若加入催化剂,可使该反应速率加快,△H不影响,C错误;
D. 碳酸钙的分解反应为吸热反应,该反应可能是碳酸钙的分解反应,D正确;
答案为D
【点睛】吸热反应不一定要加热才能进行,可以在体系外进行吸热即可进行。
9.C
【详解】硝酸铵溶于水吸热,A项错误;浓硫酸具有腐蚀性,且操作不方便,B项错误;氧化钙与水反应放出大量的热量,C项正确;酒精溶于水时放热不明显,D项错误。
10.C
【详解】A.CH3COOH是弱酸,不能用稀CH3COOH溶液和稀NaOH溶液反应测定中和热,A项错误;
B.液态水变为气态水是吸热过程,甲烷的标准燃烧热△H=- 890.3 kJ/mol,则CH4(g) +2O2(g) =CO2(g)+2H2O(g) △H>-890.3 kJ/mol,B项错误;
C.500℃、30 MPa下,N2(g)+3H2(g)2NH3(g) △H= -92.4kJ/mol,合成氨反应是可逆反应,将1.5 mol H2和过量的N2在此条件下充分反应,实际消耗的氢气不足1.5 mol,放出热量小于46.2 kJ,C项正确;
D.C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ/mol,说明金刚石的能量高于石墨,能量越低越稳定,则石墨比金刚石更稳定,D项错误;
答案选C。
11.正确
【详解】氯化铵受热分解生成NH3和HCl,该分解反应为吸热反应,该反应发生时吸收热量,降低温度,达不到幕布的着火点,生成的NH3和HCl隔绝了空气,故用浓氯化铵溶液处理过的舞台幕布不易着火;正确。
12.错误
【详解】热化学方程式前面的化学计量数只表示物质的量,不表示分子数,所以可以用分数表示,故错误。
13.错误
【详解】反应热的单位是kJ/mol。
14.×
【详解】物质发生吸热反应后,体系的总能量增大,故错误;
15.错误
【详解】一水合氨是弱电解质,电离时要吸收热量,用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热数值会偏小,所测反应热的数值小于57.3,故答案为:错误。
16.(1)SO2+2H2O-2e-=SO+4H+
(2)5.0
(3)abe
(4)4.0
(5)-53.5kJ/mol
(6)acd
【详解】(1)该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,通入氧气的N电极是正极,原电池放电时,氢离子由负极移向正极,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+=2H2O,负极M上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2+2H2O-2e-=SO+4H+;
(2)只有250mL容量瓶,溶液体积按照250mL计算,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g;
(3)氢氧化钠要在小烧杯中称量,称量固体氢氧化钠所用的仪器有托盘天平、烧杯和药匙,故选abe;
(4)四次实验温度差依次为4℃、6.1℃、3.9℃、4.1℃,其中第2次数据明显有误,所以舍去,温度差平均值==4.0℃;
(5)50mL 0.50mol/L氢氧化钠与30mL 0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80ml×1g/ml=80g,温度变化的值为Δt=4℃,则生成0.025mol水放出的热量为Q=m c Δt=80g×4.18J/(g ℃)×4.0℃=1337.6J=1.3376kJ,所以实验测得的中和热ΔH=-=-53.5kJ/mol;
(6)上述实验结果的数值与57.3kJ/mol有偏差,测得数据偏小,
a.实验装置保温、隔热效果必须好,否则放出的热量会偏小,故a符合题意;
b.由于硫酸过量,量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏多,结果偏大,故b不符合题意;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致热量的损失,故c符合题意;
d.用温度计测定NaOH溶液起始温度后,要将温度计洗净之后,直再测定H2SO4溶液的温度,否则会导致部分热量损失,故d符合题意;
故答案为acd。
17.(1)玻璃搅拌器
(2)C
(3)-53.5kJ/mol
(4)ABCD
【分析】(1)根据仪器构造解答;
(2)中和热为强酸、强碱的稀溶液反应生成1molH2O所放出的热量,注意弱电解质的电离吸热、浓硫酸溶于水放热;
(3)依据Q=m·c·△T计算;
(4)依据实验关键是保温、实验操作知识判断。
【详解】(1)仪器A用于搅拌,名称为玻璃搅拌器。
(2)中和反应为放热反应,醋酸电离会吸收热量, 若用等浓度的醋酸代替盐酸,放出的热量减小,中和热ΔH2>ΔH1,浓硫酸溶于水放热,若用浓硫酸代替盐酸,放出的热量增多,中和热ΔH1>ΔH3,即ΔH2>ΔH1>ΔH3,答案选C。
(3)3次温度差分别为:3.3℃、3.1℃、3.9℃,第3组数据有误差,删掉,温度平均值为℃=3.2℃,50mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行中和反应生成水的物质的量为0.05L0.5mol/L=0.025mol,溶液的质量为100mL1g/cm3=100g,温度变化值△T=3.2℃,则生成0.025molH2O放出的热量为Q=m·c·△T=100g4.18J/(g·℃)3.2℃=1337.6J=1.3376kJ,中和热ΔH1=-=-53.5kJ/mol。
(4)A.量热计的杯盖未盖严,会造成热量损失,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,A正确;
B.铜的导热性好,散热快,使用铜质搅拌器搅拌,会造成热量损失,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,B正确;
C.分多次把NaOH溶液倒入盛有盐酸的内筒中,热量损失较多,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,C正确;
D.用温度计测定盐酸起始温度后直接测定NaOH溶液温度,温度计上盐酸与氢氧化钠反应放热,使得氢氧化钠溶液起始温度偏高,温差值偏小,测得的值偏小,中和热ΔH1比-57.3kJ/mol偏大,D正确;
答案选ABCD。
18. 充分混合反应酸碱,加快反应速率,使上下温度一致 偏小 -56.01 kJ/mol 偏小 用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小 偏小
【详解】试题分析:(1)环形玻璃搅拌棒的作用是充分混合反应酸碱,加快反应速率,使上下温度一致。
(2)若盐酸挥发,则反应过程中放出的热量就偏少,因此测得得中和热就偏小。
(3)根据1、3次得实验数据可知,温差得平均值为6.7℃,所以反应过程中放出得热量是100g×4.18J/(g·℃)×6.7℃=2800.6J=2.8006kJ。反应中生成水是0.05mol,所以中和热是56.01KJ。
(4)用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小。
(5)在中和热测定实验中测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热数值偏小。
考点:考查中和热的测定。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
